UNIDAD TEORA DE ENLACE QUMICO Y NOMENCLATURA INORGNICA





















- Slides: 30

UNIDAD: TEORÍA DE ENLACE QUÍMICO Y NOMENCLATURA INORGÁNICA Objetivo: Realizar la estructura de Lewis y predecir sus posibles enlaces químicos. Fuente: archivos de departamento. / QUI-256 PUCV / Imágenes Educar. ar

Problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple formada por átomos de carbono. Existe otra sustancia simple formada también por átomos de carbono llamada diamante. ¿Cuál es la causa de que ambas sustancias tengan propiedades tan distintas y sin embargo estén formadas por el mismo tipo de átomo?

¿Qué entendemos por enlace químico? Se refiere al conjunto de fuerzas que mantienen unidos a los átomos, iones o moléculas que forman parte de la materia. Para explicar la formación de estos enlaces, debemos recordar el concepto de electrones de valencia.

Recordemos Realizar la configuración electrónica de un elemento químico. 12 C = 1 s 2 2 p 2 6 Último nivel de energía 4 electrones de valencia

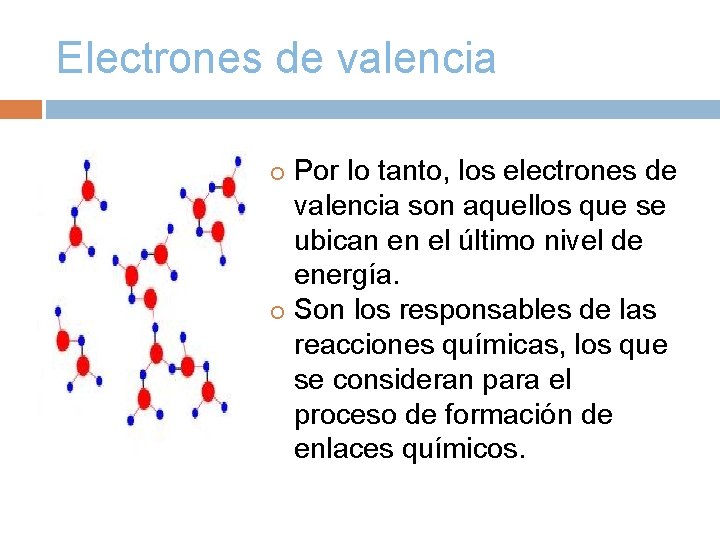
Electrones de valencia Por lo tanto, los electrones de valencia son aquellos que se ubican en el último nivel de energía. Son los responsables de las reacciones químicas, los que se consideran para el proceso de formación de enlaces químicos.

Pasos para determinar electrones de valencia 1. Conocer el número atómico (Z) 2. Escribir la configuración electrónica. 3. Marcar el último nivel de energía. 4. Sumar los electrones del último nivel de energía. 14 7 N (Z = 7) 1 s 2 2 s 2 2 p 3 e – valencia: 5

Estructura de Lewis Es una forma de representar de manera sencilla la formación de enlaces químicos y que consiste en poner el símbolo del elemento rodeado de sus electrones de valencia, los que se simbolizan por puntos o cruces.

Pasos para determinar la estructura de Lewis Primero: se siguen los pasos para determinar los electrones de valencia. 1 s 2 2 p 3 Electrones de valencia: 5 Segundo: se determina el orden en que se deben poner los electrones aplicando la regla de Hund Tercero: se anota el símbolo y, a su alrededor, con puntos o cruces, los electrones de valencia. . : N. ·

Ejercicios a) b) c) Plantea las estructuras de Lewis de los siguientes elementos: 9 F 19 K – 2 O 8

¿Por qué se forman los enlaces? Todo elemento químico forma enlaces para ganar estabilidad, es decir, para parecerse a los gases nobles, completando o llenando el último nivel de energía. Para logar dicha estabilidad los elementos pueden ganar electrones, perder electrones, compartirlos o bien establecer interacciones entre las moléculas.

Átomo Metales (cede electrones) Aluminio (Z=13) No metales (captan electrones) Azufre (Z=16) Al = 1 s 2 2 p 6 3 s S = 1 s 2 2 p 6 3 s 2 3 p 1 . . . S. . . : Al. Ion Gas noble más cercano 3 p 4 2 Al 3 + S 2 - 1 s 2 2 p 6 (Al) 3+ 1 s 2 2 p 6 3 s 2 3 p 4. . ( : S : ) 2–. . Ne 1 s 2 2 p 6. . : Ne : . . Ar 1 s 2 2 p 6 3 s. . : Ar : . . 2 3 p 6

Sin embargo, existen reglas que indican cuando un átomo alcanza estabilidad… Regla del octeto: cuando los átomos forman enlace deben completar su última capa, ya sea cediendo, captando o compartiendo electrones, así, adquirirán la configuración electrónica del gas noble más cercano. Cuando se completa con ocho electrones se dice que se cumplió con la regla del octeto.

Regla del dueto: Existen otros átomos que completan su última capa con sólo dos electrones, se dice que cumple con la regla del dueto. Estos son: hidrógeno, litio y berilio.

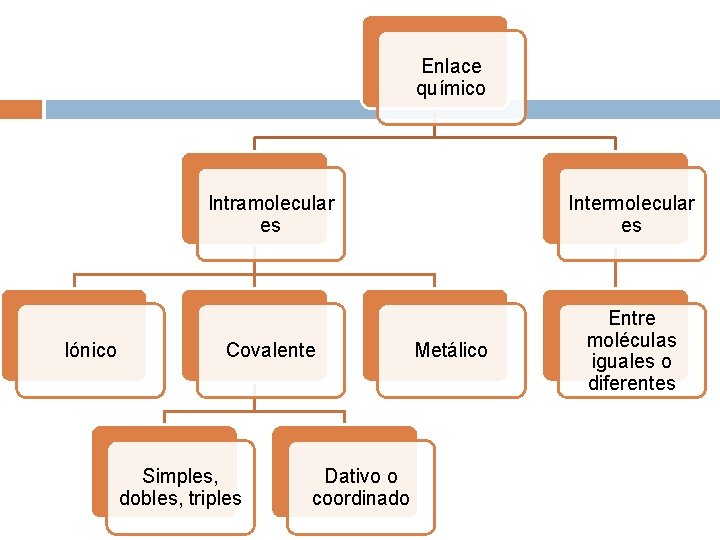
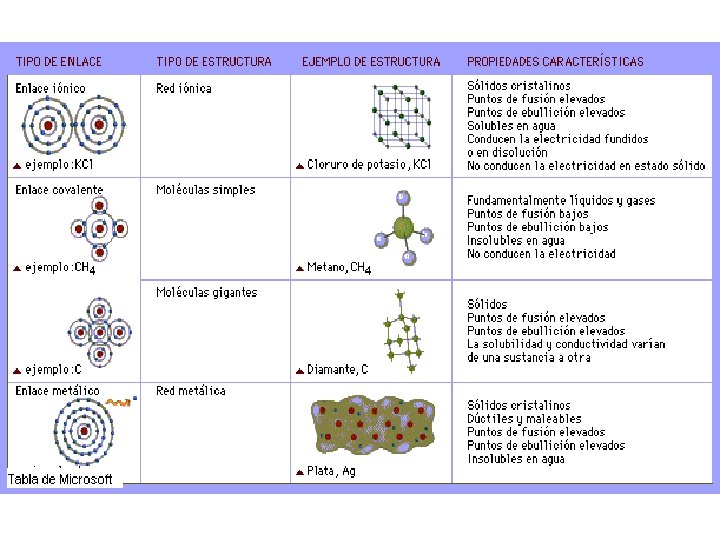
Enlace químico Iónico Intramolecular es Intermolecular es Covalente Entre moléculas iguales o diferentes Simples, dobles, triples Dativo o coordinado Metálico

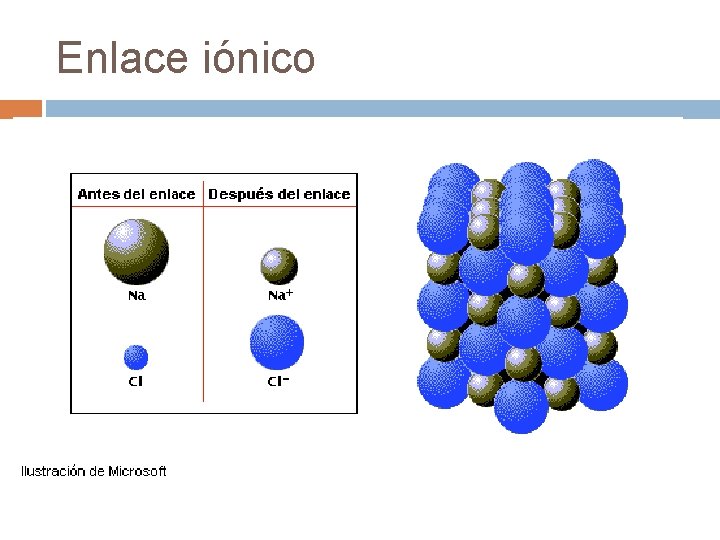
Enlace iónico Se produce por la transferencia de electrones de un átomo a otro; generalmente entre un elemento metálico (que cede electrones) y un no metal (que capta electrones). Producto de lo anterior, el metal se convierte en catión y el no metal en anión. . Cl = 1 s 2 p 3 s 3 p Estructura de Lewis : . Cl. . 11 Na = 1 s 17 2 2 s 2 2 p 6 3 s 1 Estructura de Lewis Na 2 2 6 2 5

En general si la diferencia de electronegatividad entre dos átomos es mayor a 2 unidades, estos podrán unirse por enlace iónico. En un compuesto iónico, cada ión se rodea de iones del signo contrario, dando lugar a una estructura ordenada que se extiende en todas direcciones, llamada red cristalina.

Enlace iónico

Enlace Covalente Es la fuerza de atracción entre átomos no metálicos de igual o diferente electronegatividad, cuando se comparten sus electrones de valencia para formar moléculas. En general si la diferencia de electronegatividad entre dos átomos es menor a 2 unidades, estos podrán unirse por enlace covalente (no metal- no metal).

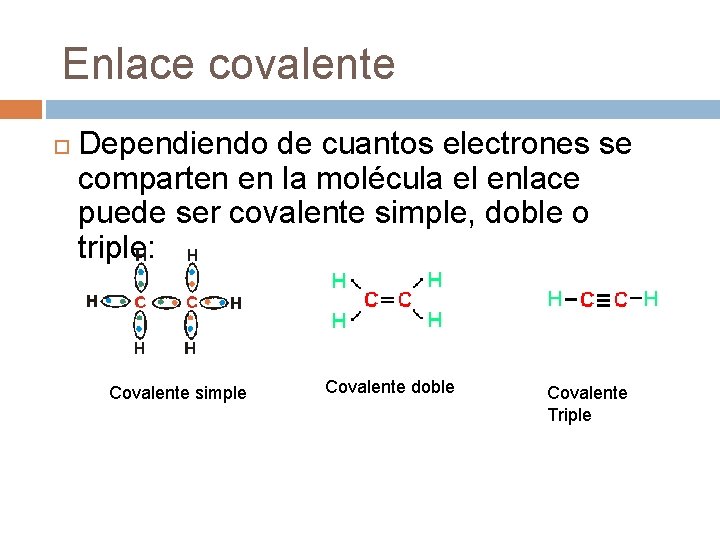
Enlace covalente Dependiendo de cuantos electrones se comparten en la molécula el enlace puede ser covalente simple, doble o triple: Covalente simple Covalente doble Covalente Triple

Enlace Covalente Apolar: Se forma entre átomos del mismo elemento o átomos de distinto elemento pero con electronegatividades similares ( E. N= 0 - 0, 4)

Enlace Covalente Polar: Se forma entre átomos distintos ( E. N= 0, 5 - 1, 9) en este caso se formarán dos polos en la molécula, uno positivo y uno negativo.

Enlace covalente Enlace Covalente Coordinado o dativo: Cuando el par de electrones compartidos pertenece solo a uno de los átomos se presenta un enlace covalente coordinado o dativo. El átomo que aporta el par de electrones se llama donador (menos electronegativo) y el que los recibe receptor o aceptor( más electronegativo).

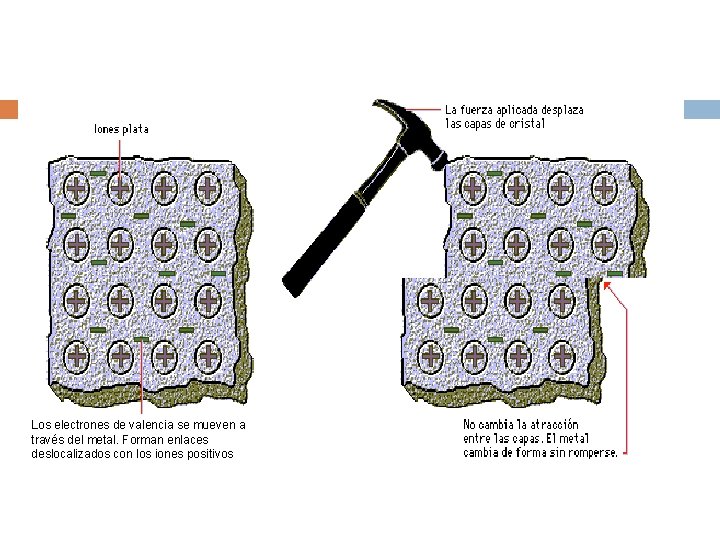
Enlace Metálico Es la fuerza de atracción que se establece entre un gran número de iones positivos que se mantienen unidos por una nube de electrones. La red cristalina de un metal está compuesto por un número indefinido de iones positivos (cationes) que se encuentran rodeados por una nube electrónica formada por los electrones de valencia de los átomos metálicos. La deslocalización de estos electrones se traduce en una gran fuerza de cohesión.

Los electrones de valencia se mueven a través del metal. Forman enlaces deslocalizados con los iones positivos


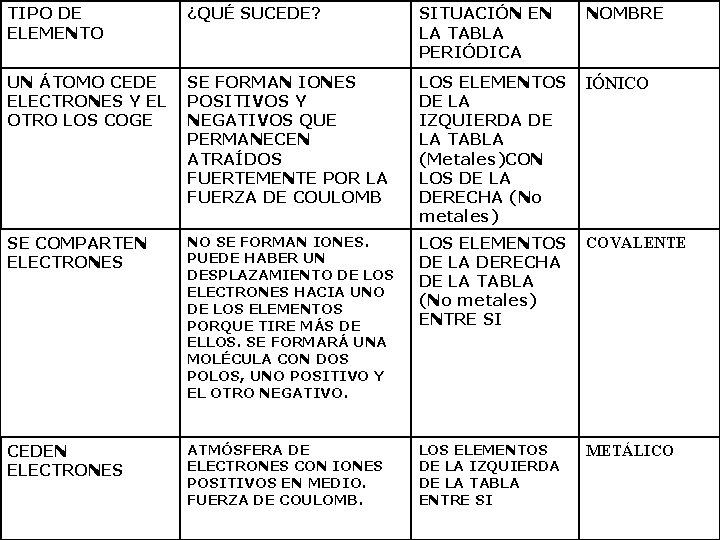
TIPO DE ELEMENTO ¿QUÉ SUCEDE? SITUACIÓN EN LA TABLA PERIÓDICA NOMBRE UN ÁTOMO CEDE ELECTRONES Y EL OTRO LOS COGE SE FORMAN IONES POSITIVOS Y NEGATIVOS QUE PERMANECEN ATRAÍDOS FUERTEMENTE POR LA FUERZA DE COULOMB LOS ELEMENTOS DE LA IZQUIERDA DE LA TABLA (Metales)CON LOS DE LA DERECHA (No metales) IÓNICO SE COMPARTEN ELECTRONES NO SE FORMAN IONES. PUEDE HABER UN DESPLAZAMIENTO DE LOS ELECTRONES HACIA UNO DE LOS ELEMENTOS PORQUE TIRE MÁS DE ELLOS. SE FORMARÁ UNA MOLÉCULA CON DOS POLOS, UNO POSITIVO Y EL OTRO NEGATIVO. LOS ELEMENTOS DE LA DERECHA DE LA TABLA (No metales) ENTRE SI COVALENTE CEDEN ELECTRONES ATMÓSFERA DE ELECTRONES CON IONES POSITIVOS EN MEDIO. FUERZA DE COULOMB. LOS ELEMENTOS DE LA IZQUIERDA DE LA TABLA ENTRE SI METÁLICO

Enlaces Intermoleculares · Fuerzas dipolo-dipolo: Se presentan entre dos o más moléculas polares, es decir, una atracción entre el polo positivo de una molécula con el polo negativo de otra, las moléculas se orientarán de manera que la repulsión sea mínima. Las sustancias cuyas moléculas presentan este tipo de unión tienen mayor punto de ebullición y fusión que aquellas que no las presentan.

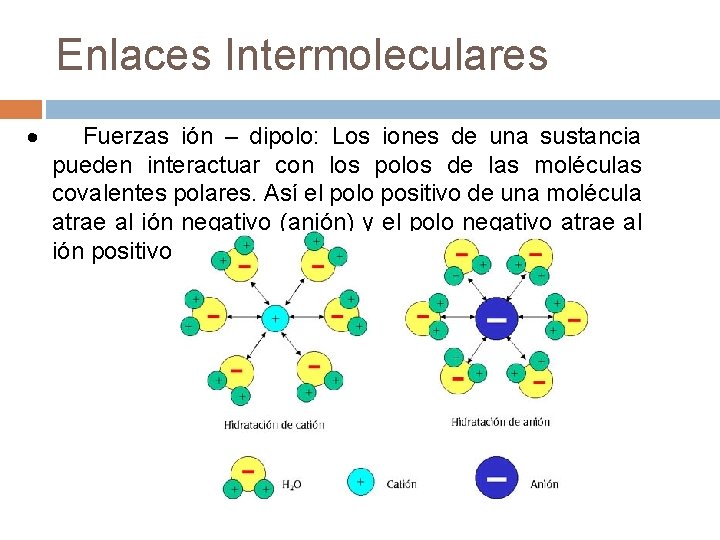
Enlaces Intermoleculares · Fuerzas ión – dipolo: Los iones de una sustancia pueden interactuar con los polos de las moléculas covalentes polares. Así el polo positivo de una molécula atrae al ión negativo (anión) y el polo negativo atrae al ión positivo (catión).

Enlaces Intermoleculares · Fuerzas de Van der Waals: Son características de las moléculas apolares, como el I 2, el metano CH 4. Debido al movimiento de los electrones, en éstas moléculas se deben producir momentáneos desequilibrios en la distribución electrónica, generándose polos positivos y negativos. Aunque estos polos cambian continuamente de posición, producen una débil interacción entre las moléculas apolares.

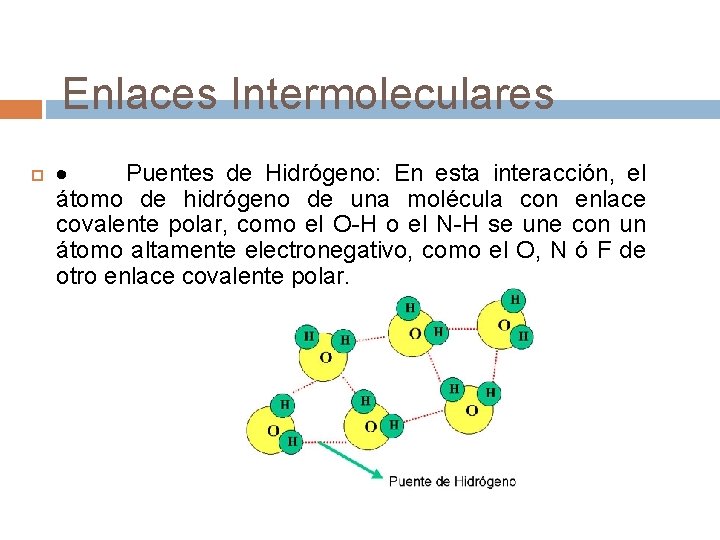
Enlaces Intermoleculares · Puentes de Hidrógeno: En esta interacción, el átomo de hidrógeno de una molécula con enlace covalente polar, como el O-H o el N-H se une con un átomo altamente electronegativo, como el O, N ó F de otro enlace covalente polar.
 Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Qumica
Qumica Estructura de lewis de hf
Estructura de lewis de hf La teora
La teora Ejemplos de enlace sigma
Ejemplos de enlace sigma Unidad decena centena millar
Unidad decena centena millar Enlace so
Enlace so Interacciones moleculares
Interacciones moleculares Enlaces pi y sigma
Enlaces pi y sigma Tipos de fórmulas del carbono
Tipos de fórmulas del carbono Naturaleza del enlace quimico
Naturaleza del enlace quimico Enrutamiento por estado de enlace
Enrutamiento por estado de enlace Enfermera de enlace
Enfermera de enlace Enlaces quimicos mapa mental
Enlaces quimicos mapa mental Estructura de lewis ejemplos
Estructura de lewis ejemplos Que es un enlace polar
Que es un enlace polar Enlace
Enlace Rango de valor de covalente puro
Rango de valor de covalente puro Ejemplos de carbonilos
Ejemplos de carbonilos Aminoacidos esenciales
Aminoacidos esenciales H-o-h tipo de enlace
H-o-h tipo de enlace Orbtale
Orbtale Monosacaridos del adn
Monosacaridos del adn Sustancias ionicas
Sustancias ionicas Como se clasifica el enlace covalente
Como se clasifica el enlace covalente Ies muriedas
Ies muriedas Enlace
Enlace Rpecv tabla
Rpecv tabla Mariana bianchi
Mariana bianchi