Protenas 1 Concepto funciones y clasificacin 2 Aminocidos



































- Slides: 71

Proteínas • • 1. Concepto, funciones y clasificación. 2. Aminoácidos. – 2. 1. Definición, características y clasificación. – 2. 2. Propiedades químicas. 3. Enlace peptídico. – 3. 1 Definición. – 3. 2 Características. 4. Proteínas. – 4. 1 Estructura. • Estructura 1ª. • Estructura 2ª. • Estructura 3ª. • Estructura 4ª – 4. 2 Propiedades. – 4. 3 Clasificación. • Holoproteínas o proteínas simples. – Holoproteínas globulares. – Holoproteínas fibrosas. • Heteroproteínas o proteínas complejas. – Glucoproteínas. – Fosfoproteínas. – Lipoprotínas. – Nucleoprotínas. – Cromoproteínas.

Proteínas • • 1. Concepto, funciones y clasificación. 2. Aminoácidos. – 2. 1. Definición, características y clasificación. – 2. 2. Propiedades químicas. 3. Enlace peptídico. – 3. 1 Definición. – 3. 2 Características. 4. Proteínas. – 4. 1 Estructura. • Estructura 1ª. • Estructura 2ª. • Estructura 3ª. • Estructura 4ª – 4. 2 Propiedades. – 4. 3 Clasificación. • Holoproteínas o proteínas simples. – Holoproteínas globulares. – Holoproteínas fibrosas. • Heteroproteínas o proteínas complejas. – Glucoproteínas. – Fosfoproteínas. – Lipoprotínas. – Nucleoprotínas. – Cromoproteínas.

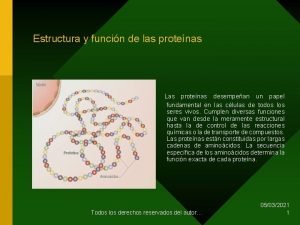
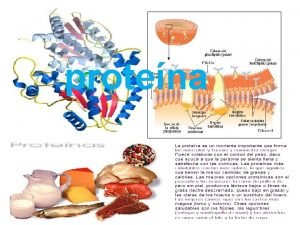
1. Concepto, funciones y clasificación. • • • Las proteínas son biomoléculas orgánicas que contienen C, H, O y N (elemento característico de las proteínas), pero además pueden contener S, P, Fe… Químicamente, las proteínas son polímeros de aminoácidos unidos entre sí por enlaces peptídicos (amida). Son las biomoléculas orgánicas más abundantes de los seres vivos, casi el 50% de su peso seco son proteínas. De ahí su nombre, (Proteína = proteios) que significa primero o principal. Atendiendo al número de aminoácidos las podemos clasificar en: – Oligopéptidos: Menos de 10 aa. – Polipéptidos: Más de 10 aa. • Según su composición química y estructura las clasificamos en: – Holoproteínas: Formadas exclusivamente por aa. • • Globulares. Con forma más o menos esférica. Fibrosas. Con forma más o menos cilíndrica. – Heteroproteínas: Formada por una parte proteica y una no proteica denominada grupo prostético. • • • Glucoproteínas. Péptidos que contienen glúcidos unidos covalentemente. Ej. Peptidoglicanos. Fosfoproteínas. Péptidos que contienen ácido fosfórico. Ej. Caseína. Lipoproteínas. Asociación no covalente entre lípidos y proteínas. Ej. LDL. Nucleoproteínas. Tienen por grupo prostético a los ácidos nucleicos. Ej. Histonas. Cromoproteínas. Proteínas asociadas a grupos protéticos coloreados. Las funciones de las proteínas son múltiples, entre ellas podemos destacar: – Función estructural: Forman parte de casi todas las estructuras celulares y extracelulares de un ser vivo. Forman parte de la bicapa lipídica, el citoesqueleto, componente de la matriz extracelular… podemos decir que un ser vivo está hecho de proteínas. – Función enzimática: Son catalizadores biológicos que intervienen en todas las reacciones químicas que se producen en un ser vivo. Cualquier reacción química de un ser vivo está catalizada por una enzima de naturaleza proteica.

1. Concepto, funciones y clasificación. – Función de transporte y almacenamiento: La bicapa lipídica es una frontera entre el exterior y el citoplasma celular que muchas moléculas no pueden atravesar sin el concurso de una proteína específica transportadora de membranas, algunas proteínas sirven para almacenar iones. Ej. ferritina en hígado y bazo. – Función hormonal: Muchas hormonas son proteínas como la insulina o la somatotropina u hormona del crecimiento. – Función contráctil: La contracción que produce movimientos coordinados se debe a la acción de dos proteínas la actina y la miosina. – Función de defensa y protección: Los anticuerpos e inmunoglobulinas que reconocen las sustancias extrañas o antígenos de las propias son proteínas. – Función de reserva: Algunas proteínas sirven de almacén de aminoácidos. Ej. Ovoalbúmina. – Función de recepción y transmisión de señales: Las proteínas situadas en la bicapa lipídica pueden interaccionar con moléculas específicas del exterior celular y provocar una respuesta celular concreta.

Proteínas • • 1. Concepto, funciones y clasificación. 2. Aminoácidos. – 2. 1. Definición, características y clasificación. – 2. 2. Propiedades químicas. 3. Enlace peptídico. – 3. 1 Definición. – 3. 2 Características. 4. Proteínas. – 4. 1 Estructura. • Estructura 1ª. • Estructura 2ª. • Estructura 3ª. • Estructura 4ª – 4. 2 Propiedades. – 4. 3 Clasificación. • Holoproteínas o proteínas simples. – Holoproteínas globulares. – Holoproteínas fibrosas. • Heteroproteínas o proteínas complejas. – Glucoproteínas. – Fosfoproteínas. – Lipoprotínas. – Nucleoprotínas. – Cromoproteínas.

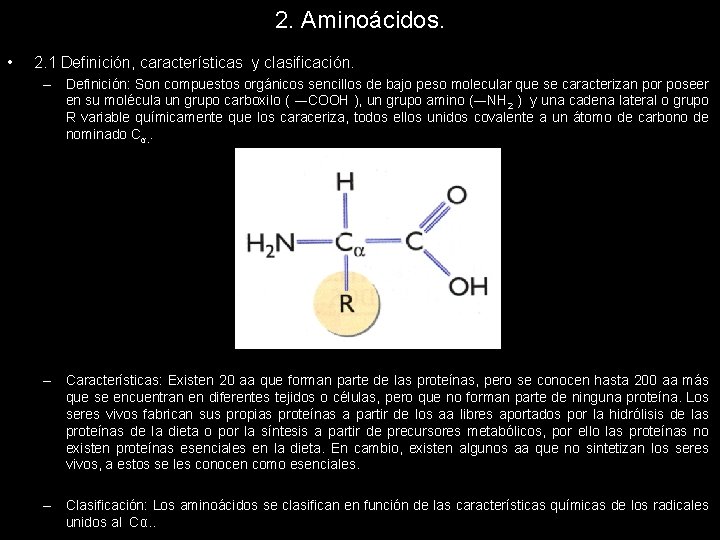
2. Aminoácidos. • 2. 1 Definición, características y clasificación. – Definición: Son compuestos orgánicos sencillos de bajo peso molecular que se caracterizan por poseer en su molécula un grupo carboxilo ( ―COOH ), un grupo amino (―NH 2 ) y una cadena lateral o grupo R variable químicamente que los caraceriza, todos ellos unidos covalente a un átomo de carbono de nominado Cα. . – Características: Existen 20 aa que forman parte de las proteínas, pero se conocen hasta 200 aa más que se encuentran en diferentes tejidos o células, pero que no forman parte de ninguna proteína. Los seres vivos fabrican sus propias proteínas a partir de los aa libres aportados por la hidrólisis de las proteínas de la dieta o por la síntesis a partir de precursores metabólicos, por ello las proteínas no existen proteínas esenciales en la dieta. En cambio, existen algunos aa que no sintetizan los seres vivos, a estos se les conocen como esenciales. – Clasificación: Los aminoácidos se clasifican en función de las características químicas de los radicales unidos al Cα. .


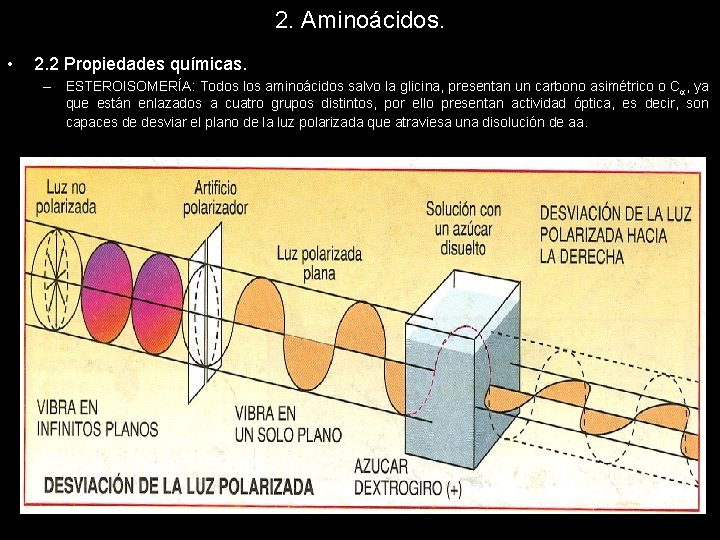
2. Aminoácidos. • 2. 2 Propiedades químicas. – ESTEROISOMERÍA: Todos los aminoácidos salvo la glicina, presentan un carbono asimétrico o C , ya que están enlazados a cuatro grupos distintos, por ello presentan actividad óptica, es decir, son capaces de desviar el plano de la luz polarizada que atraviesa una disolución de aa.

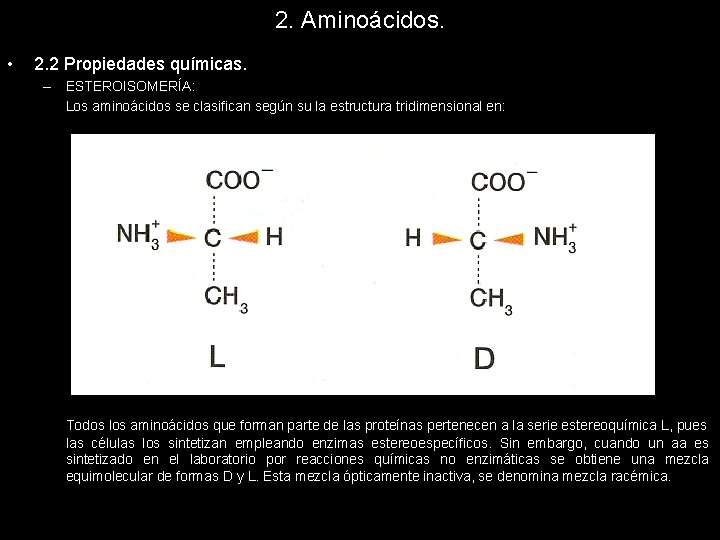
2. Aminoácidos. • 2. 2 Propiedades químicas. – ESTEROISOMERÍA: Los aminoácidos se clasifican según su la estructura tridimensional en: Todos los aminoácidos que forman parte de las proteínas pertenecen a la serie estereoquímica L, pues las células los sintetizan empleando enzimas estereoespecíficos. Sin embargo, cuando un aa es sintetizado en el laboratorio por reacciones químicas no enzimáticas se obtiene una mezcla equimolecular de formas D y L. Esta mezcla ópticamente inactiva, se denomina mezcla racémica.

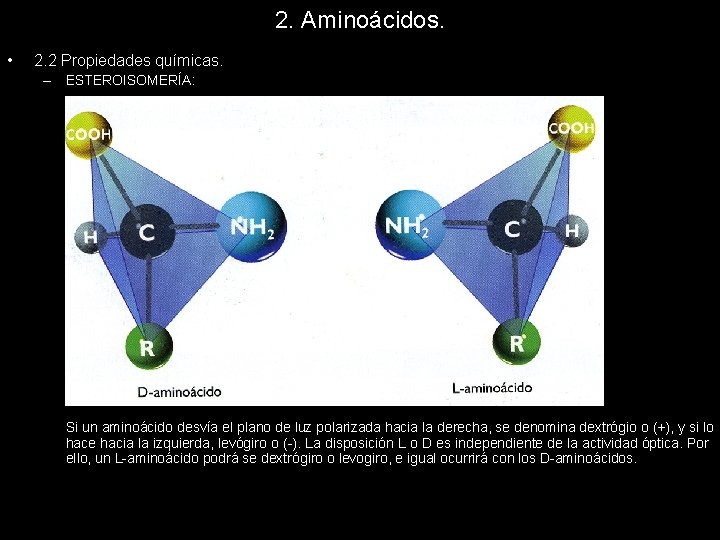
2. Aminoácidos. • 2. 2 Propiedades químicas. – ESTEROISOMERÍA: Si un aminoácido desvía el plano de luz polarizada hacia la derecha, se denomina dextrógio o (+), y si lo hace hacia la izquierda, levógiro o (-). La disposición L o D es independiente de la actividad óptica. Por ello, un L-aminoácido podrá se dextrógiro o levogiro, e igual ocurrirá con los D-aminoácidos.

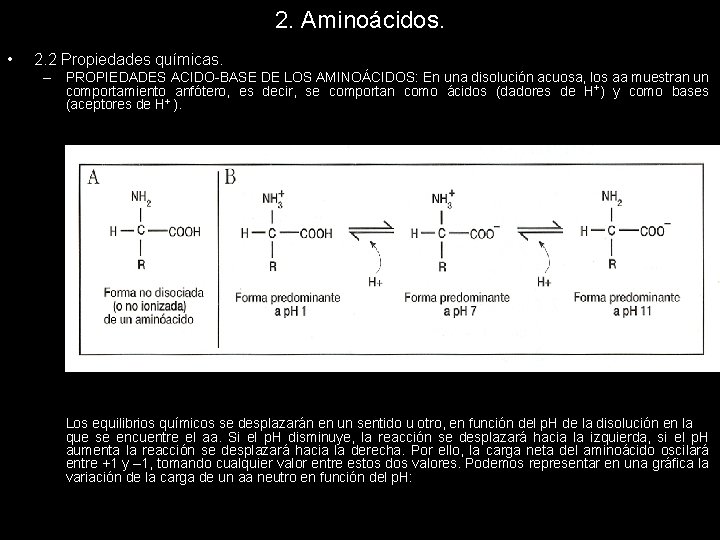
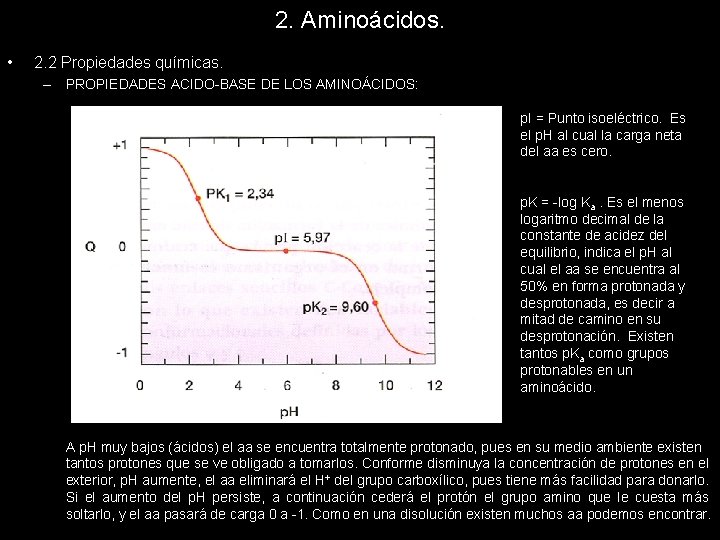
2. Aminoácidos. • 2. 2 Propiedades químicas. – PROPIEDADES ACIDO-BASE DE LOS AMINOÁCIDOS: En una disolución acuosa, los aa muestran un comportamiento anfótero, es decir, se comportan como ácidos (dadores de H+) y como bases (aceptores de H+ ). Los equilibrios químicos se desplazarán en un sentido u otro, en función del p. H de la disolución en la que se encuentre el aa. Si el p. H disminuye, la reacción se desplazará hacia la izquierda, si el p. H aumenta la reacción se desplazará hacia la derecha. Por ello, la carga neta del aminoácido oscilará entre +1 y – 1, tomando cualquier valor entre estos dos valores. Podemos representar en una gráfica la variación de la carga de un aa neutro en función del p. H:

2. Aminoácidos. • 2. 2 Propiedades químicas. – PROPIEDADES ACIDO-BASE DE LOS AMINOÁCIDOS: p. I = Punto isoeléctrico. Es el p. H al cual la carga neta del aa es cero. p. K = -log Ka. Es el menos logaritmo decimal de la constante de acidez del equilibrio, indica el p. H al cual el aa se encuentra al 50% en forma protonada y desprotonada, es decir a mitad de camino en su desprotonación. Existen tantos p. Ka como grupos protonables en un aminoácido. A p. H muy bajos (ácidos) el aa se encuentra totalmente protonado, pues en su medio ambiente existen tantos protones que se ve obligado a tomarlos. Conforme disminuya la concentración de protones en el exterior, p. H aumente, el aa eliminará el H+ del grupo carboxílico, pues tiene más facilidad para donarlo. Si el aumento del p. H persiste, a continuación cederá el protón el grupo amino que le cuesta más soltarlo, y el aa pasará de carga 0 a -1. Como en una disolución existen muchos aa podemos encontrar.

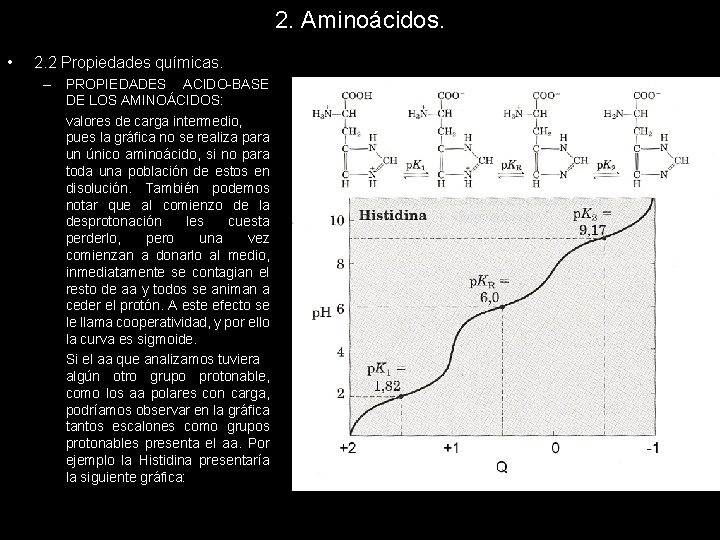
2. Aminoácidos. • 2. 2 Propiedades químicas. – PROPIEDADES ACIDO-BASE DE LOS AMINOÁCIDOS: valores de carga intermedio, pues la gráfica no se realiza para un único aminoácido, si no para toda una población de estos en disolución. También podemos notar que al comienzo de la desprotonación les cuesta perderlo, pero una vez comienzan a donarlo al medio, inmediatamente se contagian el resto de aa y todos se animan a ceder el protón. A este efecto se le llama cooperatividad, y por ello la curva es sigmoide. Si el aa que analizamos tuviera algún otro grupo protonable, como los aa polares con carga, podríamos observar en la gráfica tantos escalones como grupos protonables presenta el aa. Por ejemplo la Histidina presentaría la siguiente gráfica:

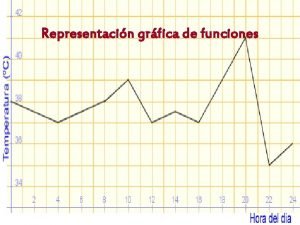
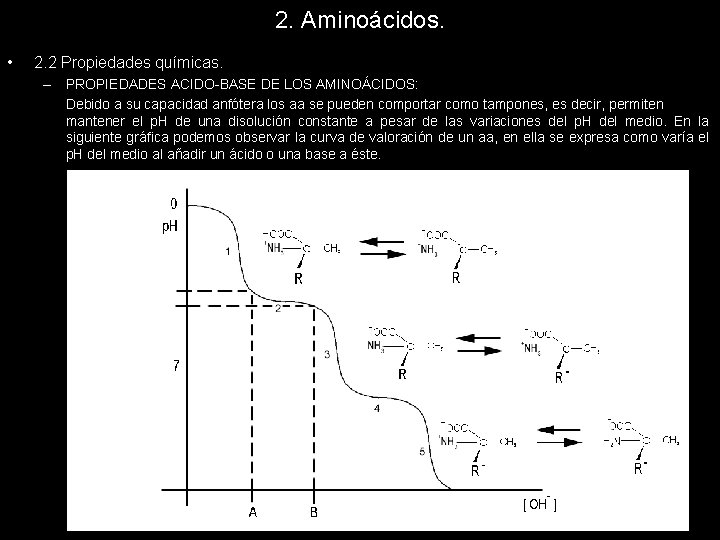
2. Aminoácidos. • 2. 2 Propiedades químicas. – PROPIEDADES ACIDO-BASE DE LOS AMINOÁCIDOS: Debido a su capacidad anfótera los aa se pueden comportar como tampones, es decir, permiten mantener el p. H de una disolución constante a pesar de las variaciones del p. H del medio. En la siguiente gráfica podemos observar la curva de valoración de un aa, en ella se expresa como varía el p. H del medio al añadir un ácido o una base a éste.

2. Aminoácidos. • 2. 2 Propiedades químicas. – PROPIEDADES ACIDO-BASE DE LOS AMINOÁCIDOS: (1) Podemos observar la desprotonación del grupo carboxílico. Como ya se ha comentado este proceso es cooperativo, es decir, con una variación muy pequeña de los OH- añadidos al medio se produce una rapidísima desprotonación de los grupos carboxílicos de los aa. Podríamos interpretar este hecho diciendo que al aminoácido le cuesta soltar el primer protón, pero cuando se anima lo hacen todos al mismo tiempo. En el punto de inflexión (donde la gráfica pasa de cóncava a convexa) se encuentra el p. Ka del aminoácido, indicándonos que a ese p. H el 50% del aminoácido está protonado y el 50% desprotonado, estamos a mitad de camino del proceso de dessprotonación del grupo carboxílico. (2) El grupo carboxílico ya se ha desprotonado al 100%, si seguimos retirando los H+ del medio porque seguimos añadiendo OH- que los neutralizan, el aminoácido perderá el siguiente protón que corresponde a un grupo carboxílico situado en el residuo. Hasta que se animen los aa a perder este protón deberemos añadir muchos grupos OH-, ya sabemos que los aa se animan pero les cuesta un poco perder los protones. Justo en este momento en que la gráfica es prácticamente horizontal se presenta la capacidad tamponadora de los aa. Tendremos que fijarnos en los puntos A y B, y observar la enorme cantidad de grupos OH- (base) que se están añadiendo y, sin embargo, el p. H no varía prácticamente nada. Por ello se dice que a ese p. H el aminoácido tiene capacidad de tamponar o amortiguar las variaciones del medio. Ya que, en resumen; lo que hacemos es añadir una base fuerte al medio y en ese tramo no conseguimos modificar el p. H, motivo por el cual lo mantienen constante. (3) Al igual que en el punto 1, cuando se animan a perder el protón lo hacen masivamente, por eso la pendiente de la gráfica es tan elevada. En el punto de inflexión encontraríamos el segundo p. Ka del aa, que corresponde al equilibrio de desprotonación del radical.

2. Aminoácidos. • 2. 2 Propiedades químicas. – PROPIEDADES ACIDO-BASE DE LOS AMINOÁCIDOS: (4) Segunda zona de tamponamiento. Razonamiento idéntico al punto 2. (5) Pérdida del tercer H+, razonamiento idéntico a los puntos 1 y 3. En el punto de inflexión encontraríamos el tercer p. Ka del aminoácido que determina la pérdida del protón del grupo amino.

Proteínas • • 1. Concepto, funciones y clasificación. 2. Aminoácidos. – 2. 1. Definición, características y clasificación. – 2. 2. Propiedades químicas. 3. Enlace peptídico. – 3. 1 Definición. – 3. 2 Características. 4. Proteínas. – 4. 1 Estructura. • Estructura 1ª. • Estructura 2ª. • Estructura 3ª. • Estructura 4ª – 4. 2 Propiedades. – 4. 3 Clasificación. • Holoproteínas o proteínas simples. – Holoproteínas globulares. – Holoproteínas fibrosas. • Heteroproteínas o proteínas complejas. – Glucoproteínas. – Fosfoproteínas. – Lipoprotínas. – Nucleoprotínas. – Cromoproteínas.

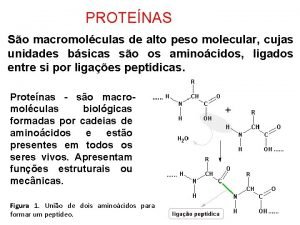
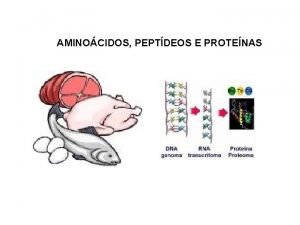
3. Enlace peptídico. • 3. 1 Definición. – Los aminoácidos se unen entre sí mediante enlaces peptídicos, estos son enlaces covalentes formados entre el grupo carboxilo y amino de dos aminoácidos por deshidratación. – Químicamente el enlace peptídico es tipo amida. A cada uno de los aminoácidos que forman un péptido se les denomina residuos.

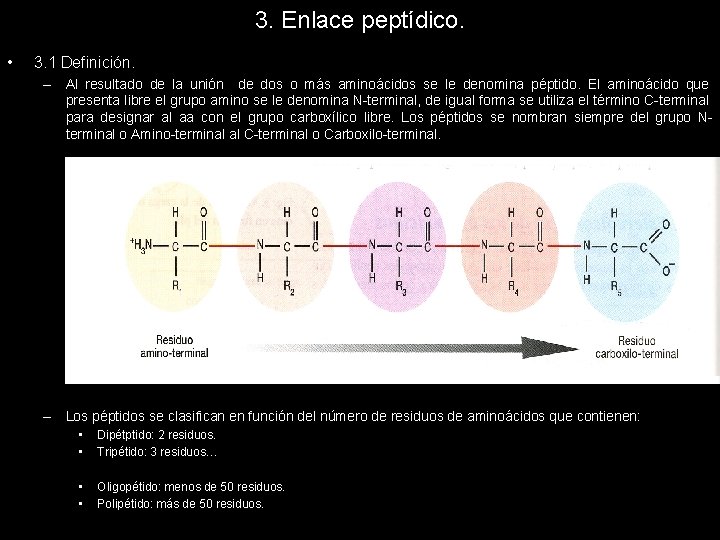
3. Enlace peptídico. • 3. 1 Definición. – Al resultado de la unión de dos o más aminoácidos se le denomina péptido. El aminoácido que presenta libre el grupo amino se le denomina N-terminal, de igual forma se utiliza el término C-terminal para designar al aa con el grupo carboxílico libre. Los péptidos se nombran siempre del grupo Nterminal o Amino-terminal al C-terminal o Carboxilo-terminal. – Los péptidos se clasifican en función del número de residuos de aminoácidos que contienen: • • Dipétptido: 2 residuos. Tripétido: 3 residuos… • • Oligopétido: menos de 50 residuos. Polipétido: más de 50 residuos.

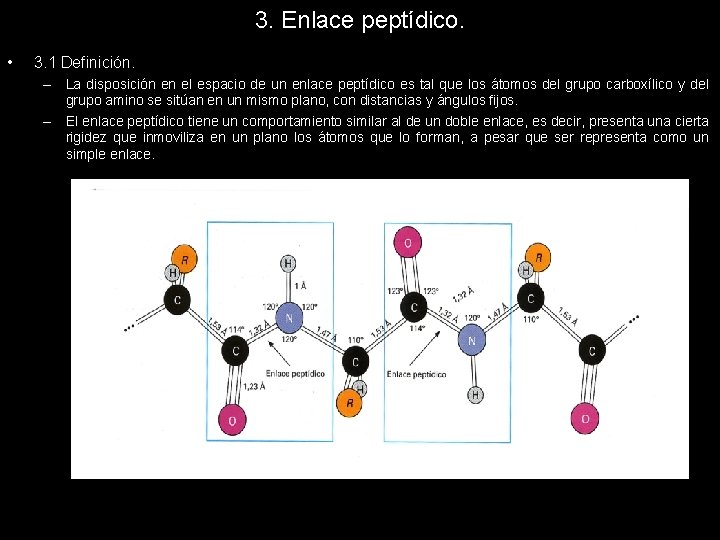
3. Enlace peptídico. • 3. 1 Definición. – La disposición en el espacio de un enlace peptídico es tal que los átomos del grupo carboxílico y del grupo amino se sitúan en un mismo plano, con distancias y ángulos fijos. – El enlace peptídico tiene un comportamiento similar al de un doble enlace, es decir, presenta una cierta rigidez que inmoviliza en un plano los átomos que lo forman, a pesar que ser representa como un simple enlace.

3. Enlace peptídico. • 3. 1 Definición. – La longitud del enlace peptídico es intermedia entre el simple y el doble enlace; otro motivo que nos hace pensar que no sea un simple enlace, tal y como se representa normalmente.

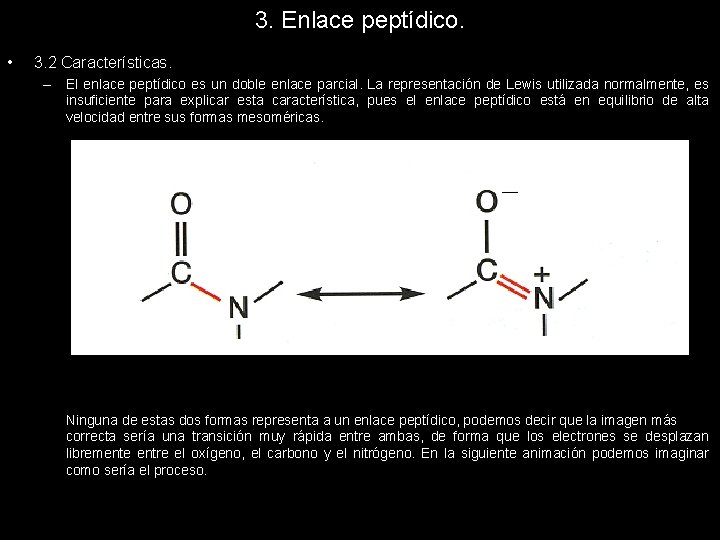
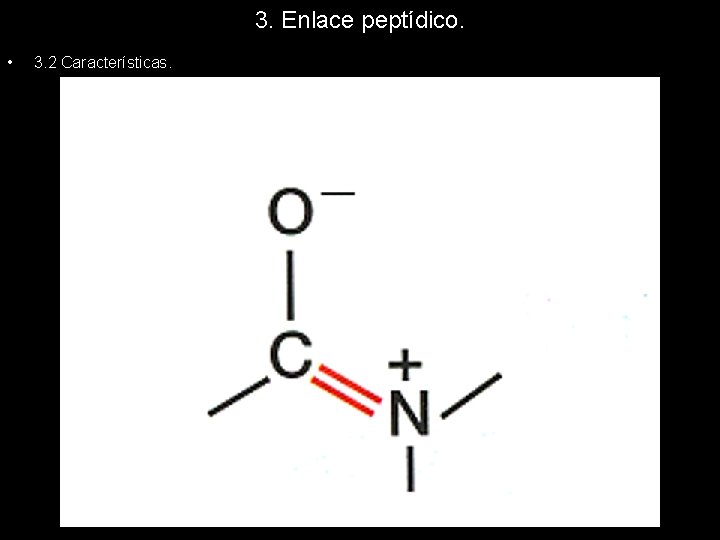
3. Enlace peptídico. • 3. 2 Características. – El enlace peptídico es un doble enlace parcial. La representación de Lewis utilizada normalmente, es insuficiente para explicar esta característica, pues el enlace peptídico está en equilibrio de alta velocidad entre sus formas mesoméricas. Ninguna de estas dos formas representa a un enlace peptídico, podemos decir que la imagen más correcta sería una transición muy rápida entre ambas, de forma que los electrones se desplazan libremente entre el oxígeno, el carbono y el nitrógeno. En la siguiente animación podemos imaginar como sería el proceso.

3. Enlace peptídico. • 3. 2 Características.

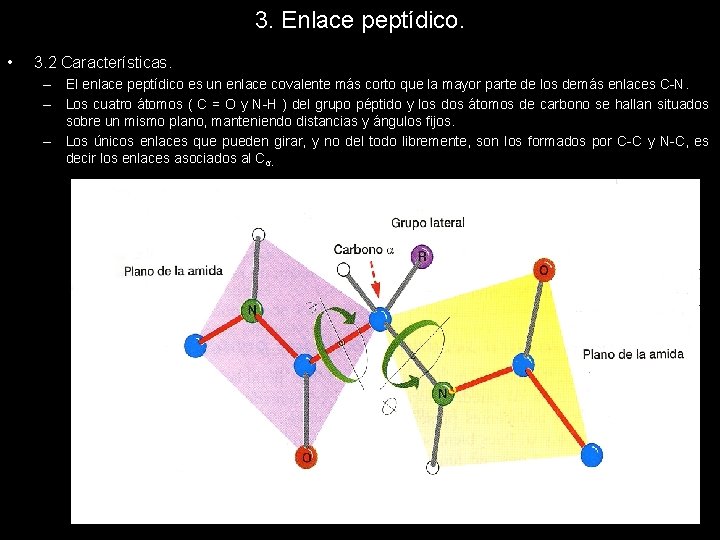
3. Enlace peptídico. • 3. 2 Características. – El enlace peptídico es un enlace covalente más corto que la mayor parte de los demás enlaces C-N. – Los cuatro átomos ( C = O y N-H ) del grupo péptido y los dos átomos de carbono se hallan situados sobre un mismo plano, manteniendo distancias y ángulos fijos. – Los únicos enlaces que pueden girar, y no del todo libremente, son los formados por C-C y N-C, es decir los enlaces asociados al Cα.

Proteínas • • 1. Concepto, funciones y clasificación. 2. Aminoácidos. – 2. 1. Definición, características y clasificación. – 2. 2. Propiedades químicas. 3. Enlace peptídico. – 3. 1 Definición. – 3. 2 Características. 4. Proteínas. – 4. 1 Estructura. • Estructura 1ª. • Estructura 2ª. • Estructura 3ª. • Estructura 4ª – 4. 2 Propiedades. – 4. 3 Clasificación. • Holoproteínas o proteínas simples. – Holoproteínas globulares. – Holoproteínas fibrosas. • Heteroproteínas o proteínas complejas. – Glucoproteínas. – Fosfoproteínas. – Lipoprotínas. – Nucleoprotínas. – Cromoproteínas.

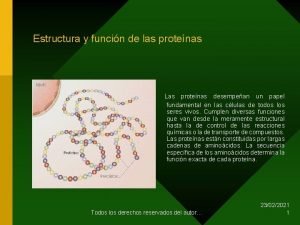
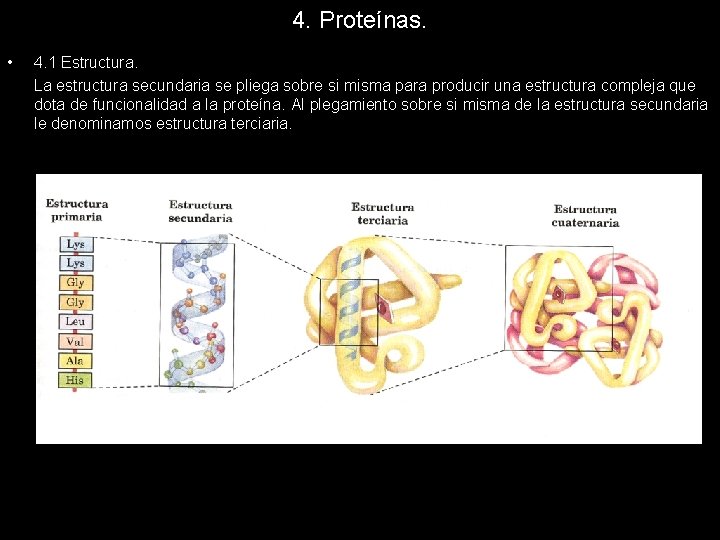
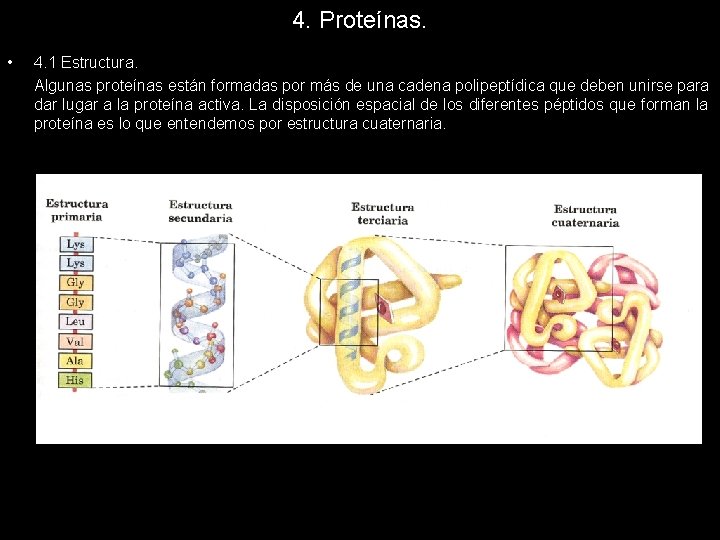
4. Proteínas. • 4. 1 Estructura. Las diferentes estructuras que adopta una proteína en el espacio y la clasificación que de ellas se hace no es más que un intento de clarificar el complejo entramado proteico que se observa cuando se estudia la estructura de una proteína cualquiera. A partir de una cadena más o menos lineal de aminoácidos, unidos mediante enlaces peptídicos, aparece la estructura primaria. El plegamiento de esta sobre si misma daría lugar a la estructura secundaria, que a su vez puede plegarse para formar la estructura terciaria. Cuando dos cadenas polipeptídicas interaccionan para formar una proteína compleja surge una nueva estructura denominada cuaternaria.

4. Proteínas. • 4. 1 Estructura. – Estructura primaria: Se define como el orden en el que están enlazados los aminoácidos desde el extremo Nterminal al C-terminal. Todas las proteínas poseen estructura primaria, pues todas ellas son polímeros de aminoácidos unidos mediante enlaces peptídicos. La estructura primaria de la proteína es la más importante, ya que determina la estructura 2ª, 3ª y 4ª de la proteína, y por lo tanto su funcionalidad. El orden de enlace de los aminoácidos en la estructura primaria viene determinado por el ADN, el cual contiene la información para determinar la estructura primaria de una proteína.

4. Proteínas. • 4. 1 Estructura. – Estructura primaria: Teniendo en cuenta que existe 20 aa proteícos, en una proteína de 100 aa se podrían crear 20100 combinaciones diferentes, un número tan grande que es imposible pensar que es el azar quien determinó la formación de las primera proteínas. De todas las combinaciones posibles, tan solo unas pocas son funcionales y tienen sentido biológico.

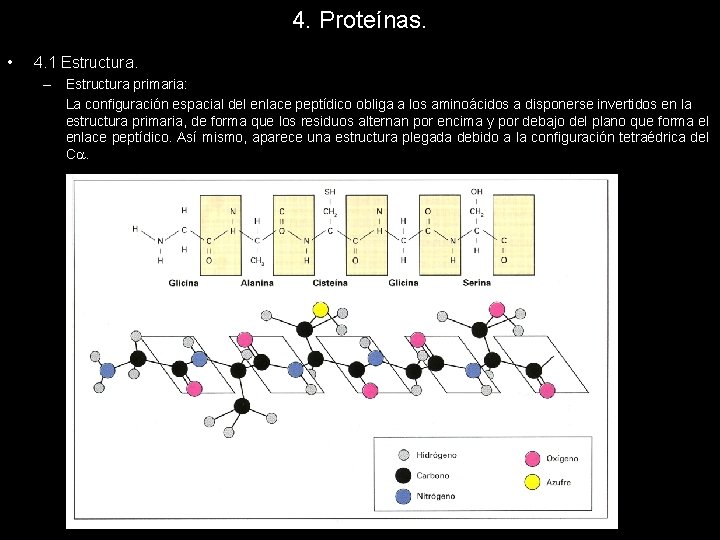
4. Proteínas. • 4. 1 Estructura. – Estructura primaria: La configuración espacial del enlace peptídico obliga a los aminoácidos a disponerse invertidos en la estructura primaria, de forma que los residuos alternan por encima y por debajo del plano que forma el enlace peptídico. Así mismo, aparece una estructura plegada debido a la configuración tetraédrica del C.

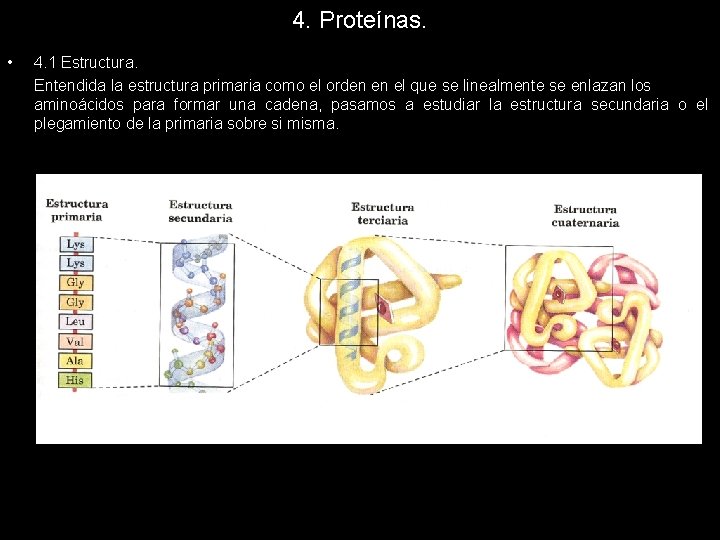
4. Proteínas. • 4. 1 Estructura. Entendida la estructura primaria como el orden en el que se linealmente se enlazan los aminoácidos para formar una cadena, pasamos a estudiar la estructura secundaria o el plegamiento de la primaria sobre si misma.

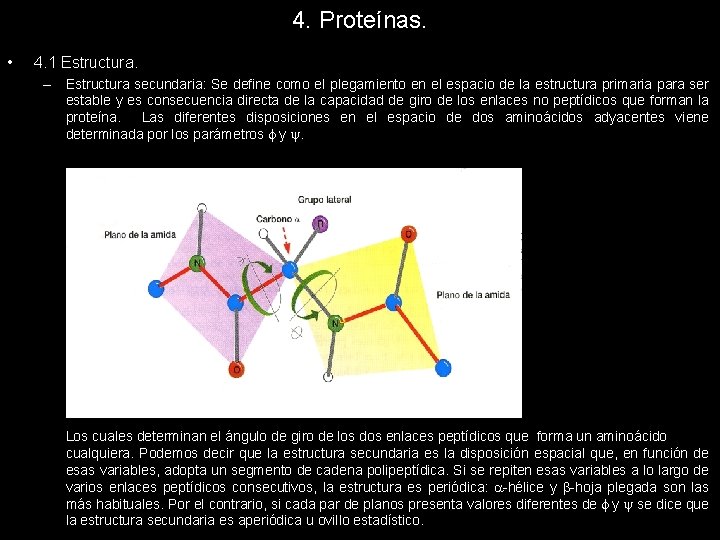
4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: Se define como el plegamiento en el espacio de la estructura primaria para ser estable y es consecuencia directa de la capacidad de giro de los enlaces no peptídicos que forman la proteína. Las diferentes disposiciones en el espacio de dos aminoácidos adyacentes viene determinada por los parámetros y . Los cuales determinan el ángulo de giro de los dos enlaces peptídicos que forma un aminoácido cualquiera. Podemos decir que la estructura secundaria es la disposición espacial que, en función de esas variables, adopta un segmento de cadena polipeptídica. Si se repiten esas variables a lo largo de varios enlaces peptídicos consecutivos, la estructura es periódica: -hélice y -hoja plegada son las más habituales. Por el contrario, si cada par de planos presenta valores diferentes de y se dice que la estructura secundaria es aperiódica u ovillo estadístico.

4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: Dentro de una misma cadena polipeptídica podemos encontrar tramos con diferentes estructuras secundarias que dependen de la estructura primaria, es decir, dependen de los aa que existan en ese tramo y el orden en el que están colocados.

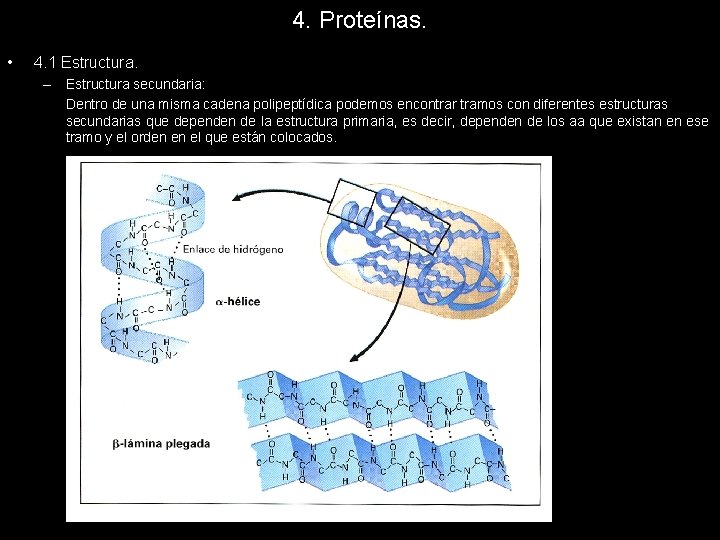
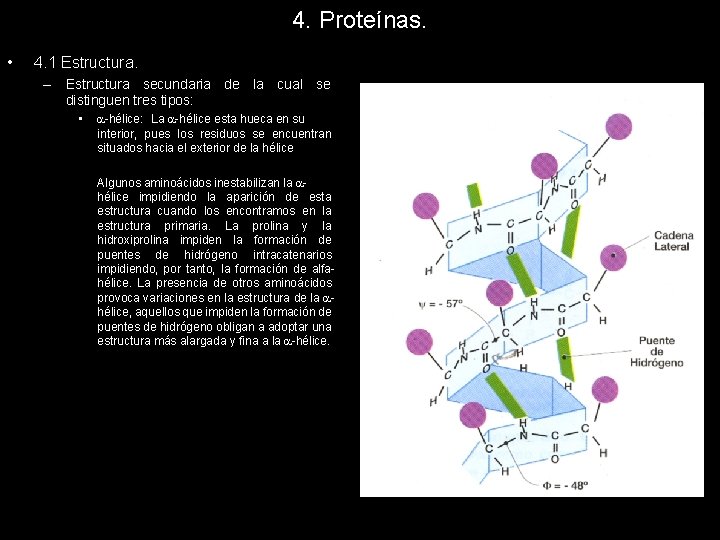
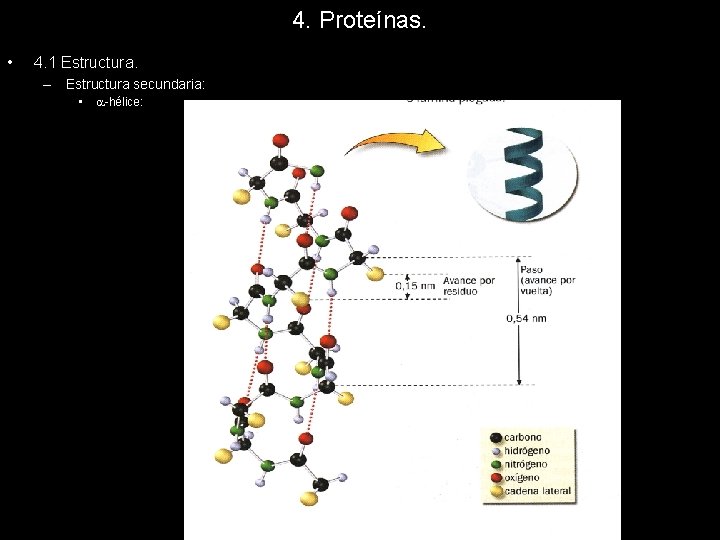
4. Proteínas. • 4. 1 Estructura. – Estructura secundaria de la cual se distinguen tres tipos: • -hélice: Los planos de los sucesivos enlaces peptídicos se encuentran formando una hélice dextrógira. Cada plano gira respecto al anterior 100º, de forma que encontramos 3, 6 residuos por vuelta de hélice. La distancia entre un residuo y el siguiente situado en la misma posición es de 5, 4 A. La estructura se mantiene estable gracias a la formación de puentes de hidrógeno intracatenarios. Cada enlace peptídico establece un puente de hidrógeno con el situado 4 posiciones por delante y por detrás en la estructura primaria. La -hélice esta hueca en su interior, pues los residuos se encuentran situados hacia el exterior de la helice

4. Proteínas. • 4. 1 Estructura. – Estructura secundaria de la cual se distinguen tres tipos: • -hélice: La -hélice esta hueca en su interior, pues los residuos se encuentran situados hacia el exterior de la hélice Algunos aminoácidos inestabilizan la hélice impidiendo la aparición de esta estructura cuando los encontramos en la estructura primaria. La prolina y la hidroxiprolina impiden la formación de puentes de hidrógeno intracatenarios impidiendo, por tanto, la formación de alfahélice. La presencia de otros aminoácidos provoca variaciones en la estructura de la hélice, aquellos que impiden la formación de puentes de hidrógeno obligan a adoptar una estructura más alargada y fina a la -hélice.

4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: • -hélice:

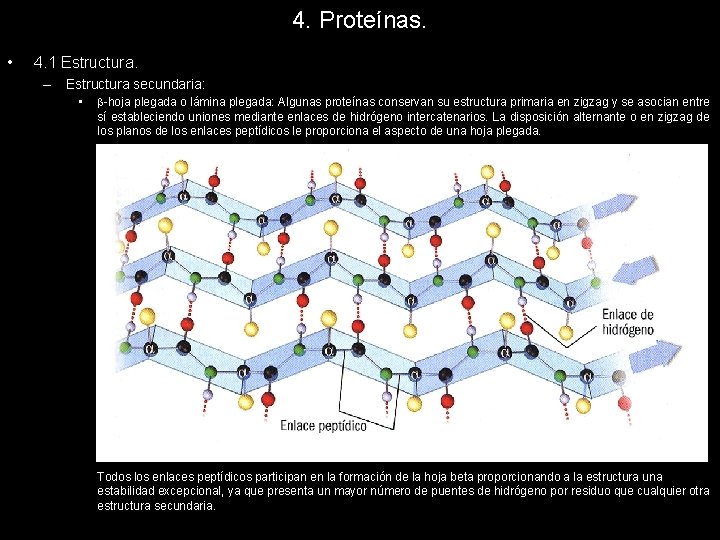
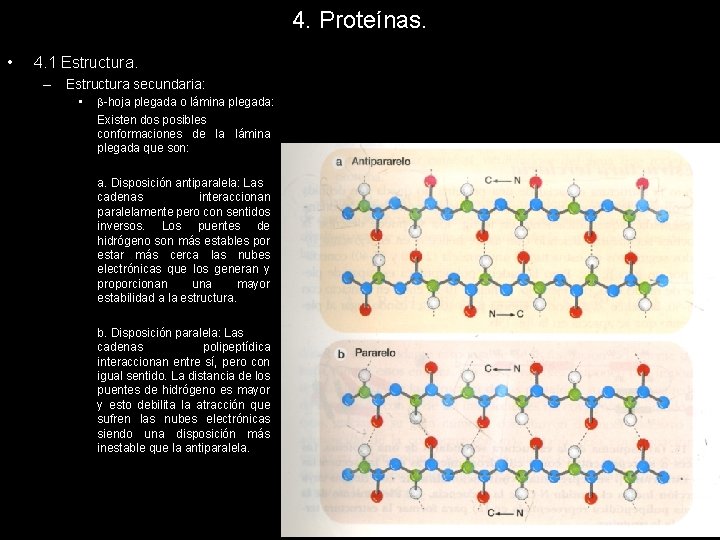
4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: • -hoja plegada o lámina plegada: Algunas proteínas conservan su estructura primaria en zigzag y se asocian entre sí estableciendo uniones mediante enlaces de hidrógeno intercatenarios. La disposición alternante o en zigzag de los planos de los enlaces peptídicos le proporciona el aspecto de una hoja plegada. Todos los enlaces peptídicos participan en la formación de la hoja beta proporcionando a la estructura una estabilidad excepcional, ya que presenta un mayor número de puentes de hidrógeno por residuo que cualquier otra estructura secundaria.

4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: • -hoja plegada o lámina plegada: Existen dos posibles conformaciones de la lámina plegada que son: a. Disposición antiparalela: Las cadenas interaccionan paralelamente pero con sentidos inversos. Los puentes de hidrógeno son más estables por estar más cerca las nubes electrónicas que los generan y proporcionan una mayor estabilidad a la estructura. b. Disposición paralela: Las cadenas polipeptídica interaccionan entre sí, pero con igual sentido. La distancia de los puentes de hidrógeno es mayor y esto debilita la atracción que sufren las nubes electrónicas siendo una disposición más inestable que la antiparalela.

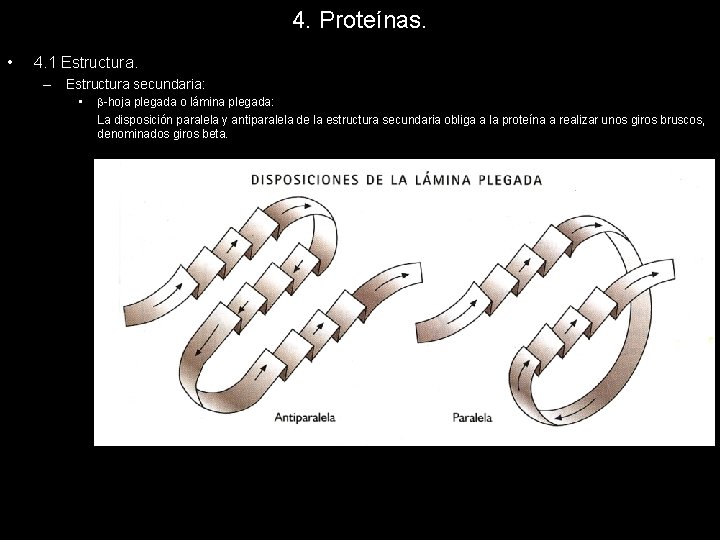
4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: • -hoja plegada o lámina plegada: La disposición paralela y antiparalela de la estructura secundaria obliga a la proteína a realizar unos giros bruscos, denominados giros beta.

4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: • Ovillo estadístico: Cuando no se repiten periódicamente los parámetros que determinan la estructura secundaria, decimos que el plegamiento de la estructura primaria es el más estable desde el punto de vista energético. Esta estructura aperiódica puede adoptar cualquier disposición espacial que depende de los aminoácidos implicados en ese tramo de proteína.

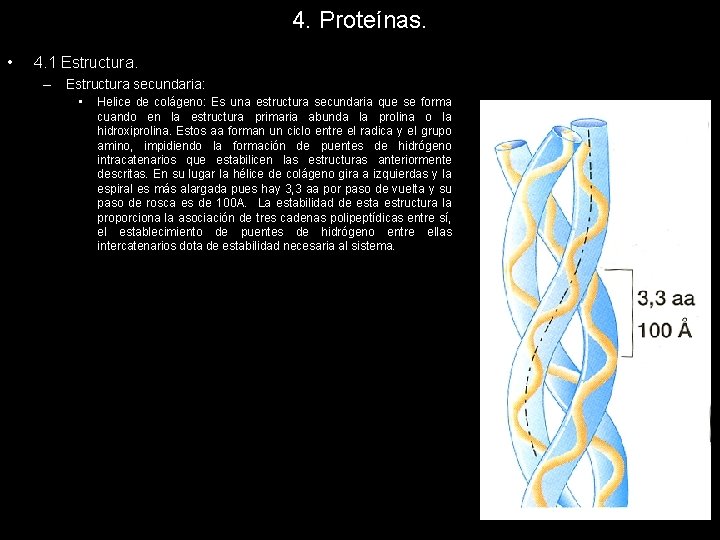
4. Proteínas. • 4. 1 Estructura. – Estructura secundaria: • Helice de colágeno: Es una estructura secundaria que se forma cuando en la estructura primaria abunda la prolina o la hidroxiprolina. Estos aa forman un ciclo entre el radica y el grupo amino, impidiendo la formación de puentes de hidrógeno intracatenarios que estabilicen las estructuras anteriormente descritas. En su lugar la hélice de colágeno gira a izquierdas y la espiral es más alargada pues hay 3, 3 aa por paso de vuelta y su paso de rosca es de 100 A. La estabilidad de esta estructura la proporciona la asociación de tres cadenas polipeptídicas entre sí, el establecimiento de puentes de hidrógeno entre ellas intercatenarios dota de estabilidad necesaria al sistema.

4. Proteínas. • 4. 1 Estructura. La estructura secundaria se pliega sobre si misma para producir una estructura compleja que dota de funcionalidad a la proteína. Al plegamiento sobre si misma de la estructura secundaria le denominamos estructura terciaria.

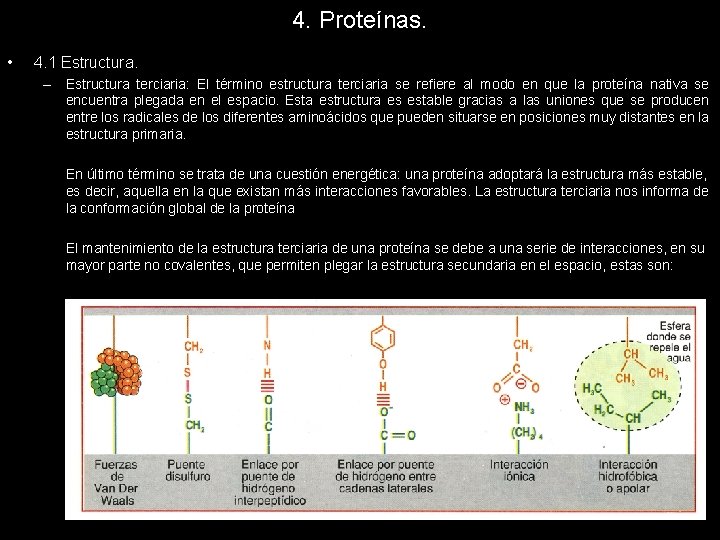
4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: El término estructura terciaria se refiere al modo en que la proteína nativa se encuentra plegada en el espacio. Esta estructura es estable gracias a las uniones que se producen entre los radicales de los diferentes aminoácidos que pueden situarse en posiciones muy distantes en la estructura primaria. En último término se trata de una cuestión energética: una proteína adoptará la estructura más estable, es decir, aquella en la que existan más interacciones favorables. La estructura terciaria nos informa de la conformación global de la proteína El mantenimiento de la estructura terciaria de una proteína se debe a una serie de interacciones, en su mayor parte no covalentes, que permiten plegar la estructura secundaria en el espacio, estas son:

4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: 1. Fuerzas de van der Waals. Son interacciones muy débiles que surgen entre grupos no cargados pero que pueden polarizarse en presencia de una carga, o como consecuencia de desplazamientos electrónicos temporales. 2. Puentes disulfuro. Interacción covalente que se produce entre dos residuos de cisteína cercanos espacialmente, resultado de la oxidación de los grupos tioles de los aa. 3. Puentes de hidrógeno intrapeptídico. Interacción no covalente que se establece entre dos residuos de aminoácidos próximos entre sí. Es el mismo tipo de interacción que mantiene la estructura secundaria. 4. Puentes de hidrógeno entre grupos R. Los residuos de los aminoácidos polares que forman la cadena polipeptídica pueden interaccionar entre sí estableciendo puentes de hidrógeno que ayudan a estabilizar la estructura terciaria de la proteína. 5. Interacciones iónicas. Los residuos de los aminoácidos con carga de la proteína pueden interaccionar, las cargas positivas con las negativas estableciéndose una atracción electrostática entre ellas. 6. Interacción hidrofóbica. Los residuos de los aa apolares repelen el agua y tienden a reunirse entre sí creando un entorno apolar más cómodo para ellos.

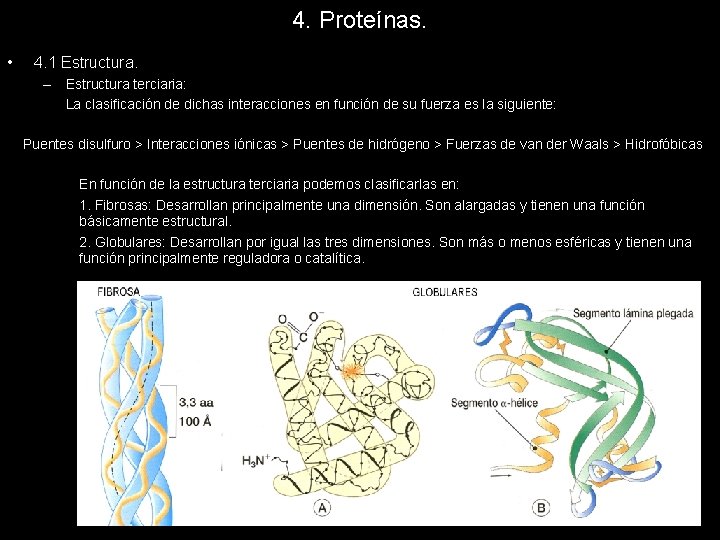
4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: La clasificación de dichas interacciones en función de su fuerza es la siguiente: Puentes disulfuro > Interacciones iónicas > Puentes de hidrógeno > Fuerzas de van der Waals > Hidrofóbicas En función de la estructura terciaria podemos clasificarlas en: 1. Fibrosas: Desarrollan principalmente una dimensión. Son alargadas y tienen una función básicamente estructural. 2. Globulares: Desarrollan por igual las tres dimensiones. Son más o menos esféricas y tienen una función principalmente reguladora o catalítica.

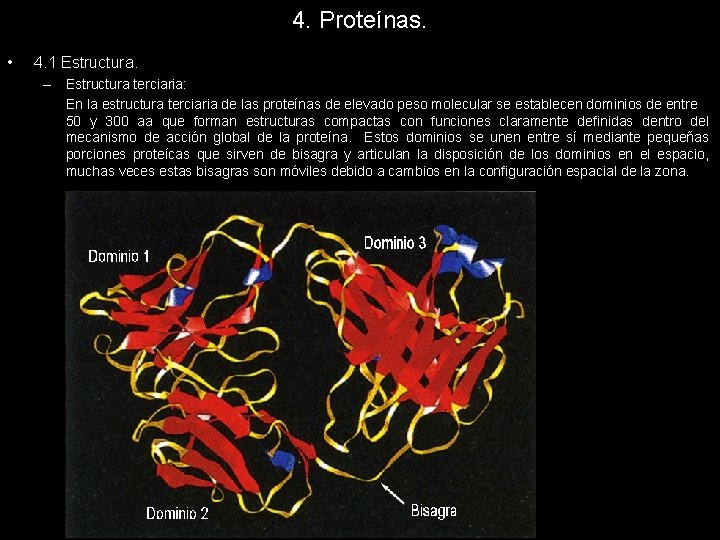
4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: En la estructura terciaria de las proteínas de elevado peso molecular se establecen dominios de entre 50 y 300 aa que forman estructuras compactas con funciones claramente definidas dentro del mecanismo de acción global de la proteína. Estos dominios se unen entre sí mediante pequeñas porciones proteícas que sirven de bisagra y articulan la disposición de los dominios en el espacio, muchas veces estas bisagras son móviles debido a cambios en la configuración espacial de la zona.

4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: Los dominios son específicos de la actividad proteica, tanto a nivel funcional como estructural y, por lo tanto desarrollan actividades muy concretas. Proteínas diferentes pueden desarrollar actividades similares, por ejemplo: las enzima hidrolíticas están encargada de romper enlaces añadiendo una molécula de agua, pero esta actividad la realizan sobre diferentes sustratos (enlaces peptídicos, enlaces fosfoester… ); en ellas podemos observar que la acividad la realizan con ciertos dominios similares entre sí que se ocupan de ejecutar la tarea hidrolítica. La repetición de estos dominios se debe a un mecanismo de evolución molecular por el cual aquellos dominios eficaces tienden a repetirse para realizar tareas similares en otras proteínas. La explicación de esta selección de motivos está en el ADN. Las proteínas primitivas estaban formadas por un único dominio que realizaba con eficacia su tarea, la fusión de los genes que codificaban la proteína provocó la aparición de proteínas más complejas con varios dominios que mejoraban la eficiencia del proceso. En la configuración de la estructura terciaria de una proteína podemos encontrar motivos estructurales que se repiten dentro de una misma proteína. Estos motivos son combinaciones de elementos de la estructura secundaria que se repiten pues realizan funciones concretas y necesarias para las proteínas. Los motivos son más pequeños que los dominios, pero se pueden confundir con facilidad pues no existe un criterio definitivo para diferenciarlos.

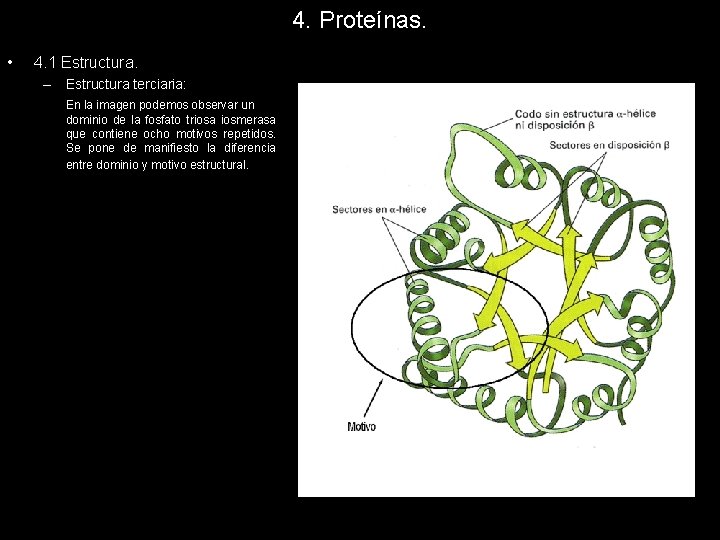
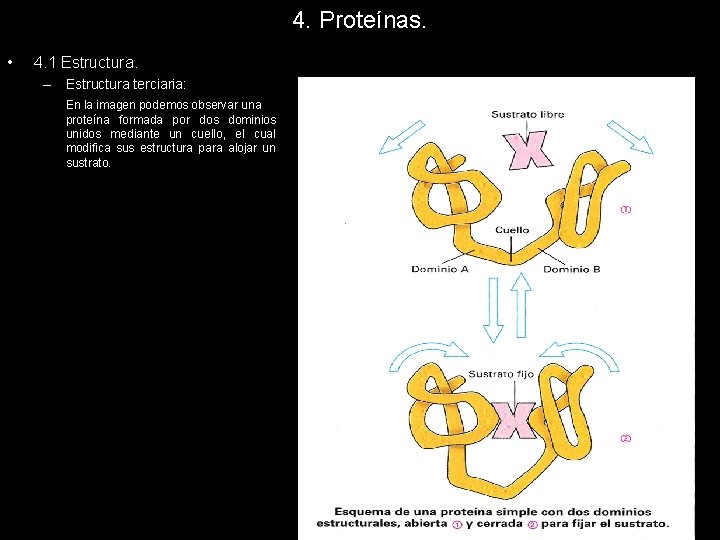
4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: En la imagen podemos observar un dominio de la fosfato triosa iosmerasa que contiene ocho motivos repetidos. Se pone de manifiesto la diferencia entre dominio y motivo estructural.

4. Proteínas. • 4. 1 Estructura. – Estructura terciaria: En la imagen podemos observar una proteína formada por dos dominios unidos mediante un cuello, el cual modifica sus estructura para alojar un sustrato.

4. Proteínas. • 4. 1 Estructura. Algunas proteínas están formadas por más de una cadena polipeptídica que deben unirse para dar lugar a la proteína activa. La disposición espacial de los diferentes péptidos que forman la proteína es lo que entendemos por estructura cuaternaria.

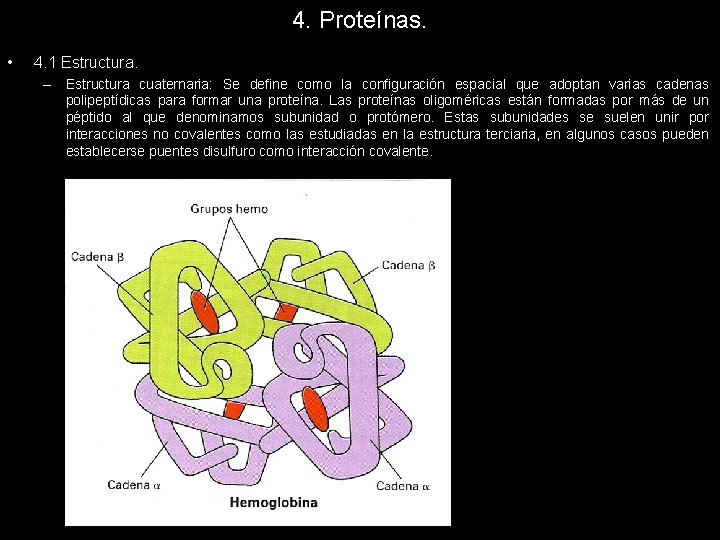
4. Proteínas. • 4. 1 Estructura. – Estructura cuaternaria: Se define como la configuración espacial que adoptan varias cadenas polipeptídicas para formar una proteína. Las proteínas oligoméricas están formadas por más de un péptido al que denominamos subunidad o protómero. Estas subunidades se suelen unir por interacciones no covalentes como las estudiadas en la estructura terciaria, en algunos casos pueden establecerse puentes disulfuro como interacción covalente.

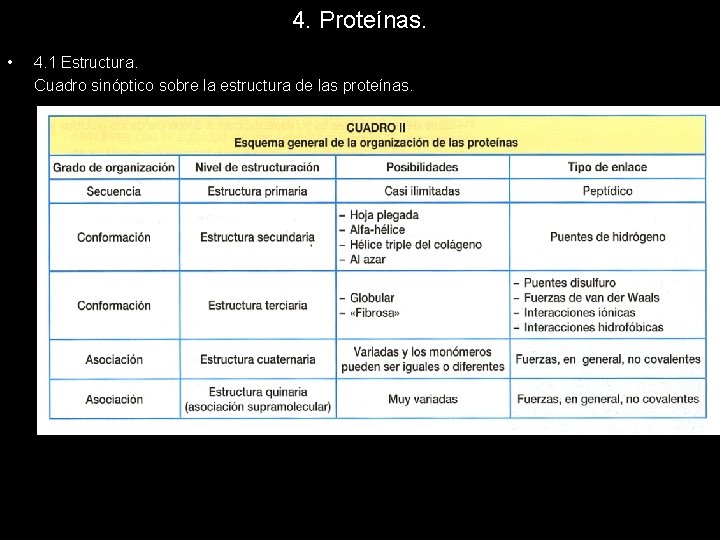
4. Proteínas. • 4. 1 Estructura. Cuadro sinóptico sobre la estructura de las proteínas.

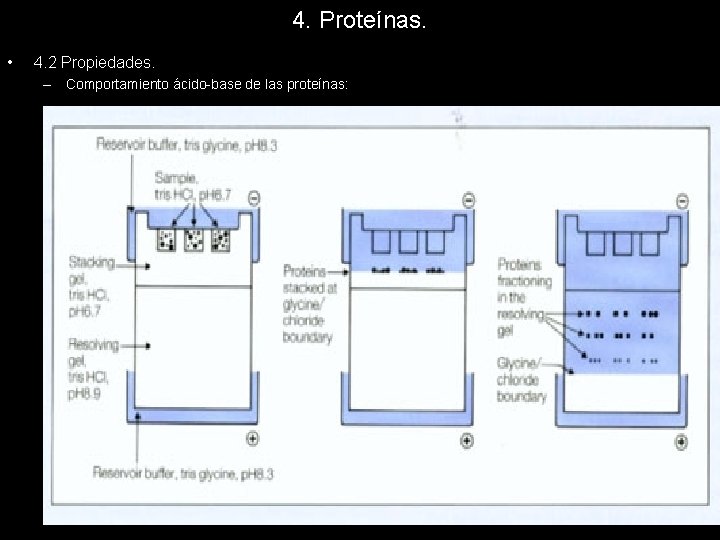
4. Proteínas. • 4. 2 Propiedades. – Comportamiento ácido-base de las proteínas: A diferencia de lo que ocurre con los aa libres, los grupos carboxílicos y aminos de estos, no contribuyen a las propiedades ácido-base de las proteínas ya que, al estar formando parte del enlace petídico desaparecen como tales grupos funcionales. Evidentemente los grupos de los aminoácidos terminales son una excepción. Los verdaderos responsables de las propiedades ácido-base son los residuos de los aminoácidos polares con carga que tienen capacidad de protonarse y desprotonarse a p. H celulares. Son básicos lisina, arginina e histidina y ácidos el aspártico y glutámico. Al reaccionar como ácidos y bases tienen la capacidad de adquirir cargas positivas y negativas existiendo un punto isoeléctrico que se define como el p. H al cual la carga neta de la proteína es cero. Dado que pueden comportarse como ácidos y bases a un tiempo, pues pueden poseer aa ácidos y básicos en una misma cadena polipeptídica, podemos decir que las proteínas son anfóteras. Esto significa que tengan capacidad de tamponar las disoluciones en las que estén presentes. Evidentemente el comportamiento en una proteína con 200 0 300 aa es tremendamente complejo pues la capacidad de protonación o desprotonación de los residuos depende en gran medida del entorno químico en el que estén situados. La capacidad de adquirir diferentes cargas en función del p. H de las proteínas nos proporciona una técnica de separación de las mismas. El método más utilizado es la electroforesis en la que las proteínas son sometidas a un campo eléctrico en el interior de un gel. Estas se desplazarán en función de la carga hacia el ánodo o cátodo, y en función de su volumen y masa.

4. Proteínas. • 4. 2 Propiedades. – Comportamiento ácido-base de las proteínas:

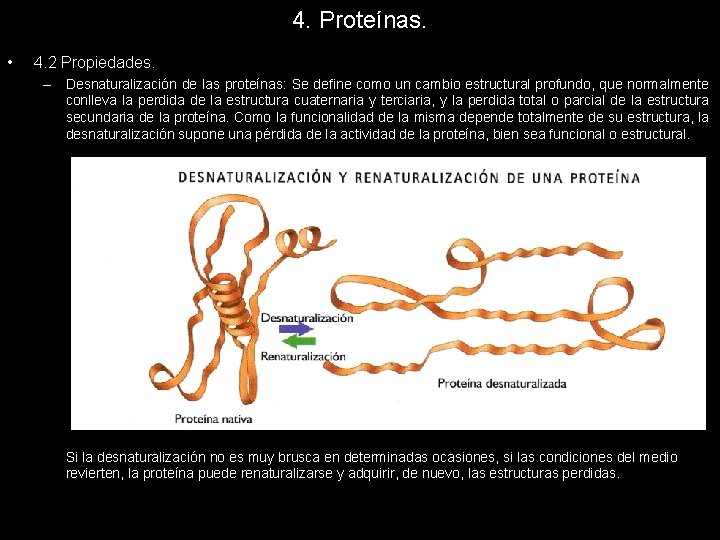
4. Proteínas. • 4. 2 Propiedades. – Desnaturalización de las proteínas: Se define como un cambio estructural profundo, que normalmente conlleva la perdida de la estructura cuaternaria y terciaria, y la perdida total o parcial de la estructura secundaria de la proteína. Como la funcionalidad de la misma depende totalmente de su estructura, la desnaturalización supone una pérdida de la actividad de la proteína, bien sea funcional o estructural. Si la desnaturalización no es muy brusca en determinadas ocasiones, si las condiciones del medio revierten, la proteína puede renaturalizarse y adquirir, de nuevo, las estructuras perdidas.

4. Proteínas. 4. 2 Propiedades. • Desnaturalización de las proteínas: Los factores que provocan la desnaturalización de las proteínas son múltiples y los agrupamos en: – Factores físicos: • Temperatura: Un aumento de la temperatura considerable provoca un cambio en el estado de vibración de los átomos que forman la molécula provocando la rotura de las interacciones que mantienen la estructura 3ª y 2ª. Ej. Ovoalbúmina del huevo. • Radiación: Las radiaciones UV provocan la

4. Proteínas. 4. 2 Propiedades. • Desnaturalización de las proteínas: Factores químicos: – p. H: Variaciones del p. H por encima de dos unidades puede provocar cambios en el estado de protonación de los residuos de los aminoácidos cargados y por lo tanto modificar las interacciones que mantienen las estructuras proteicas. – Urea: La adición de urea a una disolución de proteínas puede provocar su desnaturalizacion, pues esta compite por formar puentes de hidrógeno con los enlaces peptídicos intercalándose en la estructura proteica y provocando su desnaturalización. – Fuerza iónica: Un aumento de la fuerza iónica del medio supone una elevación en la concentración de iones, estos se adhieren a los residuos de los aminoácidos cargados

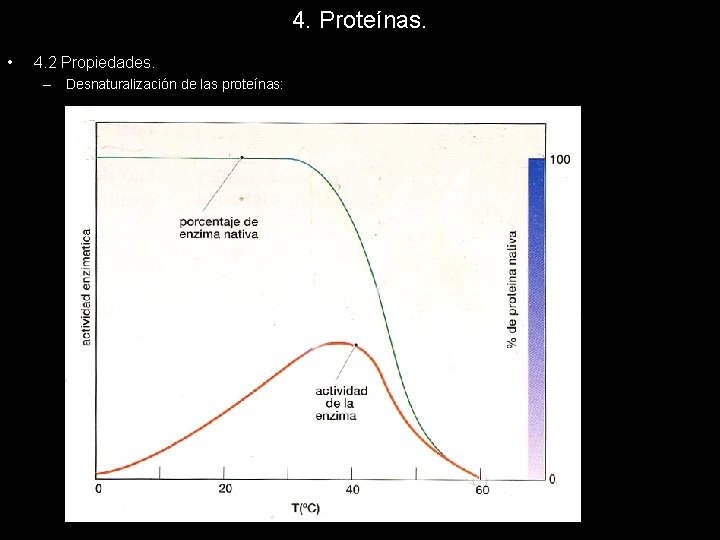
4. Proteínas. 4. 2 Propiedades. La desnaturalización de las proteínas tiene dos efectos inmediatos sobre estas: – Precipitación: Las proteínas que se desnaturalizan en una disolución acuosa suelen precipitar al perder su estructura globular. Los residuos polares que ocupan la parte exterior al cambiar la estructura se redistribuyen y la superficie de la proteína desnaturalizada deja de ser polar, y por lo tanto pierde su estabilidad en el agua. A continuación las proteínas se agregan al estabilizarse entre ellas y forman partículas de agregados proteicos de un tamaño tal que ya no se sostienen en suspensión y precipitan al fondo. La desnaturalización de las proteínas globulares también provoca un cambio en su estructura terciaria adoptando una forma más fibrosa, claramente insoluble y precipitan. – Inactivación: La perdida de la estructura tridimensional de la proteína va asociada a una perdida de su actividad, pues la estructura de una péptido es indispensable para su actividad. Por ello podemos estudiar el proceso de desnaturalización de la

4. Proteínas. • 4. 2 Propiedades. – Desnaturalización de las proteínas:

4. Proteínas. • 4. 2 Propiedades. – Solubilidad: Las proteínas son solubles en agua cuando las interacciones entre estas y el disolvente son más favorables que las interacciones entre las propias moléculas de proteína. Si se diera esta última circunstancia, las diferentes moléculas de proteína tenderían a interaccionar entre sí, aumentando el tamaño de la partícula impidiendo que se mantenga en suspensión. La mayor parte de las proteínas estructurales tienen pocos aminoácidos polares y son insolubles en agua. En las proteínas globulares, los aa polares están situados en la superficie y su solubilidad puede ser mayor o menor según la proporción de estos aa. La solubilidad de las proteínas viene afectada por varios factores: • • p. H: La solubilidad es mínima cunado el p. H = p. I, al ser la carga neta de la proteína nula, es más fácil que se produzcan interacciones proteína-proteína que cuando la molécula tiene carga + o - , ya que las repulsiones electrostática entre las molécula de proteína tienden a mantener alejadas a las moléculas proteicas. Concentración salina: Las proteínas son más solubles en disoluciones salinas diluidas que en agua pura, esto se debe a que los iones salinos que interaccionan con la proteína contribuyen a aumentar su polaridad. Sin embargo, si se sigue aumentando la concentración de salina, llega un momento en que la proteína precipita. En ese momento los iones salinos que tienden a rodearse de moléculas de agua en disolución, compiten con la proteína por las moléculas de agua: cuanta más agua se gaste en solvatar a los iones salinos, menos queda disponible para interaccionar con la proteína y esta acaba precipitando. – Especificidad: Es la capacidad de la proteína para ser selectiva en el tipo de interacciones que establece con un ligando. (Ligando = molécula que interacciona con una proteína del tipo que sea. ) • Especificidad de función: La interacción de una proteína con su ligando es una reacción estereoespecífica, es decir, se produce un reconocimiento estructural entre el centro activo de una enzima y el ligando. Cada proteína es capaz de interaccionar con un único ligando en su centro activo. La estructura tridimensional del centro activo es tal que acopla perfectamente con la estructura tridimensional del ligando, provocando un reconocimiento estereoespecífico como el de una llave con su cerradura.

4. Proteínas. • 4. 2 Propiedades. – Solubilidad: • Especificidad de especie. Existen proteínas específicas de cada especie que son exclusivas de estos individuos. Aquellas proteínas que desempeñan la misma función en especies diferentes con estructuras similares, pero no iguales, se llaman proteínas homólogas.

4. Proteínas. • 4. 3 Clasificación: • Holoproteínas o proteínas simples: Aquellas que están compuestas exclusivamente por aminoácidos. – Holoproteínas globulares. – Holoproteínas fibrosas. • Heteroproteínas o proteínas complejas: Aquellas que están compuestas por aminoácidos que consituyen la parte proteica y contienen otra porción no proteica denominada grupo prostético. – Glucoproteínas. – Fosfoproteínas. – Lipoprotínas. – Nucleoprotínas. – Cromoproteínas.

4. Proteínas. • Holoproteínas o proteínas simples: – Holoproteínas globulares. Las cadenas polipeptídicas que las forman se encuentra pelgadas formanado una estructura compacta, más o menos esférica. Son solubles en agua en su mayoría y realizan funciones dinámicas, principalmente. Las más importantes son: • • • 1. Protaminas: son proteínas básicas con una alta proporción de aminoácidos con grupos R básicos, solubles en agua, de Pm relativamente bajo (cercano a 5000). Se encuentran asociadas a los ácidos nucleicos. 2. Histonas: igualmente básicas y solubles en agua, pero de Pm algo mayor (10 000 -20 000). También se encuentran asociadas a los ácidos nucleicos. 3. Albúminas: solubles en disoluciones salinas, con Pm bastante mayor que las anteriores (30000 -100000). Destacan la ovalbúmina de la clara de huevo y la lactalbúmina de la leche, ambas con función de reserva proteica, y la seralbúmina de la sangre, cuya función es la de transportar diversas sustancias químicas. 4. Globulinas: son menos solubles que las albúminas y de Pm aún mayor (entre 100000 y 1 millón). Destacan las seroglobulinas de la sangre, la lactoglobulina de la leche, la ovoglobulina del huevo y el fibrinógeno de la sangre. Cuando se produce la coagulación, el fibrinógeno se transforma en fibrina, que adopta una estructura fibrilar y es insoluble; la fibrina se deposita en forma de fibras entrecruzadas en red constituyendo el coágulo. 5. Gluteinas: son insolubles en agua (solubles en ácidos y álcalis diluidos) y abundan en semillas (función de reserva). Destaca el gluten del trigo, que es en realidad una mezcla de varias proteínas. – Holoproteínas fibrosas. Los polipétidos que las forman se hallan ordenados o enrollados a lo largo de una sola dimensión, frecuentemente en haces paralelos. Son insolubles en agua y se presentan casi exclusivamente en los animales, desempeñando función estructural y de protección. Las más importantes son: • • 1. El colágeno, proteína estructural de los tejidos conectivos: conjuntivo, cartilaginoso y óseo. 2. Las queratinas, proteínas muy resistente a los agentes químicos, que constituyen la capa córnea de la epidermis de los vertebrados y las estructuras derivadas de ella: pelo, uñas, cuernos, plumas, pezuñas, etc. 3. Las elastinas, proteínas muy elásticas, que se encuentran en los vasos sanguíneos, tendones y pulmones. 4. Las fibroínas, proteínas resistentes, pero flexibles, que producen insectos y arañas para fabricar capullos, nidos, etc.

Holoproteínas o proteínas simples: Holoproteínas globulares. Las cadenas polipeptídicas que las forman se encuentra pelgadas formando una est más o menos esférica. Solubles en agua en y realizan funciones dinámicas: 1. Protaminas: son proteínas básicas con una alta proporción de aminoácidos con grupos R básicos, solubles en agua, de Pm relativamente bajo (cercano a 5000). Se encuentran asociadas a los ácidos nucleicos. 2. Histonas: igualmente básicas y solubles en agua, pero de Pm algo mayor (10 000 -20 000). También se encuentran asociadas a los ácidos nucleicos. 3. Albúminas: solubles en disoluciones salinas, con Pm bastante mayor que las anteriores (30000 -100000). Destacan la ovalbúmina de la clara de huevo y la lactalbúmina de la leche, ambas con función de reserva proteica, y la seralbúmina de la sangre, cuya función es la de transportar diversas sustancias químicas. 4. Globulinas: son menos solubles que las albúminas y de Pm aún mayor (entre 100000 y 1 millón). Destacan las seroglobulinas de la sangre, la lactoglobulina de la leche, la ovoglobulina del huevo y el fibrinógeno de la sangre. Cuando se produce la coagulación, el fibrinógeno se transforma en fibrina, que adopta una estructura fibrilar y es insoluble; la fibrina se deposita en forma de fibras entrecruzadas en red constituyendo el coágulo. 5. Gluteinas: son insolubles en agua (solubles en ácidos y álcalis diluidos) y abundan en semillas (función de reserva). Destaca el gluten del trigo, que es en realidad una mezcla de varias proteínas.

Holoproteínas o proteínas simples: Holoproteínas fibrosas. Los polipétidos que las forman se hallan ordenados o enrollados a lo largo de una sola dimensión, frecuentemente en haces paralelos. Son insolubles en agua y se presentan casi exclusivamente en los animales, desempeñando función estructural y de protección. Las más importantes son: 1. El colágeno, proteína estructural de los tejidos conectivos: conjuntivo, cartilaginoso y óseo. 2. Las queratinas, proteínas muy resistente a los agentes químicos, que constituyen la capa córnea de la epidermis de los vertebrados y las estructuras derivadas de ella: pelo, uñas, cuernos, plumas, pezuñas, etc. 3. Las elastinas, proteínas muy elásticas, que se encuentran en los vasos sanguíneos, tendones y pulmones. 4. Las fibroínas, proteínas resistentes, pero flexibles, que producen insectos y arañas para fabricar capullos, nidos, etc.

Heteroproteínas, proteínas conjugadas o compuestas: • Glucoproteínas: el grupo prostético está formado por restos glúcidos. • Fosfoproteínas: el grupo prostético es el ácido fosfórico. • Lipoproteínas: el grupo prostético es un lípido. • Nucleoproteínas: son heteroproteínas cuyo grupo prostético son los ácidos nucleicos.

Heteroproteínas, proteínas conjugadas o compuestas: 1. Glucoproteínas: el grupo prostético está formado por restos glúcidos. – Las mucinas, que tienen papel protector. Protegen de la desecación al tegumento de los animales blandos (mucosidades de babosas y caracoles) y constituye el mucus (moco) del aparato digestivo y del respiratorio (flemas bronquiales y nasales). En el aparato digestivo protegen del roce de los alimentos y de la digestión realizada por los jugos digestivos. En el aparato respiratorio, humedecen y limpian el aire. – Las hormonas gonadotróficas, como la FSH o estimulante de los folículos y la LH o luteinizante. – Los peptidoglucanos, que forman parte de las paredes bacterianas. – Las inmunoglobulinas o anticuerpos, con función defensiva frente a los antígenos.

Heteroproteínas, proteínas conjugadas o compuestas: 2. Fosfoproteínas: el grupo prostético es el ácido fosfórico. – caseína de la leche, función de reserva nutritiva, se obtiene el queso y los yogures. Cuando la leche se agria, por el Lactobacillus, la lactosa se transforma en ácido láctico; el ácido desnaturaliza la proteína, que precipita. 3. Lipoproteínas: el grupo prostético es un lípido. – – – Lipoproteínas de estructuras celulares, particularmente de las membranas Tromboplastina, lipoproteína de la sangre que actúa como iniciador del proceso de coagulación sanguínea Lipoproteínas transportadoras de lípidos del plasma sanguíneo, estudiadas en la Unidad anterior. 4. Nucleoproteínas: son heteroproteínas cuyo grupo prostético son los ácidos nucleicos. – protaminas e histonas asociadas a los ácidos nucleicos

Heteroproteínas, proteínas conjugadas o compuestas: Cromoproteínas: son heteroproteínas cuya característica común es la presencia de un grupo prostético coloreado, que les comunica colores característicos. En los más importantes existe como elemento fundamental en su constitución un catión metálico. Se dividen en dos grandes grupos: porfirínicas y no porfirínicas.

Cromoproteínas porfirínicas El grupo prostético es un anillo tetrapirrólico o porfirina, en cuyo interior hay un catión metálico. • Las hemoglobinas, que son los pigmentos respiratorios sanguíneos encargados del transporte de oxígeno en la sangre de los vertebrados y de algunos invertebrados (varios crustáceos, anélidos como la lombriz de tierra, nematodos, etc. ). • En los vertebrados se encuentra en los glóbulos rojos y en los invertebrados está disuelta en el plasma. • La hemoglobina está formada por cuatro cadenas peptídicas globulares, llamadas globinas, cada una de las cuales tiene unido un grupo prostético, llamado hemo, que es una porfirina caracterizada por llevar un átomo de Fe+2, o sea, es una ferroporfirina. En todas las especies examinadas el grupo hemo de las distintas hemoglobinas es el mismo, pero las globinas presentan diferencias según la especie animal de la que proceden, y realizan la misma función: transportan el oxígeno por la sangre a zonas distantes de la superficie respiratoria. Ello es posible porque la Hb tiene capacidad para unirse reversiblemente con el O 2 formando oxihemoglobina: Hb + O 2 →Hb. O 2

Cromoproteínas porfirínicas • Las mioglobinas, constituidas por un grupo prostético hemo y una cadena polipeptídica tipo globina. Se hallan localizadas en las células musculares a las cuales comunican el color rojo. Tienen avidez por el O 2 y constituyen el sistema de transporte y de reserva de este elemento en el músculo. • Los citrocromos con grupo prostético de tipo hemo, que son pigmentos con hierro, intracelulares, con función transportadora de electrones en las cadenas respiratorias de las células. En este proceso hay una interconversión de Fe+2 a Fe+3 y viceversa. • Las cloroplastinas, cuyo grupo prostético es la clorofila, que es una magnesio porfirina; gracias a ella, las plantas pueden realizar la fotosíntesis.

Cromoproteínas no porfirínicas No contienen porfirina. • Las hemocianinas, que son los pigmentos respiratorios de algunos invertebrados (cefalópodos, caracoles, cangrejo, etc. ). Son proteínas de tipo globulina con un grupo prostético no porfirínico que contiene cobre. La hemeritrina, contiene hierro y se encuentra en los anélidos marinos. • Las flavoproteínas, sin componentes metálicos, que tienen como grupo prostético derivados de la riboflavina o vitamina B 2. Intervienen en la cadena respiratoria de transporte de electrones. • Las carotenoproteínas, como la rodopsina o púrpura visual, un pigmento fotosensible de los bastones de la retina relacionada con la visión en los vertebrados. Está constituida por una proteína, la opst. Ina, y un grupo prostético, el retineno, de naturaleza carotenoidea relacionado con la vitamina A. También los pigmentos de los conos son carotenoproteínas cuyo grupo prostético es el retineno.
 Clasificacin
Clasificacin Clasificacin de las empresas
Clasificacin de las empresas Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Clasificacin
Clasificacin Clasificacin de los animales
Clasificacin de los animales Clasificación de la deuda pública
Clasificación de la deuda pública Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Clasificacin de las empresas
Clasificacin de las empresas Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Clasificacion de las proteinas
Clasificacion de las proteinas Proteinas funcion en el organismo
Proteinas funcion en el organismo Cromoproteinas definicion
Cromoproteinas definicion Protenas
Protenas La unión peptídica
La unión peptídica Protenas
Protenas Protenas
Protenas Protenas
Protenas Concepto de funciones
Concepto de funciones Concepto de funciones
Concepto de funciones Funciones angulares
Funciones angulares Estructura organizacional de una pmo
Estructura organizacional de una pmo Cual es la funcion del arn
Cual es la funcion del arn Al abordaje
Al abordaje Serrato musculo
Serrato musculo Grfica
Grfica Funcion instructiva de la escuela
Funcion instructiva de la escuela Funciones del lenguaje
Funciones del lenguaje Intipchurin
Intipchurin Proxemica
Proxemica Funciones neurocognitivas
Funciones neurocognitivas Funciones de la fotosíntesis
Funciones de la fotosíntesis Funciones lineales ejemplos
Funciones lineales ejemplos El semáforo y sus funciones para niños
El semáforo y sus funciones para niños Oligosacaridos en la membrana celular
Oligosacaridos en la membrana celular Tipo de transporte celular
Tipo de transporte celular Clula
Clula Rango de función exponencial
Rango de función exponencial Tipos de arn y sus funciones
Tipos de arn y sus funciones Raiz funciones
Raiz funciones Raiz funciones
Raiz funciones Organigrama estructural de una farmacia
Organigrama estructural de una farmacia Llaves en matematicas funciones
Llaves en matematicas funciones Junta directiva funciones y responsabilidades
Junta directiva funciones y responsabilidades Arco mitad formulas
Arco mitad formulas Ventajas y desventajas de la departamentalización
Ventajas y desventajas de la departamentalización Cuales son las 3 funciones principales del sistema nervioso
Cuales son las 3 funciones principales del sistema nervioso Graficas de funciones cubicas
Graficas de funciones cubicas Funcion reciproca
Funcion reciproca Brigada ambiental escolar
Brigada ambiental escolar Función del presidente de chile
Función del presidente de chile Integrales de funciones logaritmicas
Integrales de funciones logaritmicas Tlamo
Tlamo Se conecta a un puerto color lila de 6 agujeros
Se conecta a un puerto color lila de 6 agujeros Funciones de la sbs en el perú
Funciones de la sbs en el perú Tipos de proteina
Tipos de proteina Funciones del maestro
Funciones del maestro Modelar funciones exponenciales
Modelar funciones exponenciales Principales funciones de la mitocondria
Principales funciones de la mitocondria Funciones de un auditor nocturno
Funciones de un auditor nocturno Lisososomas
Lisososomas Tipos de relaciones humanas
Tipos de relaciones humanas Ecuaciones diferenciales del movimiento
Ecuaciones diferenciales del movimiento Clasificacion de funciones algebraicas
Clasificacion de funciones algebraicas Funciones pre-construídas
Funciones pre-construídas Funciones basicas de una empresa segun fayol
Funciones basicas de una empresa segun fayol Funciones de la prensa
Funciones de la prensa Funciones de un docente
Funciones de un docente