Aminocidos pptidos y protenas Protenas Las protenas se













- Slides: 34

Aminoácidos, péptidos y proteínas

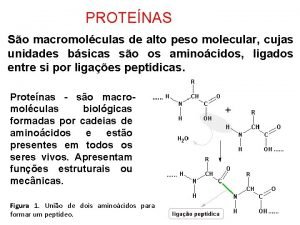
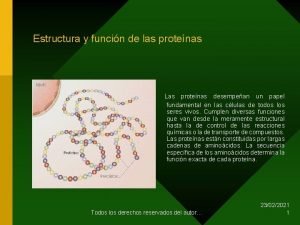
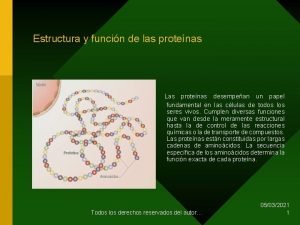
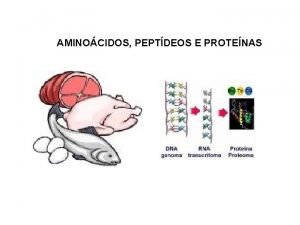
Proteínas Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas muy complejas. Su masa molecular es muy elevada, normalmente está comprendida entre 6000 da y 106 da, son macromoléculas. Las proteínas son las moléculas orgánicas más abundantes en las células, más del 50% del peso seco de la célula son proteínas. Están constituidas, fundamentalmente, por C, H, O y N y casi todas tienen también azufre. Algunas tienen, además, otros elementos químicos y en particular: P, Fe, Zn o Cu. El elemento más característico de las proteínas es el nitrógeno. Son los compuestos nitrogenados por excelencia de los seres vivos. Las proteínas son moléculas específicas que marcan la individualidad de cada ser vivo. Son además de una gran importancia porque a través de ellas se va a expresar la información genética, de hecho el dogma central de la genética molecular nos dice: DNA→ RNA → Proteína

La configuración (L) de los aminoácidos. Casi todos los aminoácidos naturales tienen configuración (S), con estereoquímica parecida a la del L-(-)-gliceraldehído, por lo que se denominan L-aminoácidos. Excepto la glicina, todos los α aminoácidos son quirales. El centro quiral es el átomo de carbono asimétrico α.

Un poco de historia El primer aminoácido descubierto en las proteínas fue la asparragina en 1806 y el último de los 20 aminoácidos en identificarse fue la treonina en 1938. Casi todos los nombres comunes de los aminoácidos provienen de la fuente a partir del cual se aislaron inicialmente: la asparragina se encontró por primera vez en el espárrago, el ácido glutámico en el gluten del trigo o la tirosina en el queso (tyros en griego significa queso). Además del nombre común todos los aminoácidos tienen un código de 3 letras (leu, tyr, asn, glu…) y otro de una sóla letra (G, N, E…)

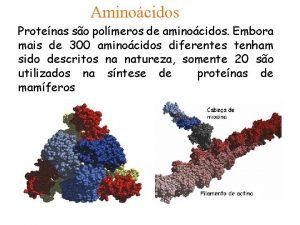
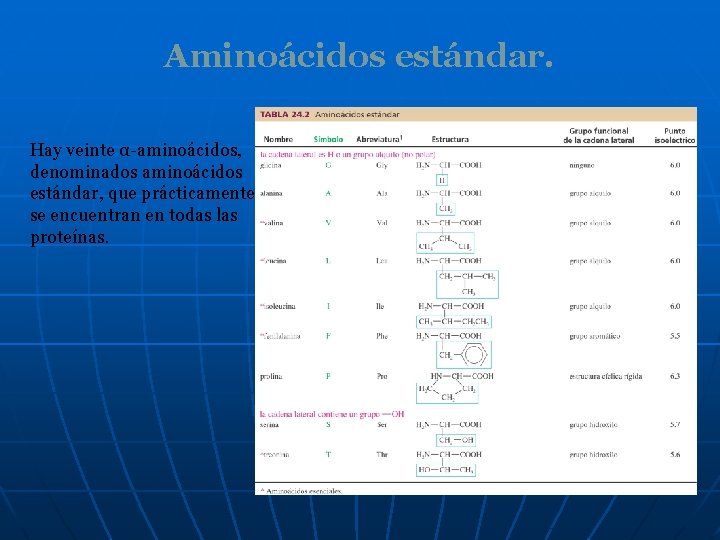
Aminoácidos estándar. Hay veinte α-aminoácidos, denominados aminoácidos estándar, que prácticamente se encuentran en todas las proteínas.

Aminoácidos estándar. Los aminoácidos estándar difieren unos de o tros en la estructura de las cadenas laterales enlazadas a los átomos de carbono α.

Formación zwitterión. A pesar de que generalmente los aminoácidos se escriben con un grupo carboxílico (-COOH) y un grupo amino (-NH 2), su estructura real es iónica y depende del p. H. El grupo carboxílico pierde un protón, dando lugar a un ión carboxilato, y el grupo amino se protona y da lugar a un ión amonio. A esta estructura se le denomina ión dipolar o zwitterión.

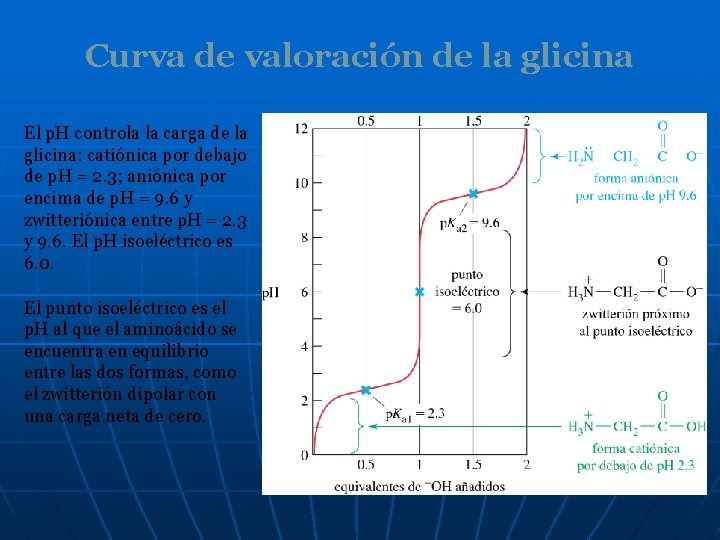
Curva de valoración de la glicina El p. H controla la carga de la glicina: catiónica por debajo de p. H = 2. 3; aniónica por encima de p. H = 9. 6 y zwitteriónica entre p. H = 2. 3 y 9. 6. El p. H isoeléctrico es 6. 0. El punto isoeléctrico es el p. H al que el aminoácido se encuentra en equilibrio entre las dos formas, como el zwitterión dipolar con una carga neta de cero.

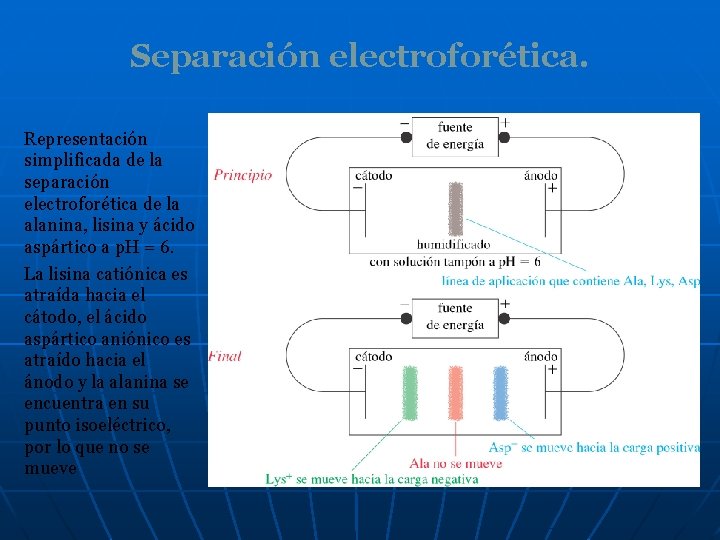
Separación electroforética. Representación simplificada de la separación electroforética de la alanina, lisina y ácido aspártico a p. H = 6. La lisina catiónica es atraída hacia el cátodo, el ácido aspártico aniónico es atraído hacia el ánodo y la alanina se encuentra en su punto isoeléctrico, por lo que no se mueve

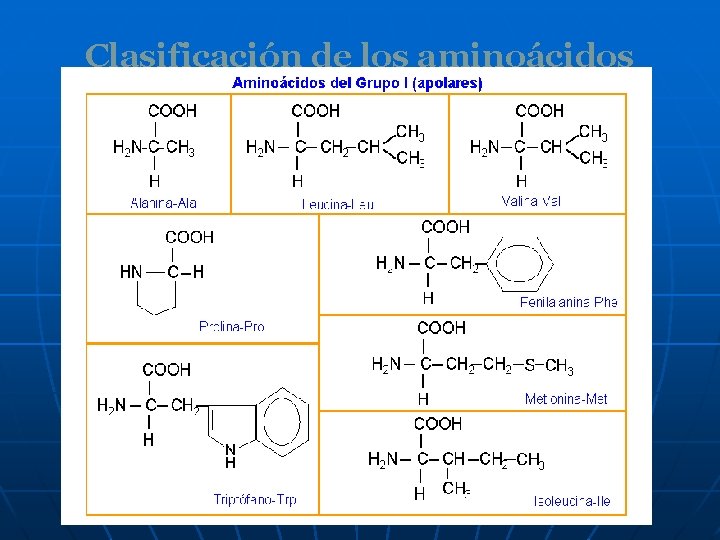
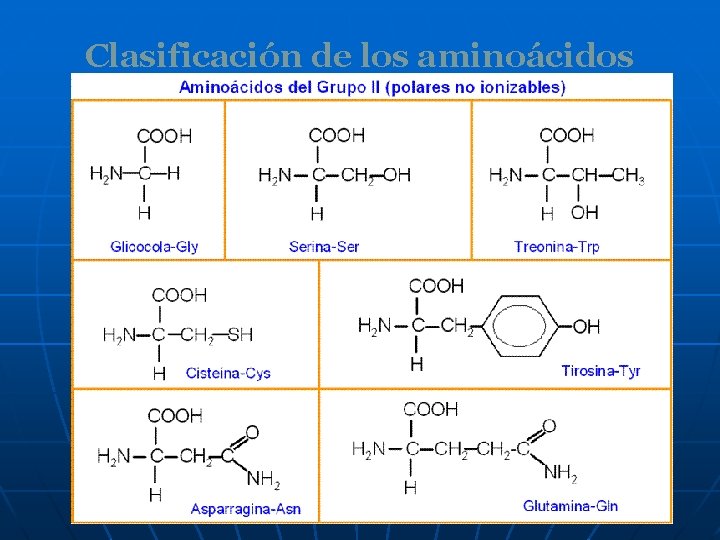
Clasificación de los aminoácidos

Clasificación de los aminoácidos

Clasificación de los aminoácidos

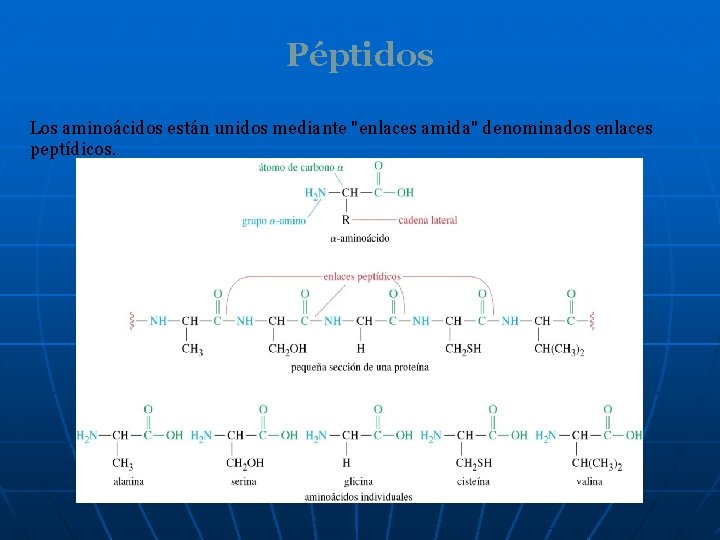
Péptidos Los aminoácidos están unidos mediante "enlaces amida" denominados enlaces peptídicos.

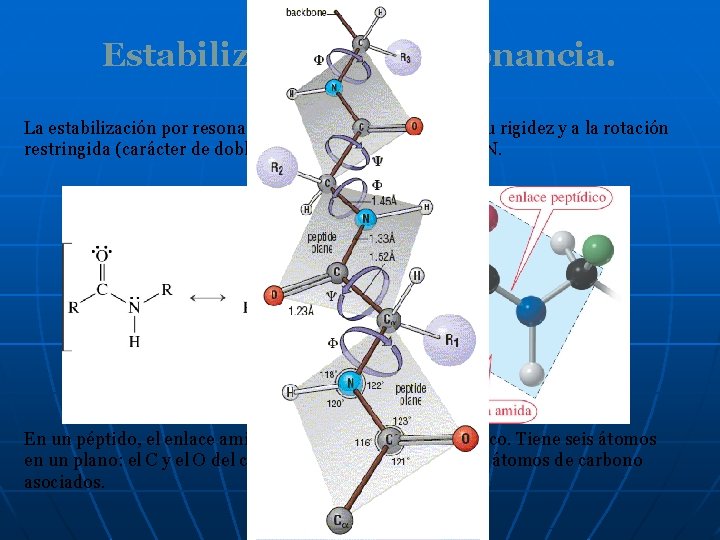
Estabilización por resonancia. La estabilización por resonancia de una amida da lugar a su rigidez y a la rotación restringida (carácter de doble enlace parcial) del enlace C-N. En un péptido, el enlace amida se denomina enlace peptídico. Tiene seis átomos en un plano: el C y el O del carbonilo, el N y su H, y los dos átomos de carbono asociados.

Péptidos importantes Hay muchos péptidos que tienen actividades biológicas importantes: • Hormonas (oxitocina, insulina, glucagón…) • Antiinflamotorios (bradiquinina) • Neuropéptidos • antibióticos

Hormona humana bradiquinina es un nonapéptido con un grupo -NH 3+ en el extremo N terminal y un -COO- libre en el extremo C terminal. Un péptido es un polímero de aminoácidos unidos por enlaces amido entre el grupo amino de cada aminoácido y el grupo carboxilo del aminoácido vecino.

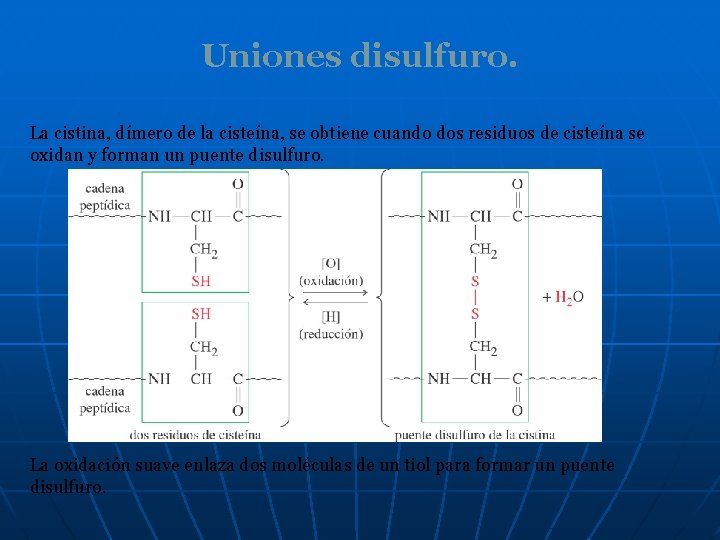
Uniones disulfuro. La cistina, dímero de la cisteína, se obtiene cuando dos residuos de cisteína se oxidan y forman un puente disulfuro. La oxidación suave enlaza dos moléculas de un tiol para formar un puente disulfuro.

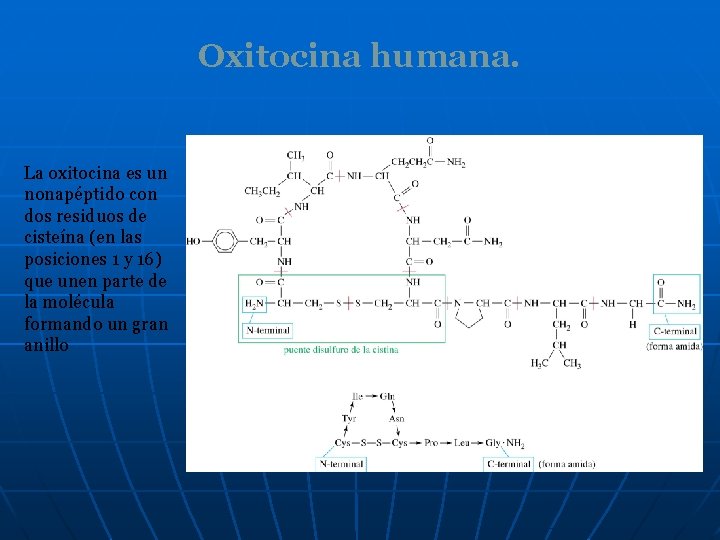
Oxitocina humana. La oxitocina es un nonapéptido con dos residuos de cisteína (en las posiciones 1 y 16) que unen parte de la molécula formando un gran anillo

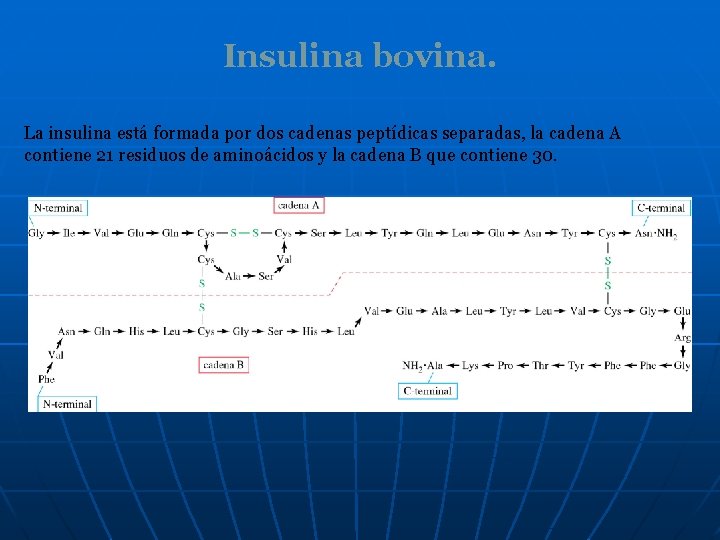
Insulina bovina. La insulina está formada por dos cadenas peptídicas separadas, la cadena A contiene 21 residuos de aminoácidos y la cadena B que contiene 30.

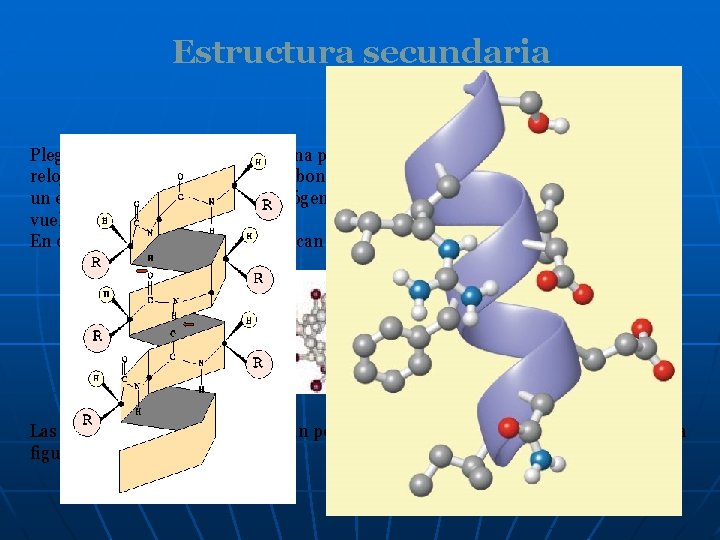
Estructura secundaria α hélice Plegamiento en espiral de la cadena polipeptídica en el sentido de las agujas del reloj (dextrógira). Cada grupo carbonilo, hacia arriba, peptídico se une mediante un enlace de hidrógeno a un hidrógeno del grupo N-H, hacia abajo, de la siguiente vuelta de la hélice. En cada vuelta de la hélice se colocan 3, 6 aminoácidos. Las cadenas laterales se simbolizan por esferas verdes en el modelo molecular de la figura

Estructura secundaria Hélices levógiras y dextrógiras

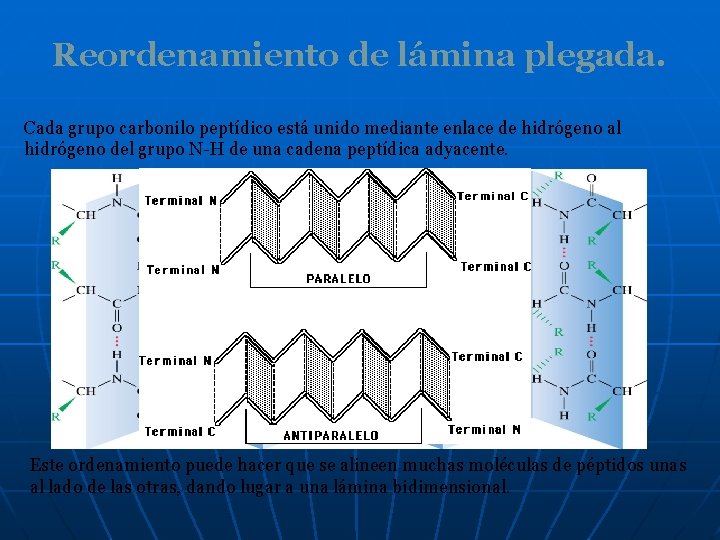
Reordenamiento de lámina plegada. Cada grupo carbonilo peptídico está unido mediante enlace de hidrógeno al hidrógeno del grupo N-H de una cadena peptídica adyacente. Este ordenamiento puede hacer que se alineen muchas moléculas de péptidos unas al lado de las otras, dando lugar a una lámina bidimensional.

Triple hélice de colágeno El colágeno es una importante proteína fibrosa cuya cadena polipeptídica está compuesta por la repetición periódica de la secuencia de tres aminoácidos: glicina, prolina o hidroxiprolina (un derivado del anterior) y un aminoácido cualquiera. No forma alfa-hélices, sino hélices levógiras más estiradas. El colágeno es la proteína más abundante en los animales superiores, pudiendo suponer un tercio de todas las proteínas del cuerpo. La asociación de 3 cadenas iguales da lugar a una hélice triple dextrógira.

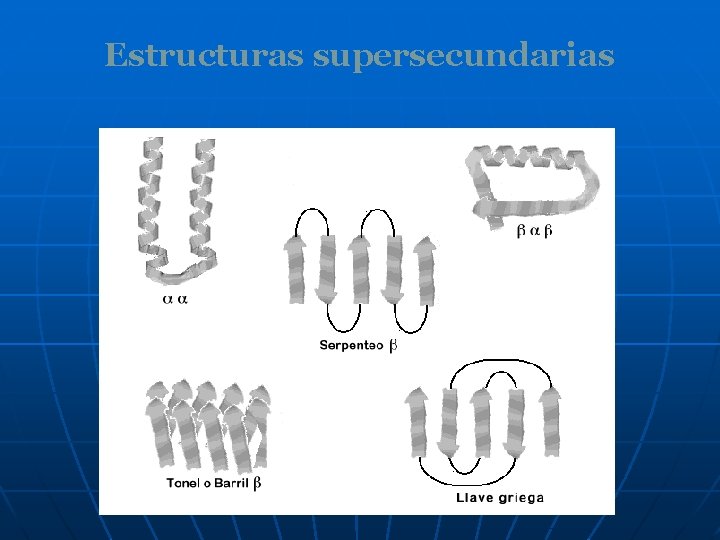
Estructuras supersecundarias

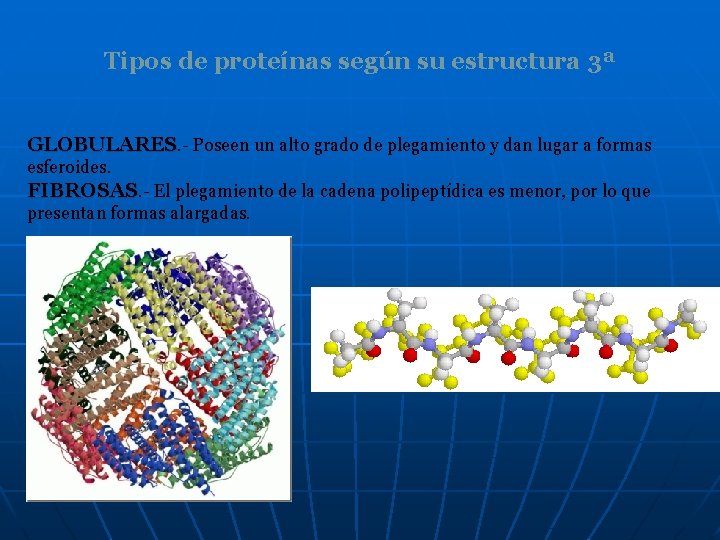
Tipos de proteínas según su estructura 3ª GLOBULARES. - Poseen un alto grado de plegamiento y dan lugar a formas esferoides. FIBROSAS. - El plegamiento de la cadena polipeptídica es menor, por lo que presentan formas alargadas.

Estructura terciaria

Enlaces que estabilizan la estructura terciaria de las proteínas

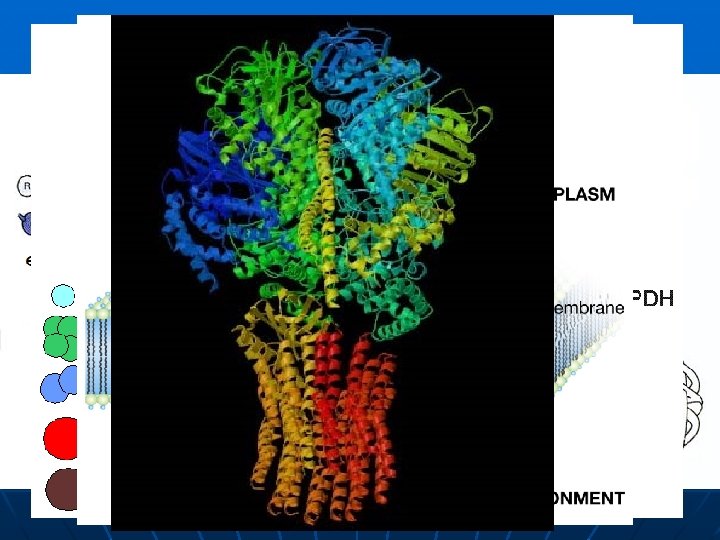
Estructuras de una proteína La estructura primaria es la estructura enlazada covalentemente, incluyendo la secuencia de aminoácidos y los puentes disulfuro. La estructura secundaria incluye las áreas de hélices α, láminas plegadas o enrollamientos al azar. En la estructura terciaria se incluye la conformación total de la molécula. En la estructura cuaternaria se incluye la asociación de dos o más cadenas peptídicas de la proteína activa.

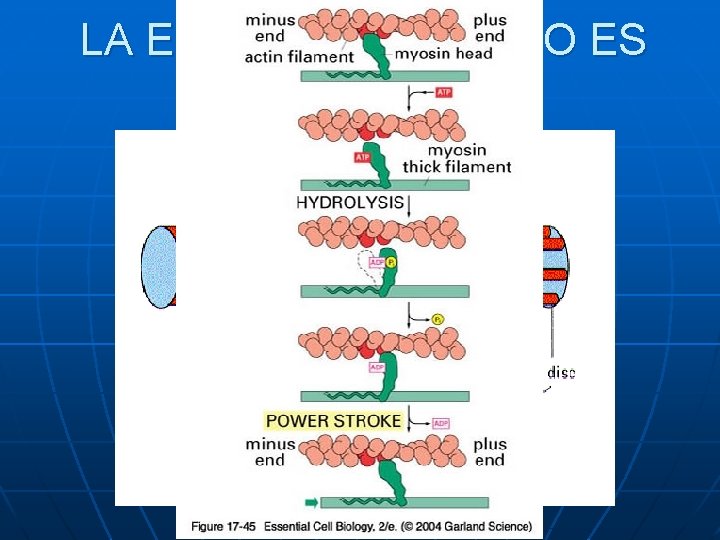
LA ESTRUCTURA 3ª NO ES RÍGIDA

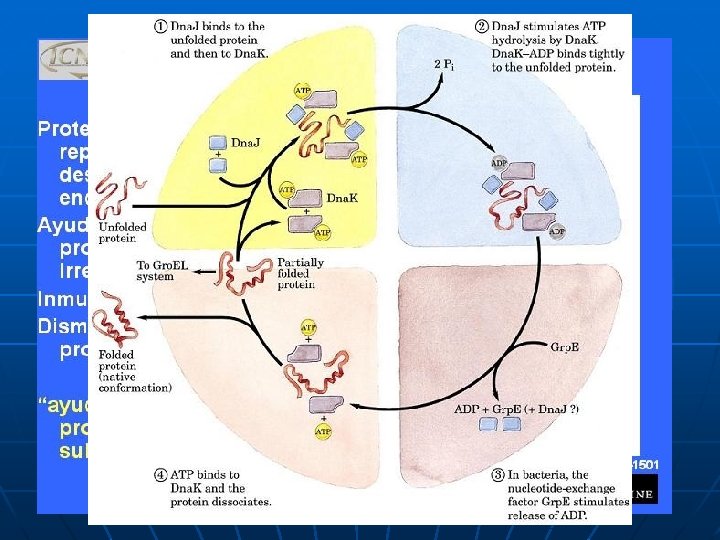
CHAPERONAS n n Proteínas presentes en el citoplasma que ayudan a las cadenas polipéptidas recién sintetizadas a plegarse correctamente. También se producen en situaciones de estrés térmico, para reducir los daños por desnaturalización.

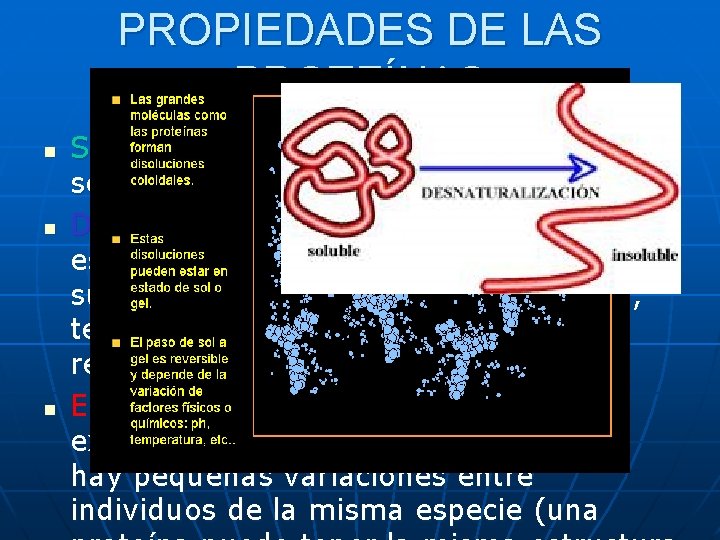
PROPIEDADES DE LAS PROTEÍNAS n n n Solubilidad: generalmente las globulares son solubles en agua y las fibrosas no. Desnaturalización: pérdida de su estructura tridimensional, y por tanto de su función biológica, debido a: presión, temperatura y p. H. Desnaturalización reversible e irreversible. Especifidad: algunas proteínas son exclusivas de ciertas especies, incluso hay pequeñas variaciones entre individuos de la misma especie (una

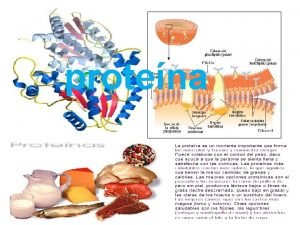
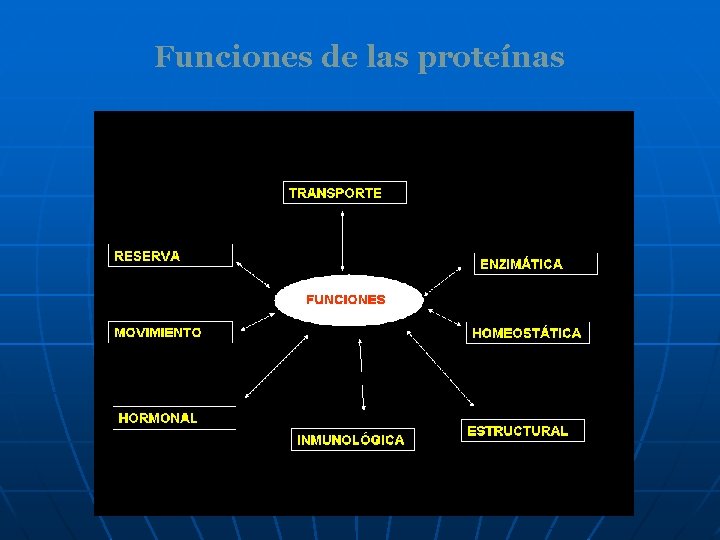
Funciones de las proteínas

Funciones de las proteínas

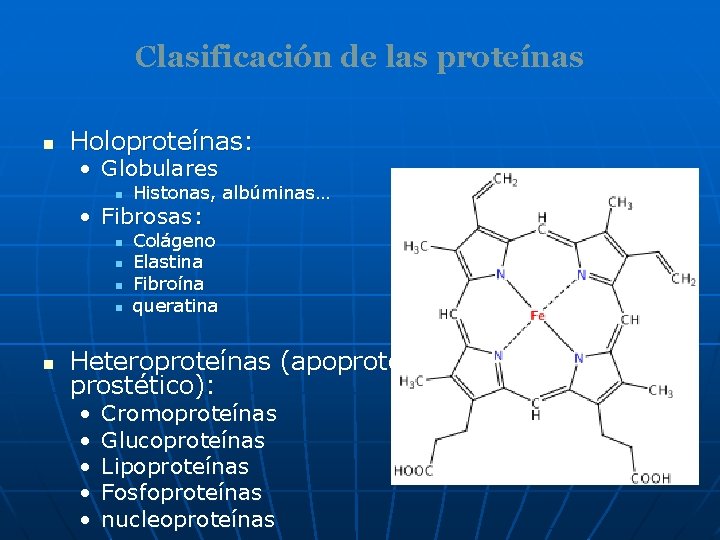
Clasificación de las proteínas n Holoproteínas: • Globulares n Histonas, albúminas… • Fibrosas: n n n Colágeno Elastina Fibroína queratina Heteroproteínas (apoproteína+grupo prostético): • • • Cromoproteínas Glucoproteínas Lipoproteínas Fosfoproteínas nucleoproteínas
 Protenas
Protenas Proteinas simples e conjugadas
Proteinas simples e conjugadas Funciones de la proteina
Funciones de la proteina La unión peptídica
La unión peptídica Protenas
Protenas Protenas
Protenas Protenas
Protenas Grupo prostético
Grupo prostético Protenas
Protenas Protenas
Protenas Cuadro sinoptico de las proteinas
Cuadro sinoptico de las proteinas Protenas
Protenas Lista de palabras para dividir en silabas
Lista de palabras para dividir en silabas Seccion 20 niif para pymes
Seccion 20 niif para pymes Tamaño de la celula
Tamaño de la celula Línea del tiempo de las generaciones de las computadoras
Línea del tiempo de las generaciones de las computadoras Las palabras bonitas se las lleva el viento
Las palabras bonitas se las lleva el viento Misiones se hacen con los pies delos que van
Misiones se hacen con los pies delos que van Las generaciones de la computadora
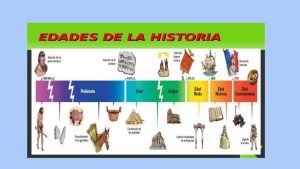
Las generaciones de la computadora Edad de la historia
Edad de la historia Fuente de las obligaciones mercantiles
Fuente de las obligaciones mercantiles Metales definicion
Metales definicion Apa itu asetilen
Apa itu asetilen Agilidad mental test
Agilidad mental test Las familias y las comunidades
Las familias y las comunidades Tabla de la verdad compuertas logicas
Tabla de la verdad compuertas logicas Funciones de palabras
Funciones de palabras Reglas para dividir
Reglas para dividir Que fraccion es
Que fraccion es Clases de predicado verbal
Clases de predicado verbal Tengo un amigo fiel
Tengo un amigo fiel Recomendaciones de los tic
Recomendaciones de los tic Abran las puertas al redentor y que brille su luz
Abran las puertas al redentor y que brille su luz Son las una y cuarto
Son las una y cuarto Que son las propiedades constitutivas y las coligativas
Que son las propiedades constitutivas y las coligativas