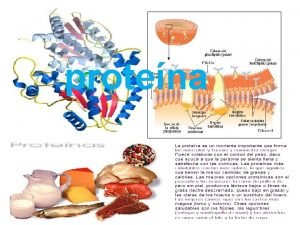
Aminocidos peptdeos e protenas AMINOCIDOS So unidades estruturais
















- Slides: 45

Aminoácidos, peptídeos e proteínas

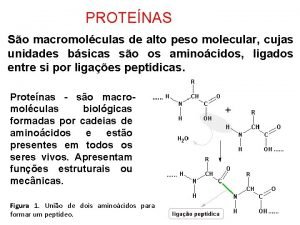
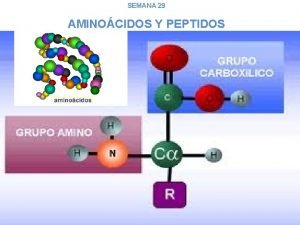
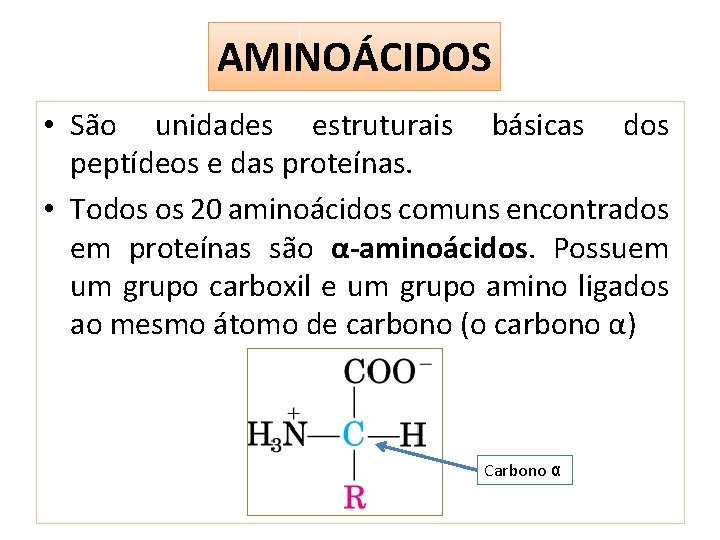
AMINOÁCIDOS • São unidades estruturais básicas dos peptídeos e das proteínas. • Todos os 20 aminoácidos comuns encontrados em proteínas são α-aminoácidos. Possuem um grupo carboxil e um grupo amino ligados ao mesmo átomo de carbono (o carbono α) Carbono α

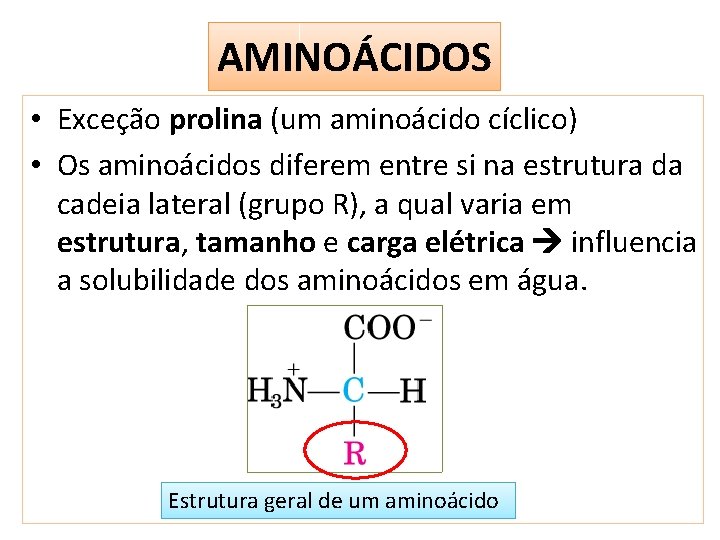
AMINOÁCIDOS • Exceção prolina (um aminoácido cíclico) • Os aminoácidos diferem entre si na estrutura da cadeia lateral (grupo R), a qual varia em estrutura, tamanho e carga elétrica influencia a solubilidade dos aminoácidos em água. Estrutura geral de um aminoácido

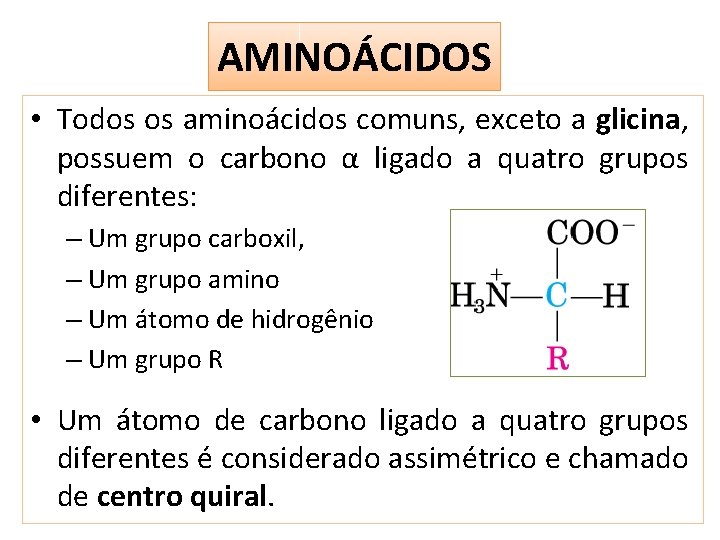
AMINOÁCIDOS • Todos os aminoácidos comuns, exceto a glicina, possuem o carbono α ligado a quatro grupos diferentes: – Um grupo carboxil, – Um grupo amino – Um átomo de hidrogênio – Um grupo R • Um átomo de carbono ligado a quatro grupos diferentes é considerado assimétrico e chamado de centro quiral.

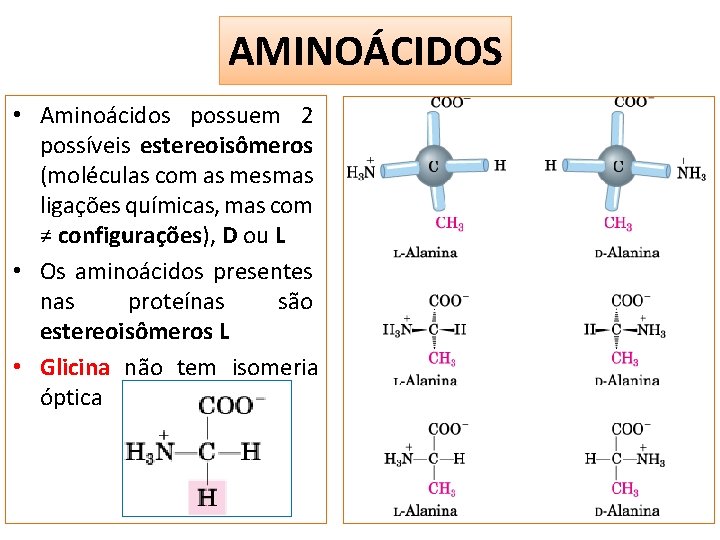
AMINOÁCIDOS • Aminoácidos possuem 2 possíveis estereoisômeros (moléculas com as mesmas ligações químicas, mas com ≠ configurações), D ou L • Os aminoácidos presentes nas proteínas são estereoisômeros L • Glicina não tem isomeria óptica

FUNÇÕES BIOLÓGICAS DOS AAs • Constituição de proteínas • Estrutura da célula • Hormônios • Receptores de proteínas e hormônios • Transporte de metabólitos e íons • Atividade enzimática • Imunidade • Gliconeogênese no jejum e diabetes

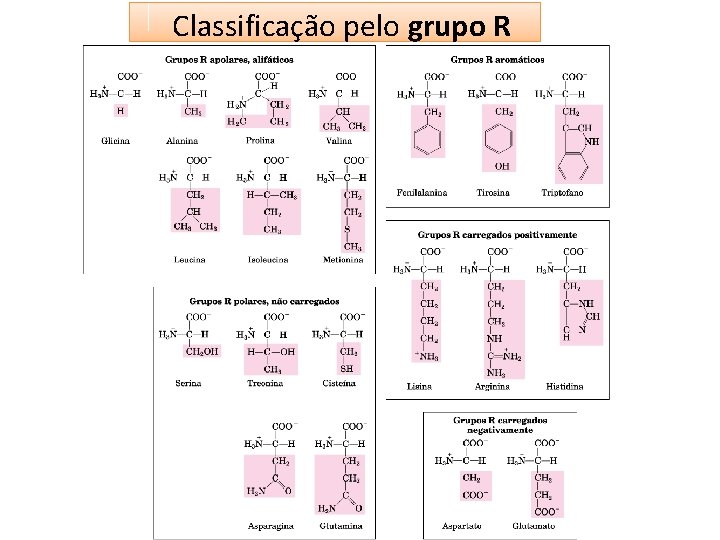
CLASSIFICAÇÃO DOS AMINOÁCIDOS • Os aminoácidos podem ser classificados segundo dois princípios: – Classificação com base nas propriedades do grupo R, em particular, suas polaridade ou tendência em interagir com a água em p. H biológico (próximo a 7). – Classificação segundo a essencialidade.

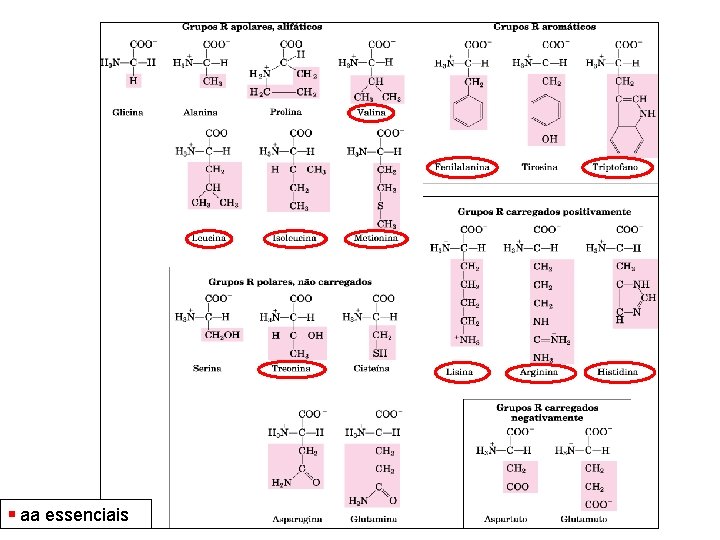
Classificação pelo grupo R

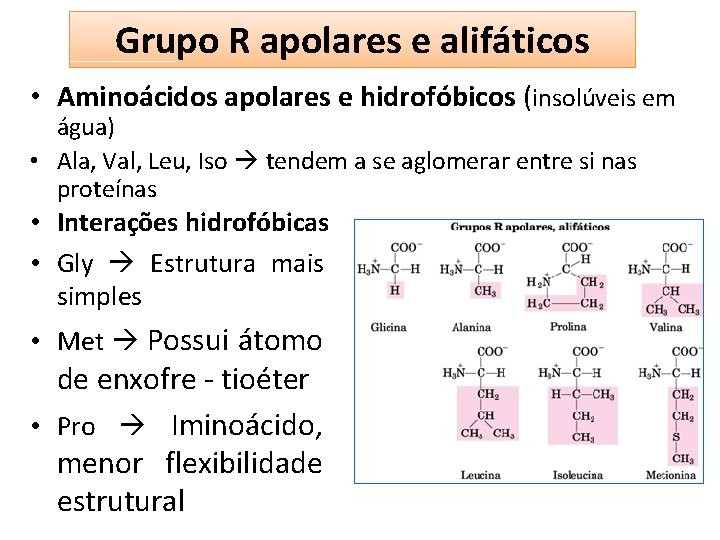
Grupo R apolares e alifáticos • Aminoácidos apolares e hidrofóbicos (insolúveis em água) • Ala, Val, Leu, Iso tendem a se aglomerar entre si nas proteínas • Interações hidrofóbicas • Gly Estrutura mais simples • Met Possui átomo de enxofre - tioéter • Pro Iminoácido, menor flexibilidade estrutural

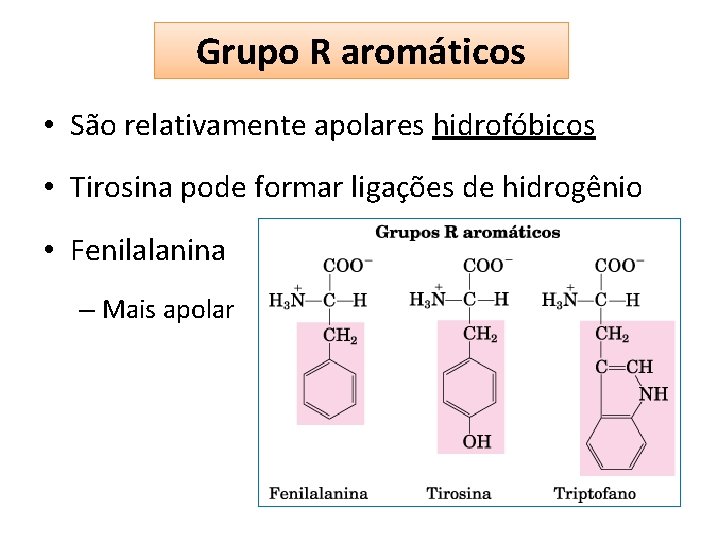
Grupo R aromáticos • São relativamente apolares hidrofóbicos • Tirosina pode formar ligações de hidrogênio • Fenilalanina – Mais apolar

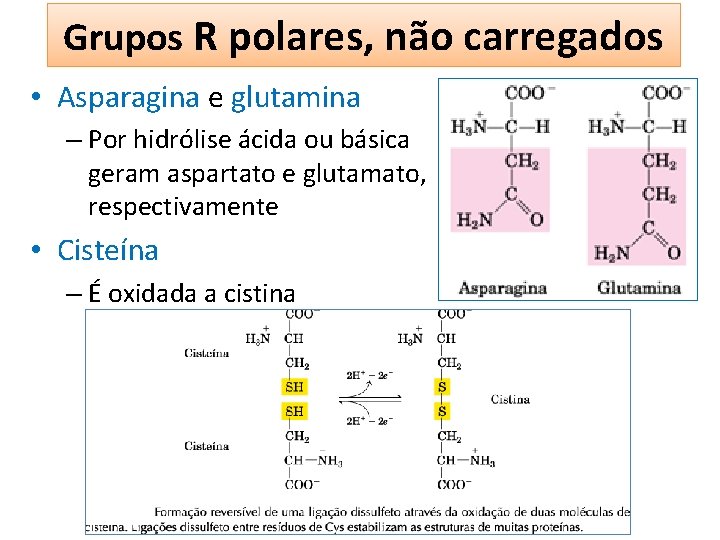
Grupos R polares, não carregados • Solubilidade intermediária em água • Possuem grupos funcionais capaz de formar ligações de hidrogênio com a água • Serina e treonina – Grupos hidroxil • Asparagina e glutamina – Grupo amida • Cisteína – Grupo sulfidril – Ligações dissulfeto

Grupos R polares, não carregados • Asparagina e glutamina – Por hidrólise ácida ou básica geram aspartato e glutamato, respectivamente • Cisteína – É oxidada a cistina

Grupos R carregados Positivamente (básicos) • Aminoácidos hidrofílicos – Carga positiva – Lisina, segundo grupo amino – Arginina, grupo guanidina – Histidina, grupo aromático imidazol ( pode estar carregada positivamente como não carregada em p. H 7, 0 - Resíduos de His facilita diversas reações catalisadas por enzimas ao servirem como aceptores/doadores de prótons

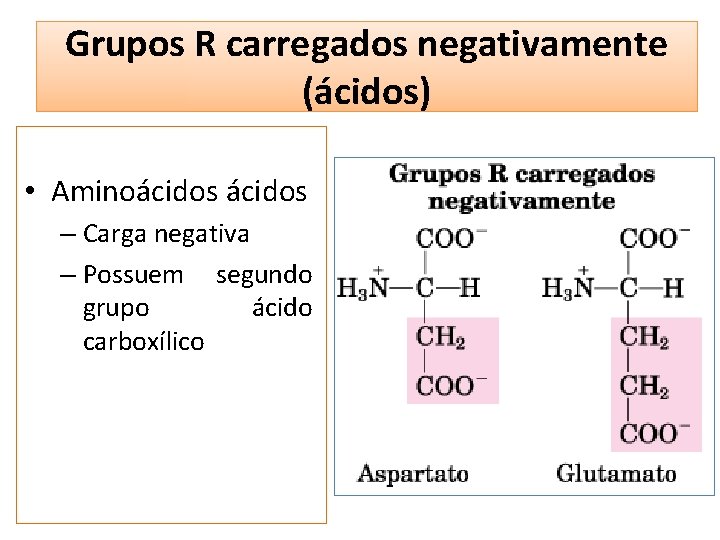
Grupos R carregados negativamente (ácidos) • Aminoácidos – Carga negativa – Possuem segundo grupo ácido carboxílico

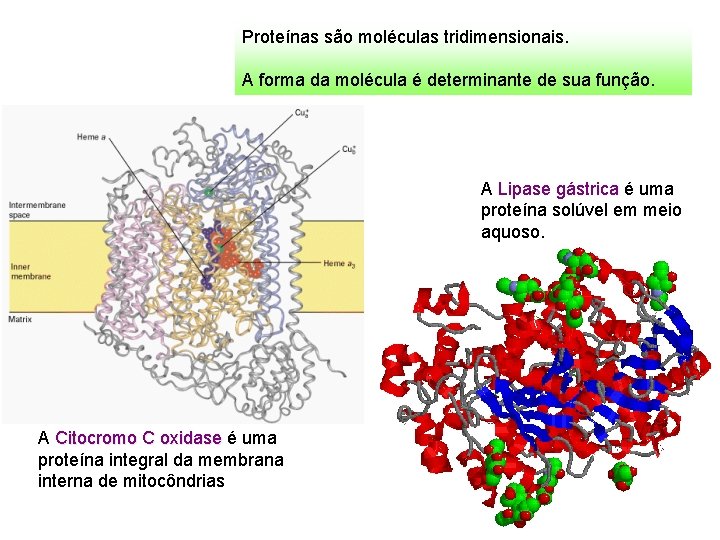
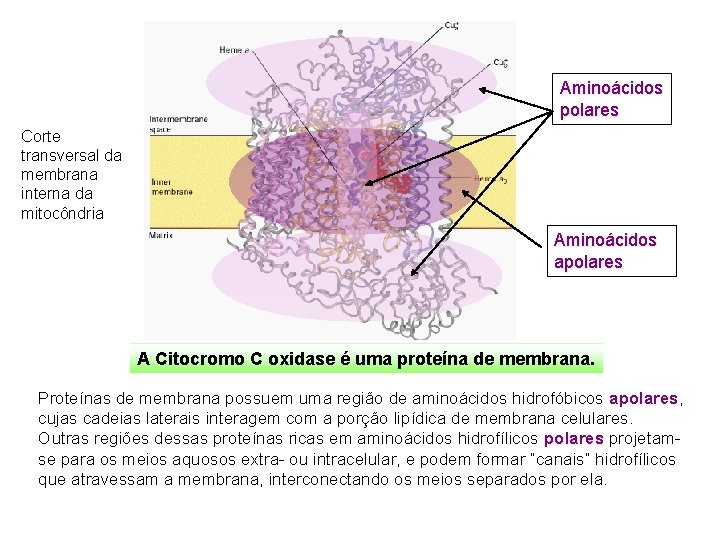
Proteínas são moléculas tridimensionais. A forma da molécula é determinante de sua função. A Lipase gástrica é uma proteína solúvel em meio aquoso. A Citocromo C oxidase é uma proteína integral da membrana interna de mitocôndrias

Aminoácidos polares Corte transversal da membrana interna da mitocôndria Aminoácidos apolares A Citocromo C oxidase é uma proteína de membrana. Proteínas de membrana possuem uma região de aminoácidos hidrofóbicos apolares, cujas cadeias laterais interagem com a porção lipídica de membrana celulares. Outras regiões dessas proteínas ricas em aminoácidos hidrofílicos polares projetamse para os meios aquosos extra- ou intracelular, e podem formar “canais” hidrofílicos que atravessam a membrana, interconectando os meios separados por ela.

Classificação segundo a essencialidade Aminoácidos essenciais - Não podem ser sintetizados pelos animais ou os são, porém, em quantidades inferiores às necessidades do organismo – Valina – Leucina Aminoácidos não essenciais – Isoleucina – Metionina – Fenilalanina – Triptofano – Treonina – Lisina – Arginina – Histidina

Classificação segundo a essencialidade Aminoácidos não essenciais - Podem ser sintetizados pelos tecidos em quantidades que satisfazem as exigências do metabolismo, a partir de fontes de carbono e grupos amino – Glicina – Alanina – Prolina – Tirosina – Serina – Cisteína – Asparagina – Glutamina – Aspartato – Glutamato

aa essenciais

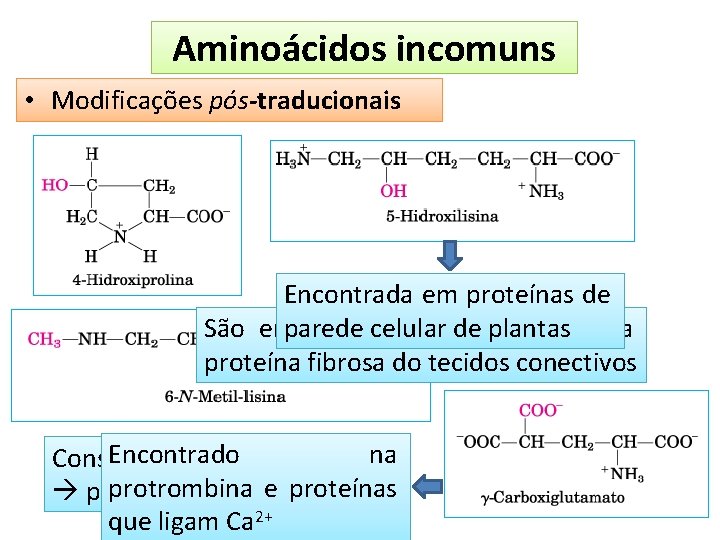
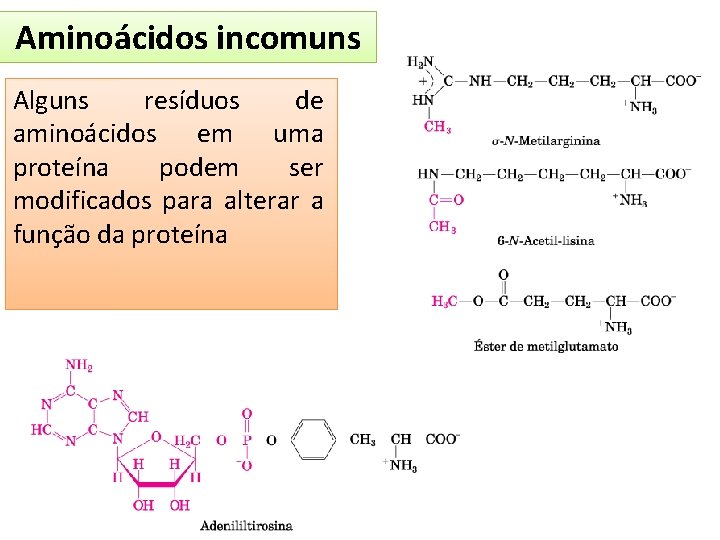
Aminoácidos incomuns • Modificações pós-traducionais Encontrada em proteínas de parede celular plantas uma São encontrados no de colágeno, proteína fibrosa do tecidos conectivos Encontrado Constituinte da miosina na protrombina e proteínas proteina do músculo que ligam Ca 2+

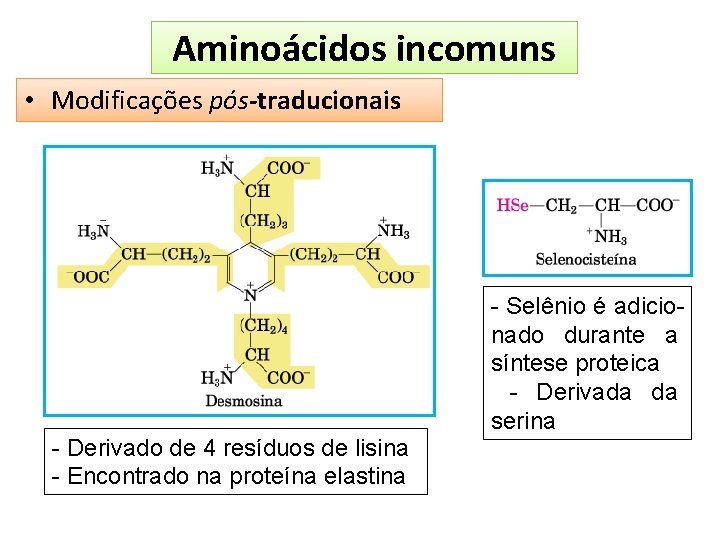
Aminoácidos incomuns • Modificações pós-traducionais - Derivado de 4 resíduos de lisina - Encontrado na proteína elastina - Selênio é adicionado durante a síntese proteica - Derivada da serina

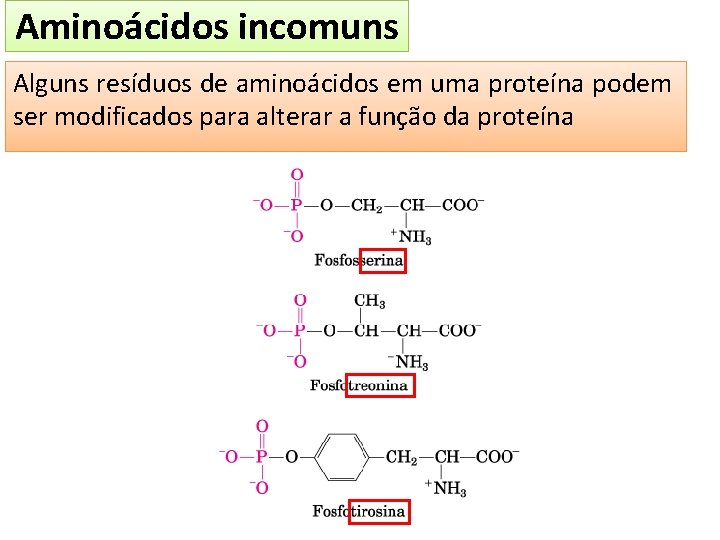
Aminoácidos incomuns Alguns resíduos de aminoácidos em uma proteína podem ser modificados para alterar a função da proteína

Aminoácidos incomuns Alguns resíduos de aminoácidos em uma proteína podem ser modificados para alterar a função da proteína

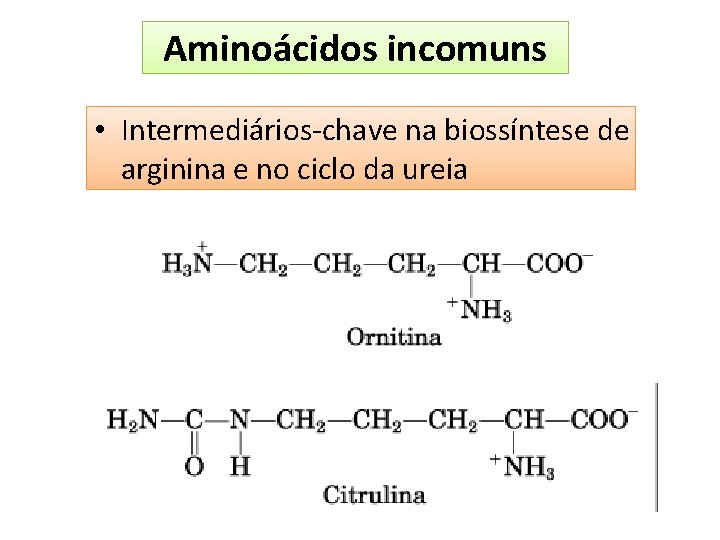
Aminoácidos incomuns • Intermediários-chave na biossíntese de arginina e no ciclo da ureia

Aminoácidos podem atuar como ácidos e bases • Grupo amino, carboxil e os grupos R ionizáveis de alguns aminoácidos funcionam como bases e ácidos fracos – Doam (ácidos) ou recebem (base) prótons • Zwitterion aa sem um grupo R ionizável é dissolvido em água a p. H neutro ele passa a existir como um íon dipolar • Substâncias anfóteras possui natureza dual (ácidobase) Forma não iônica não ocorre em quantidades significativas em soluções aquosas

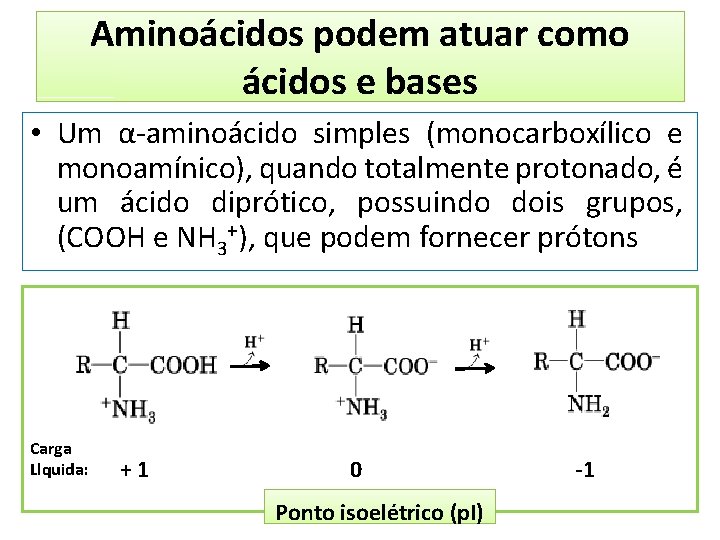
Aminoácidos podem atuar como ácidos e bases • Um α-aminoácido simples (monocarboxílico e monoamínico), quando totalmente protonado, é um ácido diprótico, possuindo dois grupos, (COOH e NH 3+), que podem fornecer prótons Carga Llquida: +1 0 Ponto isoelétrico (p. I) -1

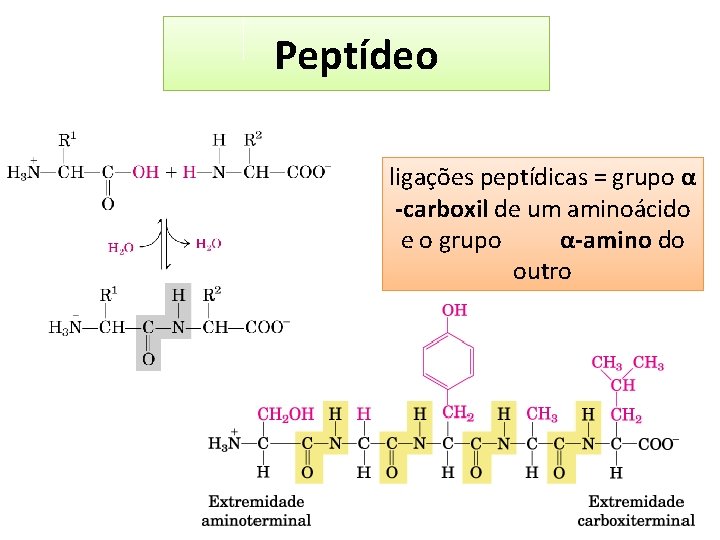
Peptídeo ligações peptídicas = grupo α -carboxil de um aminoácido e o grupo α-amino do outro

Peptídios de importância biológica Fonte: MARZZOCO, A. , TORRES, B. B. , 2007.

Classificação de Peptídeo • Os peptídeos são classificados de acordo com o número de unidades de aminoácidos. - Dipeptídeos, tripeptídeos, tetrapeptídeos. . . • Quando alguns poucos aminoácidos são unidos a estrutura resultante é chamada de oligopeptídeo. • Quando muitos aminoácidos são unidos, o produto é chamado de polipeptídeo.

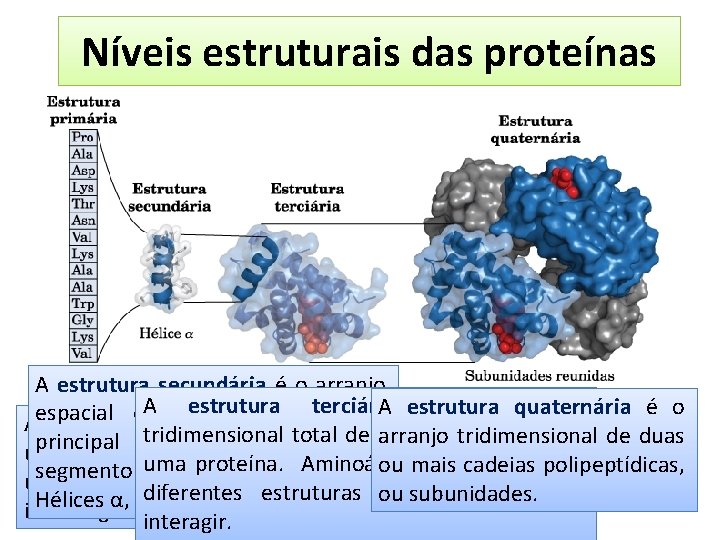
Níveis estruturais das proteínas A estrutura secundária é o arranjo A átomos estruturada terciária é o arranjo A estrutura quaternária é o espacial dos cadeia A estrutura primária consiste emde todos tridimensional total átomos de de duas arranjoostridimensional principal em um determinado uma sequência deproteína. aminoácidos uma Aminoácidos distantes em ou mais cadeiasepolipeptídicas, segmento da cadeia polipeptídica. unidos por ligações peptídicas e diferentes estruturas secundárias podem ou subunidades. Hélices α, folha β e voltas β inclui algumas ligações dissulfeto. interagir.

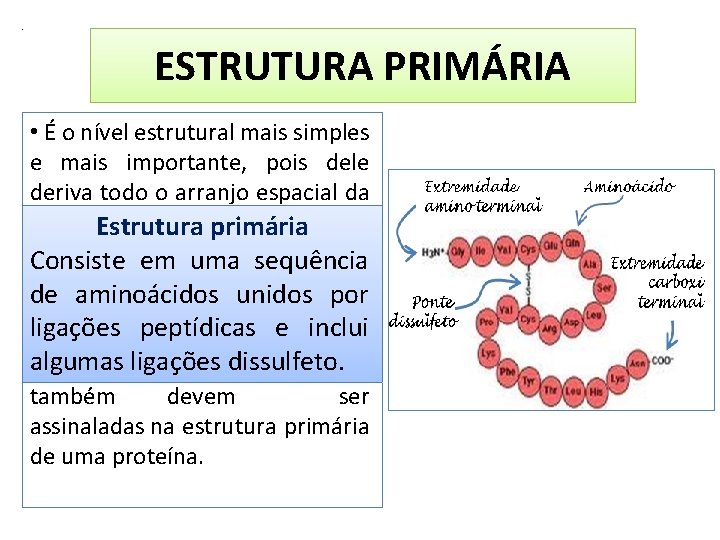
. ESTRUTURA PRIMÁRIA • É o nível estrutural mais simples e mais importante, pois dele deriva todo o arranjo espacial da molécula. Estrutura primária em de uma sequência • Consiste É a seqüência aminoácidos na cadeia polipeptídica; unidos mantidapor de aminoácidos ligaçõespeptídicas e inclui algumas ligações dissulfeto. • As pontes dissulfeto (S-S) também devem ser assinaladas na estrutura primária de uma proteína.

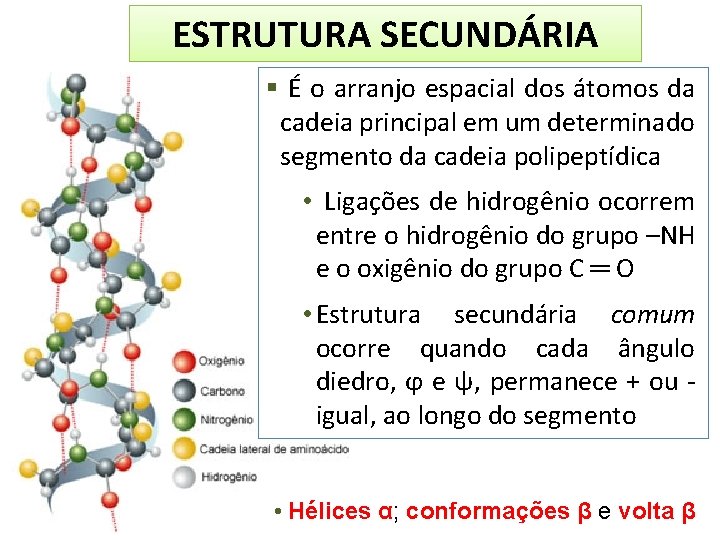
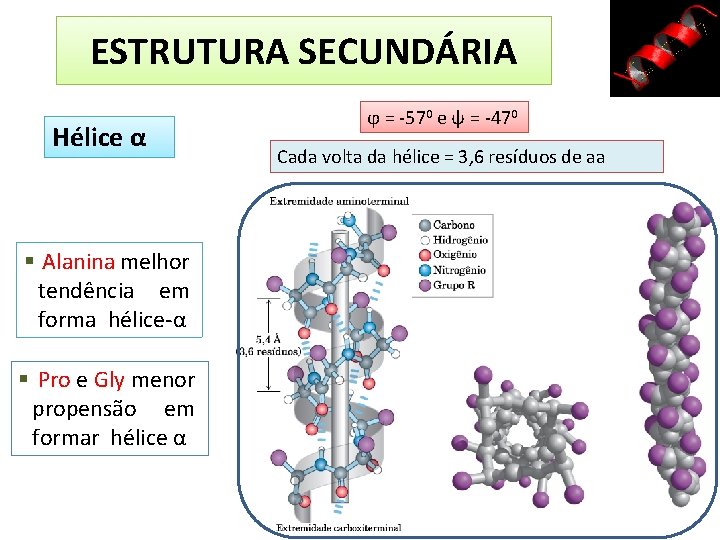
ESTRUTURA SECUNDÁRIA É o arranjo espacial dos átomos da cadeia principal em um determinado segmento da cadeia polipeptídica • Ligações de hidrogênio ocorrem entre o hidrogênio do grupo –NH e o oxigênio do grupo C ═ O • Estrutura secundária comum ocorre quando cada ângulo diedro, ϕ e ψ, permanece + ou igual, ao longo do segmento • Hélices α; conformações β e volta β

ESTRUTURA SECUNDÁRIA Hélice α Alanina melhor tendência em forma hélice-α Pro e Gly menor propensão em formar hélice α ϕ = -570 e ψ = -470 Cada volta da hélice = 3, 6 resíduos de aa

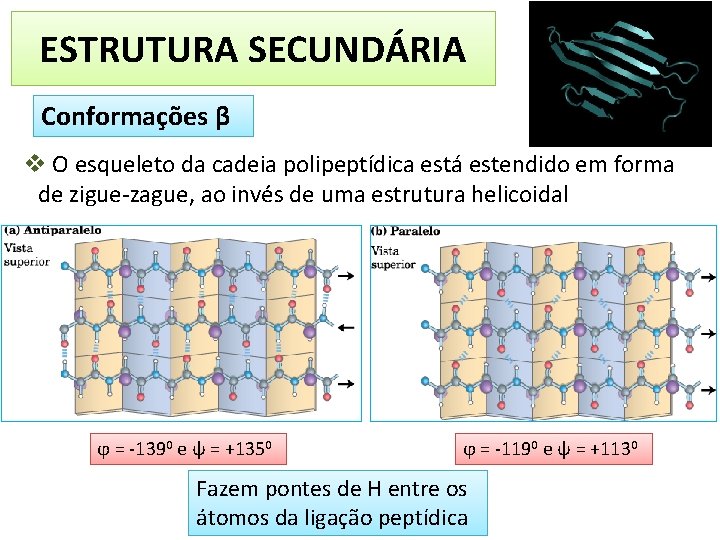
ESTRUTURA SECUNDÁRIA Conformações β v O esqueleto da cadeia polipeptídica está estendido em forma de zigue-zague, ao invés de uma estrutura helicoidal ϕ = -1390 e ψ = +1350 ϕ = -1190 e ψ = +1130 Fazem pontes de H entre os átomos da ligação peptídica

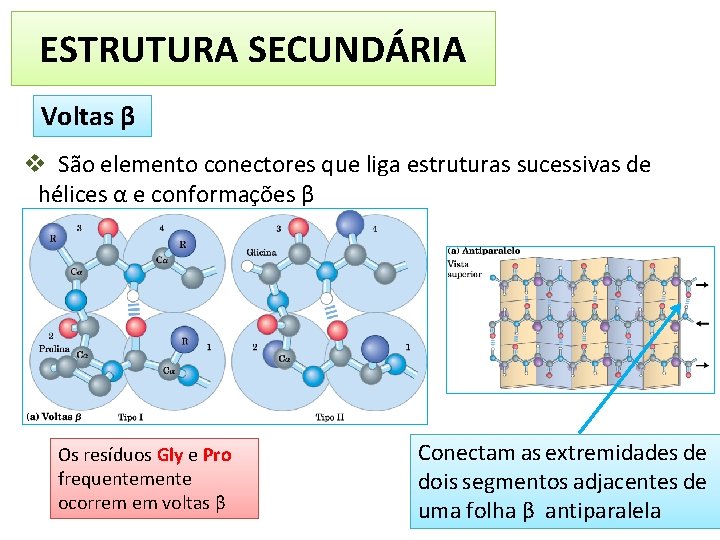
ESTRUTURA SECUNDÁRIA Voltas β v São elemento conectores que liga estruturas sucessivas de hélices α e conformações β Os resíduos Gly e Pro frequentemente ocorrem em voltas β Conectam as extremidades de dois segmentos adjacentes de uma folha β antiparalela

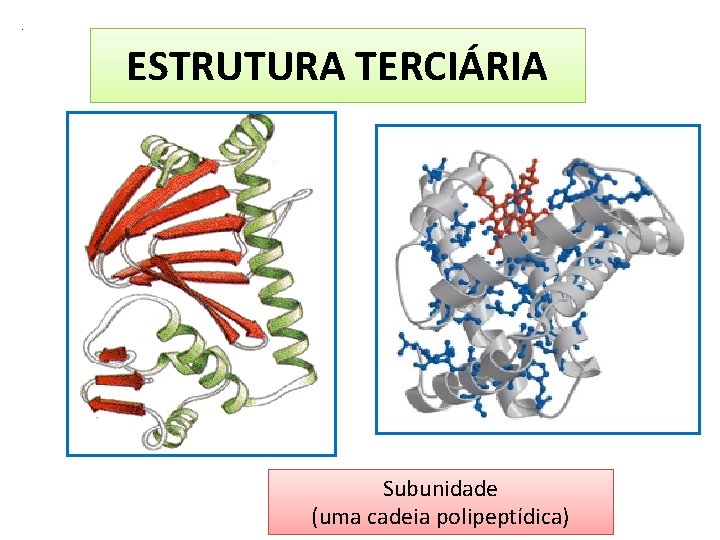
. ESTRUTURA TERCIÁRIA É o arranjo tridimensional total de todos os átomos da cadeia poliptídica Aminoácidos distantes na sequência polipeptídica e em diferentes tipos de estruturas secundárias podem interagir na estrutura proteica dobrada Enovelamento de uma cadeia polipeptídica como um todo Ocorrem ligações entre os átomos dos radicais R de todos os aminoácidos da molécula

. ESTRUTURA TERCIÁRIA Subunidade (uma cadeia polipeptídica)

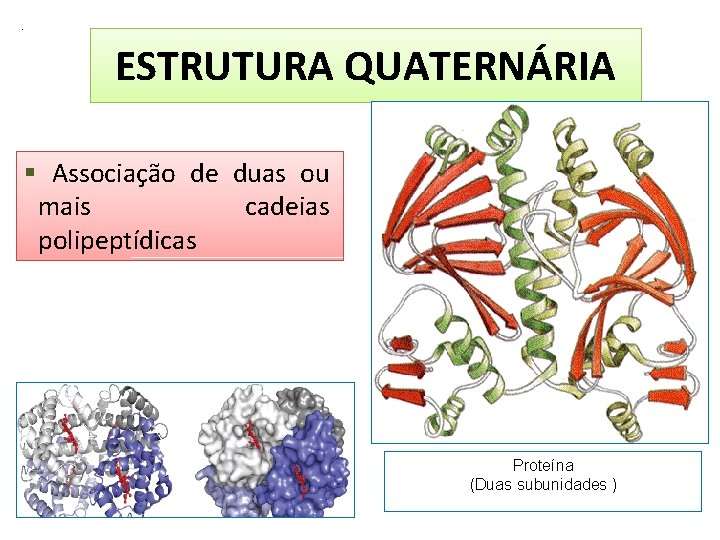
. ESTRUTURA QUATERNÁRIA Associação de duas ou mais cadeias polipeptídicas Proteína (Duas subunidades )

Classificação das proteínas QUANTO A SUA COMPOSIÇÃO Proteínas simples: Por hidrólise liberam apenas aminoácidos. Ex. albumina, globulina, actina, miosina. Proteínas conjugadas: contém componentes químicos associados denominado grupo prostético. - lipoproteínas contêm lipídeos (lipoproteína sanguínea) - glicoproteínas contêm carboidratos (Imunoglobulinas) - metaloproteína contêm um metal específico (ferro – ferritina)

Classificação das proteínas QUANTO AO NÚMERO DE CADEIAS POLIPEPTÍDICAS Proteínas com uma única cadeia polipeptídica - Mioglobina (153 resíduos) - Citocromo C (104 “) - Titina (humano) (27. 000 “) Proteínas Multissubunidade - Formadas por mais de uma cadeia polipeptídica. Ex. Hexocinase (2). Quando apresenta ao menos duas subunidades idênticas Oligomérica. Ex. Hemoglobina (4) E as subunidades idênticas denominadas de Protômero.

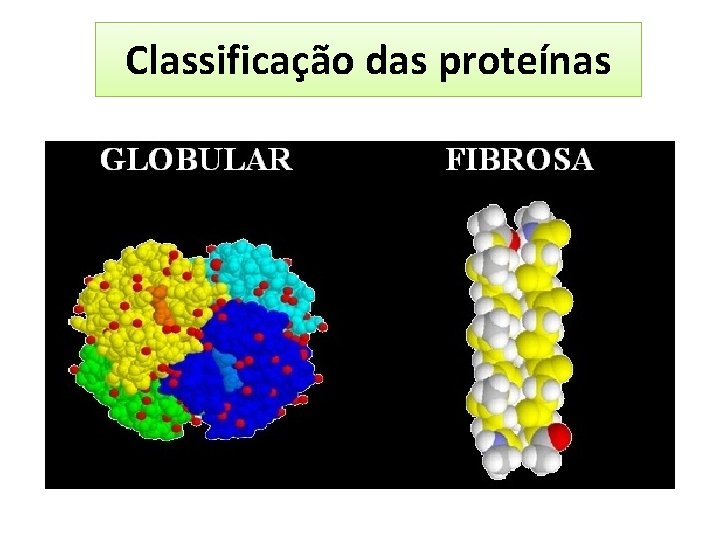
Classificação das proteínas QUANTO A SUA FORMA Proteínas fibrosas - são adaptadas às funções estruturais. Apresentam cadeias polipeptídicas arranjadas em longos filamentos. Em geral são formadas por um único tipo de estrutura secundária (hélices-α ou conformações β). São insolúveis em água. Garantem aos vertebrados suporte, forma e proteção externa. - α-queratina (hélices-α ligadas por ligações dissulfeto) - Fibroínas da seda (conformações β) - Colágeno (hélice tripla de colágeno)

Classificação das proteínas QUANTO A SUA FORMA Proteínas globulares- apresentam cadeias polipeptídicas dobradas em uma forma esférica ou globular, geralmente contêm diversos tipos de estruturas secundárias na mesma cadeia de polipeptídeo. São geralmente solúveis. Exemplo: enzimas, Hemoglobina, mioglobina, imunoglobulinas

Classificação das proteínas

Desnaturação protéica Perda de estrutura tridimensional originada pela ruptura de algumas ligações suficiente para causar a perda de função Causas: pelo calor, p. Hs extremos, solventes orgânicos miscíveis (álcool ou acetona), certos solutos (ureia e hidrocloreto de guanidina), ou detergentes. Na desnaturação ocorre o desdobramento da proteína mantendo-se intacta a sua estrutura primária.

Renaturação protéica Se retornarem às condições ideais de temperatura, pressão e p. H as moléculas desnaturadas reassumem suas estruturas nativas e suas atividades biológicas
 Fórmula bastão
Fórmula bastão Elementos estruturais da poesia
Elementos estruturais da poesia Unidad decena centena unidad de millar
Unidad decena centena unidad de millar Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Funciones de las proteinas
Funciones de las proteinas Proteinas como estan formadas
Proteinas como estan formadas Clasificacion de las proteinas
Clasificacion de las proteinas Interacciones que estabilizan la estructura terciaria
Interacciones que estabilizan la estructura terciaria Cromoproteinas
Cromoproteinas Protenas
Protenas Protenas
Protenas Protenas
Protenas Movimiento de rodadura
Movimiento de rodadura Ppm unidades
Ppm unidades Unidad de medida de densidad
Unidad de medida de densidad Medidas de volumen mapa conceptual
Medidas de volumen mapa conceptual Energia igual a
Energia igual a Numero de nusselt para flujo laminar
Numero de nusselt para flujo laminar Volumen en el sistema cegesimal
Volumen en el sistema cegesimal Unidades de fraccion molar
Unidades de fraccion molar Expansion isoentalpica
Expansion isoentalpica Unidades de medida bit
Unidades de medida bit Decimas centesimas y milesimas
Decimas centesimas y milesimas Unidades de medid
Unidades de medid Coeficiente de variación ejemplos
Coeficiente de variación ejemplos Unidades de medida bit
Unidades de medida bit Unidades de newton
Unidades de newton Estructura del relieve y su formación
Estructura del relieve y su formación Sistema sueu
Sistema sueu * monitoreo de de nuestras unidades otorgándote vi
* monitoreo de de nuestras unidades otorgándote vi Esquema funcional de un ordenador
Esquema funcional de un ordenador Punto de equilibrio fórmula
Punto de equilibrio fórmula Sistema internacional de unidades
Sistema internacional de unidades Ley de coulomb
Ley de coulomb Conjunto de semas
Conjunto de semas Unidad de comunicaciones
Unidad de comunicaciones El valor de la constante de coulomb
El valor de la constante de coulomb Lectura de unidades cortas
Lectura de unidades cortas 15 cienmilésimos
15 cienmilésimos Unidades de medida informatica
Unidades de medida informatica Coeficiente dilatacion cobre
Coeficiente dilatacion cobre Conversó de unidades
Conversó de unidades Amalgama disolvente y soluto
Amalgama disolvente y soluto