Aminocidos y Protenas Prof Hctor Cisternas R Aminocidos








- Slides: 25

Aminoácidos y Proteínas Prof. Héctor Cisternas R.

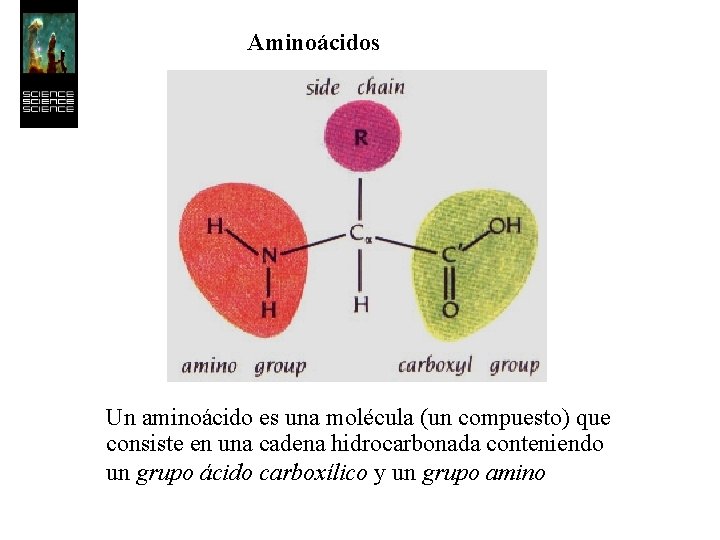
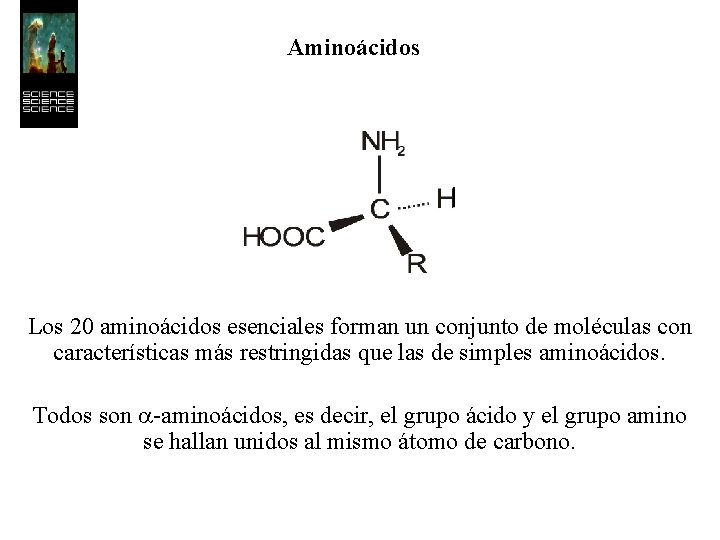
Aminoácidos Un aminoácido es una molécula (un compuesto) que consiste en una cadena hidrocarbonada conteniendo un grupo ácido carboxílico y un grupo amino

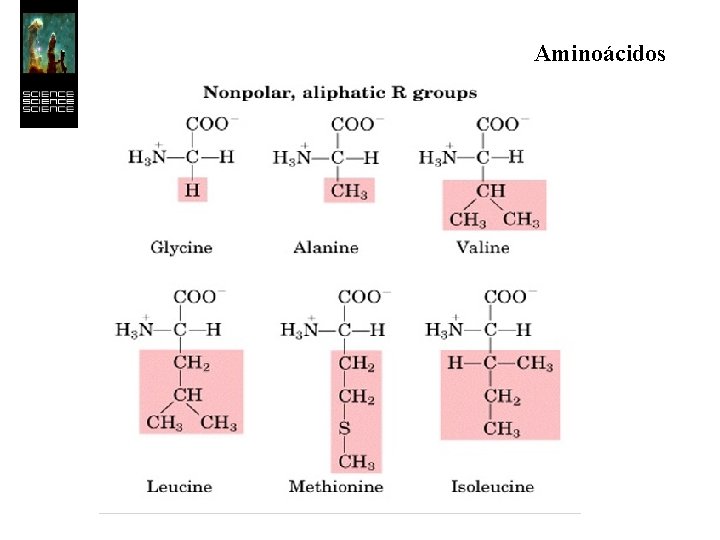
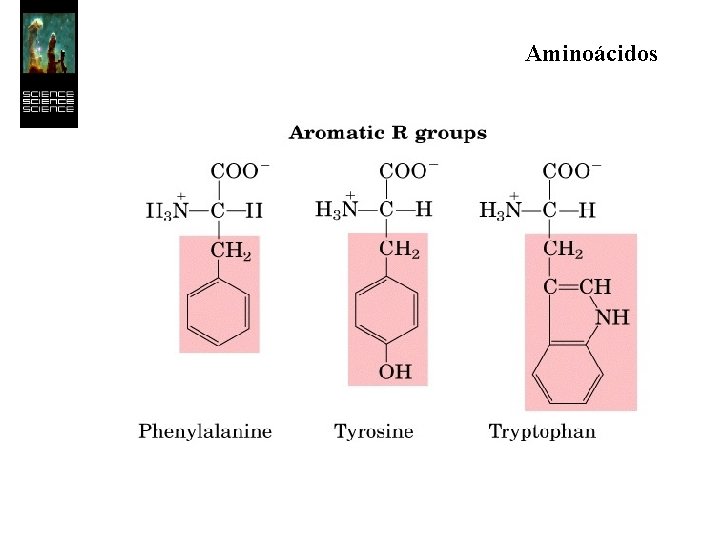
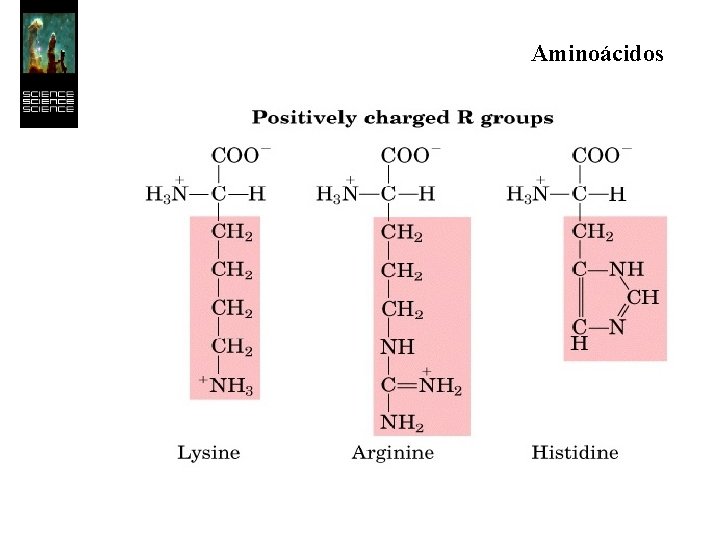
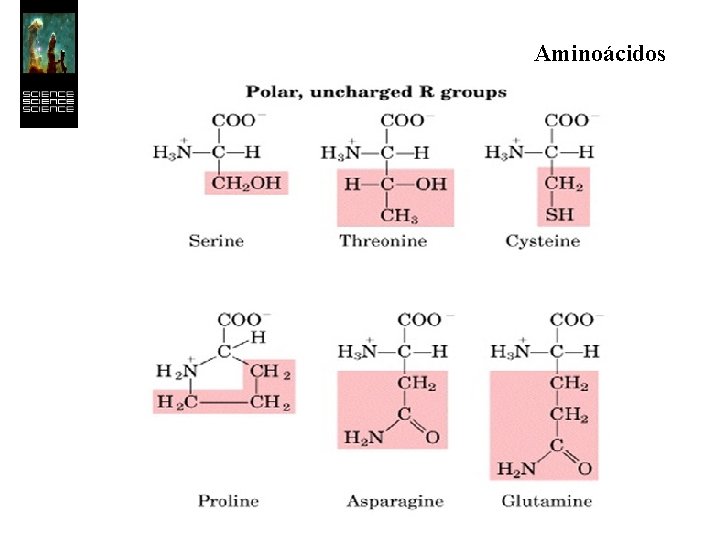
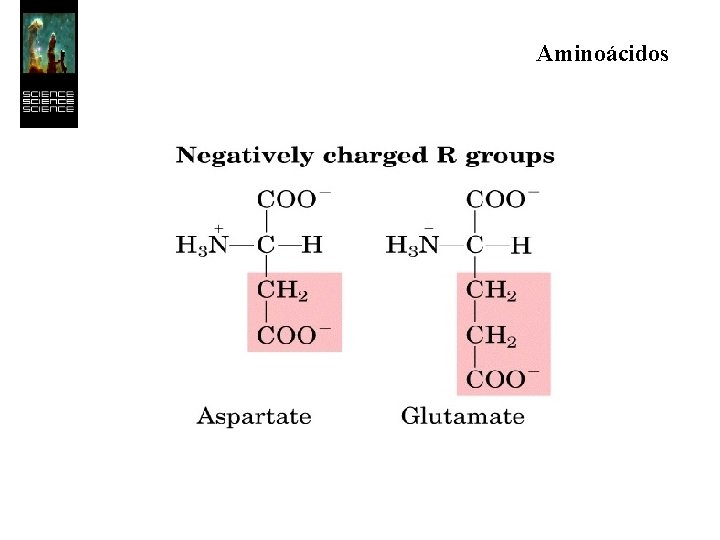
Aminoácidos Los 20 aminoácidos esenciales forman un conjunto de moléculas con características más restringidas que las de simples aminoácidos. Todos son a-aminoácidos, es decir, el grupo ácido y el grupo amino se hallan unidos al mismo átomo de carbono.

Aminoácidos

Aminoácidos

Aminoácidos

Aminoácidos

Aminoácidos

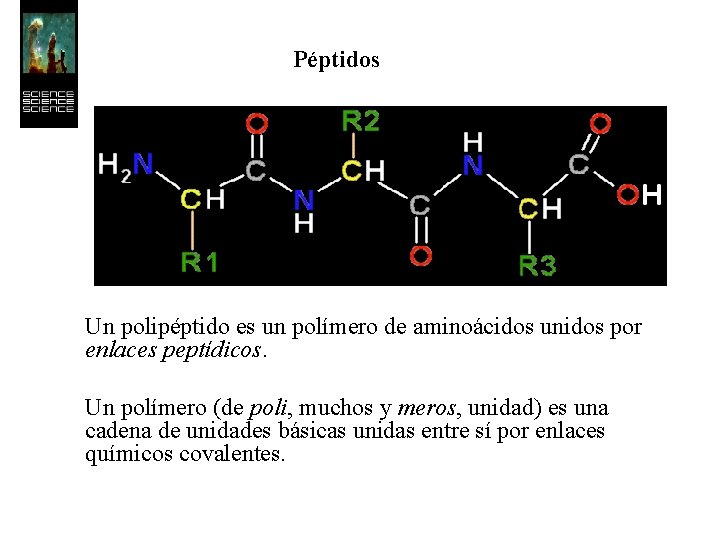
Péptidos Un polipéptido es un polímero de aminoácidos unidos por enlaces peptídicos. Un polímero (de poli, muchos y meros, unidad) es una cadena de unidades básicas unidas entre sí por enlaces químicos covalentes.

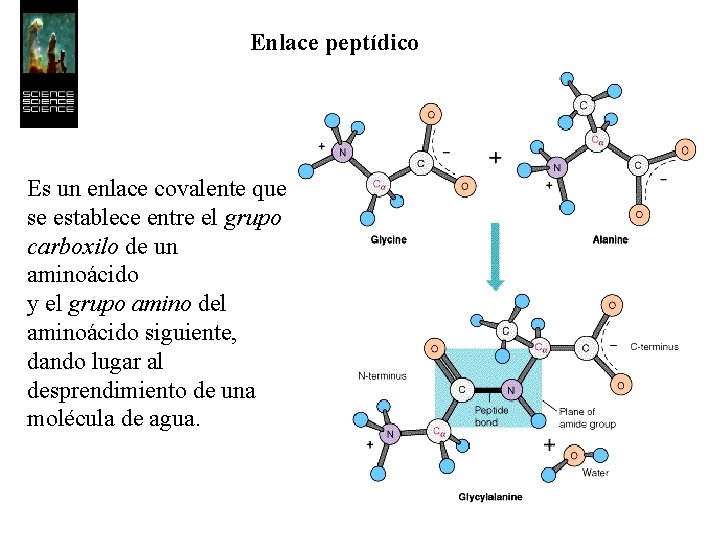
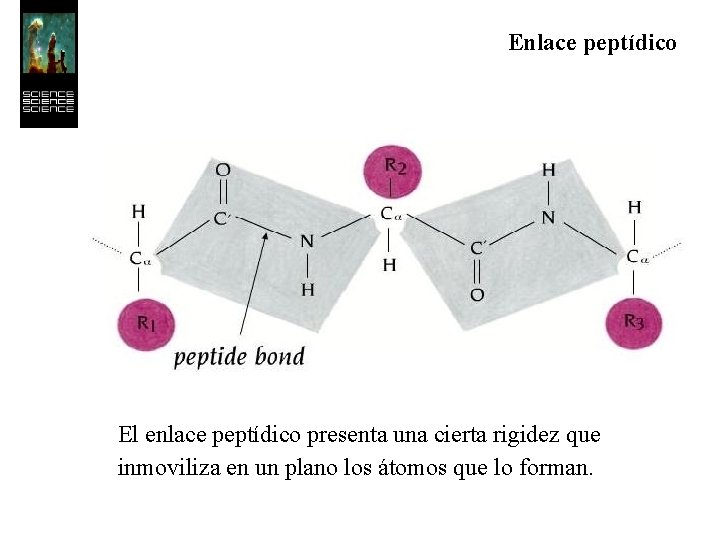
Enlace peptídico Es un enlace covalente que se establece entre el grupo carboxilo de un aminoácido y el grupo amino del aminoácido siguiente, dando lugar al desprendimiento de una molécula de agua.

Enlace peptídico El enlace peptídico presenta una cierta rigidez que inmoviliza en un plano los átomos que lo forman.

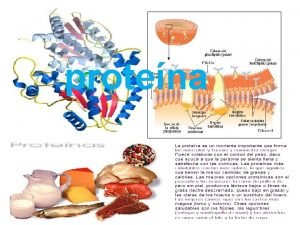
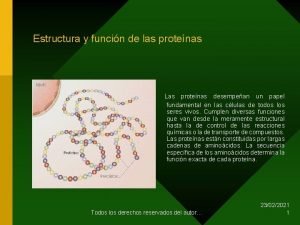
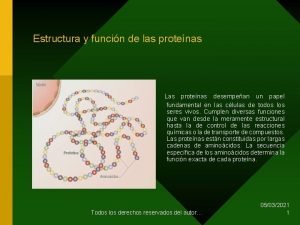
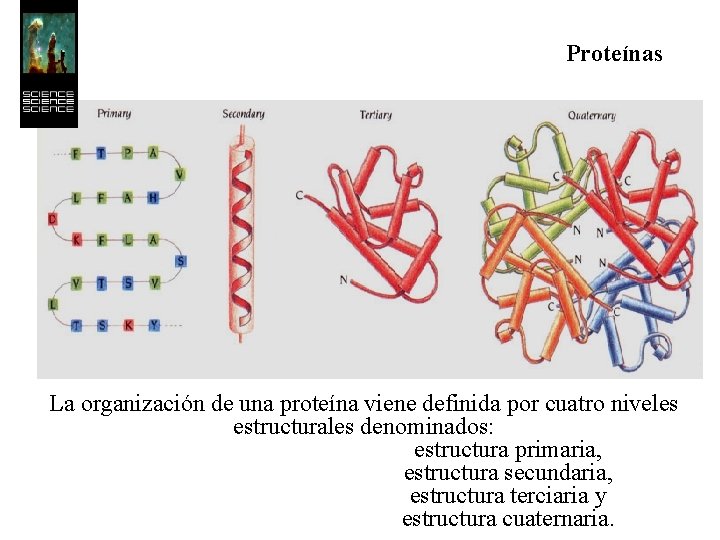
Proteínas La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria.

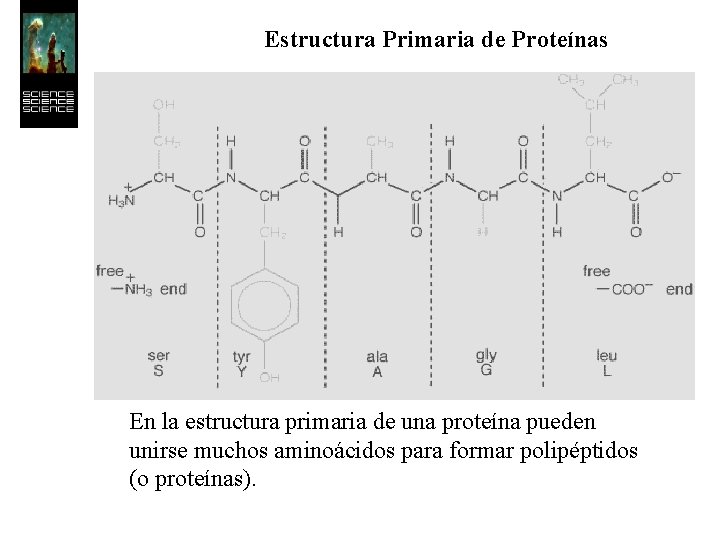
Estructura Primaria de Proteínas En la estructura primaria de una proteína pueden unirse muchos aminoácidos para formar polipéptidos (o proteínas).

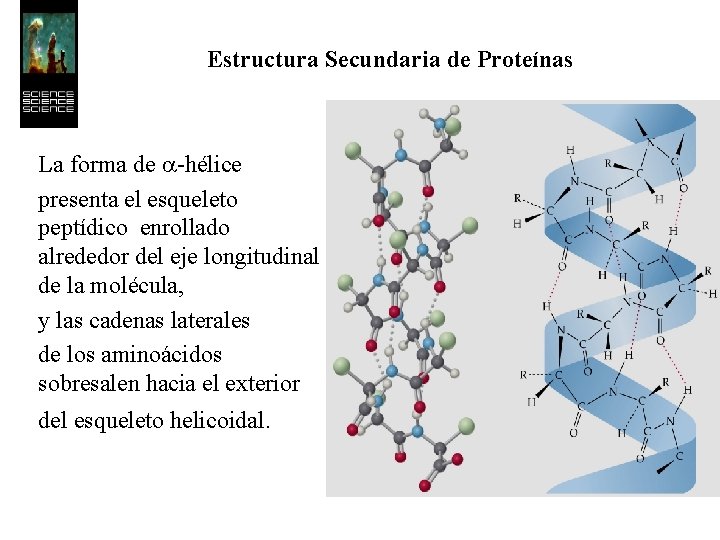
Estructura Secundaria de Proteínas La forma de a-hélice presenta el esqueleto peptídico enrollado alrededor del eje longitudinal de la molécula, y las cadenas laterales de los aminoácidos sobresalen hacia el exterior del esqueleto helicoidal.

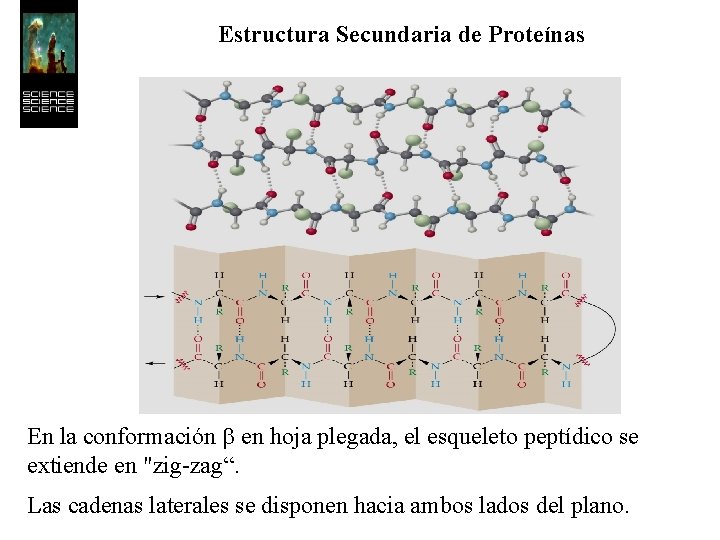
Estructura Secundaria de Proteínas En la conformación b en hoja plegada, el esqueleto peptídico se extiende en "zig-zag“. Las cadenas laterales se disponen hacia ambos lados del plano.

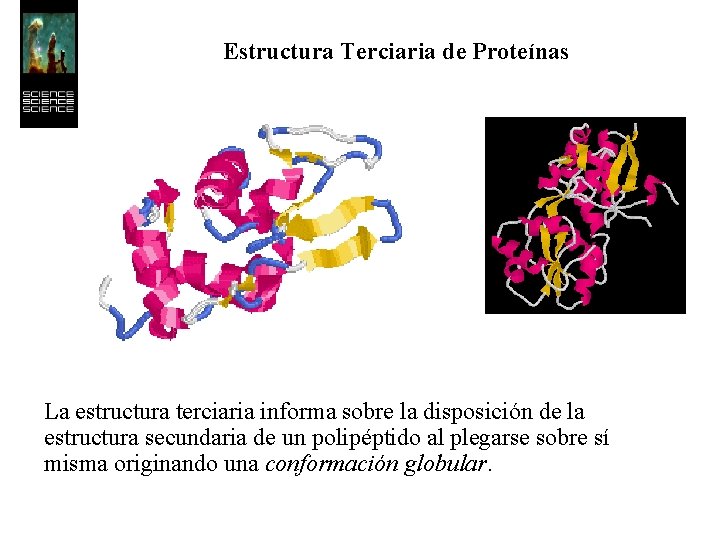
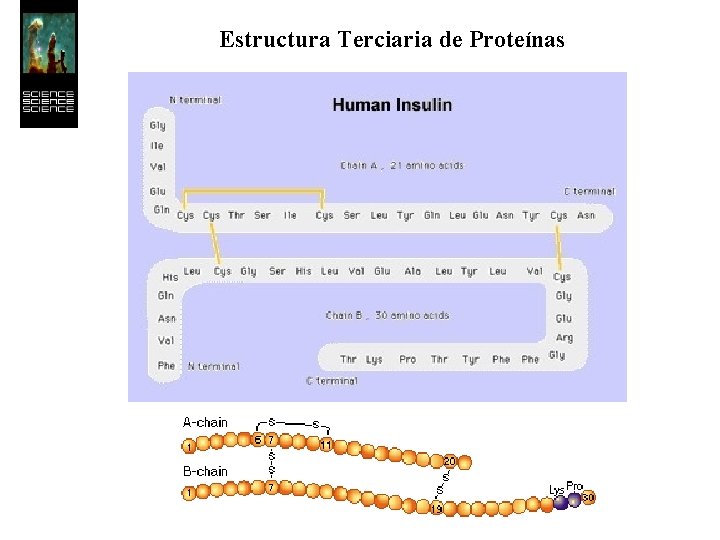
Estructura Terciaria de Proteínas La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular.

Estructura Terciaria de Proteínas

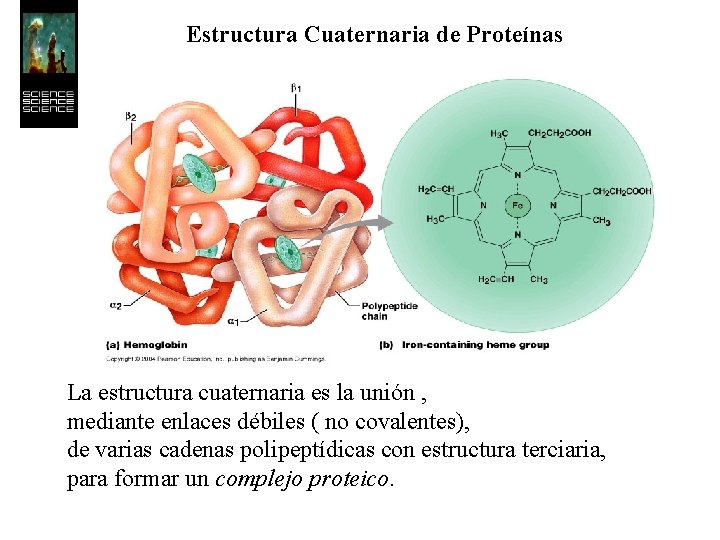
Estructura Cuaternaria de Proteínas La estructura cuaternaria es la unión , mediante enlaces débiles ( no covalentes), de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico.

Clasificación Estructural de Proteínas Las proteínas se clasifican estructuralmente en: I. HOLOPROTEÍNAS Formadas solamente por aminoácidos. II. HETEROPROTEÍNAS Formadas por una fracción proteínica y por un grupo no peptídico, que se denomina grupo prostético.

Clasificación Estructural de Proteínas I-A. Holoproteínas Globulares Prolaminas: Zeína (maíz), hordeína (cebada), etc. Gluteninas: Glutenina (trigo), orizanina (arroz), etc. Albúminas: Seroalbúmina, ovoalbúmina, lactoalbúmina, etc. Hormonas: Insulina, prolactina, tirotropina, etc. Enzimas: Hidrolasas, oxidasas, ligasas, transferasas, etc.

Clasificación Estructural de Proteínas I-B. Holoproteínas Fibrosas Colágenos: En tejidos conjuntivos, cartilaginosos, etc. Queratinas: En formaciones epidérmicas: pelos, uñas, etc. Elastinas: En tendones y vasos sanguíneos, etc. Fibroínas: En hilos de seda (arañas, insectos).

Clasificación Estructural de Proteínas II. Heteroproteínas a) Glucoproteínas Ribonucleasa, mucoproteínas, Ig, b) Lipoproteínas HDL, LDL, VLDL, etc. c) Nucleoproteínas Nucleosomas, ribosomas, etc. d) Cromoproteínas Hb, hemocianina, mioglobina, citocromos, etc.

Clasificación Funcional de Proteínas 1. Función Estructural Como las glucoproteínas que forman parte de las membranas. Las histonas que forman parte de los cromosomas. El colágeno, del tejido conjuntivo fibroso. La elastina, del tejido conjuntivo elástico. La queratina de la epidermis. 2. Enzimática Son las más numerosas y especializadas. Actúan como biocatalizadores de las reacciones químicas.

Clasificación Funcional de Proteínas 3. Hormonal Insulina. Hormona del crecimiento. Calcitonina. Hormonas tropas. 4. Defensiva Inmunoglobulina. Trombina y fibrinógeno. 5. Transporte Hemoglobina. Hemocianina. Citocromos. 6. Reserva nutricional Ovoalbúmina. Gliadina, del grano de trigo. Lactoalbúmina, de la leche.

Fin
 Cisternas hipolemicas
Cisternas hipolemicas Porque me dejaron a mi fuente de agua viva
Porque me dejaron a mi fuente de agua viva Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Funciones de las proteinas
Funciones de las proteinas Protenas
Protenas Cadena de aminoacidos
Cadena de aminoacidos La unión peptídica
La unión peptídica Holoproteinas globulares
Holoproteinas globulares Protenas
Protenas Bart selman rate my prof
Bart selman rate my prof Prof raj reddy
Prof raj reddy Dr nenad glumbic
Dr nenad glumbic Nader alaridah
Nader alaridah Gksal
Gksal Prof. stephan lorenz
Prof. stephan lorenz Alloprof registre de langue
Alloprof registre de langue Esterel iprof
Esterel iprof Prof. dr. mustafa serdar genç
Prof. dr. mustafa serdar genç Kadranlara göre karın ağrısı
Kadranlara göre karın ağrısı Ayah dr. iris rengganis
Ayah dr. iris rengganis Prof mandl
Prof mandl