PROTENAS So macromolculas de alto peso molecular cujas













- Slides: 15

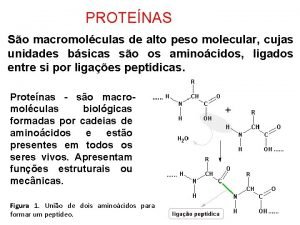
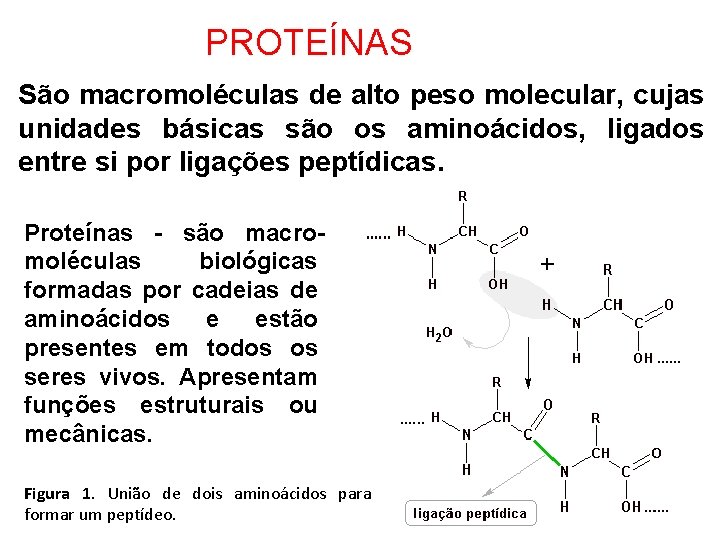
PROTEÍNAS São macromoléculas de alto peso molecular, cujas unidades básicas são os aminoácidos, ligados entre si por ligações peptídicas. Proteínas - são macromoléculas biológicas formadas por cadeias de aminoácidos e estão presentes em todos os seres vivos. Apresentam funções estruturais ou mecânicas. Figura 1. União de dois aminoácidos para formar um peptídeo.

Função das proteínas organoléptica e de textura. nos alimentos: nutricional, Tabela 1: Valor médio de proteínas em alimentos (Teor de proteína = Nx 6, 25%) Origem animal Proteínas (%) Origem vegetal Proteínas (%) Leite integral 3, 5 Arroz integral 7, 5 – 9, 0 Carne assada 25 Farinha de trigo 9, 8 – 13, 5 Ovo 13 Milho 7, 0 – 9, 4 Soja 33 – 42 Batata 10 – 13 Importância das proteínas üSão os maiores constituintes de toda célula; üSão componentes essenciais às atividades vitais; üPodem atuar como catalisadores de reações (enzimas); üSão necessárias nas reações imunológicas; üSão indispensáveis para o crescimento e reprodução.

CONSTITUIÇÃO DAS PROTEÍNAS Teor dos principais elementos químicos presentes na constituição das proteínas: Ø C: 50 a 55% H: 6 a 8% Ø O: 20 a 24% N: 15 a 18% Ø S: 0, 2 a 0, 3% P: traços Os métodos de análises existentes fundamentam-se na determinação da quantidade de carbono e nitrogênio através de fatores de conversão. CLASSIFICAÇÃO DAS PROTEÍNAS Proteínas simples: formadas apenas por aminoácidos; Proteínas conjugadas: formadas por aminoácidos e outros compostos químicos - Nucleoproteínas (ácido nucleico + proteína); Glicoproteínas (proteínas + hidratos de carbono); Fosfoproteínas ( proteína + fosfato); Cromoproteinas; Lipoproteínas; Metaloproteínas.

Propriedades funcionais As propriedades funcionais das proteínas são definidas como propriedades físico-químicas que afetam o seu comportamento no alimento durante o preparo, processamento e armazenamento, e contribuem para a qualidade e atributos sensoriais dos alimentos. Classificação Hidrofílicas: afinidade com a água. Interfásicas: capacidade das moléculas de proteína se unirem formando uma película entre duas fases. Intermoleculares: capacidade de formarem ligações entre si ou com outros componentes dos alimentos. Organolépticas: manifestam-se através dos órgãos dos sentidos, referindo-se a textura, cor, sabor e aroma.

Hidratação Capacidade de acúmulo de água na fração protéica. Capacidade de retenção de água: expressa pela capacidade de manutenção da água ligada à proteína. A capacidade de retenção de água pode sofrer interferência dos seguintes fatores: 1. Ponto isoelétrico. 2. Desnaturação protéica. PROPRIEDADES INTERFÁSICAS Emulsificação Emulsão é um sistema heterogêneo que consiste em um líquido imiscível, completamente difuso em outro na forma de gotículas com diâmetro superior a 0, 1 micron. Agente emulsificante É o que torna uma emulsão estável diminuindo a tensão superficial existente entre duas fases, ajudando na formação de uma mistura estável de duas substâncias anteriormente

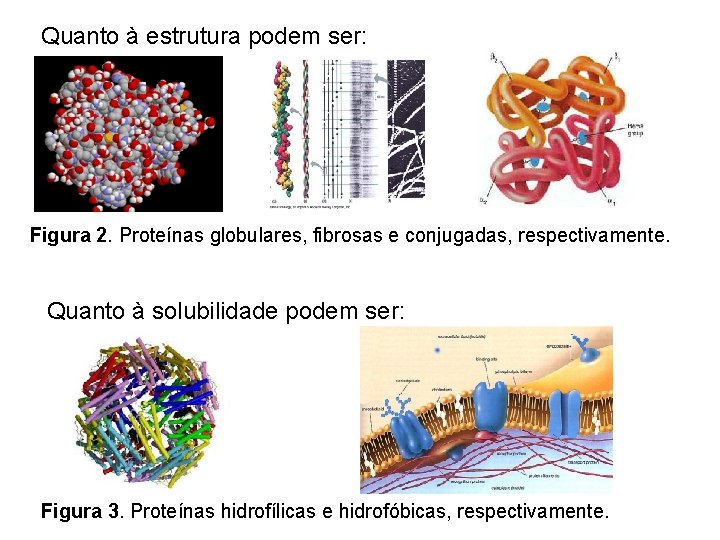
Quanto à estrutura podem ser: Figura 2. Proteínas globulares, fibrosas e conjugadas, respectivamente. Quanto à solubilidade podem ser: Figura 3. Proteínas hidrofílicas e hidrofóbicas, respectivamente.

Métodos de Análises: Métodos químicos e Métodos físicos Métodos químicos: baseia-se na determinação de um elemento (carbono ou nitrogênio) ou de um grupo (aminoácidos e ligações peptídicas) pertencentes à proteína. 1. Análise de Carbono Vantagens: mais fácil digestão que para o nitrogênio, fator de conversão mais constante, menores erros nos resultados; Desvantagens: maior dificuldade de separar os carbonos pertencentes à proteína dos carbonos de outros componentes. 2. Análise de Nitrogênio Mais utilizado, considera que as proteínas tem 16% de nitrogênio em média, fator geral de conversão de 6, 25. 16 g de N 100 g de proteínas “n” g de N “x” g de proteínas

Quadro 1. Fatores de conversão de nitrogênio total em proteínas Alimento Fator Farinha de centeio 5, 83 Amêndoas 5, 18 Farinha de trigo 5, 83 Castanha do Pará 5, 46 Macarrão 5, 70 Avelã 5, 30 Cevada 5, 83 Coco 5, 30 Aveia 5, 83 Leite e derivados 6, 38 Arroz 5, 95 Margarina 6, 38 Método de Kjeldahal -Determina o nitrogênio total (protéico e não protéico); -Está dividido em três etapas: digestão, titulação e conversão de nitrogênio em proteínas; -Vantagem: é oficial; determina microgramas de proteínas e aplicável a todos os tipos de alimentos. Apesar das várias etapas, não é um método caro. -Desvantagens: medir “N” total, demorado e usar vários reagentes corrosivos.

Digestão da amostra Esta etapa baseia-se no aquecimento da amostra por ácido sulfúrico concentrado, até que toda a matéria orgânica seja decomposta. O nitrogênio da proteína é reduzido e transformado em sulfato de amônio, (NH 4)2 SO 4 (sólido branco na temperatura ambiente). Esta reação é realizada, a quente, com auxílio de catalisadores (Na 2 SO 4 e Cu. SO 4). Amostra (N orgânico) + H 2 SO 4 (NH 4)2 SO 4 (aq) + CO 2 (g) + H 2 O (g) Na 2 SO 4: Aumenta o Ponto de Ebulição do H 2 SO 4 (de 337 o. C para mais de 400 o. C) tornando a digestão mais eficiente. Cu. SO 4 : Catalisador, acelera o processo de oxidação da matéria orgânica e indica o término da digestão (coloração azul-esverdeada).

Destilação da amostra ØNeutralização do sulfato de amônio (NH 4)2 SO 4, com solução de hidróxido de sódio (50%), formando amônia gasosa, NH 3. Ø Esta por sua vez é destilada e recolhida em solução de ácido bórico (H 3 BO 3 4%) na presença de indicador de Peterson (azul de metileno e alaranjado de metila, na proporção 1: 1). ØTérmino da reação: mudança de cor do indicador (roxo para verde), devido a formação de diborato de amônio, (NH 4)H 2 BO 3. (NH 4)2 SO 4 (aq) + 2 Na. OH (aq) 2 NH 3 (g) + Na 2 SO 4 (aq) + 2 H 2 O NH 3 (g) + H 3 BO 3 (NH 4)H 2 BO 3

Titulação da amostra Última etapa: determinação da quantidade de nitrogênio presente por volumetria de neutralização, usando solução de H 2 SO 4 0, 05 mol. L-1 padronizada, onde é liberado os íons amônio. (NH 4)H 2 BO 3 + H+ H 3 BO 3 + NH 4+ p. H 8 -9 (verde) p. H 4, 2 (roxo) O volume gasto de ácido corresponde ao teor de NH 4+ presente. O teor de proteína é calculado pelo teor de nitrogênio presente na amostra, por meio da seguinte fórmula:

Outros métodos químicos: üMétodo de Dumas: determina N total após combustão a 700800º C, por medida volumétrica do nitrogênio gasoso - método difícil e sujeito a erros. üMétodo por Biureto: substâncias que contêm ligações peptídicas formam compostos de cor roxa com o reagente biureto – o complexo formado é medido num colorímetro ou espectrofotômetro a 540 nm. üMétodo por fenol: baseia-se na interação das proteínas com o fenol e cobre em meio alcalino – o complexo formado é medido num colorímetro. üMétodo turbidimétrico: baseia-se na turbidez causada pela proteína precipitada por ácido tricloracético, ferricaneto de potássio e ácido sulfossalicílico.

üMétodo de Warrentrapp e Will: baseia-se no aquecimento da amostra, misturada com carbonato de sódio – a amônia liberada é recolhida em ácido cloroplatínico. O cloroplatinato de amônio é seco e pesado. üMétodo Dye-Binding: quando a amostra é tratada com corante em excesso, a proteína reage e forma substâncias insolúveis, que podem ser separadas – excesso de corante é medido colorimetricamente. Usado em amostras de grãos de cereais, sementes oleaginosas, produtos vegetais e animais, lácteos. MÉTODOS FÍSICOS São vários os métodos físicos disponíveis, tais como: índice de refração, densidade específica, tensão superficial, condutividade, polarização.

EXERCÍCIOS 1. O que significa desnaturação das proteínas? 2. Propriedades funcionais das proteínas nos alimentos. 3. Descreva o método de Kjeldahl 4. Um analista determinou o teor de proteínas em amostras de bolachas por meio do método de Kjeldahl. Para isso ele pesou amostras em triplicata conforme tabela abaixo. a)Explique como deve ser realizada a amostragem de bolachas de aveia. b)Quais os cuidados que o analista deve ter na etapa da digestão? c)Quais as fontes de erros na etapa da destilação? d)Sabendo-se que ele encontrou os seguintes volumes de H 2 SO 4 0, 05 mol/L (fator de correção = 1, 018), calcule o teor de proteínas amostras de bolacha. Amostras Volume de H₂SO₄ (m. L) Massa (g) 1 37, 4 1, 405 2 35, 6 1, 329 3 36, 0 1, 389 % proteínas

5. As proteínas são essenciais para todos os seres vivos, uma vez que desempenham funções extremamente importantes. Descreva cinco dessas funções no organismo
 Cuando voy vengo y cuando vengo voy quien soy
Cuando voy vengo y cuando vengo voy quien soy Control de mermas en alimentos
Control de mermas en alimentos Porcentaje peso a peso
Porcentaje peso a peso Calcular peso molecular
Calcular peso molecular Molaridad
Molaridad Calcular el peso molecular 4ca(oh)2
Calcular el peso molecular 4ca(oh)2 Cual es el peso molecular de na2so4
Cual es el peso molecular de na2so4 Heparina no fraccionada
Heparina no fraccionada El metanol se quema en el aire de acuerdo con la ecuacion
El metanol se quema en el aire de acuerdo con la ecuacion Tienopiridinas mecanismo de acción
Tienopiridinas mecanismo de acción Ionizacion del agua
Ionizacion del agua Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Classificação das proteínas
Classificação das proteínas