Unidad 1 Materia y sus transformaciones Propiedades generales







- Slides: 8

Unidad 1: Materia y sus transformaciones. Propiedades generales de las disoluciones OA#3: Aplicar relaciones cuantitativas de los componentes de una disolución expresada mediante unidades de concentración: • • Normalidad Fracción molar OBJETIVO DEL DIA: Describir unidades de concentración química: Normalidad y Fracción molar.

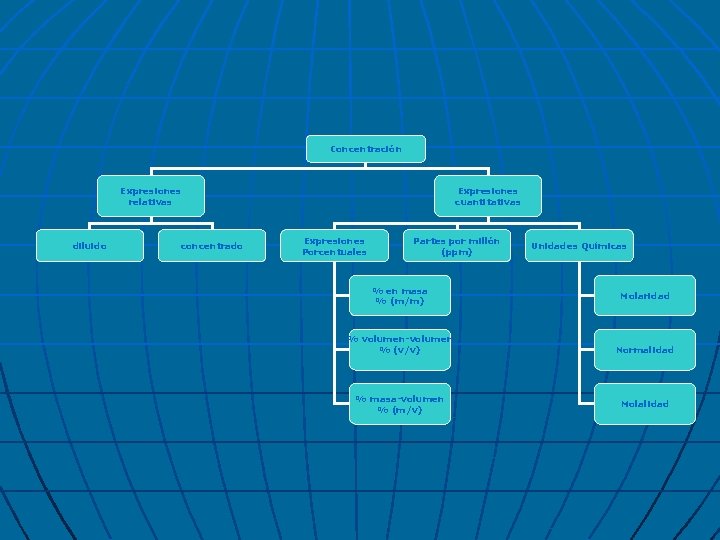
Concentración Expresiones relativas diluido concentrado Expresiones cuantitativas Expresiones Porcentuales Partes por millón (ppm) % en masa % (m/m) % volumen-volumen % (v/v) % masa-volumen % (m/v) Unidades Químicas Molaridad Normalidad Molalidad

EXPRESIONES CUANTITATIVAS. UNIDADES QUIMICAS.

Normalidad La concentración normal o normalidad (N), se define como el número de equivalentes de soluto por litro de solución: El peso equivalente de un ácido se define como la masa en gramos que producirá 1 mol de iones H+ en una reacción. El peso equivalente de una base es la cantidad en gramos que proporcionará 1 mol de iones OH-.

El peso equivalente de un ácido o una base es igual a:

Fracción molar ( ) Expresa el cociente entre el nº de moles de un soluto en relación con el nº de moles total (soluto más disolvente). n nsoluto = ————— nsoluto + ndisolvente Igualmente n ndisolvente = ————— nsoluto + ndisolvente n 6

Fracción molar ( ) (cont. ). n n nsoluto + ndisolvente soluto + disolvente = ————— = 1 nsoluto + ndisolvente Si hubiera más de un soluto siempre ocurrirá que la suma de todas las fracciones molares de todas las especies en disolución dará como resultado “ 1”. 7

Ejemplo: Calcular la fracción molar de CH 4 y de C 2 H 6 en una mezcla de 4 g de CH 4 y 6 g de C 2 H 6 y comprobar que la suma de ambas es la unidad. 4 g 6 g n (CH 4) =———— = 0, 25 mol; n (C 2 H 6) =————= 0, 20 mol 16 g/mol 30 g/mol n (CH 4) 0, 25 mol (CH 4) = ————————— = 0, 56 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol n (C 2 H 6) 0, 20 mol (C 2 H 6) = ————————— = 0, 44 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol (CH 4) + (C 2 H 6) = 0, 56 + 0, 44 = 1 8













