EL ENLACE QUMICO Los tomos se unen Profesora














- Slides: 26

EL ENLACE QUÍMICO “Los átomos se unen” Profesora: Marianet Zerené

Objetivo clase v. Identificar en que consiste el enlace químico y relacionarlo con la configuración electrónica.

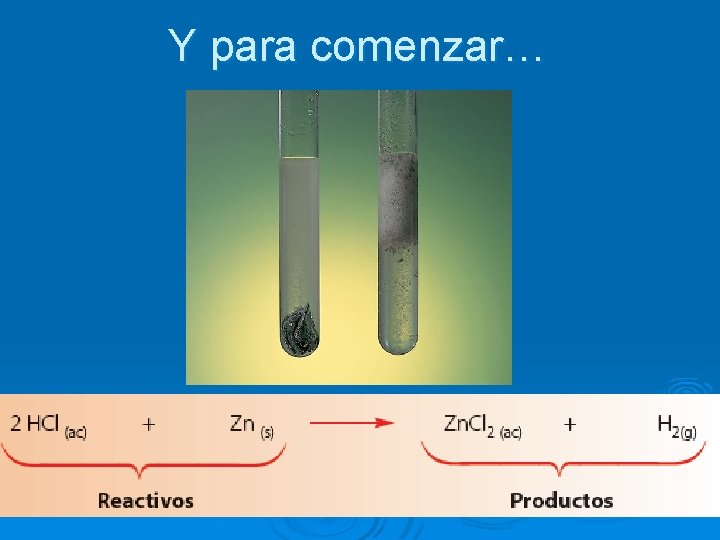
Y para comenzar…

Preguntas….

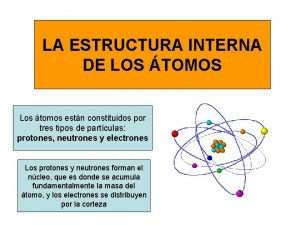
Una primera aproximación para interpretar el enlace Ø A principios del siglo XX, el científico Lewis, observando la poca reactividad de los gases nobles (estructura de 8 electrones en su último nivel), sugirió que los átomos al enlazarse “tienden” a adquirir una distribución de electrones de valencia igual a la del gas noble más próximo REGLA DEL OCTETO

Clasificación de los elementos de acuerdo con la regla del octeto Ø Metales: baja electronegatividad, baja energía de ionización. Tienden a soltar electrones. Ø No metales: alta electronegatividad. Tienden a captar electrones.

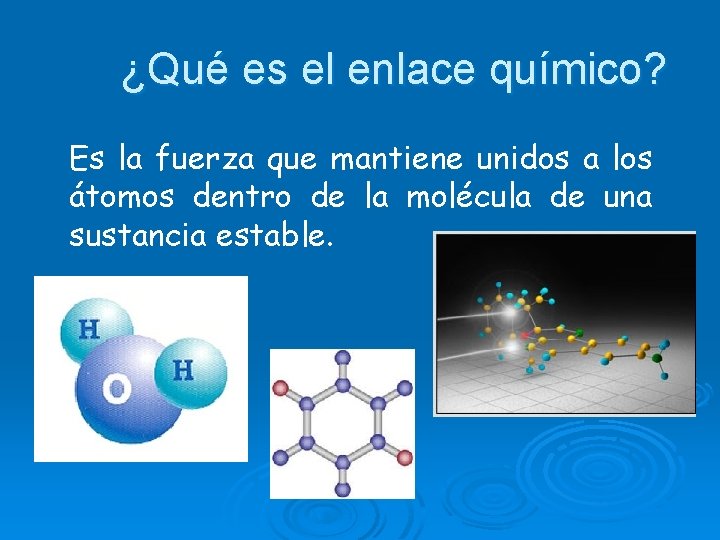
¿Qué es el enlace químico? Es la fuerza que mantiene unidos a los átomos dentro de la molécula de una sustancia estable.

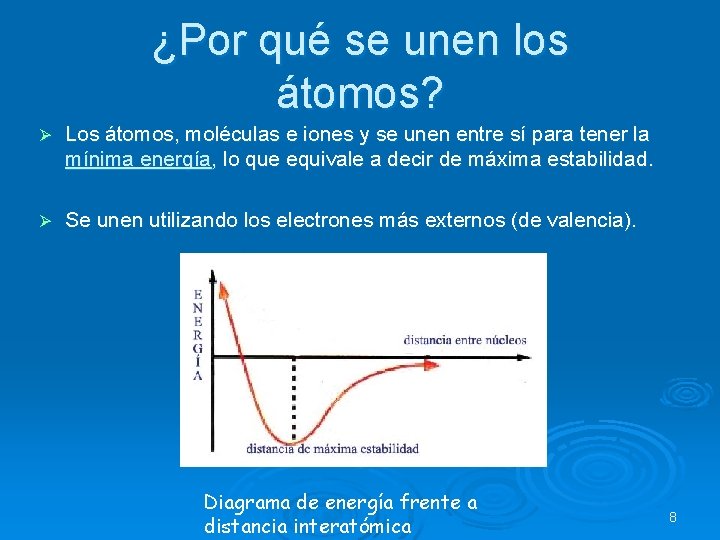
¿Por qué se unen los átomos? Ø Los átomos, moléculas e iones y se unen entre sí para tener la mínima energía, lo que equivale a decir de máxima estabilidad. Ø Se unen utilizando los electrones más externos (de valencia). Diagrama de energía frente a distancia interatómica 8


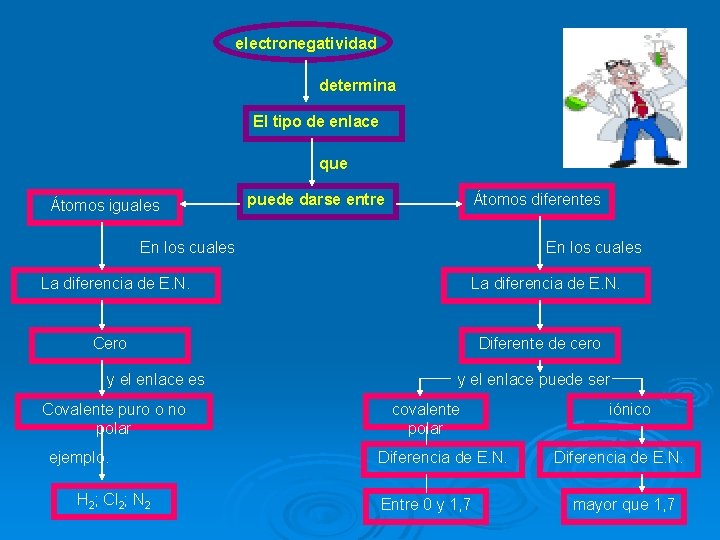
Electronegatividad (EN): Ø Es la capacidad que tiene un átomo para ganar electrones de otro átomo. v

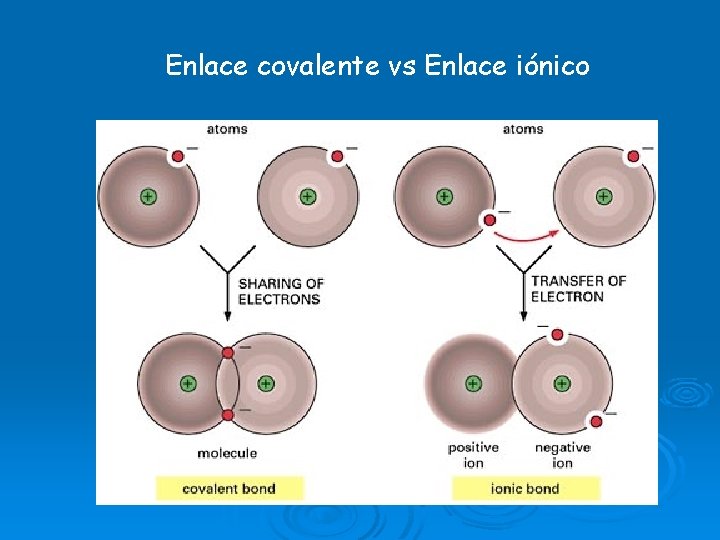
electronegatividad determina El tipo de enlace que Átomos iguales puede darse entre Átomos diferentes En los cuales La diferencia de E. N. Cero y el enlace es Covalente puro o no polar ejemplo. H 2; Cl 2; N 2 Diferente de cero y el enlace puede ser covalente polar Diferencia de E. N. Entre 0 y 1, 7 iónico Diferencia de E. N. mayor que 1, 7

ESTRUCTURAS O SIMBOLOS DE LEWIS OBJETIVO: X Conocer y aplicar las estructuras de Lewis. Relacionar los simbolos de Lewis con el enlace químico.

v Los gases nobles presentan gran estabilidad química, y existen como moléculas mono-atómicas. e- de Valencia v Su configuración electrónica es muy estable y contiene 8 He). e- en la capa de valencia (excepto el v La idea de enlace covalente fue sugerida en 1916 por G. N. Lewis: G. N. Lewis Los átomos pueden adquirir estructura de gas noble compartiendo electrones para formar un enlace de pares de electrones. He Ne Ar Kr Xe Rn 2 8 8 8

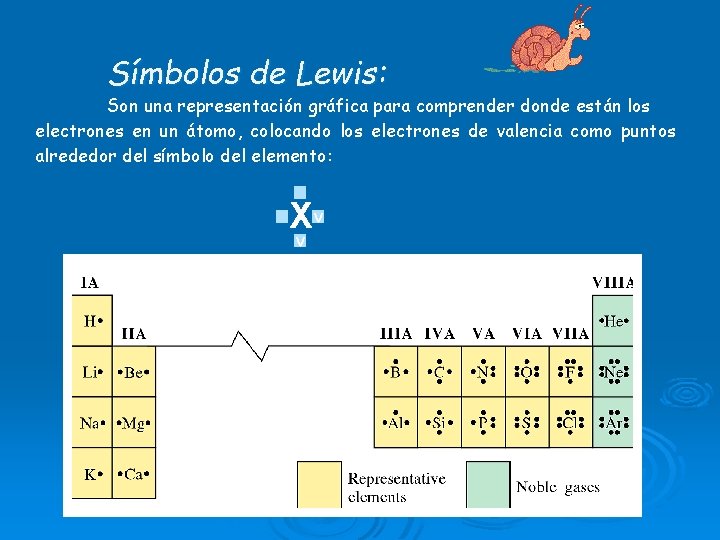
Símbolos de Lewis: Son una representación gráfica para comprender donde están los electrones en un átomo, colocando los electrones de valencia como puntos alrededor del símbolo del elemento: Xv v

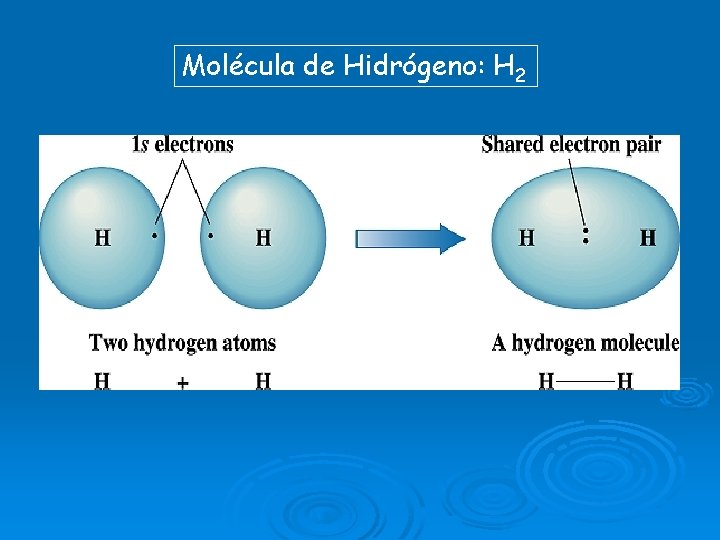
Regla del octeto: Los átomos se unen compartiendo electrones hasta conseguir completar la última capa con 8 e- (4 pares de e-) es decir conseguir la configuración de gas noble: s 2 p 6 Tipos de pares de electrones: 1 - Pares de e- compartidos entre dos átomos (representado con una línea entre los átomos unidos) · enlaces sencillos · enlaces dobles · enlaces triples 2 - Pares de e- no compartidos (ó par solitario)

Molécula de Hidrógeno: H 2

Enlace covalente vs Enlace iónico

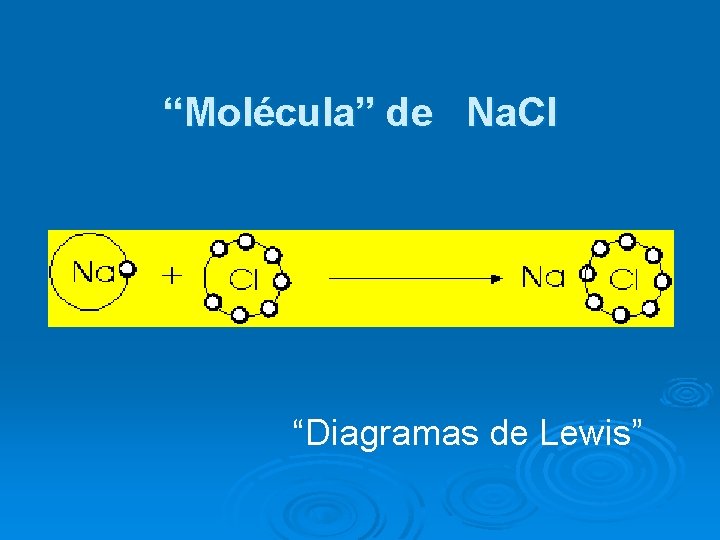
“Molécula” de Na. Cl “Diagramas de Lewis”

“Molécula” de Mg. F 2

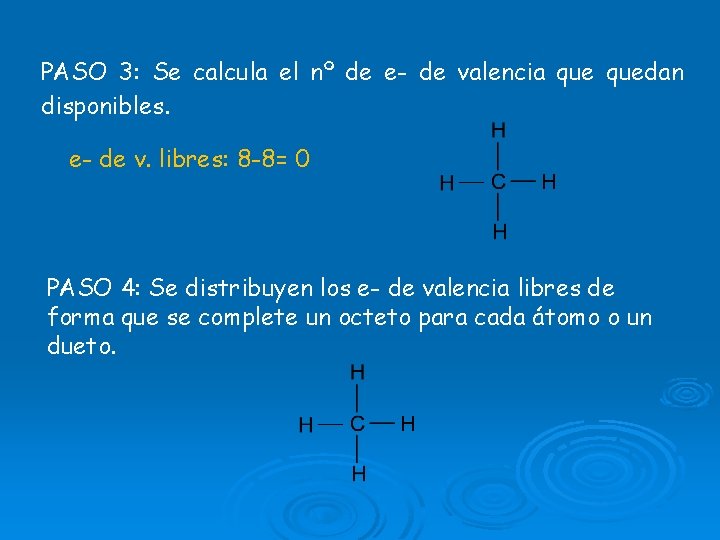
¿Como se dibujan las estructuras de Lewis? PASO 1: Se suman los e- de valencia de los átomos presentes en la molécula. Ejemplo 1: CH 4 C: 1 s 22 s 2 p 2 4 e. H: 1 s 1 1 e- x 4= 4 e- 8 e- PASO 2: Se dibuja una estructura esquemática con los símbolos atómicos unidos mediante enlaces sencillos.

PASO 3: Se calcula el nº de e- de valencia quedan disponibles. e- de v. libres: 8 -8= 0 PASO 4: Se distribuyen los e- de valencia libres de forma que se complete un octeto para cada átomo o un dueto.

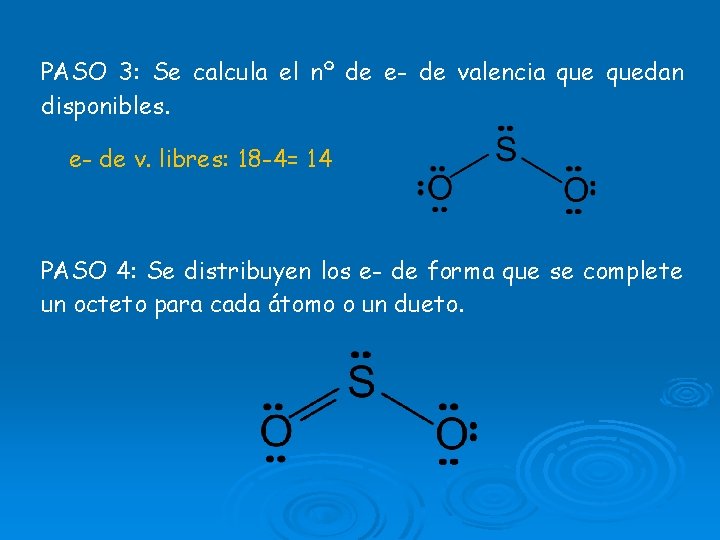
¿Como se dibujan las estructuras de Lewis? PASO 1: Se suman los e- de valencia de los átomos presentes en la molécula. Ejemplo 4: SO 2 S: 3 s 2 p 4 6 e. O: 2 s 2 p 4 6 e-x 2 = 12 18 e- PASO 2: Se dibuja una estructura esquemática con los símbolos atómicos unidos mediante enlaces sencillos.

PASO 3: Se calcula el nº de e- de valencia quedan disponibles. e- de v. libres: 18 -4= 14 PASO 4: Se distribuyen los e- de forma que se complete un octeto para cada átomo o un dueto.

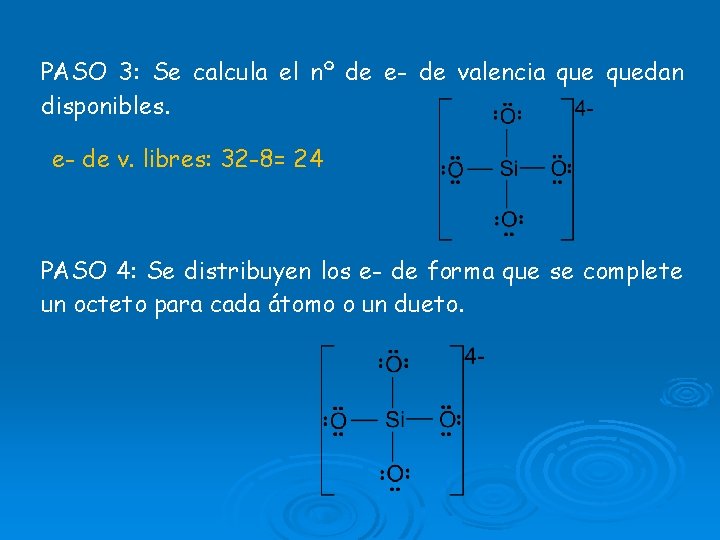
¿Como se dibujan las estructuras de Lewis? PASO 1: Se suman los e- de valencia de los átomos presentes en la molécula. Ejemplo 3: Si. O 4 -4 Si: 3 s 2 p 2 4 e. O: 2 s 2 p 4 6 e-x 4 = 24 + 4 cargas neg. 32 e- PASO 2: Se dibuja una estructura esquemática con los símbolos atómicos unidos mediante enlaces sencillos.

PASO 3: Se calcula el nº de e- de valencia quedan disponibles. e- de v. libres: 32 -8= 24 PASO 4: Se distribuyen los e- de forma que se complete un octeto para cada átomo o un dueto.

A trabajar… 1. - Desarrolla en tu cuaderno las actividades en amarillo del texto que están en la unidad de enlace químico. Serán décimas para la prueba
 Ngembang jambu
Ngembang jambu Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Polar y no polar
Polar y no polar Oxígeno tipo de enlace
Oxígeno tipo de enlace Enlace qumico
Enlace qumico Tomos trivia answers
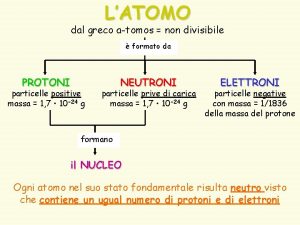
Tomos trivia answers Tomos greco
Tomos greco Que son los enlaces sigma
Que son los enlaces sigma Isomeria de carbohidratos
Isomeria de carbohidratos Amorfos
Amorfos Gusano silaba tonica
Gusano silaba tonica Profesora adjetivo
Profesora adjetivo 5 adjetivos de maestra
5 adjetivos de maestra Soy oraciones
Soy oraciones Acatadora
Acatadora Profesora caricatura
Profesora caricatura Cual es el texto informativo por excelencia
Cual es el texto informativo por excelencia Presente profesora
Presente profesora Características de la profesora thompson para otros
Características de la profesora thompson para otros Profesora ma
Profesora ma La profesora marta en el proceso de desarrollo
La profesora marta en el proceso de desarrollo Sigla edu
Sigla edu Sigla de profesora
Sigla de profesora Completar nombre
Completar nombre Que son las ondas
Que son las ondas Maestra thompson
Maestra thompson