LA ESTRUCTURA INTERNA DE LOS TOMOS Los tomos











- Slides: 28

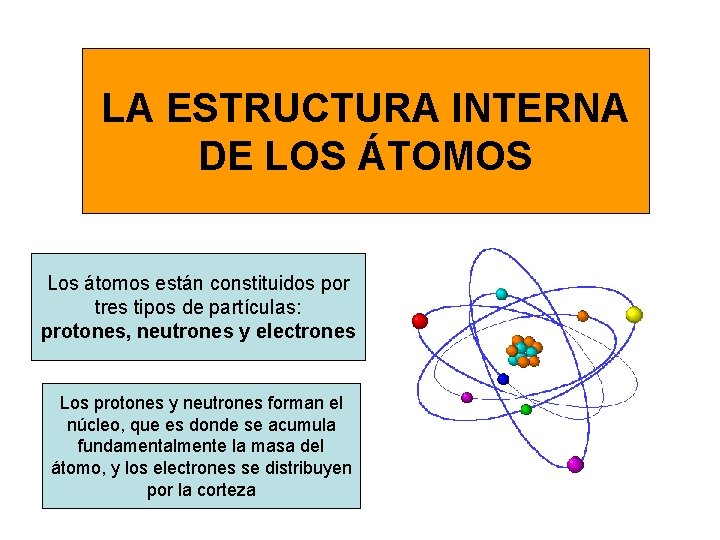
LA ESTRUCTURA INTERNA DE LOS ÁTOMOS Los átomos están constituidos por tres tipos de partículas: protones, neutrones y electrones Los protones y neutrones forman el núcleo, que es donde se acumula fundamentalmente la masa del átomo, y los electrones se distribuyen por la corteza

MODELOS ATÓMICOS Los distintos modelos atómicos surgen para tratar de explicar las propiedades de los átomos y, en particular, sus espectros de emisión (Ver Web sobre cómo se obtienen los espectros de emisión) A medida que se dispuso de nuevas tecnologías y se conocieron más propiedades de los átomos se fueron ampliando los modelos atómicos con el fin de poder explicar los nuevos fenómenos y propiedades En este curso, el modelo atómico de Bohr, la ampliación de Sommerfeld y algunas aportaciones de la mecánica ondulatoria serán suficientes para entender el átomo

MODELO ATÓMICO DE BORH El modelo atómico planetario de Ernst Rutherford (1911) presentaba una serie de problemas que la Física clásica no conseguía resolver. Niels Bohr, en 1913, dio un gran paso adelante resolviendo parte de estos problemas apoyándose en las incipientes ideas cuánticas de Planck Max Planck introdujo una teoría revolucionaria en el año 1900 según la cual la energía no podía ser absorbida ni emitida en forma continua, sino en cantidades discretas de valores específicos que son múltiplos de una unidad fundamental, cuanto. El cuanto corresponde a la menor cantidad posible de energía que se puede absorber o emitir por un cuerpo Bohr aplicó las ideas de Planck al modelo planetario de Rutherford proponiendo tres postulados: Primer postulado El electrón puede girar en un cierto Segundo postulado número de órbitas circulares o Sólo son posibles aquellas órbitasdel en “estados estacionarios” alrededor Tercer postulado las que el momento angular del núcleo sin emitir energía radiante Cuando un electrón salta de una electrón sea múltiplo entero de h/2 p órbita a otra, absorbe o emite Ver Web en el blog energía en forma de radiación e. m. , cuya n viene dada por: DE = hn

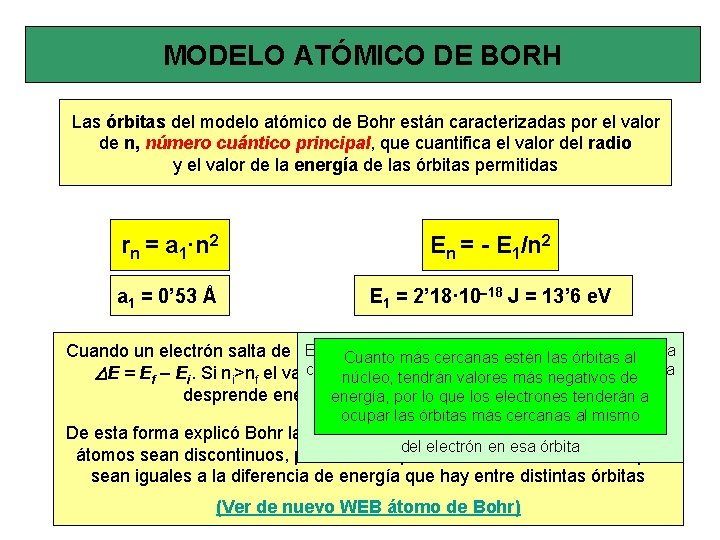
MODELO ATÓMICO DE BORH Las órbitas del modelo atómico de Bohr están caracterizadas por el valor de n, número cuántico principal, que cuantifica el valor del radio y el valor de la energía de las órbitas permitidas rn = a 1·n 2 En = - E 1/n 2 a 1 = 0’ 53 Å E 1 = 2’ 18· 10 -18 J = 13’ 6 e. V El valor dea. Eotra se considera negativo queun se toma Cuando un electrón salta de una órbita variará energía en nmás Cuanto cercanassu estén lasya órbitas alvalor como cero la tendrán energía dello electrón a distancia infinita DE = Ef – Ei. Si ni>nf el valor denúcleo, DE es negativo, que indica que de se valores más negativos del forma núcleo, en eselos momento noa desprende energía, en radiación e. m. el electrón porde lo que electrones tenderán pertenece átomo, al acercarse ocuparallas órbitasy más cercanasalalmismoy ser atraídode porque éstelos desprenderá que será la De esta forma explicó Bohr la causa espectrosenergía, de emisión de los del electrón en esa órbita átomos sean discontinuos, pues sólo se pueden emitir valores de DE que sean iguales a la diferencia de energía que hay entre distintas órbitas (Ver de nuevo WEB átomo de Bohr)

MODELO ATÓMICO DE BORH-SOMMERFELD Cuando. No seobstante, pudieronalutilizar espectroscopios de mayor poder observar un nuevo desdoblamiento en resolutivo, las rayas se observó unnuevo desdoblamiento lasde rayas decampos losespectrales primeros espectros y esto Un desdoblamiento las de líneas en uno campo espectrales producido por ladepresencia magnéticos eléctricos le hizo a Arnold Sommerfeld ampliar el modelo de Bohr, queel magnético débil, justificó suponiendo dentro deindicando cada órbita hubo que introducir lase posibilidad de que sóloque fueran posibles unas ciertas noelectrón sólo podría haber circulares, sino también cuyapor podía tener un giro sobre mismo en que doselípticas, posibles para sentidos, orientaciones en elórbitas espacio, por losíque habría introducir un tercer definición hace falta segundo números, cuántico, l, o número lo quecuántico, se introdujo nuevounnúmero cuántico o número cuántico de número mlintroducir , ounnúmero cuántico magnético, que cuantifica estas cuántico secundario, pueden hasta (n-1) espín, con valores decuyos +1/2 óvalores – 1/2, para cuantificar su 0 sentido de–lgiro orientaciones y puede tomar los valores de ir+l, desde +(l-1), . . . 0. . . -(l-1), Espectro discontinuo del H

MODELO ATÓMICO DE BORH-SOMMERFELD Así pues, según este modelo atómico se puede definir al electrón mediante un conjunto de cuatro números cuánticos: (n , l , ml , s) A pesar de todo, este modelo sólo es adecuado para interpretar las propiedades del átomo de hidrógeno y de los llamados hidrogenoides (núcleos rodeados de un solo electrón, como el He+) Estos fallos se corrigieron mediante la aplicación del modelo mecano cuántico del electrón. Las ideas cuánticas de Planck, la dualidad ondacorpúsculo de De Broglie y el principio de incertidumbre de Heisemberg constituyen la base de la mecánica cuántica

MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO Dualidad partícula-onda (De Broglie) A partir de que Einstein introdujera (para explicar el efecto fotoeléctrico) la idea de que la luz podía tener un comportamiento corpuscular además de un comportamiento ondulatorio, Louis De Broglie propuso que las partículas clásicas también podrían mostrar propiedades de onda, y aplicó su hipótesis de la dualidad onda-partícula al electrón. Cuando con posterioridad se difractaron electrones en cristales, se confirmó la hipótesis de De Broglie, observándose el comportamiento ondulatorio del electrón Principio de incertidumbre (Heisemberg) De acuerdo con la mecánica clásica, podemos determinar simultáneamente la posición y la cantidad de movimiento de un cuerpo. La aplicación del principio de incertidumbre de Heisemberg al electrón considera que, debido a su naturaleza ondulatoria, no es posible determinar con precisión la posición del electrón y su cantidad de movimiento, sino que debe haber una incertidumbre en sus medidas. Por lo tanto, si se determina con precisión la energía de un electrón, no se puede localizar sino que podemos hablar de la probabilidad de encontrarlo en un lugar en un instante de tiempo determinado

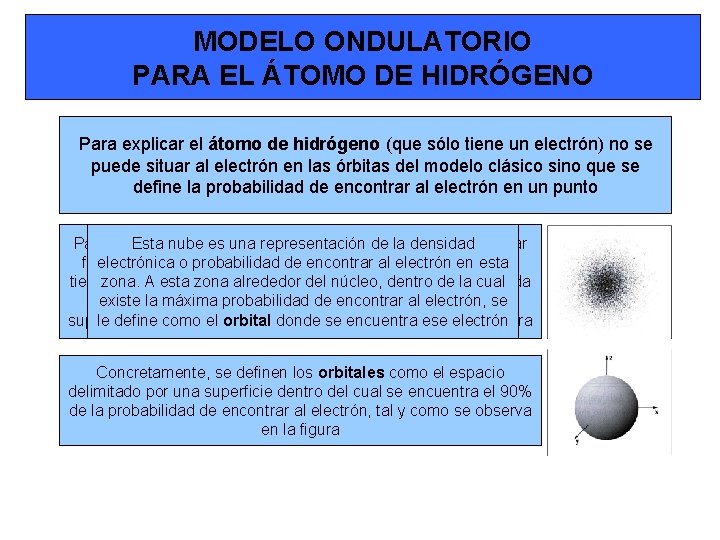
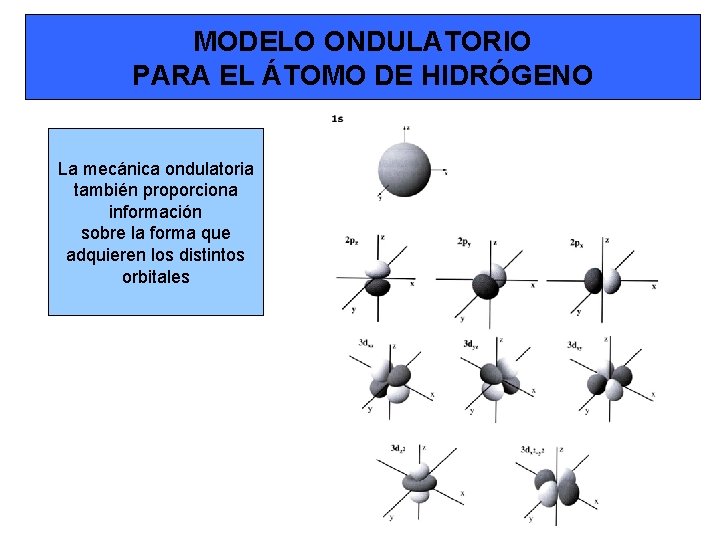
MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO Para explicar el átomo de hidrógeno (que sólo tiene un electrón) no se puede situar al electrón en las órbitas del modelo clásico sino que se define la probabilidad de encontrar al electrón en un punto Para explicar Esta nube este concepto, es una representación supongamosde que la se densidad pueden tomar fotografías electrónica deoun probabilidad electrón alrededor de encontrar del núcleo. al electrón Al cabo en esta de un tiempo zona. y de. A tomar esta zona un número alrededor muydel grande núcleo, dedentro fotografías de la en cual cada una existe de la lasmáxima cuales probabilidad aparecerá el de electrón encontrar como al un electrón, punto, se al superponer le definetodas comoellas el orbital se tendrá donde unaseimagen encuentra como ese la electrón de la figura Concretamente, se definen los orbitales como el espacio delimitado por una superficie dentro del cual se encuentra el 90% de la probabilidad de encontrar al electrón, tal y como se observa en la figura

MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO La aplicación de este modelo ondulatorio al átomo de hidrógeno implica, de manera similar a como ocurría con el modelo de Bohr-Sommerfeld, la introducción de tres números cuánticos: n, l y ml. Para caracterizar a un orbital estos números sólo pueden tomar una serie de valores determinados: El número cuántico principal (n) sólo puede tener valores enteros y positivos (n = 1, 2, 3, 4. . ) y determina el tamaño y energía del orbital El número cuántico secundario (l), cuyos valores pueden ser l = 0, 1, 2, . . . , (n-1), determina la forma del orbital El número cuántico magnético (ml) puede tomar los valores ml = -l, -(l-1), -(l-2). . . 0. . . (l-2), (l-1), l, y determina la orientación del orbital

MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO Todos los orbitales con el mismo valor de n pertenecen a la misma capa o nivel, y los que tienen los mismos valores de l, a la misma subcapa o subnivel. A la capa con valor n = 1 se le llama capa K A la capa con valor n = 2 se le llama capa L A la capa con valor n = 3 se le llama capa M etc Los orbitales se nombran en función del valor de l Para l = 0, se nombra orbital s Para l = 1, se nombra orbital p Para l = 2, se nombra orbital d Para l = 3, se nombra orbital f etc

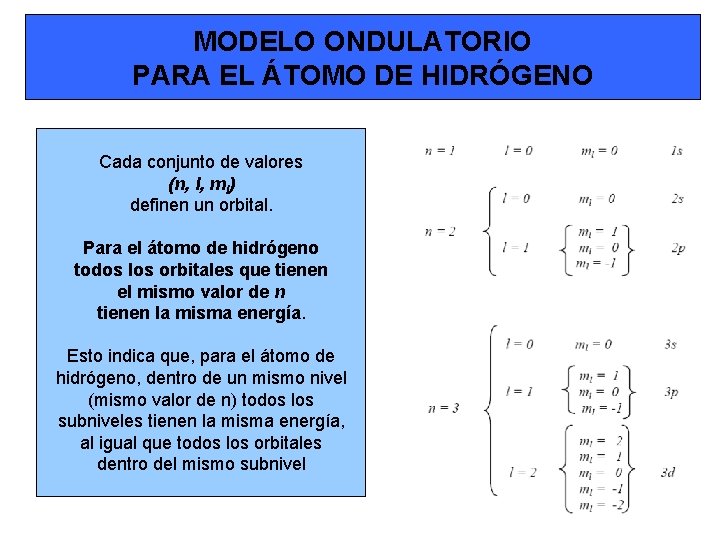
MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO Cada conjunto de valores (n, l, ml) definen un orbital. Para el átomo de hidrógeno todos los orbitales que tienen el mismo valor de n tienen la misma energía. Esto indica que, para el átomo de hidrógeno, dentro de un mismo nivel (mismo valor de n) todos los subniveles tienen la misma energía, al igual que todos los orbitales dentro del mismo subnivel

MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO La mecánica ondulatoria sólo da lugar a tres números cuánticos para describir a los orbitales electrónicos (n, l, ml ). No obstante, el electrón se comporta como si girase sobre sí mismo, lo cual sugiere dos posibilidades de giro del electrón dentro de un mismo orbital: El número cuántico de espín (ms) sólo puede tener los valores +1/2 y – 1/2 y determina el giro del electrón sobre sí mismo

MODELO ONDULATORIO PARA EL ÁTOMO DE HIDRÓGENO La mecánica ondulatoria también proporciona información sobre la forma que adquieren los distintos orbitales

MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS En el átomo de hidrógeno el valor de la energía de un orbital sólo depende del valor de n. Así, todos los orbitales de la misma subcapa y todas las subcapas de la misma capa tienen la misma energía, es decir, son orbitales degenerados No obstante, en los átomos En los átomos polielectrónicos los orbitales son (átomos conamás de un electrón)y no semejantes los del hidrógeno se ocurre esto, mediante pues aparecen nuevos definen los mismos factores a tener en cuenta, como son números cuánticos. La diferencia las repulsiones que estriba en que interelectrónicas, ahora sólo aparecen modifican la energía de losde la como degenerados los orbitales orbítales conforme dependiendo cambia el número misma subcapa, la atómico energía no sólo del valor de n, sino también del valor de l

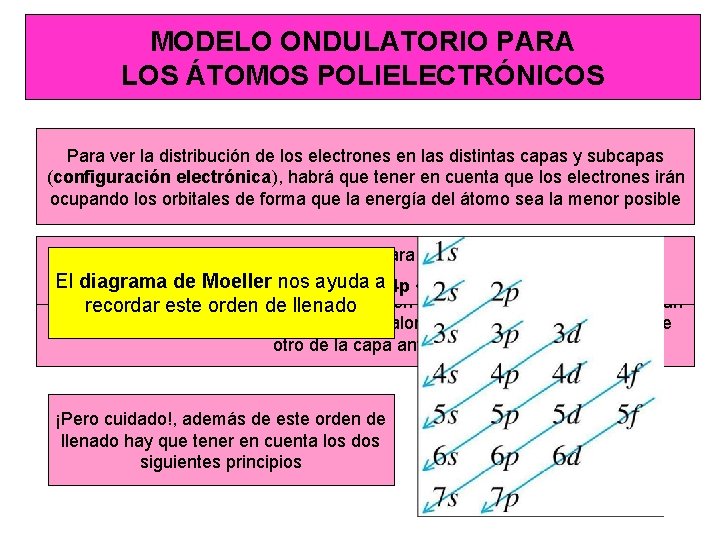
MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS Para ver la distribución de los electrones en las distintas capas y subcapas (configuración electrónica), habrá que tener en cuenta que los electrones irán ocupando los orbitales de forma que la energía del átomo sea la menor posible El orden para en pocas excepciones es: La disminución de determinado, la energía de excepto los orbitales los átomos polielectrónicos al aumentar carga nuclear no en<todos El diagrama ayuda 1 s < 2 sla<de 2 p. Moeller < 3 s < 3 pnos <(Z) 4 s < ocurre 3 d <a 4 pde< la 5 smisma < 4 d <forma 5 p <6 s 4 f … los orbitales, por loeste que orden aparecen en el orden, pudiendo ocurrir que un recordar de alteraciones llenado orbital de una capa con un determinado valor de n tenga menos energía que otro de la capa anterior ¡Pero cuidado!, además de este orden de llenado hay que tener en cuenta los dos siguientes principios

MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS Principio de exclusión de Pauli Dos electrones de un mismo átomo no pueden tener los cuatro números cuánticos iguales Como cada orbital viene definido por los tres números cuánticos n, l y ml, en cada uno de ellos sólo podrá haber dos electrones: uno con ms = +1/2 y otro con ms = -1/2 Es decir que cada orbital sólo puede estar ocupado por dos electrones y éstos han de tener sus espines opuestos (electrones apareados)

MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS Regla de Hund En orbitales que tienen iguales valores de n y l, los electrones tenderán a ocupar orbitales con distintos valores de ml, y sus espines serán paralelos Es decir, en orbitales degenerados (con la misma energía) los electrones tienden a estar lo más desapareados posible

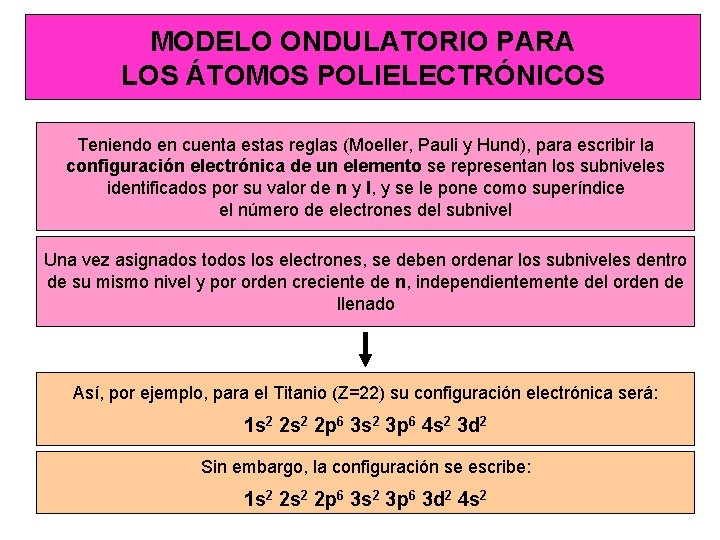
MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS Teniendo en cuenta estas reglas (Moeller, Pauli y Hund), para escribir la configuración electrónica de un elemento se representan los subniveles identificados por su valor de n y l, y se le pone como superíndice el número de electrones del subnivel Una vez asignados todos los electrones, se deben ordenar los subniveles dentro de su mismo nivel y por orden creciente de n, independientemente del orden de llenado Así, por ejemplo, para el Titanio (Z=22) su configuración electrónica será: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 2 Sin embargo, la configuración se escribe: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 2 4 s 2

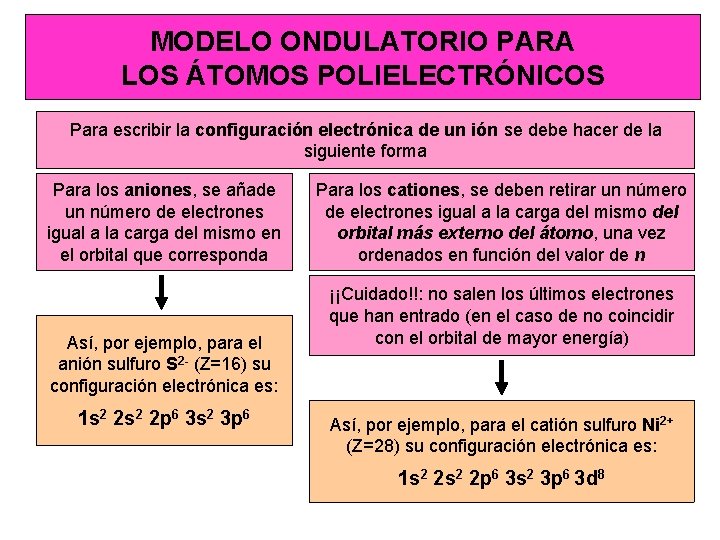
MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS Para escribir la configuración electrónica de un ión se debe hacer de la siguiente forma Para los aniones, se añade un número de electrones igual a la carga del mismo en el orbital que corresponda Así, por ejemplo, para el anión sulfuro S 2 - (Z=16) su configuración electrónica es: 1 s 2 2 p 6 3 s 2 3 p 6 Para los cationes, se deben retirar un número de electrones igual a la carga del mismo del orbital más externo del átomo, una vez ordenados en función del valor de n ¡¡Cuidado!!: no salen los últimos electrones que han entrado (en el caso de no coincidir con el orbital de mayor energía) Así, por ejemplo, para el catión sulfuro Ni 2+ (Z=28) su configuración electrónica es: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 8

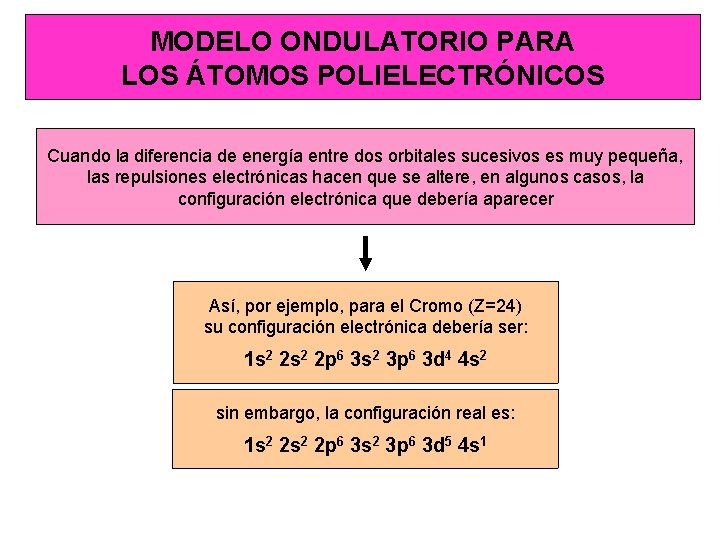
MODELO ONDULATORIO PARA LOS ÁTOMOS POLIELECTRÓNICOS Cuando la diferencia de energía entre dos orbitales sucesivos es muy pequeña, las repulsiones electrónicas hacen que se altere, en algunos casos, la configuración electrónica que debería aparecer Así, por ejemplo, para el Cromo (Z=24) su configuración electrónica debería ser: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 4 4 s 2 sin embargo, la configuración real es: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1

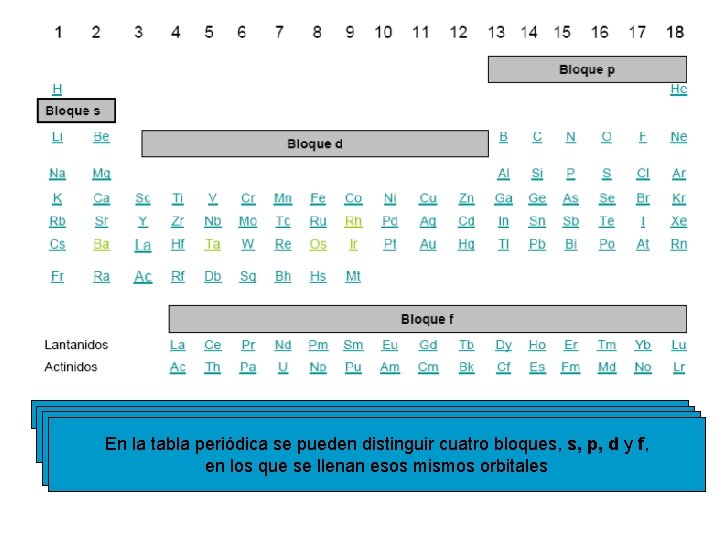
TABLA PERIÓDICA La tabla periódica se elaboró colocando los elementos en orden creciente de su número atómico, Z, y situando en el mismo grupo aquellos que tienen propiedades químicas similares Ahora ya sabemos que los elementos de un mismo grupo tienen propiedades químicas similares porque tienen la misma configuración electrónica en su capa de valencia

Se llaman períodos a las filas y grupos a las columnas Haylos siete períodos, numerados 1 alde 7, n en la capa de En los períodos, elementos tienen el mismodel valor En la tabla segrupos, pueden distinguir cuatro s, p, d y f, yperiódica dieciocho nombrados del 1 bloques, al 18. configuración valencia, y en los grupos los elementos tienen la misma en los más que se llenancon esos mismos orbitalesde n electrónica externa valores crecientes

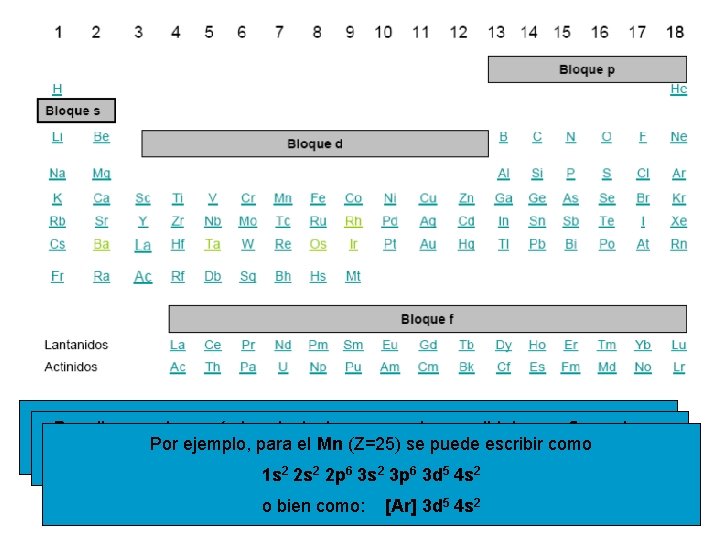
Enello, el grupo completa la llamada de las gasconfiguraciones noble que, Por para 18 losse períodos siguientes, seconfiguración pueden escribir 2, para se ejemplo, para el Mn (Z=25) escribir salvo. Por para el He que tiene 1 s lospuede demás es ns 2 como np electrónicas resumiendo la del gas noble anterior y añadiendo los 6 electrones 6 3 s 2 3 porbitales 6 3 d 5 4 s 2 situados 1 s 2 2 s 2 en 2 pnuevos o bien como: [Ar] 3 d 5 4 s 2

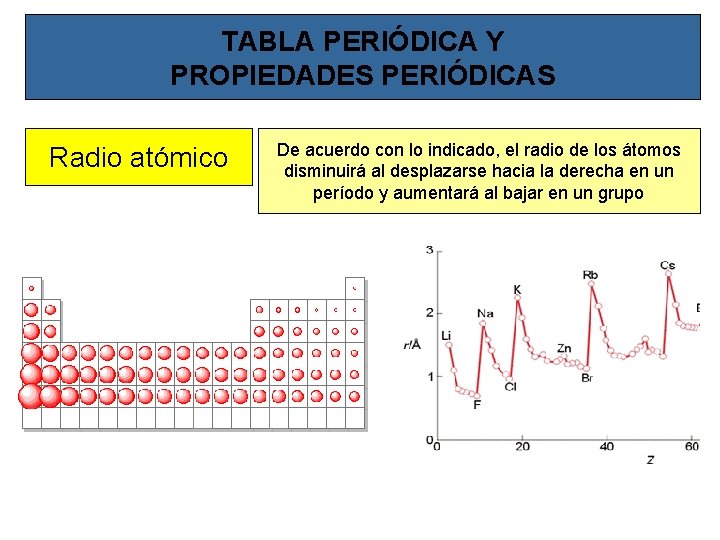
TABLA PERIÓDICA Y PROPIEDADES PERIÓDICAS Existe una variación periódica de determinadas propiedades de los elementos que forman los grupos y los períodos de la tabla periódica como consecuencia de la periodicidad en la configuración electrónica de los elementos En los períodos, al avanzar hacia la derecha, aumenta en una unidad la carga nuclear (a la vez que se añade un electrón a la corteza), por lo que los electrones de la capa de valencia serán cada vez más atraídos por la carga positiva del núcleo En los grupos, al bajar en los mismos, los electrones entran cada vez en capas de mayor valor de n, por lo que irá aumentando su distancia al núcleo y por tanto se sentirán menos atraídos Como consecuencia de ello, existen algunas propiedades de los elementos que varían de manera periódica

TABLA PERIÓDICA Y PROPIEDADES PERIÓDICAS Radio atómico De acuerdo con lo indicado, el radio de los átomos disminuirá al desplazarse hacia la derecha en un período y aumentará al bajar en un grupo

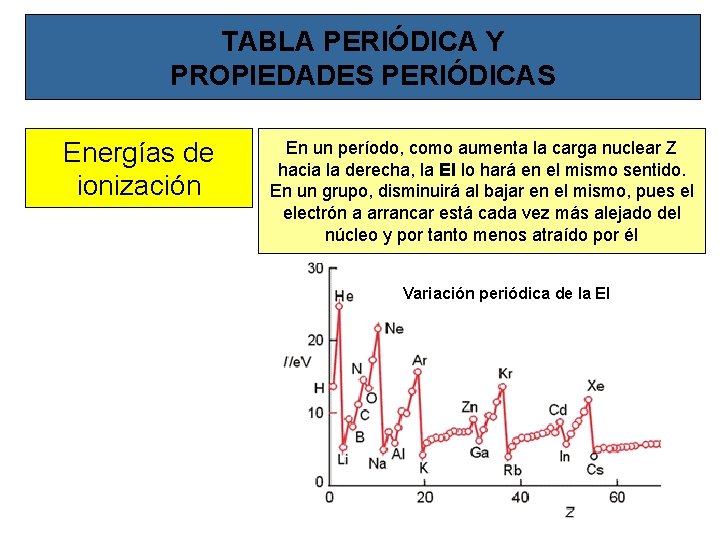
TABLA PERIÓDICA Y PROPIEDADES PERIÓDICAS Energías de ionización La energía de ionización de un elemento es la energía necesaria para arrancar un mol de electrones a un mol de átomos de ese elemento cuando se encuentra en su estado fundamental y gaseoso Se puede arrancar más de un electrón y entonces se llamará segunda energía de ionización, tercera, etc. Al arrancar un electrón se forma un ión positivo, por lo que para arrancarle un segundo electrón habrá que suministrar más energía que para el primero. Es por ello que los valores de EI aumentarán de modo que: 1ª EI < 2ª EI < 3ª EI <. .

TABLA PERIÓDICA Y PROPIEDADES PERIÓDICAS Energías de ionización En un período, como aumenta la carga nuclear Z hacia la derecha, la EI lo hará en el mismo sentido. En un grupo, disminuirá al bajar en el mismo, pues el electrón a arrancar está cada vez más alejado del núcleo y por tanto menos atraído por él Variación periódica de la EI

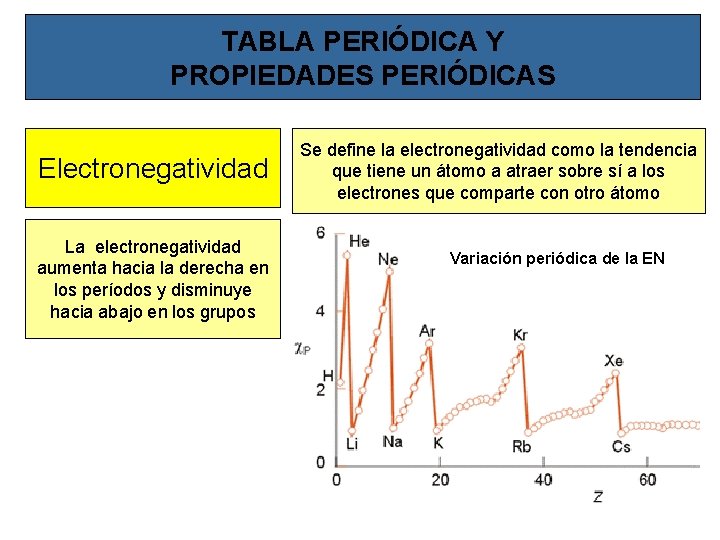
TABLA PERIÓDICA Y PROPIEDADES PERIÓDICAS Electronegatividad La electronegatividad aumenta hacia la derecha en los períodos y disminuye hacia abajo en los grupos Se define la electronegatividad como la tendencia que tiene un átomo a atraer sobre sí a los electrones que comparte con otro átomo Variación periódica de la EN