Podstawy farmakokinetyki klinicznej Metody monitorowania farmakoterapii Dr n



















































- Slides: 63

Podstawy farmakokinetyki klinicznej. Metody monitorowania farmakoterapii. Dr n. med. Melania Mikołajczyk-Solińska Klinika Chorób Wewnętrznych, Diabetologii i Farmakologii Klinicznej Uniwersytet Medyczny w Łodzi

farmakokinetyka PODANA DAWKA LEKU PROCESY LADME STEŻENIE LEKU WE KRWI

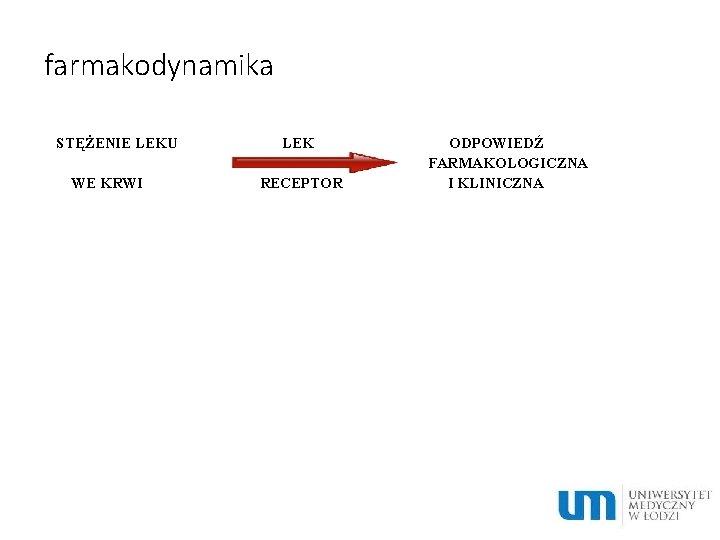
farmakodynamika STĘŻENIE LEKU WE KRWI LEK RECEPTOR ODPOWIEDŹ FARMAKOLOGICZNA I KLINICZNA

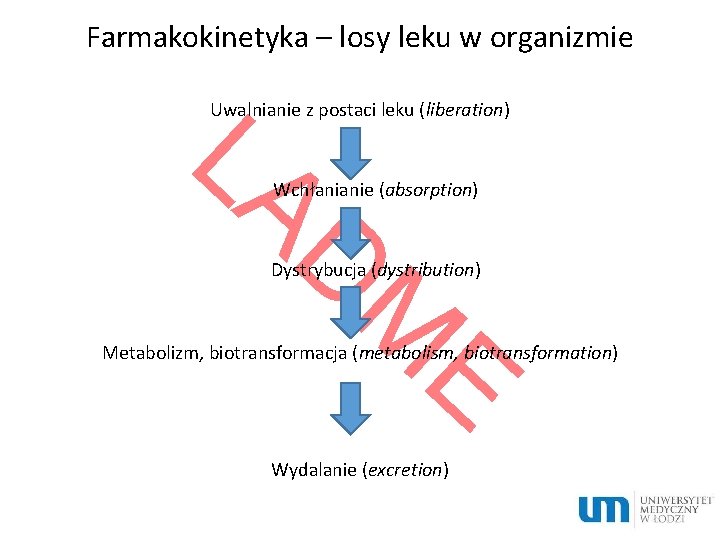
Farmakokinetyka – losy leku w organizmie LA Uwalnianie z postaci leku (liberation) DM E Wchłanianie (absorption) Dystrybucja (dystribution) Metabolizm, biotransformacja (metabolism, biotransformation) Wydalanie (excretion)

Uwalnianie Rozpad postaci, w której lek został wprowadzony (np. tabletki, kapsułki lub drażetki), uwolnienie jego cząsteczek i ich rozpuszczenie w płynach ustrojowych Etapy: 1. Rozpad postaci leku 2. Rozpuszczenie substancji leczniczej 3. Dyfuzja leku do miejsca wchłaniania Przebieg tych procesów zależy głównie od czynników technologicznych

Rozpad postaci leku üim mniejsze elementy tym lepiej rozpuszczalne i lepiej wchłanialne üproces zależy od czynników farmakotechnicznych (technologia produkcji leków) üstopień rozpadalności wpływa na szybkość rozpuszczania üróżnice pomiędzy firmami

Wchłanianie Definicja: Procesy związane z przejściem leku z miejsca podania do krążenia ogólnego Drogi wchłaniania leków: skóra, płuca, błony śluzowe (jama ustna, żołądek, jelita, odbytnica, oskrzela, drogi rodne, drogi moczowe), tkanka podskórna i mięśniowa Drogi podawania leków: a) b) doustna, dożylna, podskórna, domięśniowa, wziewna doodbytnicza (stopień wchłaniania ograniczony, duże różnice międzyosobnicze wchłaniania, c) d) e) f) donosowa (uwaga na działanie ogólne) podjęzykowa (łatwość wchłaniania przy dobrym ukrwieniu, niewielka powierzchnia) na skórę (uwaga na większy stopień wchłaniania u niemowląt i osób starszych) do worka spojówkowego (uwaga na działanie ogólne) częściowe ominięcie efektu pierwszego przejścia)

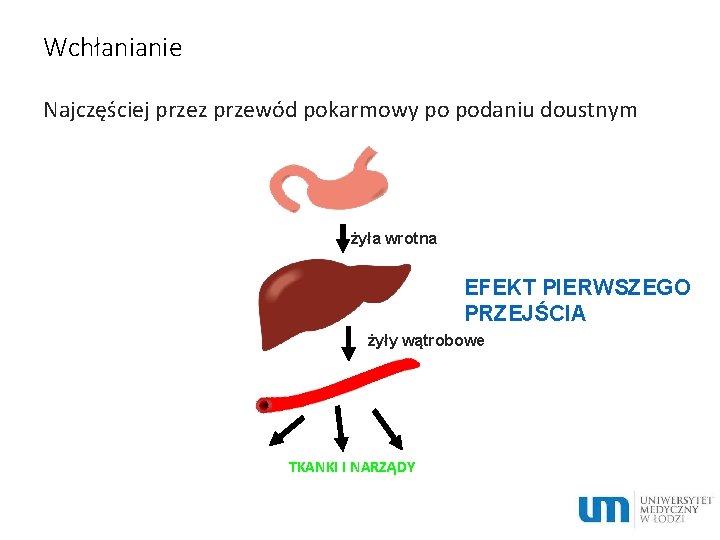
Wchłanianie Najczęściej przez przewód pokarmowy po podaniu doustnym żyła wrotna EFEKT PIERWSZEGO PRZEJŚCIA żyły wątrobowe TKANKI I NARZĄDY

Wchłanianie Czynniki warunkujące wybór drogi podania leku: - właściwości fizykochemiczne leku - oczekiwany początek działania leku - docelowe miejsce działania leku - stan ogólny pacjenta - wiek pacjenta

Wchłanianie Przyczyny ograniczenia i opóźnienia wchłaniania leku: üadsorpcja leku - pektyny ükompleksowanie – tetracykliny i jony wapniowe z mleka üwytrącanie leku – neuroleptyki fanotiazynowe üwiązanie z białkiem pokarmowym – sulfonamidy, glikozydy nasercowe ükonkurencja składników pokarmowych z lekiem – aminokwasy i L-Dopa üzmiana p. H treści pokarmowej Na czczo

Efekt pierwszego przejścia First pass effect - intensywność metabolizowania leku w czasie pierwszego przepływu przez wątrobę Może wykluczyć doustną drogę podawania leku lub sprawić, że dawka podawana doustnie jest dużo większa niż równoważna jej dawka podawana dożylnie Drogi podania: • doustna • do tętnicy wątrobowej lub żyły wrotnej • doodbytnicza (częściowo)

Przykłady leków, które charakteryzują efekt pierwszego przejścia: Ø acebutolol, propranolol, metoprolol, labetalol Ø nifedypina, werapamil, diltiazem, nifedypina Ø nitrogliceryna Ø kwas acetylosalicylowy, paracetamol Ø petydyna, morfina, nalokson Ø lidokaina Øcyklosporyna Øchlorpormazyna Ømetoklopramid Øhydrokortyzon Øalprenolol, amitryptylina, chlormetiazol, doksepina, dwuazotan izosorbidu, fenacetyna, fluorouracyl, hydralazyna, imipramina, izoprenalina, metylfenidat, nortryptylina, pentazocyna, prazosyna, propoksyfen, salicylamid

Transport leków przez błony biologiczne üdyfuzja bierna (najwięcej leków, stała dyfuzji, stała dysocjacji) ütransport przez tworzenie par jonowych ütransport konwekcyjny (przenikanie przez pory) ütransport przenośnikowy (aktywny i ułatwiony) üpinocytoza

Dostępność biologiczna (F) (biodostępność) Ułamek dawki substancji leczniczej, który dostaje się w formie aktywnej farmakologicznie do krążenia ogólnego po podaniu pozanaczyniowym oraz szybkość, z jaką ten proces zachodzi Dla leków niewchłaniających się z miejsca podania lub wychwytywanych przed dotarciem do krążenia ogólnego wartość tego ułamka jest zbliżona do zera

Parametry określające dostępność biologiczną – od czego zależą? Ødroga podania (po podaniu dożylnym = 1 (100%) Øwłaściwości fizykochemiczne preparatu – warunkują szybkość i ilość substancji czynnej uwolnionej z postaci leku (rozpuszczalność, lipofilność, stopień zjonizowania, masa cząsteczkowa, substancje pomocnicze) Østan fizjopatologiczny organizmu (zmiany p. H lub motoryki przewodu pokarmowego, choroby przewodu pokarmowego lub wątroby) Øefekt pierwszego przejścia Øinterakcje pomiędzy lekami lub lekiem i treścią pokarmową w miejscu wchłaniania

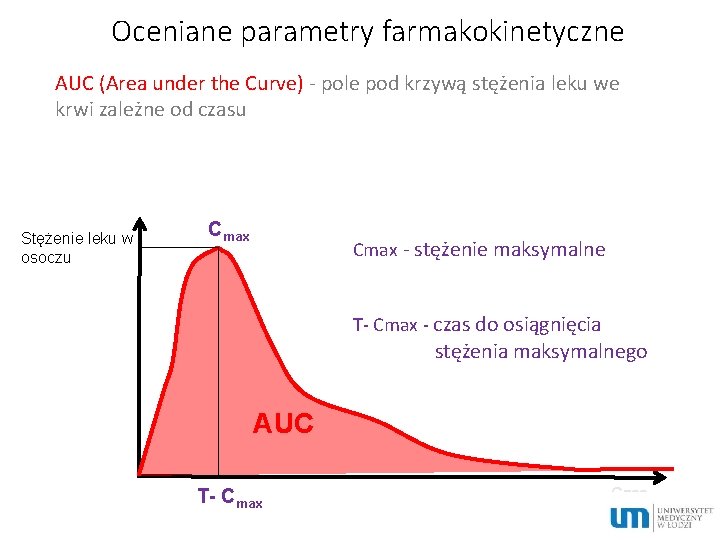
Parametry określające dostępność biologiczną ØWielkość powierzchni pod krzywą zmiany stężenia leku we krwi (AUC – area under the curve) ØMaksymalne stężenie leku we krwi (C maks) ØCzas, po którym zostaje osiągnięte stężenie maksymalne (t maks)

Oceniane parametry farmakokinetyczne AUC (Area under the Curve) - pole pod krzywą stężenia leku we krwi zależne od czasu Stężenie leku w osoczu Cmax - stężenie maksymalne T- Cmax - czas do osiągnięcia stężenia maksymalnego AUC T- Cmax Czas ~

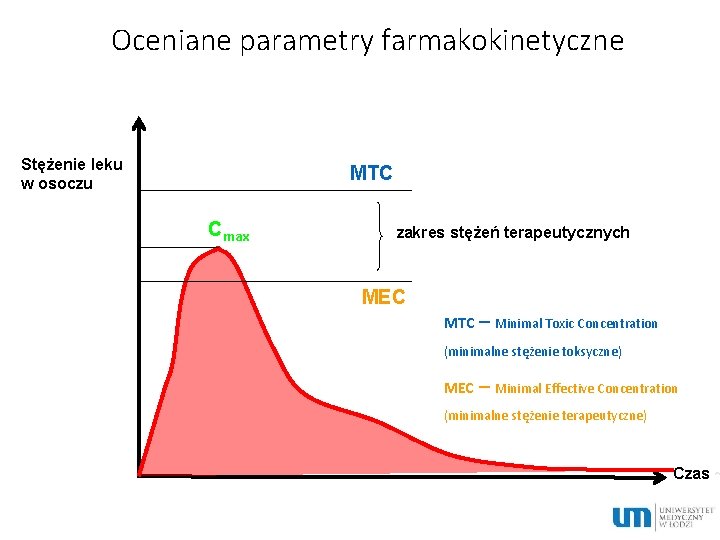
Oceniane parametry farmakokinetyczne Stężenie leku w osoczu MTC Cmax zakres stężeń terapeutycznych MEC MTC – Minimal Toxic Concentration (minimalne stężenie toksyczne) MEC – Minimal Effective Concentration (minimalne stężenie terapeutyczne) Czas ~

Dostępność biologiczna Bezwzględna porównanie badanego leku podanego pozanaczyniowo z tym samym lekiem podanym donaczyniowo EBA = Względna D iv. x AUC po. D po. x AUC iv. porównanie preparatu badanego z preparatem standardowym o znanej dostępności biologicznej EBA = EBA - Extend of Bioavailability Ds x AUCb Db x AUCs s – preparat standardowy b – preparat badany

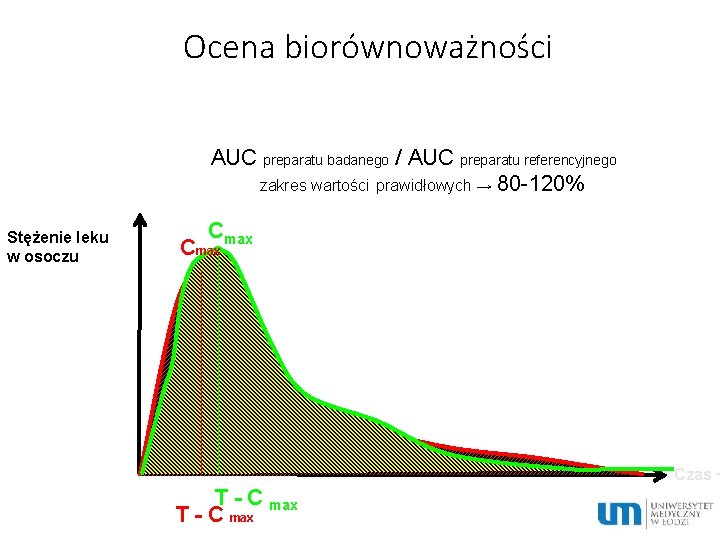
Ocena biorównoważności AUC preparatu badanego / AUC preparatu referencyjnego zakres wartości prawidłowych → 80 -120% Stężenie leku w osoczu Cmax Czas ~ T - C max

Dystrybucja Proces rozmieszczania leku w płynach i tkankach organizmu Czynniki warunkujące dystrybucję: üszybkość przepływu krwi przez poszczególne tkanki i narządy (pojęcie kompartmentu) üszybkość transportu przez błony biologiczne üróżnice p. H między osoczem a tkanką üczynniki związane z lekiem (wielkość cząsteczek, stopień wiązania z białkami osocza i tkanek, rozpuszczalność i właściwości fizykochemiczne)

Kompartment Definicja kompartmentu: jest to kinetycznie jednolity obszar zespołu tkanek lub narządów, w których lek lub jego metabolit jest rozmieszczony w sposób jednorodny i w których procesy farmakokinetyczne są funkcją stężenia leku lub jego metabolitów Modele kompartmentowe: są to układy (obszary ) organizmu oddzielone od siebie błonami, przez które leki i jego metabolity przechodzą z określoną szybkością

Modele farmakokinetyczne Model jednokompartmentowy najprostszy lek niezwłocznie po podaniu zostaje równomiernie rozmieszczony w dostępnej przestrzeni dystrybucji Model dwukompartmentowy rozmieszczanie leku do przestrzeni dystrybucyjnych zachodzi z różną prędkością Model wielokompartmentowy

Kompartment centralny osocze oraz tkanki i narządy dobrze ukrwione (wątroba, płuca, nerki, mózg, serce, gruczoły wydzielania wewnętrznego) Kompartment obwodowy (tkankowy) tkanki i narządy gorzej lub słabo ukrwione (tkanka tłuszczowa, skóra, mięśnie, tkanka kostna)

Objętość dystrybucji (Vd) Hipotetyczna objętość płynów ustrojowych, w której lek w stanie stacjonarnym miałby podobne stężenie jak we krwi Objętość organizmu do której dociera lek Vd bezwzględna - wyrażana w litrach Vd względna – wyrażana w litrach/kilogram

Objętość dystrybucji (Vd) A Vd = C A – ilość leku w organizmie (mg) C – stężenie leku we krwi (mg/l)

Objętość dystrybucji (Vd) znaczenie praktyczne Vd = 5 l - dystrybucja ograniczona jest do krwi Vd = 10 -20 l - przenikanie leku do płynu pozakomórkowego (ECF) Vd = 25 -35 l - przenikanie leku do płynu wewnątrzkomórkowego (ICF) Vd = 40 l - rozmieszczanie we wszystkich płynach organizmu Vd > 100 l - lek silnie kumuluje się w tkankach

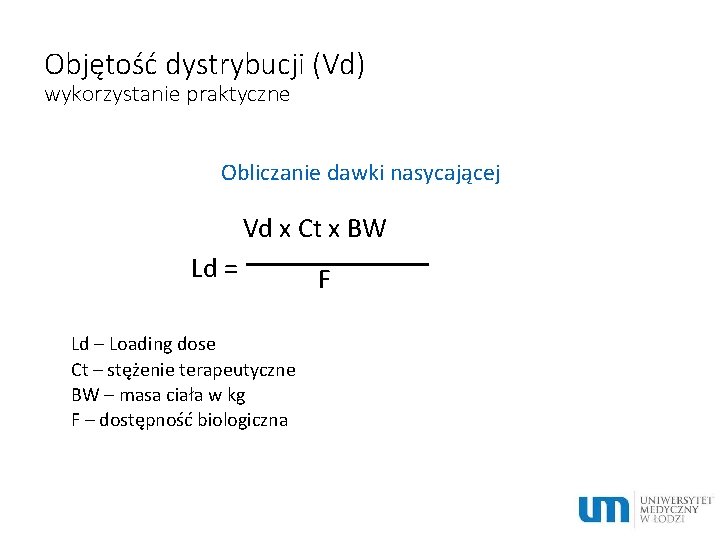
Objętość dystrybucji (Vd) wykorzystanie praktyczne Obliczanie dawki nasycającej Vd x Ct x BW Ld = Ld – Loading dose Ct – stężenie terapeutyczne BW – masa ciała w kg F – dostępność biologiczna F

Wiązanie leku z białkami üOdwracalny proces powstawania kompleksu lekbiałko üZnaczenie kliniczne ma wówczas, gdy stopień wiązania leku z białkami jest większy niż 80%

Wiązanie leku z białkami Lek związany z białkami: üjest nieaktywny farmakologicznie ünie może przechodzić przez błony biologiczne ünie ulega metabolizmowi ünie może się wydalać Zmniejszenie stopnia wiązania leku skutkuje: ü wzrostem siły działania leku ü skróceniem czasu działania leku

Wiązanie leku z białkami Czynniki warunkujące stopień wiązania z białkami: Østężenie leku (wysycenie miejsc wiążących już w zakresie stężeń terapeutycznych dla salicylanów, fenylbutazonu, kwasu walproinowego, prednizolonu) Øpowinowactwo leku do miejsc wiążących Østężenie białek (wydolność nerek, wątroby, wiek, stan odżywienia itp. . . ) Øobecność substancji egzogennych (leki, trucizny środowiskowe) endogennych (kwasy tłuszczowe, bilirubina, mocznik, hormony) Øp. H osocza (spadek wiązania np. barbituranów z białkami w kwasicy) i

Wiązanie leku z białkami Przykłady leków o dużym stopniu wiązania z białkami: üPochodne kumaryny üFenylobutazon üSalicylany üSulfonamidy üPenicyliny

Metabolizm (M) üSzereg procesów biochemicznych, których głównym celem jest unieczynnienie leku oraz ułatwienie jego eliminacji z organizmu üProcesy te zachodzą głównie z udziałem różnych układów enzymatycznych zawartych w wątrobie, przewodzie pokarmowym, płucach, nerkach, w obrębie skóry i innych tkankach

Metabolizm Procesy I fazy: - Utlenianie (przy udziale cytochromu P-450) - Redukcja - Hydroliza Procesy II fazy: - Sprzęganie z kwasem glukuronowym, siarkowym i - Acetylacja - Alkilacja glicyną

Metabolizm Procesy I fazy prowadzą do: - inaktywacji leku macierzystego - aktywacji proleku do czynnej farmakologicznie postaci (enalapril) - powstania metabolitu aktywnego farmakologicznie (imipramina) - powstania metabolitu toksycznego (paracetamol) Procesy II fazy prowadzą zwykle do powstania związków nieczynnych farmakologicznie

Czynniki wpływające na metabolizm Wiek pacjenta: - Noworodki – niedojrzały układ mikrosomalny - Małe dzieci – przyspieszony metabolizm - Chorzy w wieku podeszłym – zmniejszenie aktywności enzymów mikrosomalnych Płeć (mężczyźni metabolizują szybciej) Stany chorobowe (niewydolność krążenia, marskość wątroby) Interakcje lekowe Czynniki genetyczne

Izoenzymy cytochromu P-450 Najważniejsze: CYP 1 A 2 CYP 2 C 9 CYP 2 C 19 CYP 2 D 6 CYP 2 E 1 CYP 3 A 4 Czynniki warunkujące aktywność izoenzymów: - polimorfizm genetyczny - indukcja i inhibicja

Wpływ leków na izoenzymy cytochromu P-450 Znaczenie kliniczne indukcji i inhibicji zmiana siły działania stosowanego induktora / inhibitora i innych stosowanych jednocześnie leków Indukcja: → osłabienie siły działania i skrócenie czasu działania w przypadku metabolitów nieaktywnych lub mniej aktywnych → wzrost siły działania w przypadku metabolitów bardziej aktywnych → możliwość działania toksycznego innych stosowanych jednocześnie leków w przypadku odstawienia induktora po uprzedniej korekcji ich dawki

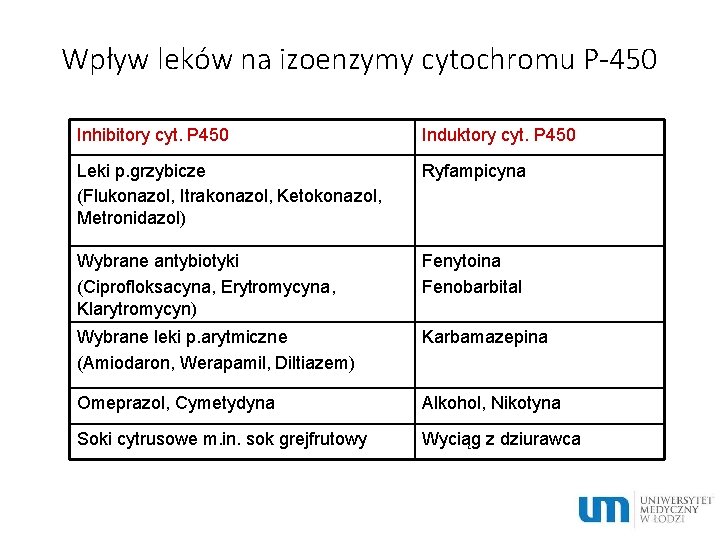
Wpływ leków na izoenzymy cytochromu P-450 Inhibitory cyt. P 450 Induktory cyt. P 450 Leki p. grzybicze (Flukonazol, Itrakonazol, Ketokonazol, Metronidazol) Ryfampicyna Wybrane antybiotyki (Ciprofloksacyna, Erytromycyna, Klarytromycyn) Fenytoina Fenobarbital Wybrane leki p. arytmiczne (Amiodaron, Werapamil, Diltiazem) Karbamazepina Omeprazol, Cymetydyna Alkohol, Nikotyna Soki cytrusowe m. in. sok grejfrutowy Wyciąg z dziurawca

Wydalanie (E) Procesy związane z usuwaniem leku z organizmu przez: ünerki (większość leków) üz żółcią (makrolidy, glikozydy) üze śliną (fenytoina) üz powietrzem wydychanym (alkohol, środki znieczulenia ogólnego) üz potem (witamina B 1)

Wydalanie przez nerki obejmuje: ü przesączanie kłębuszkowe (brak wpływu rozpuszczalności leków) ü wydzielanie kanalikowe (proces czynny) ü wchłanianie zwrotne (silne wchłanianie leków lipofilnych)

Wydalanie przez nerki Poprzez zmianę p. H moczu można wpłynąć na proces wydalania leków przez nerki Alkalizacja moczu w celu przyspieszenia wydalania leków o charakterze słabych kwasów (ASA, barbiturany, sulfonamidy) Zakwaszanie moczu w celu przyspieszenia wydalania leków o charakterze słabych zasad (kodeina, morfina, chinina)

Klirens leku üObjętość osocza całkowicie oczyszczonego z leku w jednostce czasu przez narząd eliminujący ten lek z organizmu üPozwala dostosować dawkę leku do określonej sytuacji klinicznej Cl = K x Vd Cl – klirens leku K – stała eliminacji objętość dystrybucji Vd –

Stała eliminacji üOkreśla szybkość usuwania określonej porcji leku z kompartmentu centralnego jako konsekwencji metabolizmu i wydalania üPozwala ustalić wielkość dawki podtrzymującej K= K – stała eliminacji Cl – klirens leku Vd – objętość dystrybucji Cl Vd

Stężenie stacjonarne üStan równowagi pomiędzy ilością leku wprowadzanego do organizmu i przez niego wydalanego üUwarunkowane głównie przez podawanie kolejnych dawek leku oraz klirens leku üSpadek klirensu może stwarzać ryzyko przedawkowania!!! Jest ono osiągane po 4 -5 okresach t½ od podania pierwszej dawki

Biologiczny okres półtrwania (t½) Czas, po upływie którego stężenie leku we krwi zmniejsza się o połowę Pozwala określić odstępy dawkowania leków t½ = 0, 693 K t½ = 0, 693 x Vd Cl

Biologiczny okres półtrwania Czynniki warunkujące biologiczny okres półtrwania: Øczynniki genetyczne Øpłeć Øwiek Øwydolności układu krążenia, wątroby i nerek Østan enzymów mikrosomalnych wątroby

Farmakokinetyka Liniowa - szybkość poszczególnych procesów farmakokinetycznych jest proporcjonalna do stężenia leku, a wykres tej zależności ma charakter liniowy Nieliniowa - szybkość procesów farmakokinetycznych zmienia się wraz ze zmianą stężenia leku w sposób nieliniowy Modele farmakokinetyczno-farmakodynamiczne – nowoczesna metoda rozpatrująca dane dotyczące zarówno farmakokinetyki jak i farmakodynamiki. Umożliwia ilościową analizę związku między dawką, stężeniem a efektem działania leku.

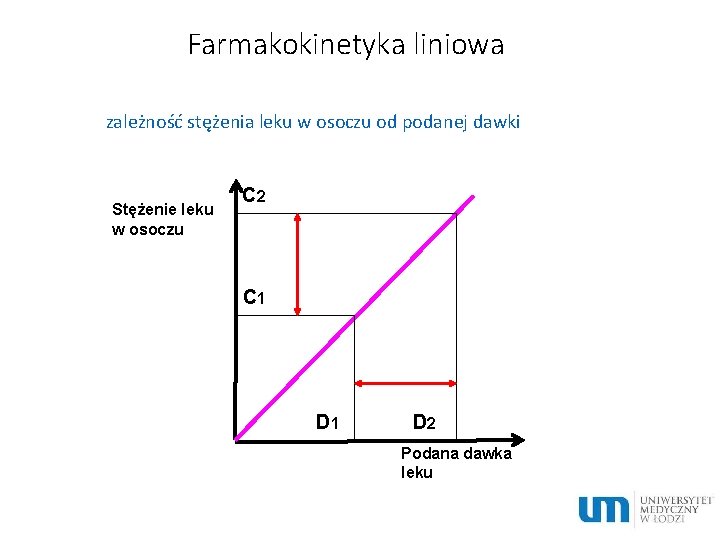
Farmakokinetyka liniowa zależność stężenia leku w osoczu od podanej dawki Stężenie leku w osoczu C 2 C 1 D 2 Podana dawka leku

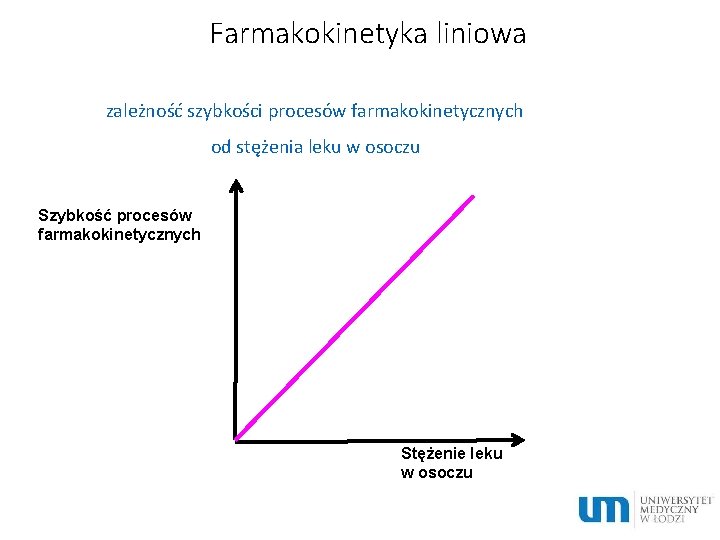
Farmakokinetyka liniowa zależność szybkości procesów farmakokinetycznych od stężenia leku w osoczu Szybkość procesów farmakokinetycznych Stężenie leku w osoczu

Charakterystyka procesów przebiegających według kinetyki liniowej • t½, Vd, Cl jest stały, niezależny od dawki • AUC jest proporcjonalne do dawki • stężenie w stanie stacjonarnym jest proporcjonalne do dawki

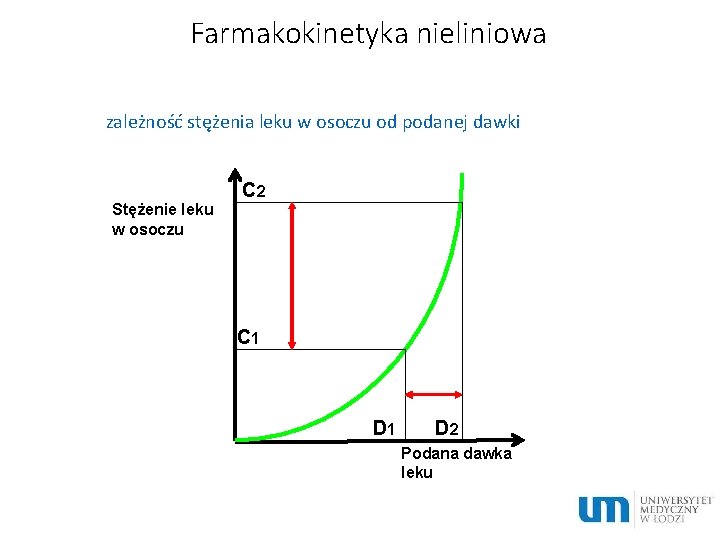
Farmakokinetyka nieliniowa zależność stężenia leku w osoczu od podanej dawki C 2 Stężenie leku w osoczu C 1 D 2 Podana dawka leku

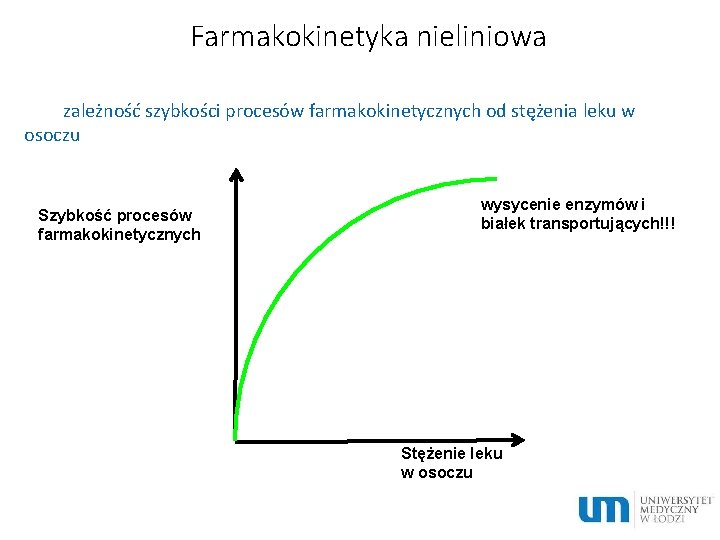
Farmakokinetyka nieliniowa zależność szybkości procesów farmakokinetycznych od stężenia leku w osoczu Szybkość procesów farmakokinetycznych wysycenie enzymów i białek transportujących!!! Stężenie leku w osoczu

Charakterystyka procesów przebiegających według kinetyki nieliniowej Ø szybkość procesów eliminacji nie jest proporcjonalna do stężenia leku Ø t½ ulega wydłużeniu wraz ze wzrostem dawki Ø AUC i stężenie w stanie stacjonarnym nie jest proporcjonalne do ilości leku

Zagrożenia wynikające z kinetyki nieliniowej ! niewielkie zmiany dawkowania mogą prowadzić do ujawnienia działania toksycznego ! eliminacja i osiągnięcie stanu stacjonarnego mogą wydłużać się w sposób nieoczekiwany

Leki podlegające prawom kinetyki nieliniowej Ø salicylany Ø fenytoina Ø prednizolon Ø dikumarol Ø teofilina Ø winkrystyna Ø TLPD (po przedawkowaniu)

Metody monitorowania farmakoterapii

Terapia monitorowana • wielokrotne pomiary skutków farmakologicznych wdrożonego leczenia • cel: optymalizacja skuteczności i bezpieczeństwa leczenia

Metody monitorowania farmakoterapii • Wywiad • Ocena objawów klinicznych • Badania dodatkowe - laboratoryjne (np. glikemia, INR, APTT, morfologia krwi, ALAT, ASPAT, CK, kreatynina) - obrazowe • Terapeutyczne monitorowanie leków (TDM-terapeutic drug monitoring)

Terapeutyczne monitorowanie leków (TDM) umożliwia: • • wykrycie niedodawkowania (tzw. „terapia pozorna”) wykrycie przedawkowania, często zanim wystąpią objawy kliniczne w zatruciach wykrycie niesubordynacji chorego tj niezgodnego z zaleceniami lekarza zażywania leku (zjawisko non-compliance) ocena parametrów kinetyki leków w różnych stanach patologicznych (niewydolność wątroby lub nerek), dostosowanie dawki do określonej sytuacji klinicznej bezpieczeństwo stosowania potencjalnie toksycznych dawek leków w profilaktyce i leczeniu uzależnień

Co charakteryzuje leki dla których stosuje się TDM? • korelacja między stężeniem leku we krwi i w obrębie receptora farmakologicznego • wąski wskaźnik terapeutycznym (niewielka rozpiętość między stężeniem terapeutycznym i toksycznym) • silne działanie biologiczne, ale efekt kliniczny tego działania jest trudny do jednolitej interpretacji • niebezpieczne działania toksyczne • skłonność do interakcji z innymi lekami • znaczne różnice osobnicze w zakresie farmakokinetyki • istotne zmiany podstawowych parametrów kinetycznych w chorobach układu krążenia, nerek i wątroby • farmakokinetyką nieliniowa (niewielkie zwiększenie dawki leku powoduje nieproporcjonalny wzrost jego stężenia we krwi)

Przykłady leków: • • • glikozydy naparstnicy (digoksyna) aminoglikozydy (amikacyna, gentamycyna) wankomycyna leki przeciwpadaczkowe(fenytoina, karbamazepina, kwas walproinowy) metyloksantyny (teofilina) leki przeciwdepresyjne (sole litu) leki antyarytmiczne (chinidyna, lidokaina, propafenon) leki przeciwbólowe i NLPZ (paracetamol, ASA) leki immunosupresyjne (cyklosporyna) leki przeciwnowotworowe (metotreksat)

Terapeutyczne monitorowanie leków - zasady Nie rutynowo!!! • ocena w stanie stacjonarnym • niezbędne uwzględnienie: - interakcji pomiędzy lekami - stanu zdrowia chorego - wyników innych badań • oznaczanie stężenia przed następna dawką (rano) wyjątek: - zatrucia - ciężki stan chorego • znane są stężenia terapeutyczne i toksyczne dla danej metody oznaczenia stężenia leku w warunkach określonego laboratorium
 Sprinttimer
Sprinttimer System monitorowania usług publicznych
System monitorowania usług publicznych System monitorowania usług publicznych
System monitorowania usług publicznych Podstawy statyki budowli
Podstawy statyki budowli L
L Implementacja bazy danych
Implementacja bazy danych Monitorowanie podstawy programowej wzór
Monitorowanie podstawy programowej wzór Kolumna konwekcyjna ognia
Kolumna konwekcyjna ognia Bpmn xor
Bpmn xor Monitorowanie realizacji podstawy programowej
Monitorowanie realizacji podstawy programowej Podstawy savoir vivre
Podstawy savoir vivre Podstawy akustyki
Podstawy akustyki Program do tworzenia stron html
Program do tworzenia stron html Podstawy hydrauliki
Podstawy hydrauliki Edukacja formalna i nieformalna
Edukacja formalna i nieformalna Php podstawy
Php podstawy Maria dems
Maria dems Html podstawy
Html podstawy Warunki realizacji podstawy programowej
Warunki realizacji podstawy programowej Vhdl podstawy
Vhdl podstawy Html podstawy
Html podstawy Podstawy sztucznej inteligencji
Podstawy sztucznej inteligencji Spis liter cyfr i innych znaków danego kroju pisma
Spis liter cyfr i innych znaków danego kroju pisma Podstawy fizykochemii spalania
Podstawy fizykochemii spalania Teoretyczne podstawy informatyki
Teoretyczne podstawy informatyki Płomień kinetyczny
Płomień kinetyczny Fizyka kwantowa podstawy
Fizyka kwantowa podstawy Teoretyczne podstawy informatyki
Teoretyczne podstawy informatyki Wzór na pp graniastosłupa
Wzór na pp graniastosłupa Podstawy kryptografii
Podstawy kryptografii Nowa podstawa programowa religia
Nowa podstawa programowa religia Warunki i sposoby realizacji podstawy programowej
Warunki i sposoby realizacji podstawy programowej Oznaczenia na skalach mierników
Oznaczenia na skalach mierników Język sql - podstawy zapytań
Język sql - podstawy zapytań Metody historyczne
Metody historyczne Fazy procesu obserwacji
Fazy procesu obserwacji Metody, techniki i narzędzia badawcze
Metody, techniki i narzędzia badawcze Marzenna czarnocka
Marzenna czarnocka Otrzymywanie soli zadania
Otrzymywanie soli zadania Metody doboru pracowników
Metody doboru pracowników Metody podziału kosztów na stałe i zmienne
Metody podziału kosztów na stałe i zmienne Pedagogická diagnostika žiaka vzor
Pedagogická diagnostika žiaka vzor Formy prezentacji danych statystycznych
Formy prezentacji danych statystycznych Metody utrwalania żywności
Metody utrwalania żywności Metody optyczne
Metody optyczne Siedmiopunktowy plan rodgera
Siedmiopunktowy plan rodgera Metody weryfikacji części
Metody weryfikacji części Metody výuky
Metody výuky Metoda rybi szkielet
Metoda rybi szkielet Metody badawcze w prawoznawstwie
Metody badawcze w prawoznawstwie Zadanie
Zadanie Burza mózgów wg gordona przykłady
Burza mózgów wg gordona przykłady Metodologia drp
Metodologia drp Metody aktywizujące podział
Metody aktywizujące podział Prawo lamberta beera
Prawo lamberta beera Metody szacowania ryzyka
Metody szacowania ryzyka Metody pomiaru bezrobocia
Metody pomiaru bezrobocia Techniki nauczania
Techniki nauczania Pirometr fotoelektryczny
Pirometr fotoelektryczny Planowanie potrzeb materiałowych
Planowanie potrzeb materiałowych Metody numeryczne
Metody numeryczne Dyscyplina w klasie
Dyscyplina w klasie Metody rozdzielcze
Metody rozdzielcze Turbidancja
Turbidancja