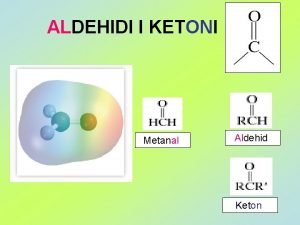
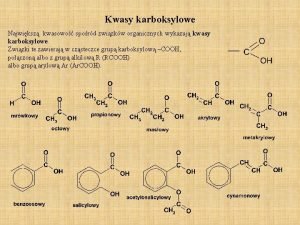
Senyawasenyawa Alkohol PERTEMUAN 8 Harizal S Pd M


















































































- Slides: 108

Senyawa-senyawa Alkohol PERTEMUAN 8 Harizal, S. Pd. , M. Sc Program Studi Farmasi Universitas Esa Unggul 1

KEMAMPUAN AKHIR YANG DIHARAPKAN • Mahasiswa mampu menjelaskan tatanama, sifat fisik, sifat kimia, sintesis, dan reaksi yang melibatkan senyawa alkohol 2

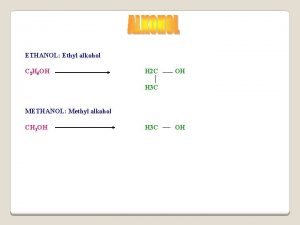
Struktur air dan metanol • Oksigen memiliki hibridisasi sp 3 dan memiliki struktur tetrahedral. • Sudut ikatan H—O—H pada air adalah 104. 5°. • Sudut ikatan C—O—H pada metil alkohol adalah 108. 9°. 3

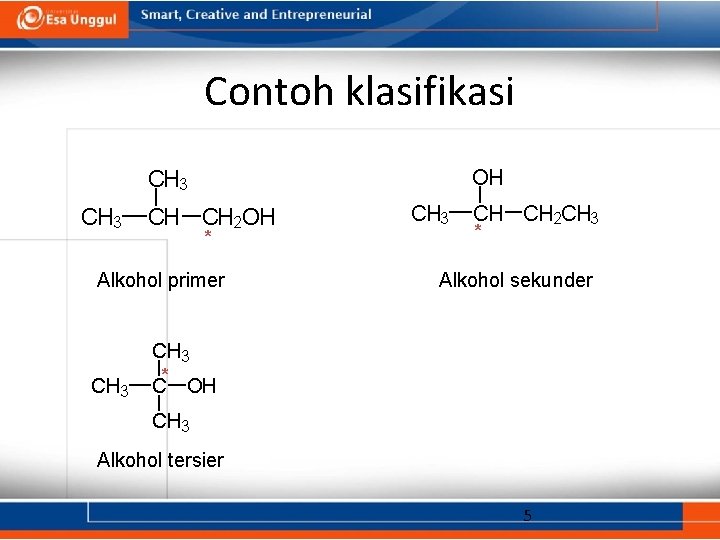
Klasifikasi alkohol • Primer: gugus —OH terikat pada karbon yang berikatan dengan satu karbon yang lain. • Sekunder: gugus —OH terikat pada karbon yang berikatan dengan dua karbon yang lain. • Tersier: gugus —OH terikat pada karbon yang berikatan dengan tiga karbon yang lain. • Aromatik (fenol): gugus —OH terikat pada cincin benzena. 4

Contoh klasifikasi OH CH 3 CH CH 2 OH * Alkohol primer CH 3 CH CH 2 CH 3 * Alkohol sekunder CH 3 * C OH CH 3 Alkohol tersier 5

Penamaan IUPAC • Tentukan rantai karbon terpanjang yang mengandung karbon yang terikat langsung dengan gugus —OH. • Ganti akhiran -a pada nama alkana nya menjadi –ol pada alkohol. • Nomori rantai sedemikian sehingga gugus —OH memiliki nomor terkecil. • Nomori dan namai semua rantai samping dan tulis secara alfabetis. 6

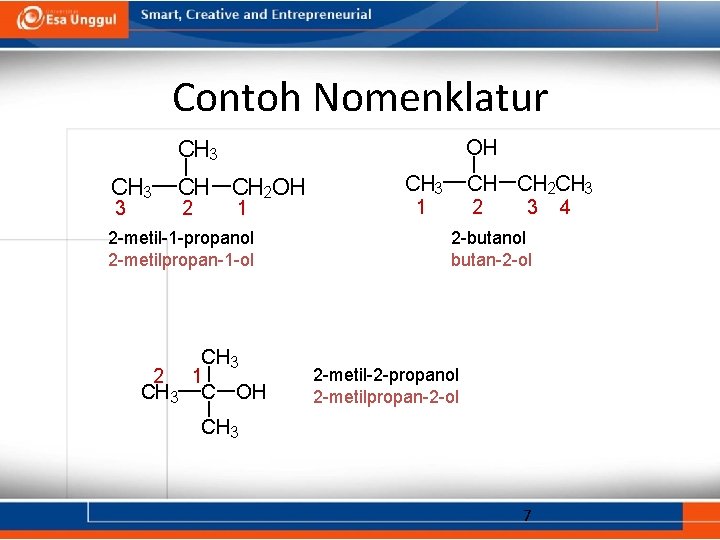
Contoh Nomenklatur OH CH 3 CH CH 2 OH 3 2 1 2 -metil-1 -propanol 2 -metilpropan-1 -ol 2 CH 3 1 C OH CH 3 CH CH 2 CH 3 1 2 3 2 -butanol butan-2 -ol 2 -metil-2 -propanol 2 -metilpropan-2 -ol CH 3 7 4

Alkenol (Enol) • Gugus hidroksil memiliki urutan prioritas yang lebih tinggi dibandingkan dengan gugu alkena. Tandai karbon yang memiliki gugus —OH dengan nomor terendah. • Akhiri nama senyawa dengan akhiran –ol, namun beri sisipan –en sebelum akhiran -ol OH CH 2 5 CHCH 2 CHCH 3 4 3 2 1 4 -penten-2 -ol pent-4 -en-2 -ol 8

Prioritas penamaan Urutan teratas Urutas terbawah 1. Asam 2. Ester 3. Aldehida 4. Keton 5. Alkohol 6. Amina 7. Alkena 8. Alkuna 9. Alkana 10. Eter 11. Halida 9

Substituen hidroksi • Ketika —OH merupakan gugus dengan prioritas yang lebih kecil dibandingkan dengan gugus asam karboksilat, maka dinamakan sebagai hidroksi. Asam karboksilat OH CH 2 CH 2 COOH 4 3 2 1 Asam 4 -hydroksibutanoat Juga dikenal sebagai asam g-hidroksibutirat (GHB) 10

Nama umum • Alkohol dapat dinamai sebagai alkil alkohol. • Sistem penaman ini hanya dapat digunakan untuk alkohol rantai pendek OH CH 3 CH CH 2 OH isobutil alkohol CH 3 CH CH 2 CH 3 sec-butil alkohol 11

Penamaan Diol • Dibutuhkan dua nomor sebagai lokasi dari gugus —OH. • Gunakan akhiran -diol untuk menunjukkan ada dua akhiran -ol. 1 2 3 4 5 6 heksana-1, 6 - diol 12

Glikol • 1, 2 -diol (vicinal diol) disebut juga sebagai glikol. • Nama umum untuk glikol menggunakan nama alkena asal dari glikol tersebut. etana-1, 2 - diol etilen glikol propana-1, 2 - diol Propilen glikol 13

Penamaan fenol • Gugus —OH dianggap berada posisi 1. • Untuk nama umum pada fenol dengan dua subtituen, gunakan awalan orto untuk 1, 2; metauntuk 1, 3; dan para- untuk 1, 4. • Metil fenol disebut kresol. 3 -chlorofenol (meta-klorofenol) 4 -metilfenol (para-kresol) 14

Contoh soal 1 Tentukan nama sistematik (IUPAC) dari senyawa alkohol berikut Penyelesaian Rantai karbon terpanjang mengandung enam atom karbon, namun tidak ikatan karbon-OH. Rantai karbon terpanjang yang berikatan langsung dengan gugus —OH dapat dilihat pada gambar. Rantai karbon ini mengandung lima atom karbon. Rantai ini dinomori dari kanan ke kiri sehingga diperoleh karbon dengan gugus hidroksil yang memiliki nomor terkecil. Nama yang benar untuk senyawa ini adalah 3 -(iodometil)-2 -isopropilpentan-1 -ol. 15

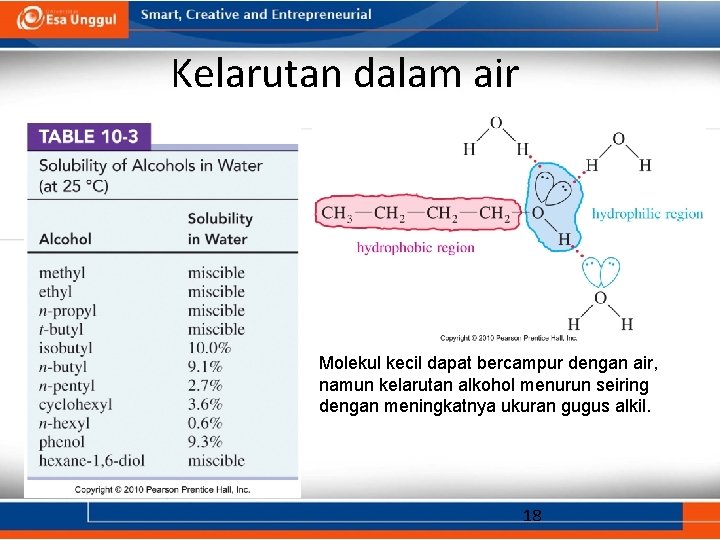
Sifat Fisik • Alkohol memiliki titik didih yang tinggi karena dapat membentuk ikatan hidrogen antara sesama molekulnya. • Alkohol rantai pendek biasanya dapat bercampur dengan air, namun kelarutan nya menurun seiring dengan semakin besarnya gugus alkil. 16

Titik didih alkohol • Alkohol memiliki titik didih yang lebih tinggi dibandingkan eter dan alkana karena alkohol dapat membentuk ikatan hidrogen. • Semakin kuat interaksi antara molekul alkohol, semakin banyak energi yang dibutuhkan untuk memutus ikatan antar sesama molekul tersebut. 17

Kelarutan dalam air Molekul kecil dapat bercampur dengan air, namun kelarutan alkohol menurun seiring dengan meningkatnya ukuran gugus alkil. 18

Beberapa senyawa alkohol yang cukup dikenal: Metanol • Disebut juga sebagai “alkohol kayu” • Produksi skala industri dilakukan menggunakan gas sintetik sebagai bahan dasar. • Merupakan jenis pelarut yang biasa digunakan dalam industri • Dosis racun: 100 m. L metanol (kandungan miras oplosan biasanya sebagian besar terdiri atas metanol sehingga memiliki tingkat racun yang tinggi) • Penggunaan metanol sebagai bahan bakar: – – Memiliki nilai oktan yang tinggi (baik untuk mesin) Memiliki emisi yang rendah (ramah lingkungan) Kandungan energi rendah Nyala api tidak berwarna 19

Beberapa senyawa alkohol yang cukup dikenal: Etanol • Etanol merupakan senyawa alkohol yang memiliki banyak kegunaan terutama di bidang kesehatan dan energi. • Tidak memiliki warna dan cukup mudah menguap (titik didih 78 o. C) • Etanol dapat diperoleh dari hasil fermentasi gula dan pati. – Hasil fermentasi bahan mengandung 12– 15% etanol. – Hasil fermentasi didistilasi hingga diperoleh sejenis cairan etanol dengan kadar yang cukup tinggi (70%) – Distilasi ulang dilakukan untuk mendapatkan etanol 95% (membentuk campuran azeotrop yang sulit dipisahkan) – Pengeringan etanol menggunakan zat pengering seperti norit dan zeolit menghasilkan etanol 99%. • Dosis toksik: 200 m. L 20

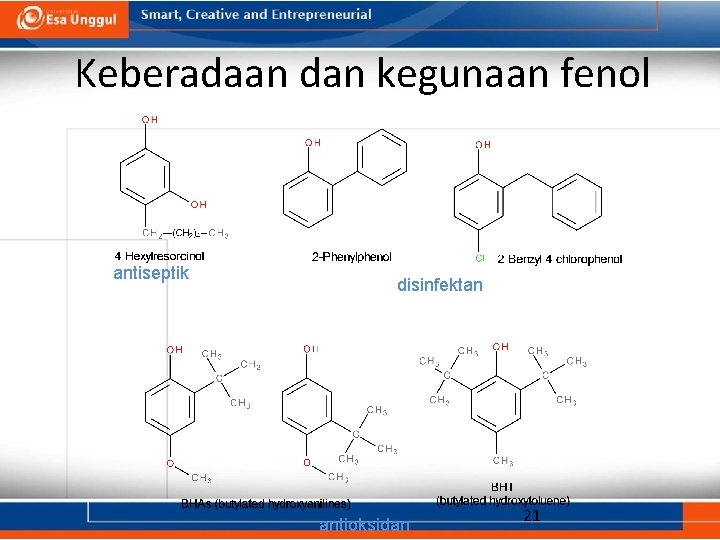
Keberadaan dan kegunaan fenol antiseptik disinfektan antioksidan 21

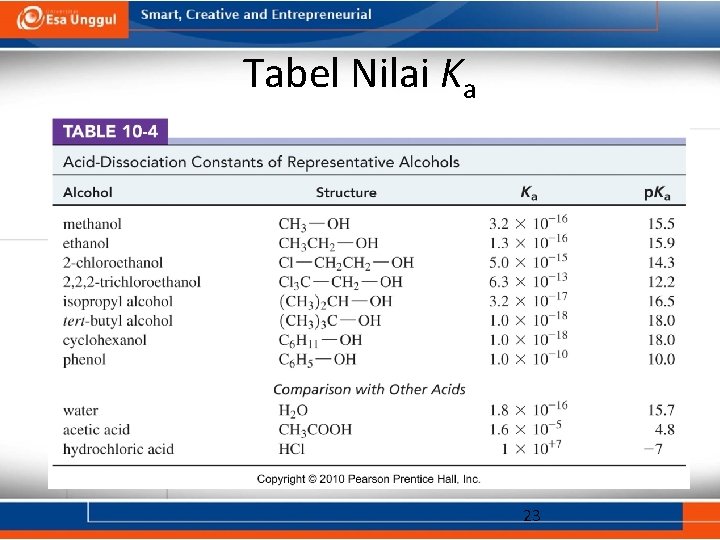
Keasaman Alkohol • Kisaran p. Ka : 15. 5– 18. 0 (air: 15. 7) • Keasaman menurun seiring dengan meningkatnya jumlah karbon. • Halogen dan gugus penarik elektron lain dapat meningkatkan keasaman. • Fenol 100 kali lebih asam dibandingkan dengan sikloheksanol. 22

Tabel Nilai Ka 23

Pembentukan ion alkoksida • Etanol bereaksi dengan logam natrium membentuk natrium etoksida (Na. OCH 2 CH 3), suatu basa kuat yang biasanya digunakan untuk reaksi eliminasi. • Struktur alkohol yang lebih besar seperti 2 -propanol atau tert-butanol bereaksi lebih cepat dengan kalium dibandingkan dengan natrium. 24

Pembentukan ion fenoksida Alkohol aromatik/fenol relatif lebih asam dibandingkan dengan alkohol alifatik karena cincin benzena memiliki kemampuan untuk mendelokalisasi muatan negatif atom oksigen pada karbon yang ada pada cincin. 25

Delokalisasi muatan pada ion fenoksdia • Muatan negatif pada oksigen dapat dilokalisasikan pada keempat atom dari ion fenoksida. • Terdapat tiga struktur resonansi yang dapat melokalisasikan muatan pada tiga atom karbon yang ada pada cincin. • Struktur yang sebenarnya dari ketika bentuk resonansi iniadalah struktur gabungan dari ketiga bentuk isomer tersebut. 26

Sintesis Alkohol (Review) • Alkohol dapat disintesis melalui reaksi substitusi nukleofilik alkil halida. • Hidrasi alkena juga menghasilkan alkohol: – Air dalam larutan asam (mengalami penataulangan) – Oksimerkurasi-demerkurasi – Hidroborasi–oksidasi 27

Sintesis alkohol visinal diol visinal dapat disintesis melalui dua metode: • Hidroksilasi Syn dari alkena – Osmium tetroksida, hidrogen peroksida – Kalium permanganat dingin dan encer dan suasana basa • Hidroksilasi anti dari alkena – Asam peroksi diikuti dengan hidrolisis 28

Reagen organologam • Pada reagen organologam, karbon memiliki muatan negatif karena berikatan dengan logam (biasanya Mg atau Li). • Karbon bermuatan negatif akan menyerang karbon yang bermuatan positif parsial. – C—X – C═O • Sangat bagus untuk digunakan dalam pembentukan ikatan karbon–karbon. 29

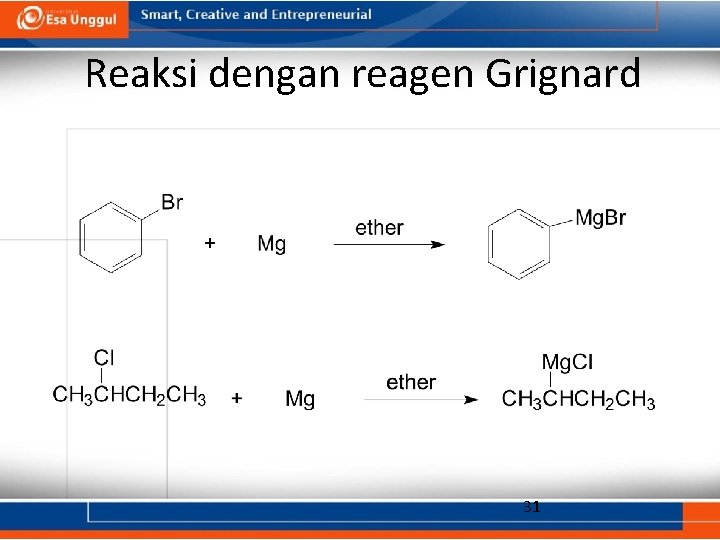
Reagen Grignard • Rumus umum R—Mg—X (bereaksi dengan senyawa lain dalam bentuk R: - +Mg. X). • Eter digunakan sebagai pelarut untuk menstabilkan senyawa kompleks. • Bentuk iodida dari reagen ini merupakan yang paling reaktif. • Dapat dibentuk dari halida yang lain. 30

Reaksi dengan reagen Grignard 31

Reagen Organolitium • Rumus umum: R—Li (bereaksi dengan senyawa lain dalam bentuk R: - +Li) • Dapat dihasilkan dari alkil, vinil, atau aril halida seperti juga reagen Grignard. • Dapat menggunakan berbagai macam pelarut selain eter. 32

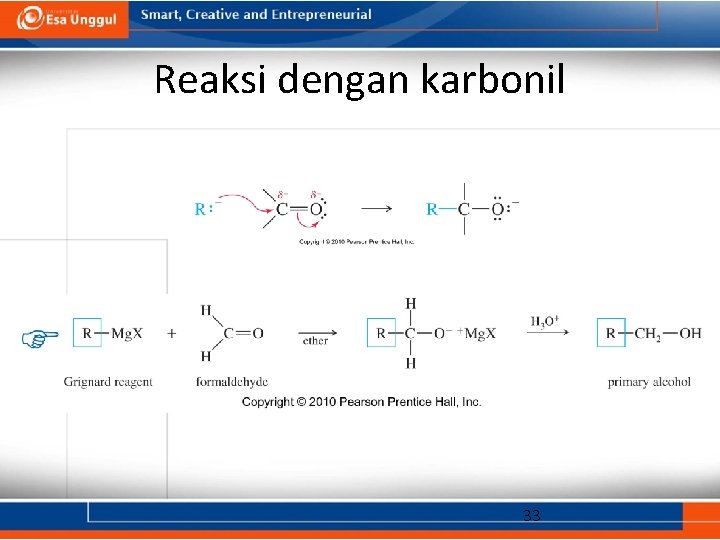
Reaksi dengan karbonil 33

Pembentukan alkohol primer dengan reagen Grignard • Reaksi reagen Grignard dengan formaldehida akan menghasilkan suatu alkohol primer setelah protonasi. 34

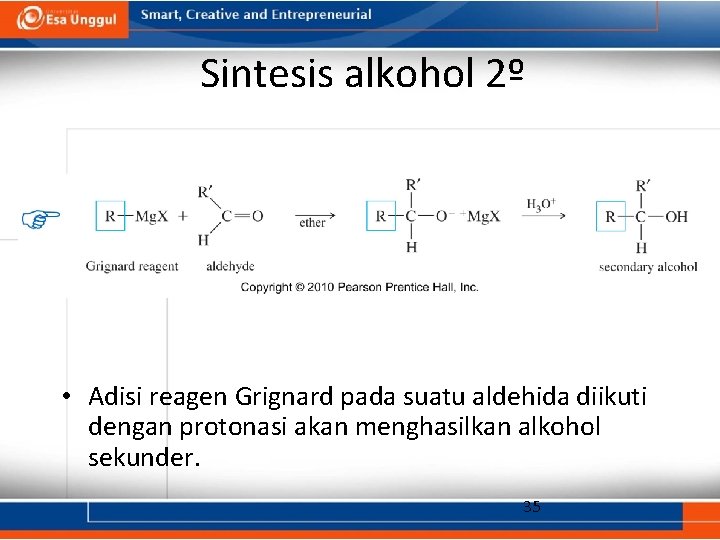
Sintesis alkohol 2º • Adisi reagen Grignard pada suatu aldehida diikuti dengan protonasi akan menghasilkan alkohol sekunder. 35

Sintesis alkohol 3º • Alkohol tersier dapat diperoleh melalui adisi oleh reagen Grignard diikuti dengan protonasi oleh asam encer. 36

Contoh Soal 2 Tunjukkan bagaimana cara mensintesis senyawa alkohol berikut dari senyawa yang memiliki tidak lebih dari lima karbon. Penyelesaian Senyawa ini merupakan alkohol tersier; salah satu dari ketiga gugus alkil tersebut bisa jadi berasal dari adisi menggunakan regen Grignard. Terdapat tiga kombinasi reagen yang dapat digunakan untuk menghasilkan alkohol ini antara lain: 37

Contoh Soal 2 (Lanjutan) Penyelesaian (Lanjutan) Ketiga jalur reaksi dapat menghasilkan alkohol yang sama, namun, hanya jalur ketiga yang dimulai dengan senyawa yang memiliki tidak lebih dari lima atom akrbon. Dua jalur yang lain akan membutuhkan langkah lain untuk menghasilkan senyawa keton dengan lima atom karbon. 38

Reaksi Grignard dengan klorida asam dan ester • Gunakan dua mol reagen Grignard. • Produk yang dihasilkan berupa alkohol tersier dengan dua gugus alkil yang sama. • Reaksi dengan satu mol reagen Grignard menghasilkan suatu intermediet keton yang lebih lanjut bereaksi dengan mol kedua dari reagen Grignard. 39

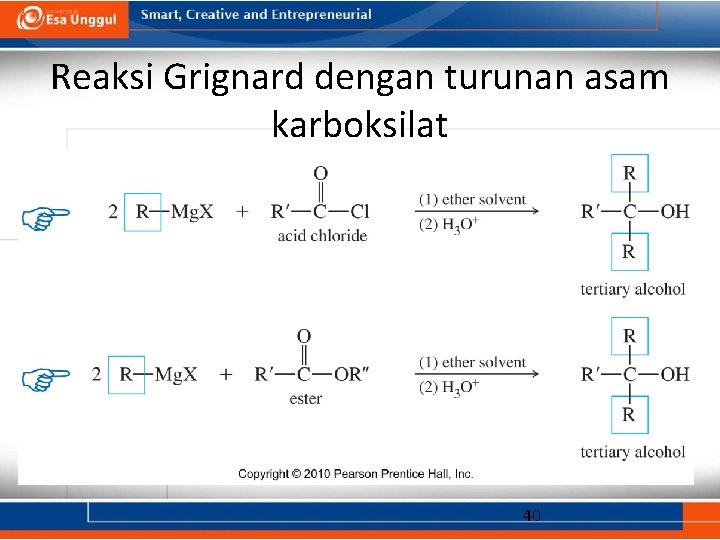
Reaksi Grignard dengan turunan asam karboksilat 40

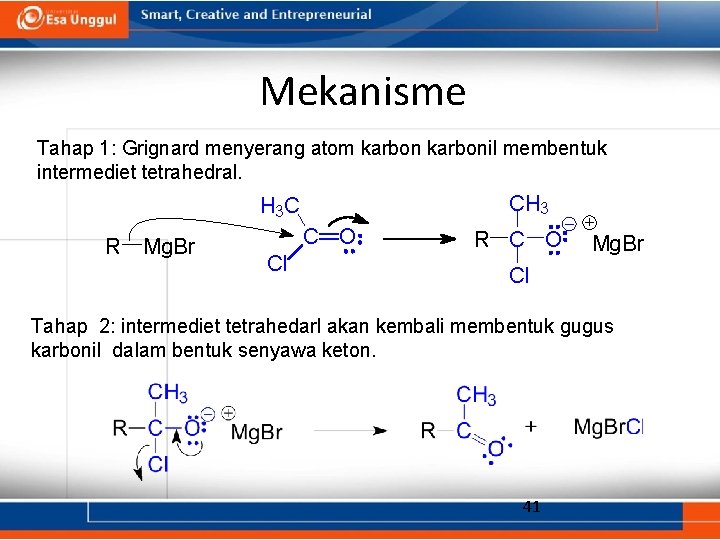
Mekanisme Tahap 1: Grignard menyerang atom karbonil membentuk intermediet tetrahedral. CH 3 H 3 C R Mg. Br C O Cl R C O Mg. Br Cl Tahap 2: intermediet tetrahedarl akan kembali membentuk gugus karbonil dalam bentuk senyawa keton. 41

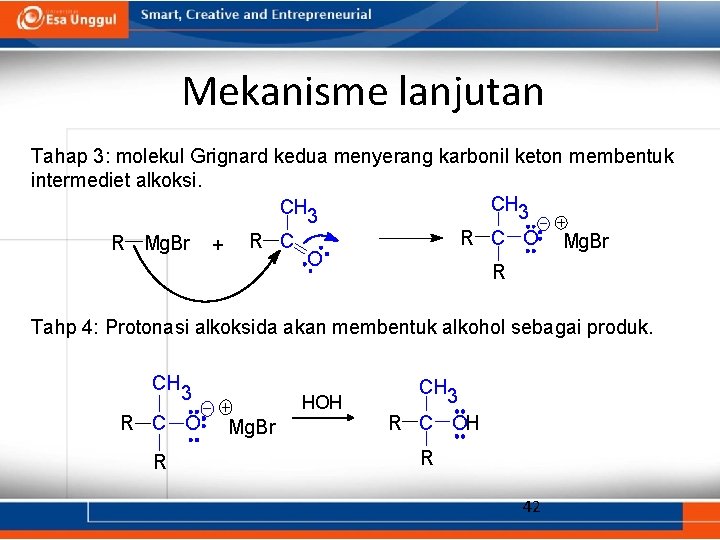
Mekanisme lanjutan Tahap 3: molekul Grignard kedua menyerang karbonil keton membentuk intermediet alkoksi. CH 3 R Mg. Br + R C O O Mg. Br R Tahp 4: Protonasi alkoksida akan membentuk alkohol sebagai produk. CH 3 R C O R HOH Mg. Br CH 3 R C OH R 42

Adisi etilen oksida • Reagen Grignard dan lithium akan menyerang cincin epoksida (oksirena) dan membuka cincin ini membentuk alkohol. • Reaksi ini sangat mungkin terjadi karena adanya tegangan cincin pada epoksida akan berkurang dengan terbukanya cincin. • Reaksi umumnya digunakan untuk memperpanjang rantai karbon dengan dua karbon. 43

Kekurangan reaksi Grignard • Grignard merupakan nukleofil yang bagus, namun dengan keberadaan proton asam, reagen ini akan berperan sebagai basa kuat. • Tidak boleh ada air atau proton asam lain seperti O— H, N—H, S—H, atau alkuna ujung. • Tidak boleh ada elektrofil dengan ikatan rangkap seperti C═N, C N, S═O, atau N═O dalam reaksi. 44

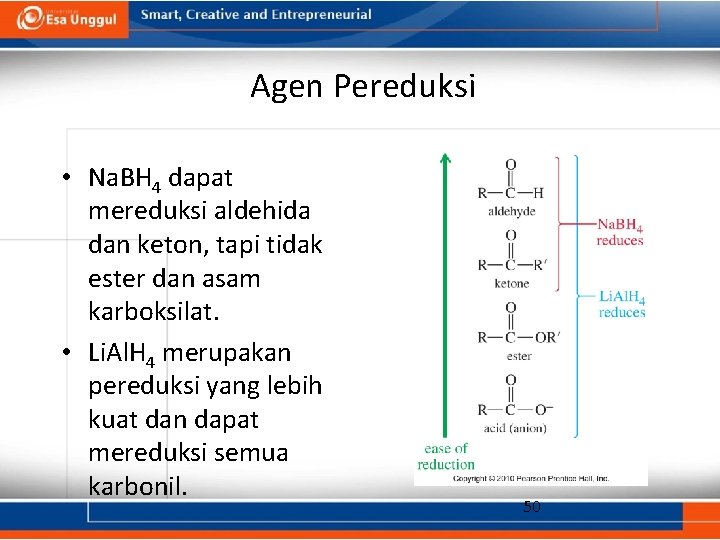
Reduksi karbonil • Reduksi aldehida menghasilkan alkohol primer. • Reduksi keton menghasilkan alkohol sekunder. • Reagen: – Natrium borohidrida, Na. BH 4 – Litium aluminum hidrida, Li. Al. H 4 – Nikel Raney 45

Natrium Borohidrida • Na. BH 4 merupakan sumber hidrida (H-) • Hidrida menyerang karbonil membentuk ion alkoksida. • Kemudian ion alkoksida terprotonasi oleh asam encer. • Hanya bereaksi dengan karbonil aldehida dan keton, bukan pada karbonil ester atau asam karboksilat. 46

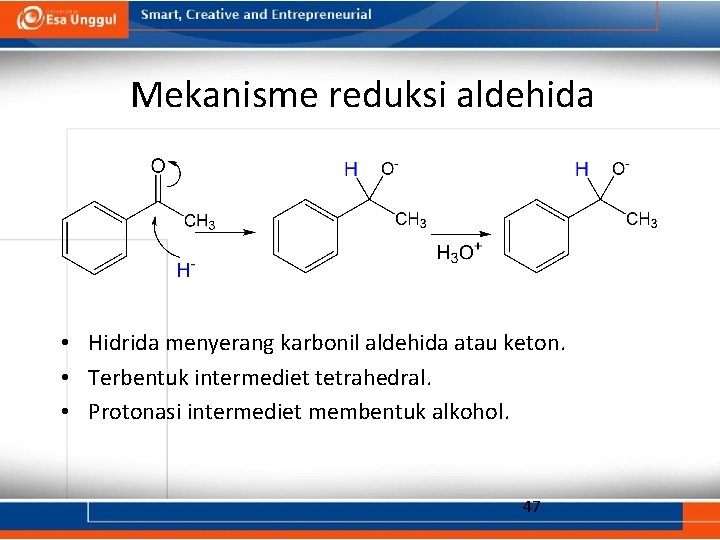
Mekanisme reduksi aldehida • Hidrida menyerang karbonil aldehida atau keton. • Terbentuk intermediet tetrahedral. • Protonasi intermediet membentuk alkohol. 47

Litium Aluminum Hidrida • Li. Al. H 4 merupakan sumber hidrida (H-) • Merupakan agen pereduksi yang lebih kuat dibandingkan natrium borohidrida, namun lebih berbahaya. • Mereduksi keton dan aldehida menjadi alkohol sekunder dan tersier. • Mengubah ester dan asam karboksilat menjadi alkohol primer. 48

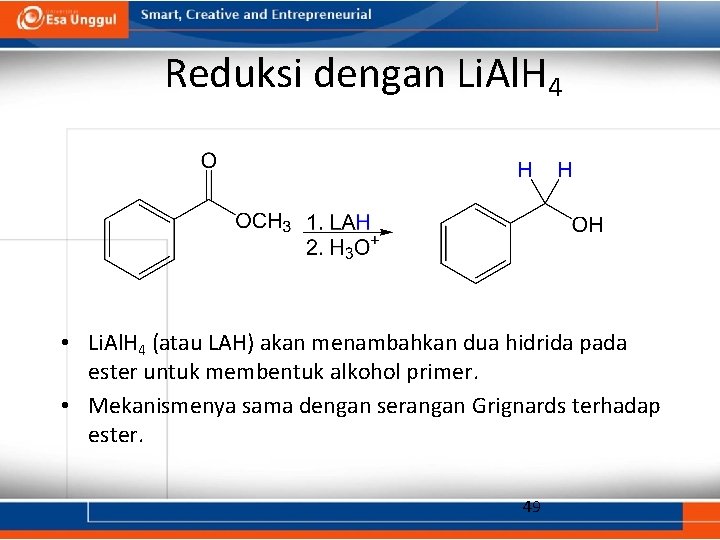
Reduksi dengan Li. Al. H 4 • Li. Al. H 4 (atau LAH) akan menambahkan dua hidrida pada ester untuk membentuk alkohol primer. • Mekanismenya sama dengan serangan Grignards terhadap ester. 49

Agen Pereduksi • Na. BH 4 dapat mereduksi aldehida dan keton, tapi tidak ester dan asam karboksilat. • Li. Al. H 4 merupakan pereduksi yang lebih kuat dan dapat mereduksi semua karbonil. 50

Hidrogenasi terkatalisis • Nikel Raney merupakan suatu nikel yang kaya hidrogen dan lebih reaktif dibandingkan dengan katalis Pd atau Pt. • Reaksi ini tidak umum digunakan untuk mereduksi karbonil karena dapat mereduksi ikatan rangkap dua dan ikatan rangkap tiga yang ada pada molekul. • Reagen Hidrida relatif lebih selektif sehingga lebih serig digunakan untuk reduksi karbonil. 51

Tiol (Merkaptan) • Analog sulfur dari alkohol disebut tiol. • gugus —SH disebut gugus merkapto. • Dinamakan dengan menambahkan akhiran tiol pada nama alkananya. • Reaksi ini umumnya dibuat melalui reaksi SN 2 sehingga biasanya menggunakan alkil halida primer sebagai bahan dasar. 52

Sintesis tiol • Ion tiolat akan menyerang karbon dan mengganti halida. • Reaksi ini merupakan reaksi SN 2 sehingga metil halida akan bereaksi lebih cepat dibandingkan dengan alkil halida primer. • Untuk mencegah pembentukan dialkilasi, gunakan natrium hidrosulfida dalam jumlah berlebih dibandingkan dengan alkil halidanya. 53

Oksidasi tiol Tiol dapat dioksidasi untuk membentuk diulfida. Ikatan disulfida dapat direduksi kembali ke bentuk tiol menggunakan agen pereduksi. 54

Reaksi-Reaksi Senyawa Alkohol 55

Beberapa reaksi pada alkohol • • Dehidrasi menjadi alkena Oksidasi menjadi aldehida dan keton Substitusi menjadi alkil halida Reduksi menjadi alkana Esterifikasi Tosilasi Sintesis eter Williamson 56

Ringkasan reaksi 57

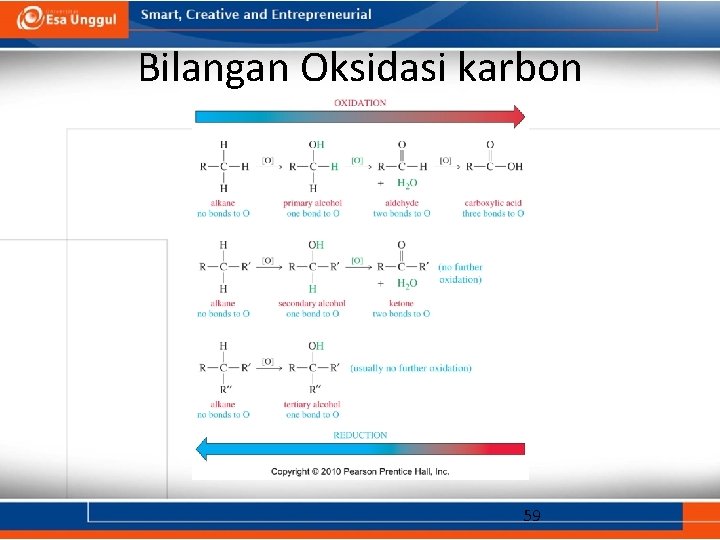
Bilangan oksidasi • Penilaian bilangan oksidasi relatif mudah dilakukan untuk garam anorganik: – Cr. O 42 - direduksi menjadi Cr 2 O 3. – KMn. O 4 direduksi menjadi Mn. O 2. • Oksidasi: bertambahnya jumlah O, O 2, atau X 2; berkurangnya jumlah H 2. • Reduksi: bertambahnya jumlah H 2 (atau H-); berkurangnya jumlah O atau O 2; dan berkurangnya jumlah X 2. • Bertambahnya atau berkurangnya jumlah H+, H 2 O, HX, dst. Tidak menunjukkan terjadinya oksidasi maupun reduksi 58

Bilangan Oksidasi karbon 59

Oksidasi alkohol 2° • Alkohol 2° dioksidasi menjadi keton. • Agen oksidasi misalnya Na 2 Cr 2 O 7/H 2 SO 4. • Reagen aktif pada reaktan tersebut adalah H 2 Cr. O 4. • Terjadi perubahan warna pada reaksi ini dari jinga menjadi hijau-kebiruan. 60

Mekanisme reaksi oksidasi 61

Oksidasi alkohol 1° menjadi asam karboksilat • Reagen asam kromat mengoksidasi alkohol primer menjadi asam karboksilat. • Agen pengoksidasi ini terlalu kuat untuk berhenti pada produk aldehida. 62

Piridinium klorokromat (PCC) • PCC merupakan suatu senyawa kompleks dari kromium trioksida, piridin, dan HCl. • Oksidasi alkohol primer menjadi aldehida. • Oksidasi alkohol sekunder menjadi keton. 63

Piridinium klorokromat (PCC) 64

Alkohol 3° tidak dapat teroksidasi • Karbon tersier tidak memiliki hidrogen sehingga sulit dioksidasi dan melibatkan pemutusan ikatan C—C bond. • Uji asam kromat untuk alkohol primer dan sekunder karena alkohol tersier tidak dapat bereaksi. 65

Reagen oksidasi lain • • • Cu. O, 300°C (dehidrogenasi di industri) Reagen Collins : Cr 2 O 3 dalam piridin Reagen Jones : asam kromat dalam aseton KMn. O 4 (oksidator kuat) Asam nitrat (oksidator kuat) Oksidasi Swern : dimetilsulfoksida, dengan oksalil klorida dan basa (meruah), mengoksidasi alkohol 2 menjadi keton dan alkohol 1 menjadi aldehida. 66

Contoh soal 1 Tuliskan metode yang paling cocok untuk tiap reaksi sintesis berikut. (a) siklopentanol ––––––> siklopentanon Penyelesaian Banyak jenis reagen yang bisa digunakan untuk mengoksidasi alkohol sekunder sederhana menjadi keton. Namun, untuk sintesis di laboratorium, reagen yang digunakan adalah kromium trioksida atau natrium dikromat. PCC dan oksidator Swern juga dapat digunakan, meski relatif rumit. 67

Contoh soal 1 (lanjutan) Tuliskan metode yang paling cocok untuk tiap reaksi sintesis berikut. . (b) 2 -okten-1 -ol ––––––> 2 -oktenal Penyelesaian Sintesis ini memerlukan pemikiran lebih jauh mengingat terdapat beberapa faktor yang bisa mengubah jalannya reaksi. Misalnya, aldehid dapat dengan mudah dioksidasi leih lanjut menjadi asam karboksilat dan ikatan rangkap bereaksi dengan oksidator seperti KMn. O 4. Reagen yang dapat digunakan sukup terbatas diantaranya PCC atau oksidator Swern. 68

Dehidrogenasi alkohol jarang dilakukan dalam laboratorium karena banyak senyawa organik yang terdekomposisi pada suhu 300°C. 69

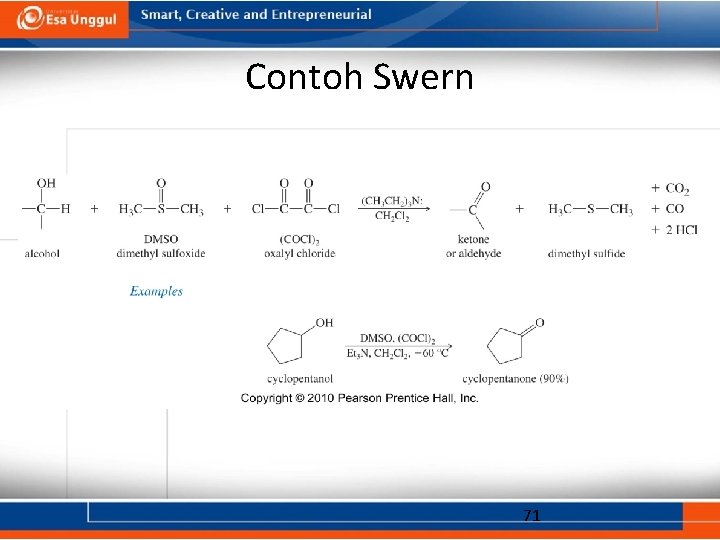
Oksidasi Swern • Reaksi ini menggunakan dimetil sulfoksida (DMSO) sebagai oksidator bersamaan dengan oksalil klorida dan piridin. • Alkohol primer dapat dioksidasi menjadi aldehida. • Alkohol sekunder dapat dioksidasi menjadi keton pada kondisi reaksi ini. • Produk samping dari reaksi dapat dengan mudah dipisahkan dari produk sehingga relatif mudah dilakukan. 70

Contoh Swern 71

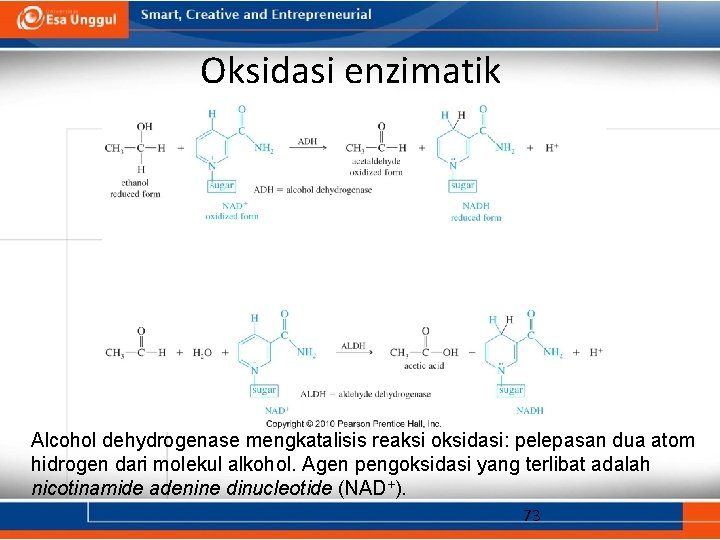
Oksidasi Biologis • Dikatalis oleh alcohol dehydrogenase (ADH). • Agen pengoksidasi yang berperan adalah nicotinamide adenine dinucleotide (NAD+). • Etanol teroksidasi menjadi asetaldehida, kemudian menjadi asam asetat (relatif tidak beracun). • Metanol teroksidasi menjadi formaldehida, kemudian menjadi asam format (yang mana relatif lebih beracun). • Etilen glikol dioksidasi menjadi asam oksalat (cukup beracun). 72

Oksidasi enzimatik Alcohol dehydrogenase mengkatalisis reaksi oksidasi: pelepasan dua atom hidrogen dari molekul alkohol. Agen pengoksidasi yang terlibat adalah nicotinamide adenine dinucleotide (NAD+). 73

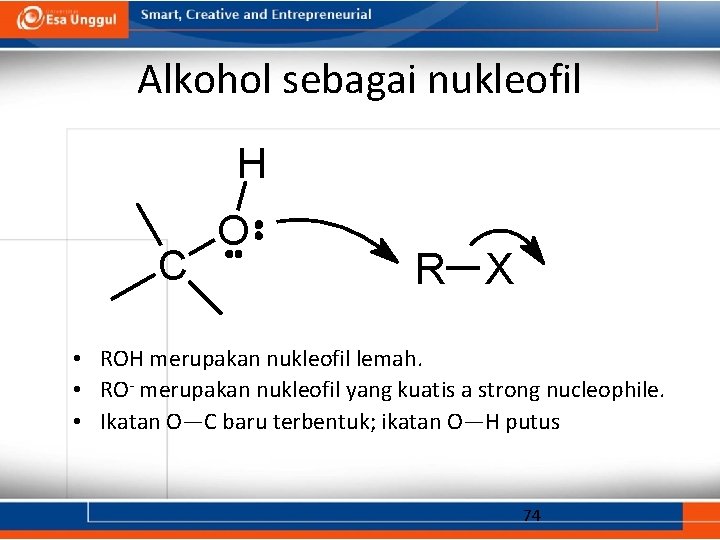
Alkohol sebagai nukleofil H C O R X • ROH merupakan nukleofil lemah. • RO- merupakan nukleofil yang kuatis a strong nucleophile. • Ikatan O—C baru terbentuk; ikatan O—H putus 74

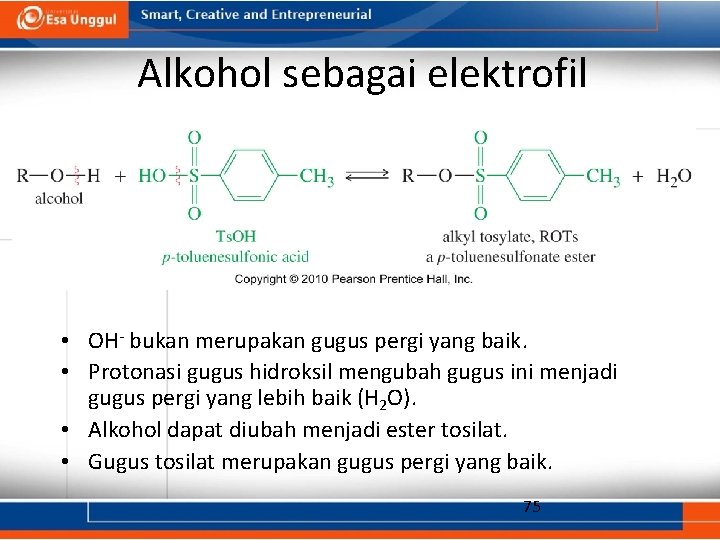
Alkohol sebagai elektrofil • OH- bukan merupakan gugus pergi yang baik. • Protonasi gugus hidroksil mengubah gugus ini menjadi gugus pergi yang lebih baik (H 2 O). • Alkohol dapat diubah menjadi ester tosilat. • Gugus tosilat merupakan gugus pergi yang baik. 75

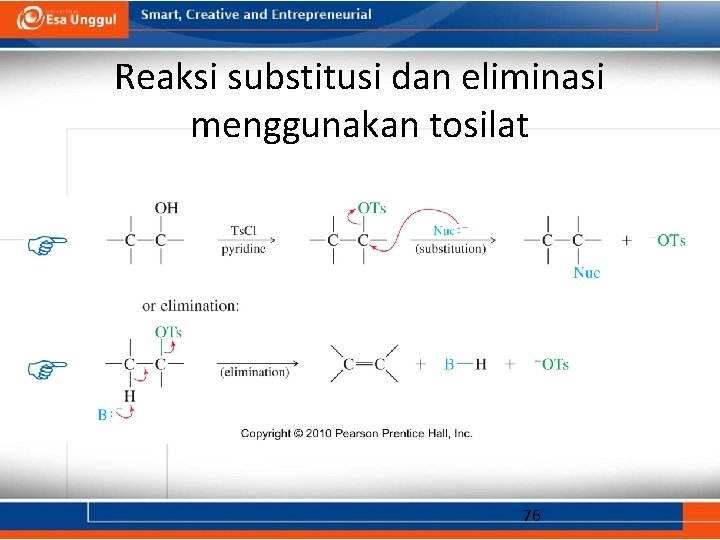
Reaksi substitusi dan eliminasi menggunakan tosilat 76

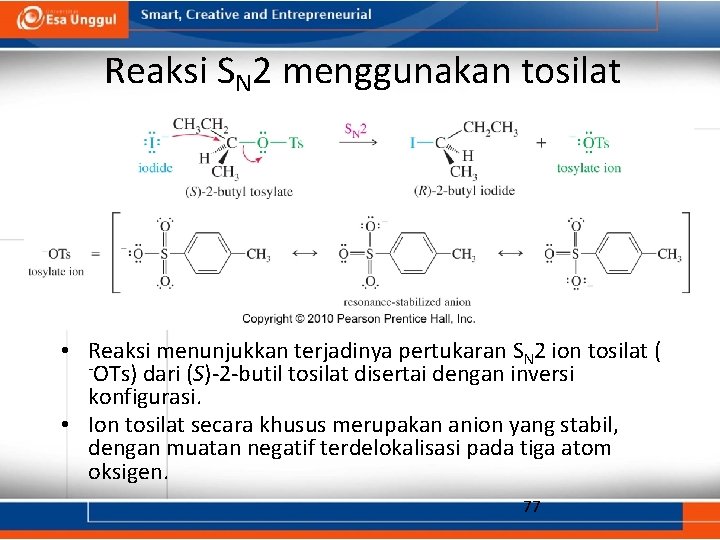
Reaksi SN 2 menggunakan tosilat • Reaksi menunjukkan terjadinya pertukaran SN 2 ion tosilat ( -OTs) dari (S)-2 -butil tosilat disertai dengan inversi konfigurasi. • Ion tosilat secara khusus merupakan anion yang stabil, dengan muatan negatif terdelokalisasi pada tiga atom oksigen. 77

Rangkuman reaksi tosilat 78

Reduksi alkohol • Dehidrasi dengan H 2 SO 4 pekat, kemudian adisi dengan H 2. • Konversi gugus alkohol menjadi tosilat kemudian reduksi gugus tersebut dengan Li. Al. H 4. OH CH 3 CHCH 3 H 2 SO 4 alkohol OH CH 3 CHCH 3 alkohol CH 2 CHCH 3 alkena Ts. Cl OTs CH 3 CHCH 3 tosilat H 2 Pt Li. Al. H 4 CH 3 CH 2 CH 3 alkana 79

Reaksi alkohol dengan asam • Gugus hidroksil terprotonasi oleh asam dan mengubahnya menjadi gugus pergi yang baik (H 2 O). • Jika protonasi alkohol telah terjadi, alkohol tersebut dapat mengalami reaksi substitusi dan eliminasi. 80

Reaksi dengan HBr • • Gugus –OH dapat terprotonasi. Gugus –OH 2+ merupakan gugus pergi yang baik. Alkohol 3° dan 2° bereaksi dengan Br- melalui reaksi SN 1. Alkohol 1° bereaksi melalui SN 2. + R O H H 3 O H R O H - Br R Br 81

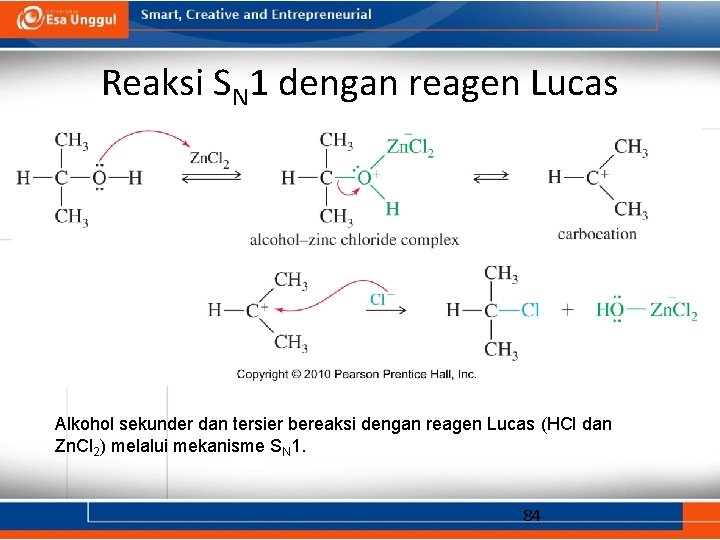
Reaksi dengan HCl • Klorin merupakan nukleofil yang lebih lemah dibandingkan bromida. • Dengan menambahkan Zn. Cl 2, yang dapat mengikat gugus – OH dengan kuat, reaksi ini dapat berlangsung dengan baik. • Produk klorida seringkali tidak larut dalam pelarut. • Uji Lucas: Zn. Cl 2 dalam HCl pekat: – Alkohol 1° bereaksi secara perlahan atau tidak bereaksi sama sekali. – Alkohol 2 bereaksi dalam 1 -5 menit. – Alkohol 3 bereaksi kurang dari 1 menit. 82

Reaksi SN 2 dengan reagen Lucas • Alkohol primer bereaksi dengan reagen Lucas (HCl dan Zn. Cl 2) melalui mekanisme SN 2. • Reaksi terjadi dengan sangat lambat. Reaksi terjadi dalam beberapa menit hingga beberapa hari. 83

Reaksi SN 1 dengan reagen Lucas Alkohol sekunder dan tersier bereaksi dengan reagen Lucas (HCl dan Zn. Cl 2) melalui mekanisme SN 1. 84

Kelemahan reaksi HX • Alkohol primer dan sekunder menghasilkan rendemen alkil klorida yang rendah. • Reaksi eliminasi berkompetisi dengan reaksi substitusi. • Intermediet karbokation dapat mengalami penataulangan. 85

Contoh soal 2 Ketika 3 -metil-2 -butanol direaksikan dengan HBr pekat, produk mayor yang dihasilkan adalah 2 bromo-2 -metilbutana. Tulis mekanisme untuk pembentukan produk ini. Penyelesaian Gugus alkohol diprotonasi oleh asam kuat. Alkohol terprotonasi ini melepaskan molekul air membentuk karbokation sekunder. 86

Contoh soal 2 (Lanjutan) Penyelesaian (lanjutan) Karbokation ini mengalami pergeseran hidrida sehingga mengubah karbokation sekunder menjadi karbokation tersier. Serangan ion bromida kemudian menghasilkan produk. 87

Reaksi dengan fosfor halida • Menghasilkan rendemen yang tinggi pada alkohol 1° dan 2°. • PCl 3 digunakan untuk sintesis alkil klorida (SOCl 2 dapat juga digunakan). • PBr 3 digunakan untuk sintesis alkil bromida. • P dan I 2 digunakan untuk mensintesis alkil iodida (PI 3 tidak stabil). 88

Mekanisme reaksi dengan PBr 3 • Oksigen menyerang fosfor, menggantikan salah satu atom halida. • Br- menyerang sisi belakang dari atom karbon (SN 2). 89

Reaksi alkohol dengan tionil klorida • Tionil klorida (SOCl 2) dapat digunakan untuk mengubah alkohol menjadi alkil klorida dalam suatu reaksi yang menghasilkan gas HCl dan SO 2. 90

Mekanisme reaksi tionil klorida 91

Reaksi dehidrasi H 2 SO 4 pekat menghasilkan alkena. Reaksi terjadi melalui intermediet karbokation. Menghasilkan produk Zaitsev Dehidrasi bimolekular menghasilkan eter. Reaksi temperatur rendah (kurang dari 140°C), cenderung menghasilkan eter. • Reaksi temperatur tinggi (lebih dari 180°C), cenderung menghasilkan alkena • • • 92

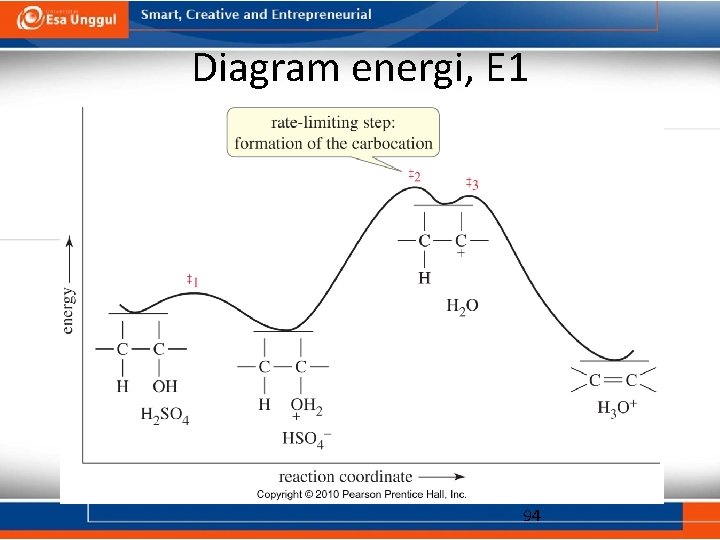
Dehidrasi sikloheksanol • Dehidrasi sikloheksanol dengan H 2 SO 4 pekat terjadi dalam tiga tahap: protonasi hidroksida, pelepasan air, dan deprotonasi. • Dehidrasi alkohol umumnya terjadi melalui mekanisme E 1. Penataulangan dapat terjadi pada reaksi ini. • Laju reaksi sesuai dengan kecepatan pembentukan karbokation: 3 o > 2 o > 1 o. 93

Diagram energi, E 1 94

Contoh soal 3 Prediksikan produk dehidrasi terkatalisis asam sulfat pekat dengan bahan dasar 1 -metilsikloheksanol Penyelesaian 1 -Metilsikloheksanol bereaksi membentuk karbokation tersier. Salah satu proton akan dilepas dari salah satu dari tiga karbon disekitar karbokation. Dua atom karbon sekunder ekuivalen satu sama lain dan pelepasan atom hidrogen dari kedua karbon ini akan melepaskan produk alkena dengan tiga substituen (produk mayor). Pelepasan proton dari karbon metil akan menghasilkan produk alkena dengan dua substituen (produk minor) 95

Reaksi khas Diol diol visinal dapat mengalami dua reaksi khas berikut: – Penataulangan Pinacol – Pembelahan asam Periodat 96

Penataulangan pinakol • Pada penataulangan pinakol, sebuah diol visinal diubah menjadi keton (pinakolon) pada kondisi asam dan dipanaskan. • Reaksi ini merupakan salah satu bentuk reaksi dehidrasi karena pada prosesnya saru molekul air akan dilepaskan dari bahan dasar. 97

Mekanisme penataulangan pinakol • Tahap pertama dari penataulangan ini adalah protonasi dan pelepasan molekul air menghasilkan suatu karbokation. 98

Mekanisme penataulangan pinakol (Lanjutan) • Kemudian terjadi pergeseran metil membentuk suatu karbokation terstabilisai melalui efek resonansi. Karbokation ini kemudian dideprotonasi oleh air menghasilkan produk pinakolon. 99

Pembelahan glikol oleh periodat • Glikol dapat dibelah secara oksidatif oleh asam periodat (HIO 4) membentuk keton dan aldehida. • Pembelahan ini dapat digabungkan dengan hidroksilasi alkena oleh osmium tetraoksida atau kalium permanganat dingin membentuk glikol dan pembelahan glikol dengan asam periodat. • Produk yang sama juga dapat diperoleh melalui reaksi ozonolisis alkena yang sama 100

Esterifikasi • Esterifikasi Fischer: Alkohol + asam karboksilat • Ester tosilat • Ester sulfat • Ester nitrat • Ester fosfat 101

Esterifikasi Fischer • Reaksi ini merupakan reaksi antara alkohol dan asam karboksilat menghasilkan ester. • Asam sulfat digunakan sebagai katalis. • Reaksi ini merupakan reaksi kesetimbangan antara bahan dasar dan produk. Oleh karena itu, esterifikasi Fischer jarang digunakan untuk mensintesis ester. 102

Reaksi alkohol dan asil klorida • Reaksi esterifikasi dapat menghasilkan rendemen yang lebih bagus jika menggunakan reaksi antara alkohol dan asil klorida. • Reaksi yang terjadi merupakan reaksi eksotermik dan menghasilkan ester dengan rendemen yang tinggi. Produk samping hanya berupa HCl. 103

Ester Nitrat • Salah satu contoh senyawa ester nitrat yang cukup dikenal adalah gliseril trinitrat. • Gliseril trinitrat diperoleh dari reaksi antara gliserol (1, 2, 3 propanatriol) dengan tiga molekul asam nitrat. 104

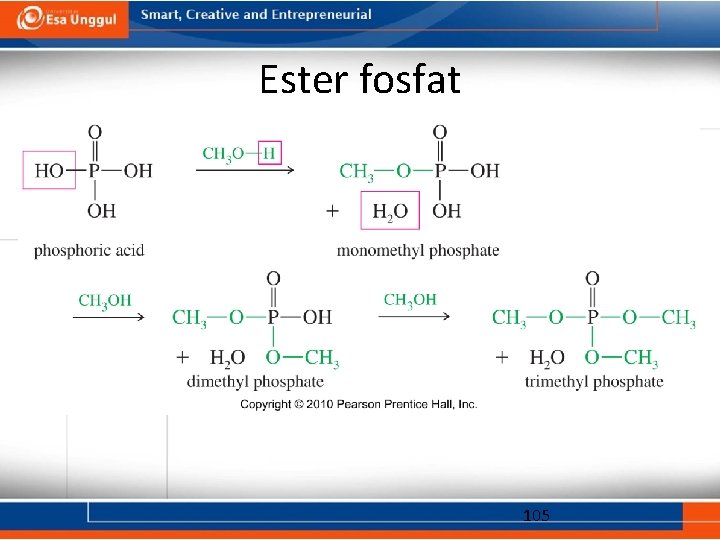
Ester fosfat 105

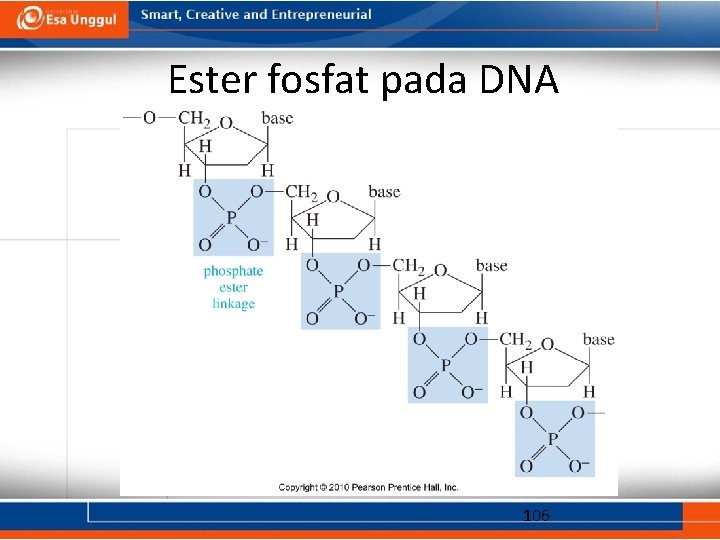
Ester fosfat pada DNA 106

Ion alkoksida: Sintesis eter Williamson • Eter dapat disintesis melalui reaksi ion alkoksida dengan alkil halida primer. Reaksi ini disebut sintesis eter Williamson. • Reaksi in terjadi melalui mekanisme SN 2 sehingga biasanya dilakukan menggunakan alkil halida primer. • Jika menggunakan alkil halida sekunder atau tersier, ion alkoksida akan berperan sebagai basa sehingga mengakibatkan reaksi eliminasi. 107

Sekian 108
 Tugas pertemuan 9 metode perancangan program
Tugas pertemuan 9 metode perancangan program Dari gambar ini notasi infix yang dihasilkan adalah :
Dari gambar ini notasi infix yang dihasilkan adalah : Denah ruang pertemuan
Denah ruang pertemuan Logo pertemuan
Logo pertemuan Pertemuan ini
Pertemuan ini Sumbu datar pada diagram batang menyatakan
Sumbu datar pada diagram batang menyatakan Spk latihan pertemuan 6
Spk latihan pertemuan 6 Tipe data yang terdiri dari aksara
Tipe data yang terdiri dari aksara Contoh hiperkorek pleonasme dan kontaminasi
Contoh hiperkorek pleonasme dan kontaminasi Penawaran elastis uniter terjadi jika
Penawaran elastis uniter terjadi jika Pertemuan 9
Pertemuan 9 Contoh pendekatan kontribusi
Contoh pendekatan kontribusi Sel adalah pertemuan antara titik-titik dan titik-titik
Sel adalah pertemuan antara titik-titik dan titik-titik Sell adalah pertemuan antara
Sell adalah pertemuan antara Tugas statistika pertemuan 2
Tugas statistika pertemuan 2 Peranan atau fungsi etika
Peranan atau fungsi etika Pertemuan awal pkh adalah
Pertemuan awal pkh adalah Pertemuan multikultural
Pertemuan multikultural Array dimensi 3
Array dimensi 3 Sukrosa
Sukrosa Pada pertemuan kali ini kita
Pada pertemuan kali ini kita Fenolok
Fenolok Oksidacija cikloheksanola
Oksidacija cikloheksanola Kwas karboksylowy + alkohol
Kwas karboksylowy + alkohol Oxidation primärer alkohol
Oxidation primärer alkohol Roh alkohol
Roh alkohol Motiron og alkohol
Motiron og alkohol Alkohol al kuhl
Alkohol al kuhl Kwas mrówkowy próba trommera
Kwas mrówkowy próba trommera Alkohol al kuhl
Alkohol al kuhl Semaglutyd tabletki cena
Semaglutyd tabletki cena Alkoholok értékűsége
Alkoholok értékűsége Ethanal zu ethansäure
Ethanal zu ethansäure Endokrin akademiska
Endokrin akademiska Alkohol felszívódása
Alkohol felszívódása Rumusan penyalahgunaan bahan
Rumusan penyalahgunaan bahan Kein alkohol
Kein alkohol Vistula alkohol
Vistula alkohol Laestadianer finland
Laestadianer finland Ada berapa tekanan zat
Ada berapa tekanan zat Jak długo utrzymuje się alkohol we krwi tabela
Jak długo utrzymuje się alkohol we krwi tabela Funktionelle gruppen
Funktionelle gruppen Levertal på 145
Levertal på 145 Alkohol
Alkohol Kataralia
Kataralia Meos alkohol
Meos alkohol Alkohol zorné pole vodiča
Alkohol zorné pole vodiča Szlovénia alkohol vezetés
Szlovénia alkohol vezetés Profuses schwitzen
Profuses schwitzen Promilleberechnung
Promilleberechnung Fermentasi alkohol
Fermentasi alkohol Contoh minuman artificial water
Contoh minuman artificial water Redoxreaktion alkanole
Redoxreaktion alkanole Alkohol problem
Alkohol problem Ile kalorii mają papierosy
Ile kalorii mają papierosy Energetsko pice i alkohol
Energetsko pice i alkohol Perbedaan fermentasi alkohol dan asam laktat
Perbedaan fermentasi alkohol dan asam laktat Alkohol funkciós csoport
Alkohol funkciós csoport Spiritusz folyadék
Spiritusz folyadék Antidotum alkohol
Antidotum alkohol 3 metil 2 butanol
3 metil 2 butanol Chabzda alkohol
Chabzda alkohol Perbedaan fermentasi alkohol dan asam laktat
Perbedaan fermentasi alkohol dan asam laktat Reagen carr price
Reagen carr price Reakcje alkoholi
Reakcje alkoholi Trinkmengenberechnung
Trinkmengenberechnung Za sta se koristi spiritus
Za sta se koristi spiritus Vinjak sastav
Vinjak sastav Sug efter alkohol
Sug efter alkohol Akropolis alkohol
Akropolis alkohol Andra slan
Andra slan Syndesmofyty
Syndesmofyty Syndrom brett mellan ögonen
Syndrom brett mellan ögonen Alkohol
Alkohol Leukovarin
Leukovarin Illamående alkohol
Illamående alkohol Fenolftalien
Fenolftalien Zellgift alkohol
Zellgift alkohol Odtrutka na alkohol metylowy
Odtrutka na alkohol metylowy Gram alkohol pr genstand
Gram alkohol pr genstand