Senyawasenyawa Amina PERTEMUAN 12 Harizal S Pd M














































- Slides: 68

Senyawa-senyawa Amina PERTEMUAN 12 Harizal, S. Pd. , M. Sc Program Studi Gizi Universitas Esa Unggul 1

KEMAMPUAN AKHIR YANG DIHARAPKAN • Mahasiswa mampu menjelaskan tatanama, sifat fisik, sifat kimia, sintesis, dan reaksi yang melibatkan senyawa-senyawa amina 2

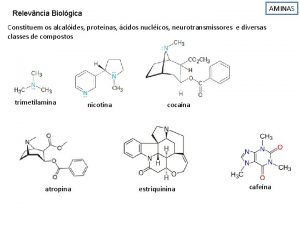
Beberapa senyawa amina dengan aktivitas biologis • Alkaloid merupakan kelompok senyawa amina yang memiliki berbagai aktivitas biologis. Sebagian besar senyawa ini disintesis oleh tanaman untuk melindungi diri dari serangga dan hewan lain. • Banyak obat aditif biasanya diklasifikasikan dalam golongan alkaloid. 3

Aktivitas biologis amina • Dopamin merupakan suatu neurotransmiter. • Epinephrin merupakan bioregulator. • Niasin, Vitamin B 6, merupakan senyawa yang mengandung gugus amina. • Alkaloid: nikotin, morfin, dan kokain • Asam amino 4

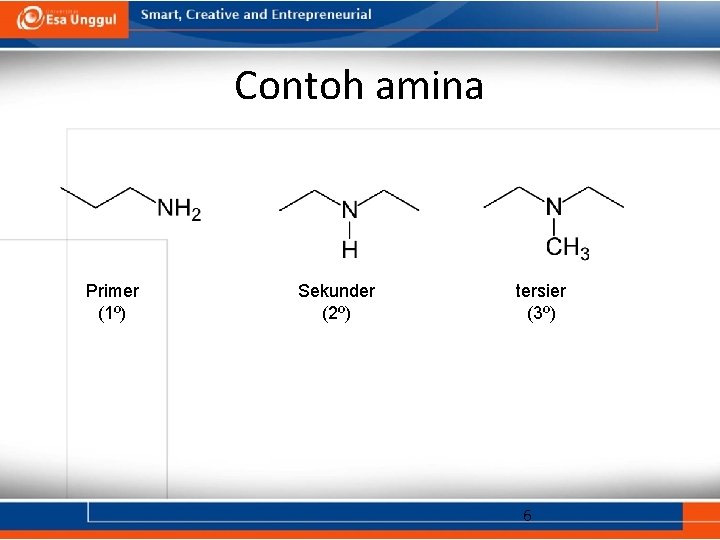
Klasifikasi Amina • primer (1 ): memiliki satu gugus alkil yang terikat pada atom nitrogen (RNH 2). • sekunder (2 ): memiliki dua gugus alkil yang terikat pada atom nitrogen (R 2 NH). • tersier (3 ): memiliki tiga gugus alkil yang terikat pada atom nitrogen (R 3 N). • kuarterner (4 ): memiliki empat gugus alkil yang terikat pada atom nitrogen dan + mengemban muatan positif (R 4 N ). 5

Contoh amina Primer (1º) Sekunder (2º) tersier (3º) 6

Nama umum 7

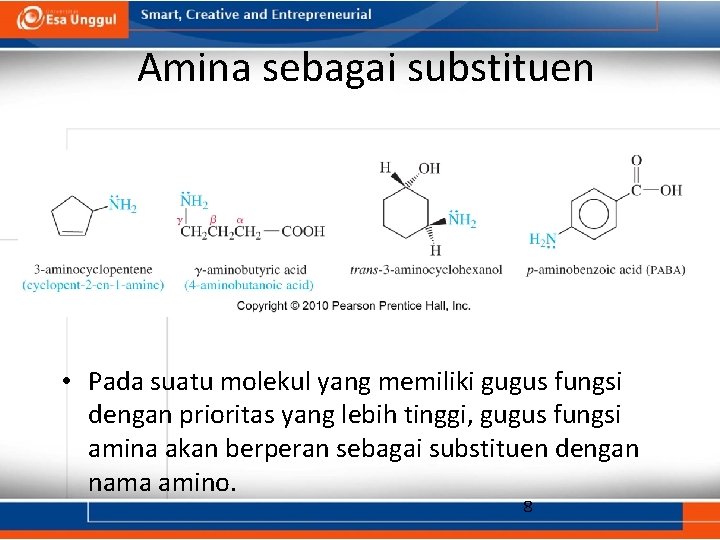
Amina sebagai substituen • Pada suatu molekul yang memiliki gugus fungsi dengan prioritas yang lebih tinggi, gugus fungsi amina akan berperan sebagai substituen dengan nama amino. 8

Nama IUPAC • Nama didasari oleh rantai karbon terpanjang. • Akhiran -e pada alkana diganti dengan -amina. • Substituen pada atom nitrogen diberi awalan N-. Br N H CH CH CH 2 2 3 3 -bromo-1 -pentanamine N(CH 3)2 CH 3 CH 2 CH 2 CH 3 N, N-dimethyl-3 -hexanamine 9

Amina aromatik • Pada amina aromatik, gugus amina terikat pada cincin benzena. • Senyawa induk dinamakan anilina. 10

Amina heterosiklik Dalam penamaan senyawa amina siklik, atom nitrogen ditandai sebagai posisi 1. 11

Struktur amina • Atom nitrogen memiliki hibridisasi sp 3 dengan satu pasangan elektron bebas. • Sudut ikatan kurang dari 109. 5º. 12

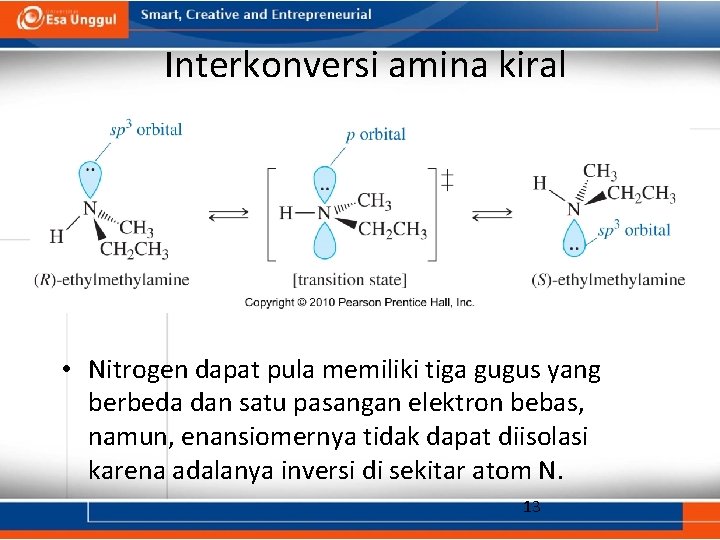
Interkonversi amina kiral • Nitrogen dapat pula memiliki tiga gugus yang berbeda dan satu pasangan elektron bebas, namun, enansiomernya tidak dapat diisolasi karena adalanya inversi di sekitar atom N. 13

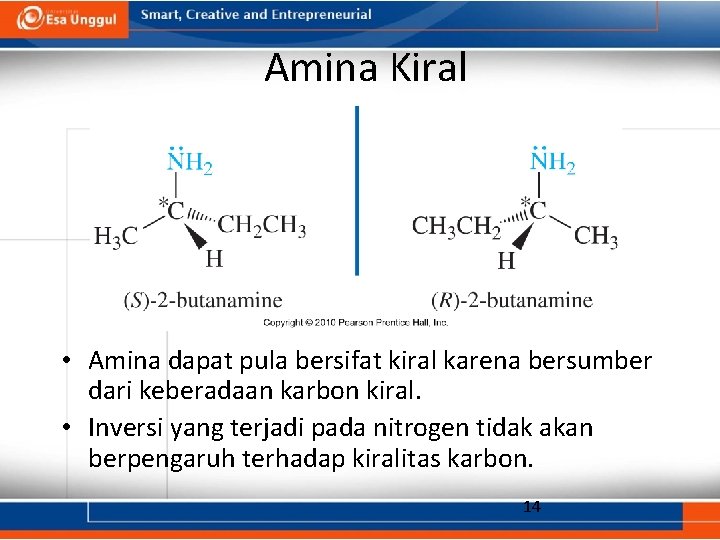
Amina Kiral • Amina dapat pula bersifat kiral karena bersumber dari keberadaan karbon kiral. • Inversi yang terjadi pada nitrogen tidak akan berpengaruh terhadap kiralitas karbon. 14

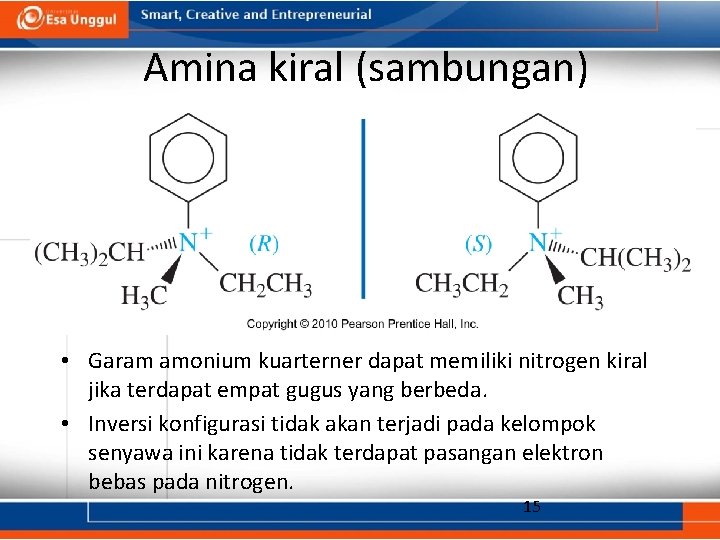
Amina kiral (sambungan) • Garam amonium kuarterner dapat memiliki nitrogen kiral jika terdapat empat gugus yang berbeda. • Inversi konfigurasi tidak akan terjadi pada kelompok senyawa ini karena tidak terdapat pasangan elektron bebas pada nitrogen. 15

Amina siklik kiral • Jika nitrogen berada pada suatu sistem cincin yang kecil, sistem ini akan mencegah pembentukan sudut ikatan sebesar 120° yang memungkin terjadinya inversi. • Senyawa semacam ini memiliki energi aktivasi inversi yang lebih tinggi sehingga memperlambat terjadinya inversi. 16

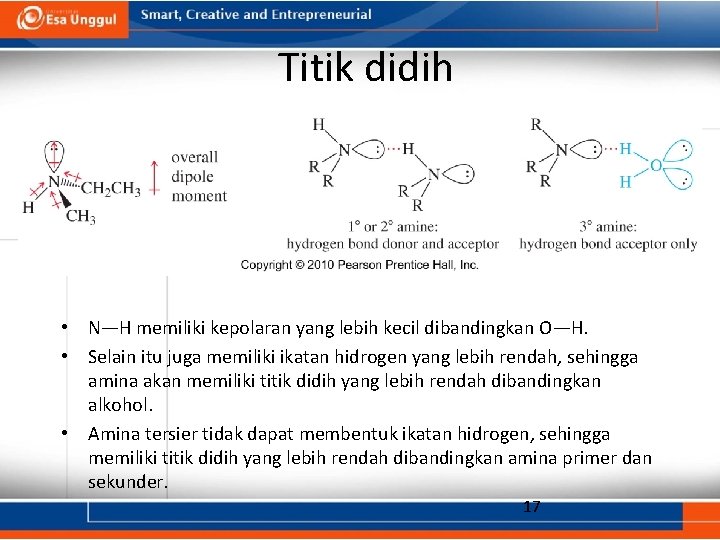
Titik didih • N—H memiliki kepolaran yang lebih kecil dibandingkan O—H. • Selain itu juga memiliki ikatan hidrogen yang lebih rendah, sehingga amina akan memiliki titik didih yang lebih rendah dibandingkan alkohol. • Amina tersier tidak dapat membentuk ikatan hidrogen, sehingga memiliki titik didih yang lebih rendah dibandingkan amina primer dan sekunder. 17

Kelarutan dan aroma • Amina yang kecil (< 6 C) biasanya larut dalam air. • Semua amina dapat membentuk ikatan hidrogen dengan air dan alkohol. • Percabangan pada senyawa amina meningkatkan kelarutan. • Sebagian besar amina memiliki bau seperti ikan busuk. NH 2 CH 2 CH 2 CH 2 NH 2 1, 5 -pentanadiamina atau kadaverin 18

Kebasaan Amina • Pasangan elektron bebas pada nitrogen dapat menerima satu proton dari suatu asam. • Larutan berair dari suatu amina juga bersifat basa terhadap kertas lakmus. • Amonia memiliki p. Kb = 4. 74 • Alkil amina biasanya merupakan basa yang lebih kuat dibandingkan amonia. • Peningkatan jumlah gugus alkil akan menurunkan tingkat solvasi ion, sehingga amina 2 dan 3 biasanya memiliki kebasaan yang sama dengan amina 1. 19

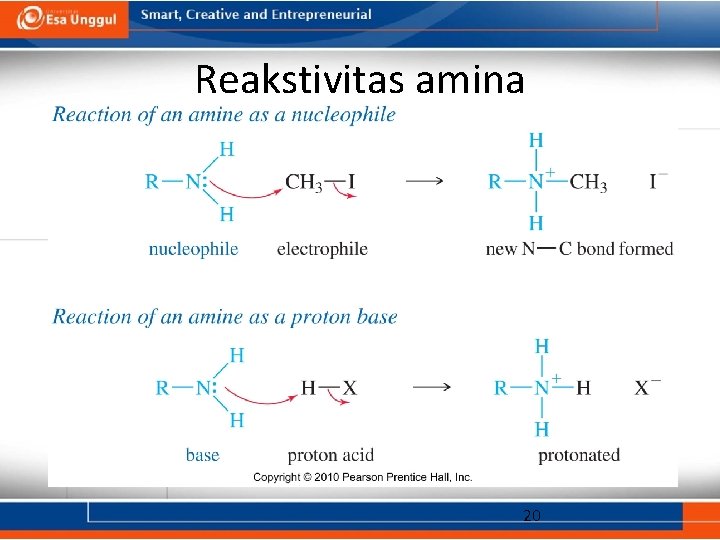
Reakstivitas amina 20

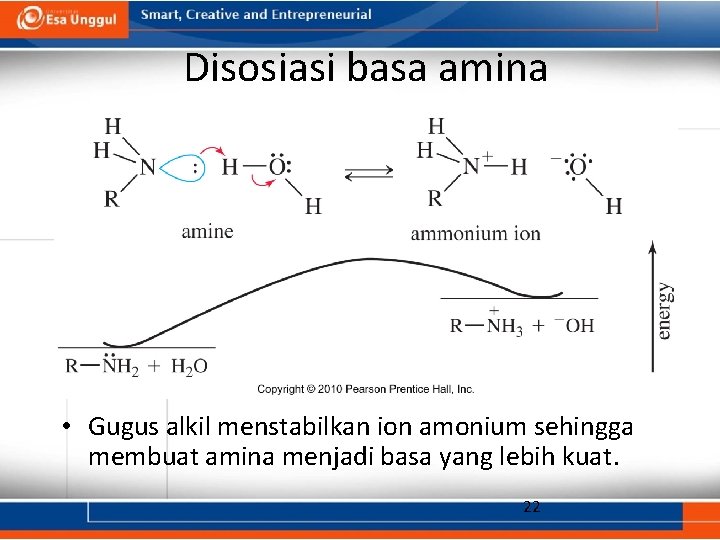
Konstanta disosiasi basa amina • Suatu amina dapat mengikat suatu proton dari molekul air, menghasilkan suatu ion amonium dan ion hidroksida. • Konstanta kesetimbangan untuk reaksi ini disebut konstanta disosiasi basa amina yang disimbolkan dengan K b. 21

Disosiasi basa amina • Gugus alkil menstabilkan ion amonium sehingga membuat amina menjadi basa yang lebih kuat. 22

Gugus alkil menstabilkan amina • Gugus alkil membuat nitrogen amina memiliki kebasaan yang lebih kuat dibandingkan amonia. 23

Efek resonansi • Delokalisasi pasangan elektron akan memperkecil kebasaan amina. 24

Protonasi pirol • Ketika nitrogen pirol diprotonasi, pirol kehilangan stabilitas aromatiknya. • Sehingga protonasi nitrogen menjadi tidak disukai dan pirol menjadi basa yang sangat lemah. 25

Efek hibridisasi • Piridin merupakan yang lebih lemah dibandingkan amina alifatik, namun relatif lebih bas dibandingkan pirol karena piridin tidak kehilangan aromatisasinya ketika terjadi protonasi nitrogen. 26

Garam amonium • Garam amonium merupakan padatan ionik dengan titik leleh yang tinggi. • Relatif larut dalam air. • Tidak memiliki bau busuk. 27

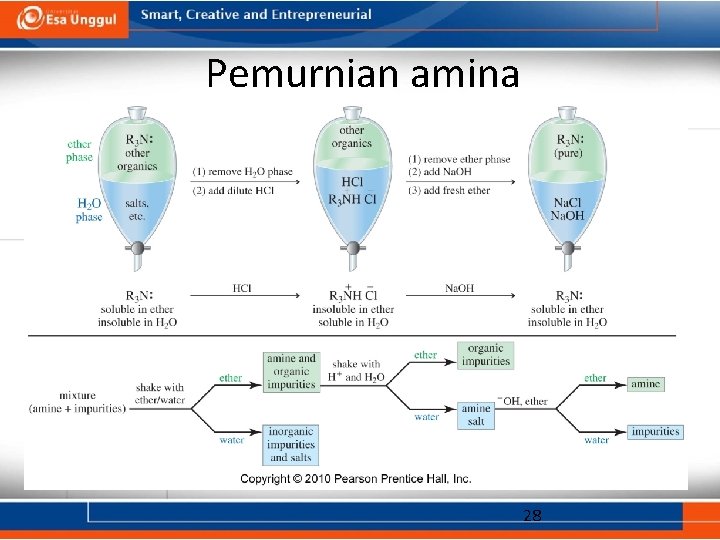
Pemurnian amina 28

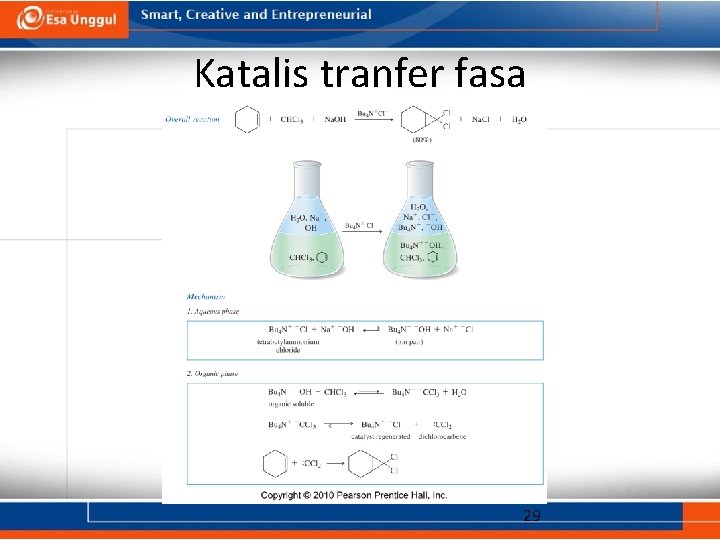
Katalis tranfer fasa 29

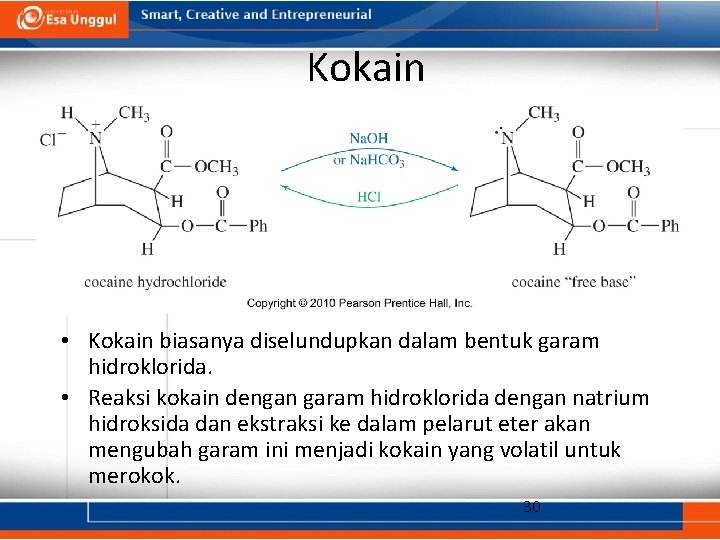
Kokain • Kokain biasanya diselundupkan dalam bentuk garam hidroklorida. • Reaksi kokain dengan garam hidroklorida dengan natrium hidroksida dan ekstraksi ke dalam pelarut eter akan mengubah garam ini menjadi kokain yang volatil untuk merokok. 30

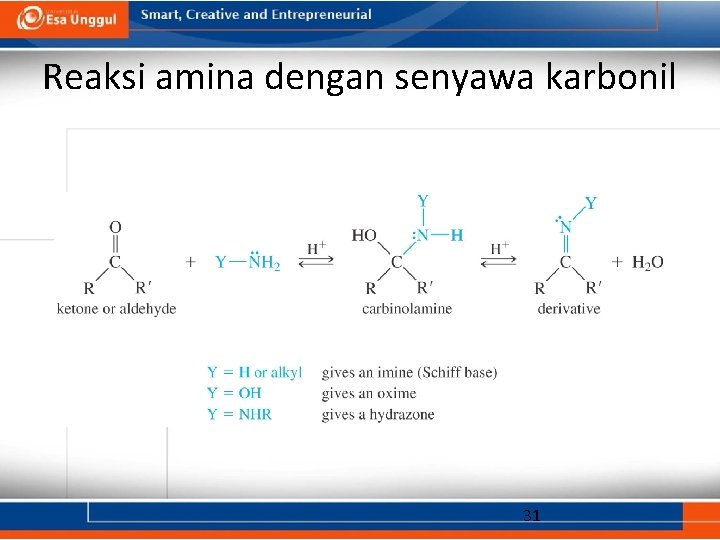
Reaksi amina dengan senyawa karbonil 31

Substitusi elektrofilik amonia • Gugus —NH 2 merupakan aktivator yang kuat, dan pengarah, ortho- dan para • Alkilasi anilina seringkali menghasilkan substitusi ganda. • Protonasi amina mengubah gugus amina menjadi amonium (—NH 3+) yang bersifat mendeaktivasi. • Nitrasi anilina akan menghasilkan ledakan. 32

Protonasi anilina dalam reaksi substitusi • Asam kuat akan memprotonasi gugus amina, menghasilkan garam amonium. • Gugus —NH 3+ merupakan gugus pendeaktivasi yang kuat (dan pengarah meta). • Sehingga asam kuat sangat tidak dianjurkan dalam reaksi substitusi anilina 33

Substitusi elektrofilik piridin • Keberadaan atom N sangat mendeaktivasi piridin. • Reaksi substitusi terjadi pada posisi 3 • Elektron pada N bereaksi dengan elektrofil. 34

Nucleophilic Substitution of Pyridine • terdeaktivasi terhadap serangan elektrofil. • Teraktivasi terhadap serangan nukleofil. • Nukleofil akan mensubstitusi gugus pergi yang bagus pada posisi 2 atau 4. 35

Mekanisme substitusi nukleofilik • Serangan pada posisi-3 tidak mengakibatkan N memiliki muatan negatif sehingga substitusi pada posisi 3 biasanya tidak teramati. 36

Alkilasi amina menggunakan alkil halida • Bahkan jika ditambahkan satu equivalen alkil halida, sebagian amina akan bereaksi sekali, sedangkan sebagian lain bereaksi dua hingga tiga kali (menghasilkan garam alkilamonium) 37

Asilasi amina • Amina primer dan sekunder bereaksi membentuk halida asam membentuk amida. • Reaksi ini merupakan reaksi substitusi asil nukleofilik. 38

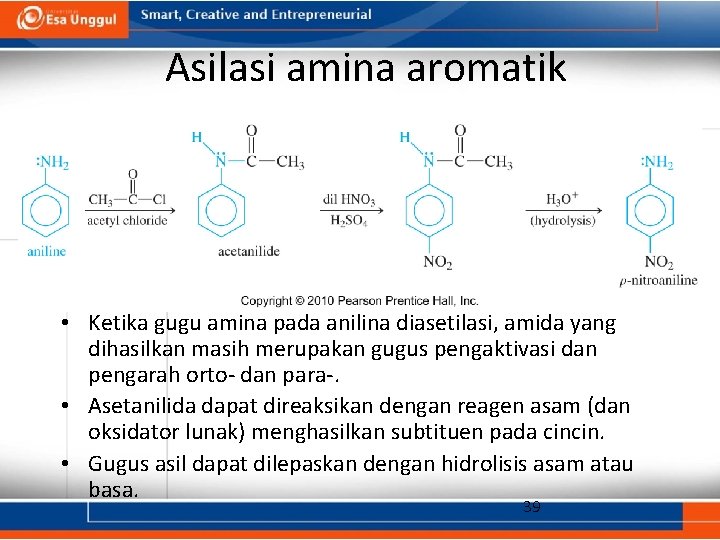
Asilasi amina aromatik • Ketika gugu amina pada anilina diasetilasi, amida yang dihasilkan masih merupakan gugus pengaktivasi dan pengarah orto- dan para-. • Asetanilida dapat direaksikan dengan reagen asam (dan oksidator lunak) menghasilkan subtituen pada cincin. • Gugus asil dapat dilepaskan dengan hidrolisis asam atau basa. 39

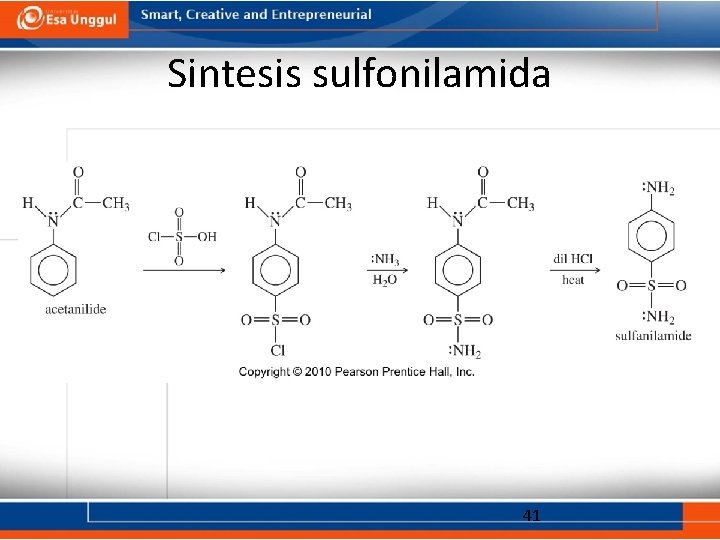
Pembentukan sulfonamida • Amina primer atau sekunder bereaksi dengan sulfonil klorida. 40

Sintesis sulfonilamida 41

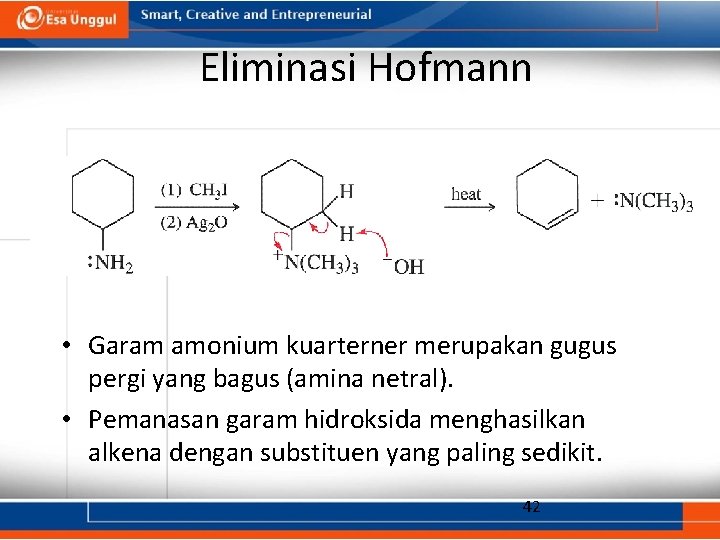
Eliminasi Hofmann • Garam amonium kuarterner merupakan gugus pergi yang bagus (amina netral). • Pemanasan garam hidroksida menghasilkan alkena dengan substituen yang paling sedikit. 42

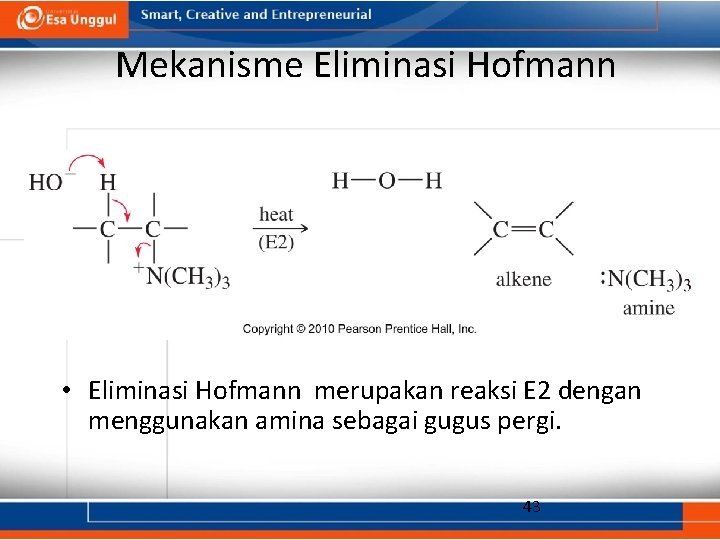
Mekanisme Eliminasi Hofmann • Eliminasi Hofmann merupakan reaksi E 2 dengan menggunakan amina sebagai gugus pergi. 43

Regioselektivitas Eliminasi Hofmann • Produk dengan substituen paling sedikit merupakan produk mayor dari reaksi Hofmann. 44

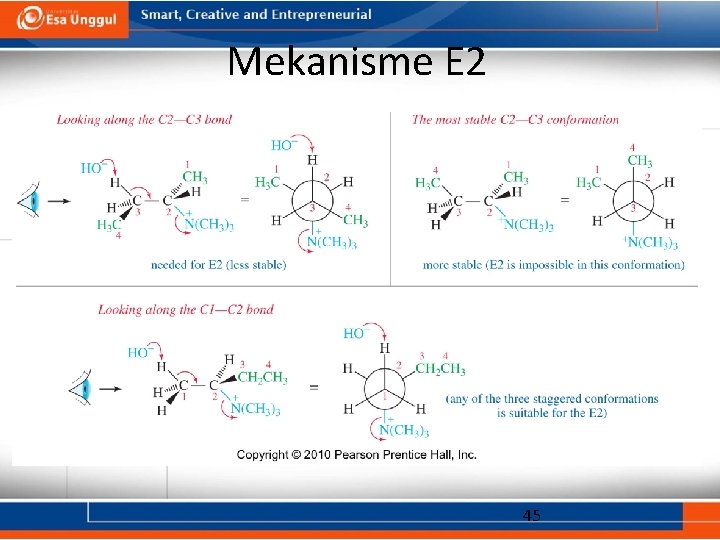
Mekanisme E 2 45

Oksidasi amina • • amina dapat dengan mudah teroksidasi bahakan di udara sekalipun. Oksidator yang paling umum digunakan adalah: H 2 O 2 , MCPBA. Amina 2 teroksidasi menghasilkan hidroksilamina (—NOH) Amina 3 teroksidasi menjadi amina oksida (R 3 N+—O-) 46

Preparasi amina oksida • Amina tersier teroksidasi menjadi amina oksida dan seringkali menghasilkan rendemen yang tinggi • Baik H 2 O 2 atau peroksida dapat digunakan dalam reaksi oksidasi ini. 47

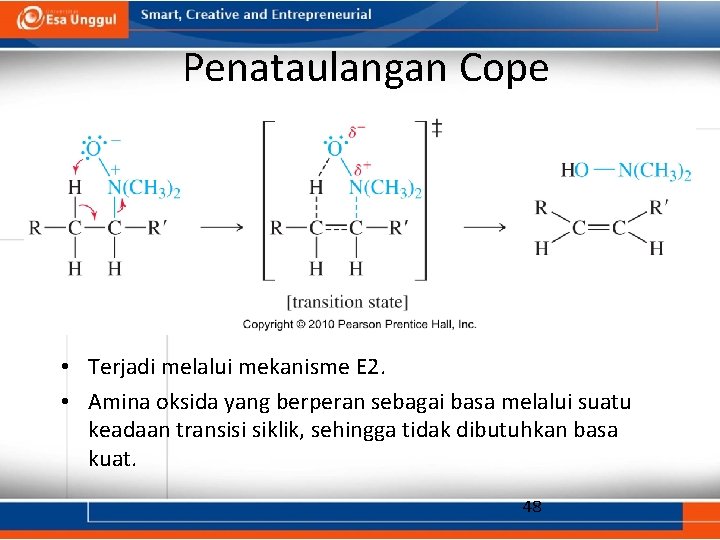
Penataulangan Cope • Terjadi melalui mekanisme E 2. • Amina oksida yang berperan sebagai basa melalui suatu keadaan transisi siklik, sehingga tidak dibutuhkan basa kuat. 48

Pembentukan garam Diazonium • Amina primer bereaksi dengan asam nitrit (HNO 2) membentuk garam dialkildiazonium. • Garam diazonium relatif tidak stabil dan terdekomposisi menjadi karbokation dan nitrogen. 49

Diazotisasi suatu amina Tahap 1: amina menyerang ion nitrosonium dan membentuk N-nitrosoamina Tahap 2: suatu transfer proton (tautomerisasi) terjadi dari nitrogen ke oksigen membentuk suatu gugus hidroksi dan ikatan N-N kedua. 50

Garam Arenediazonium • Dengan membentuk dan mendiazotisasi suatu amina aromatik, gugus ini bisa dikonversi menjadi gugus fungsi lain. 51

Reaksi garam Arenediazonium 52

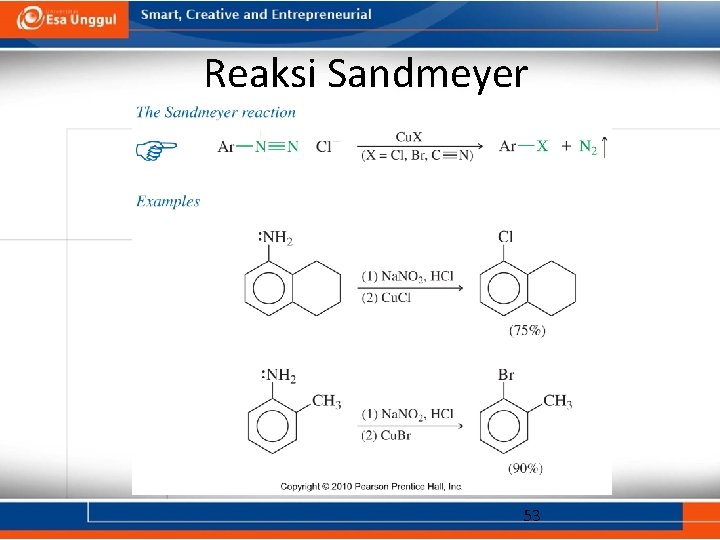
Reaksi Sandmeyer 53

Pembentukan N-Nitrosoamina • Amina sekunder bereaksi dengan asam nitrit (HNO 2) membentuk N-nitrosoamina. • N-nitrosoamina sekunder merupakan molekul stabil dan merupakan molekul karsinogen. 54

Aminasi reduktif: 1º Amina • Amina primer dapat diperoleh dari kondensasi hidroksilamina dengan suatu keton atau aldehida, diikuti dengan reduksi oksim. • Li. Al. H 4 atau Na. BH 3 CN dapat digunakan dalam reduksi oksim. 55

Aminasi reduktif: 2º Amina • Kondensasi suatu keton atau aldehida dengan amina primer akan menghasilkan imina ter-N-substitusi (suatu basa Schiff). • Reduksi imina ter-N-substitusi menghasilkan amina sekunder. 56

Aminasi reduktif: 3º Amina • Kondensasi suatu keton atau aldehida dengan amina sekunder menghasilkan garam iminium. • Garam iminium biasanya tidak stabil sehingga jarang dapat diisolasi. • Suatu reduktor dalam campuran reaksi ini akan mereduksi garam iminium menjadi suatu amina tersier 57

Sintesis amina 1º melalui asilasireduksi • Asilasi amina dengan suatu klorida asam akan menghasilkan suatu amida tanpa ada kecenderungan terjadi overasilasi. • Reduksi amina oleh Li. Al. H 4 menghasilkan amina yang sesuai. 58

Sintesis amina 2º melalui asilasireduksi • Asilasi-reduksi mengubah suatu amina primer menjadi amina sekunder. • Li. Al. H 4, diikuti dengan hidrolisis, dapat dengan mudah mereduksi intermediet amida menjadi amina. 59

Sintesis amina 3º melalui asilasireduksi • Asilasi-reduksi mengubah amina sekunder menjadi amina tersier. • Reduksi intermediet amida dapat dilakukan menggunakan Li. Al. H 4. 60

Sintesis Gabriel • Ion phthalimida merupakan nukleofil kuat, dan dapat mensubstitusi ion halida atau tosilat dari suatu substrat yang bagus untuk reaksi SN 2. • Pemanasan N-alkil phthalimida dengan hidrazin akan menggantikan amina primer menghasilkan turunan hidrazin yang stabil dari phthalimida. 61

Reduksi azida • Ion azida, N 3 -, merupakan suatu nukleofil yang bagus. • Ion azida dapat bereaksi dengan halida atau tosilat primer atau sekunder melalui mekanisme (SN 2). • Alkil azida mudah meledak sehingga tidak diisolasi. 62

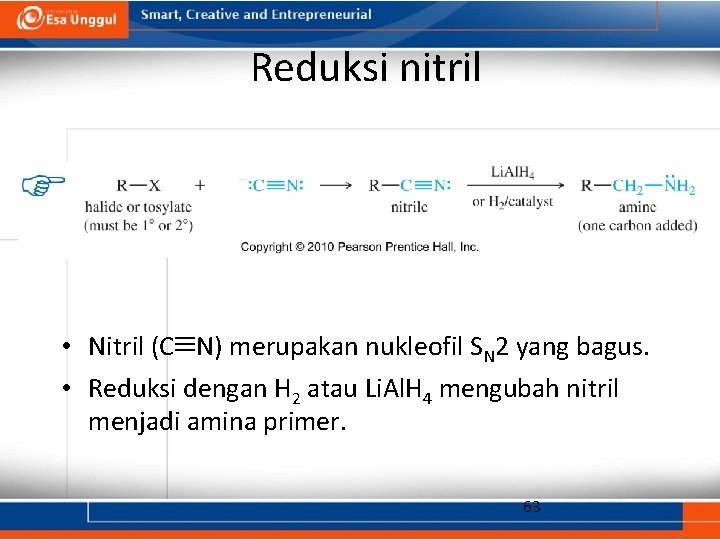
Reduksi nitril • Nitril (C N) merupakan nukleofil SN 2 yang bagus. • Reduksi dengan H 2 atau Li. Al. H 4 mengubah nitril menjadi amina primer. 63

Reduksi senyawa nitro • Gugus nitro dapat direduksi menjadi amina melalui hidrogenasi terkatalitik atau melalui logam aktif dan H+. • Umumnya digunakan untuk mensintesis anilina 64

Penataulangan Hofmann Amida • Pada keberadaan basa kuat, amida primer bereaksi dengan klorin atau bromin membentuk amina yang lebih pendek. Pemendekan ini dilakukan dengan menghilangkan karbonil. • Reaksi ini, disebut penataulangan Hofmann, biasanya digunakan untuk mensintesis amina primer dan amina aril. 65

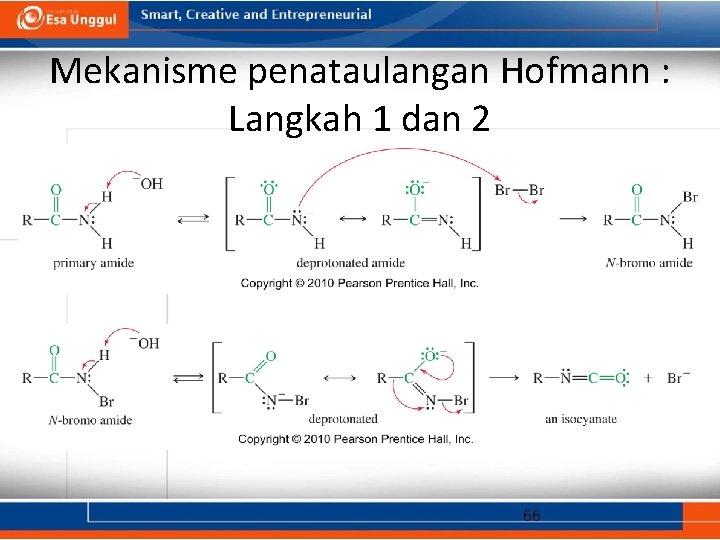
Mekanisme penataulangan Hofmann : Langkah 1 dan 2 66

Mekanisme penataulangan Hofmann : Langkah 3 dan 4 67

Sekian 68
 N-etil propilamina
N-etil propilamina Pertemuan multikultural
Pertemuan multikultural Sukrosa
Sukrosa Pada pertemuan kali ini kita
Pada pertemuan kali ini kita Tugas pertemuan 9 metode perancangan program
Tugas pertemuan 9 metode perancangan program Latihan soal struktur data pertemuan 4
Latihan soal struktur data pertemuan 4 Diketahui sebuah graph tak terarah memiliki 4 vertex
Diketahui sebuah graph tak terarah memiliki 4 vertex Denah ruang pertemuan
Denah ruang pertemuan Logo pertemuan
Logo pertemuan Tester
Tester Diagram batang
Diagram batang Tipe data int memiliki nilai jangkauan antara
Tipe data int memiliki nilai jangkauan antara Spk latihan pertemuan 6
Spk latihan pertemuan 6 Contoh hiperkorek pleonasme dan kontaminasi
Contoh hiperkorek pleonasme dan kontaminasi Penawaran elastis uniter terjadi jika
Penawaran elastis uniter terjadi jika Pertemuan 9
Pertemuan 9 Pendekatan kontribusi adalah
Pendekatan kontribusi adalah Sell adalah pertemuan antara
Sell adalah pertemuan antara Sel adalah pertemuan antara titik-titik dan titik-titik
Sel adalah pertemuan antara titik-titik dan titik-titik Tugas statistika pertemuan 2
Tugas statistika pertemuan 2 Perbezaan etika dan etiket
Perbezaan etika dan etiket Pertemuan awal pkh adalah
Pertemuan awal pkh adalah Dr sead dizdarevic tuzla
Dr sead dizdarevic tuzla 2 metil butanamina
2 metil butanamina Amina ahmed md
Amina ahmed md Amina ka matlab
Amina ka matlab Amina secundaria ejemplos
Amina secundaria ejemplos Cahg nomenclatura
Cahg nomenclatura Amina nikolajev
Amina nikolajev Etil fenilamina
Etil fenilamina Amina nh
Amina nh Amina kilpatrick
Amina kilpatrick Amina
Amina Sead dizdarevic profesor
Sead dizdarevic profesor Amina vs amida
Amina vs amida Amina hussein height
Amina hussein height Amina biogena
Amina biogena Amina rwakunda
Amina rwakunda Gugus amina
Gugus amina Fenildimetilamina
Fenildimetilamina Amina boubendir
Amina boubendir Etil propil amina
Etil propil amina Amina mustafa
Amina mustafa Büyük menderes nerede
Büyük menderes nerede Trimetilamina
Trimetilamina Espectro ir
Espectro ir Gugus amida
Gugus amida Ch3chnh
Ch3chnh Burnard 1991
Burnard 1991 Amina akbar
Amina akbar Amina ejemplos
Amina ejemplos Amina
Amina Coy amina show
Coy amina show Amina data labs
Amina data labs Tia amina
Tia amina Nombres uiqpa
Nombres uiqpa Amina vasoativa
Amina vasoativa Amina slide that branches to different events
Amina slide that branches to different events Grupo nitro
Grupo nitro Coy amina model
Coy amina model Amina ka matlab
Amina ka matlab Amina purak
Amina purak Aminas biogenas neurotransmisores
Aminas biogenas neurotransmisores