Oxidation primrer Alkohole V Redoxreaktion zwischen Ethanol und




- Slides: 11

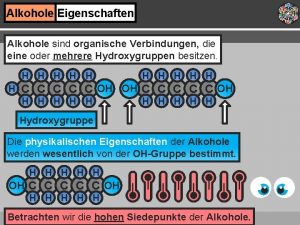
Oxidation primärer Alkohole V: Redoxreaktion zwischen Ethanol und schwarzem Kupferoxid Cu. O B: Taucht man heißes, mit schwarzem Kupferoxid überzogenes Kupferblech in Ethanol, so wird das Blech blank. E: Das Kupferoxid ist zu Kupfer reduziert worden. Ethanol wird von dem schwachen Oxidationsmittel Kupferoxid zum Aldehyd Ethanal oxidiert. Ethanol gibt zwei Elektronen an das Kupferion Cu 2+ ab. Edukte und Produkte formulieren!

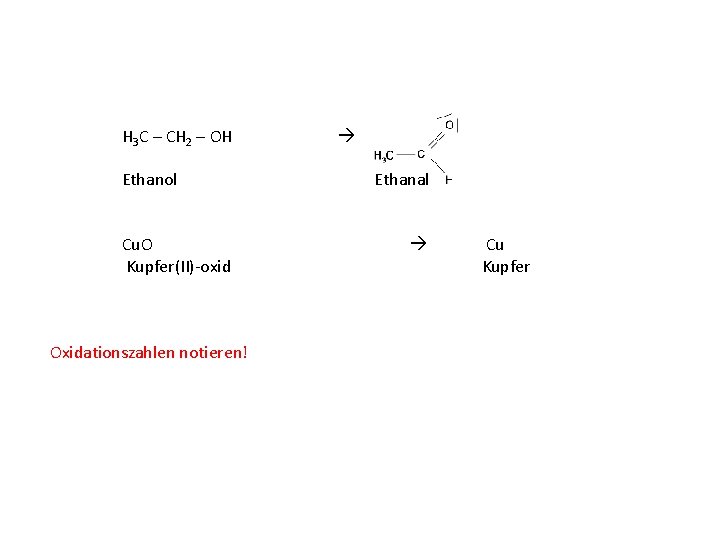
Ethanol Ethanal Kupfer(II)-oxid Kupfer Formeln aufstellen!

H 3 C – CH 2 – OH Ethanol Ethanal Cu. O Kupfer(II)-oxid Oxidationszahlen notieren! Cu Kupfer

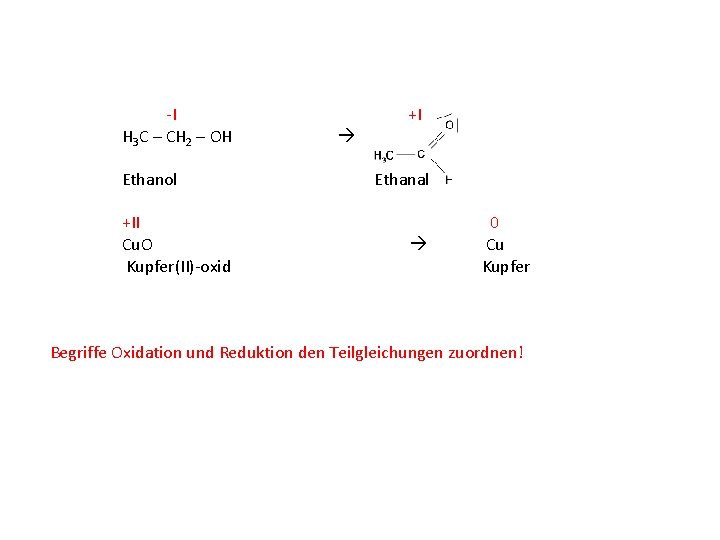
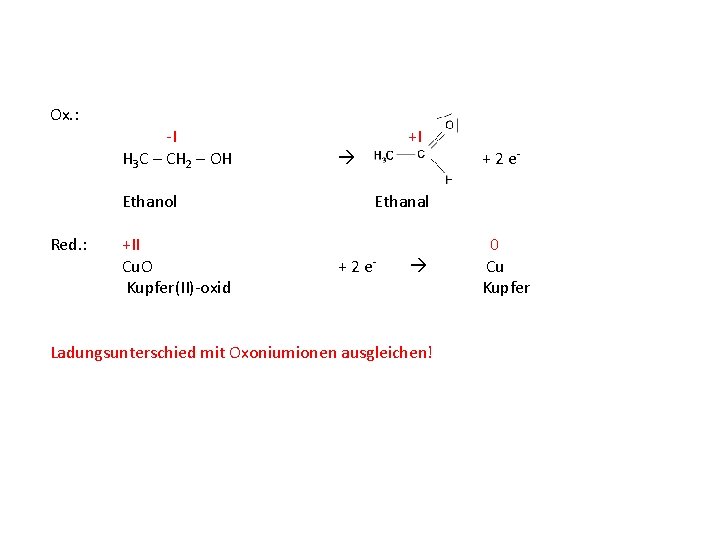
-I +I H 3 C – CH 2 – OH Ethanol +II Cu. O Kupfer(II)-oxid Ethanal 0 Cu Kupfer Begriffe Oxidation und Reduktion den Teilgleichungen zuordnen!

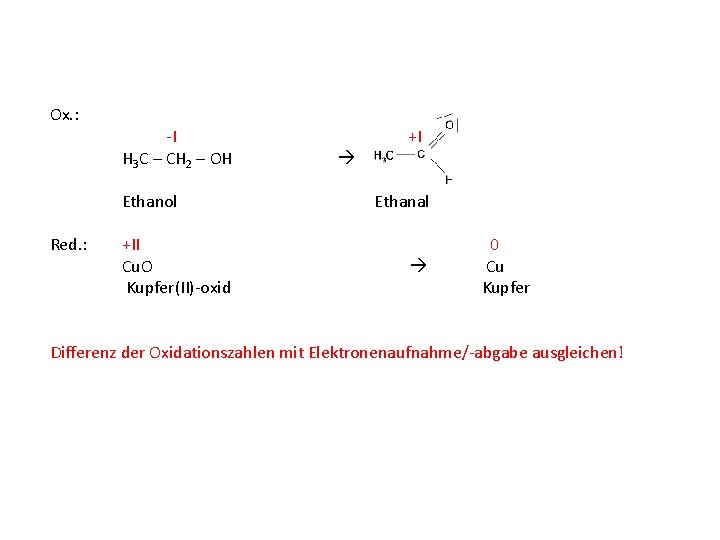
Ox. : -I +I H 3 C – CH 2 – OH Ethanol Red. : +II Cu. O Kupfer(II)-oxid Ethanal 0 Cu Kupfer Differenz der Oxidationszahlen mit Elektronenaufnahme/-abgabe ausgleichen!

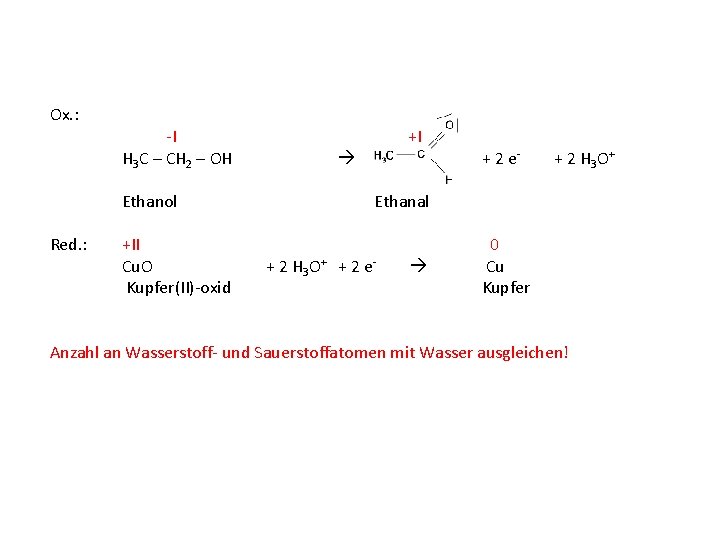
Ox. : -I +I H 3 C – CH 2 – OH Ethanol Red. : +II Cu. O Kupfer(II)-oxid + 2 e- Ethanal + 2 e- Ladungsunterschied mit Oxoniumionen ausgleichen! 0 Cu Kupfer

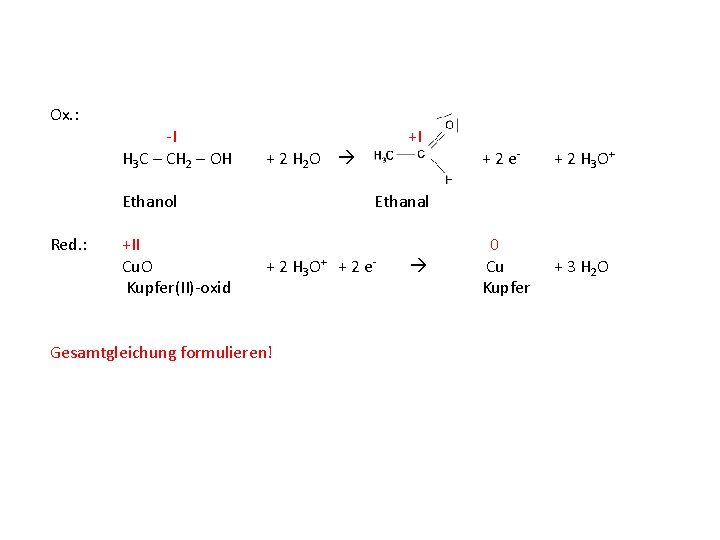
Ox. : -I +I H 3 C – CH 2 – OH Ethanol Red. : +II Cu. O Kupfer(II)-oxid + 2 e- + 2 H 3 O+ Ethanal + 2 H 3 O+ + 2 e- 0 Cu Kupfer Anzahl an Wasserstoff- und Sauerstoffatomen mit Wasser ausgleichen!

Ox. : -I +I H 3 C – CH 2 – OH + 2 H 2 O Ethanol Red. : +II Cu. O Kupfer(II)-oxid + 2 e- + 2 H 3 O+ 0 Cu Kupfer + 3 H 2 O Ethanal + 2 H 3 O+ + 2 e- Gesamtgleichung formulieren!

Redox. : -I +II +I H 3 C – CH 2 – OH + Cu. O + 2 H 2 O + 2 H 3 O+ + 2 e- Ethanol Kupfer(II)-oxid Kürzen! 0 +Cu + 3 H 2 O+ 2 e- + 2 H 3 O+ Ethanal. Kupfer

Oxidation primärer Alkohole V: Redoxreaktion zwischen Ethanol und schwarzem Kupferoxid Cu. O B: Taucht man heißes, mit schwarzem Kupferoxid überzogenes Kupferblech in Ethanol, so wird das Blech blank. E: Das Kupferoxid ist zu Kupfer reduziert worden. Ethanol wird von dem schwachen Oxidationsmittel Kupferoxid zum Aldehyd Ethanal oxidiert. Ethanol gibt zwei Elektronen an das Kupferion Cu 2+ ab. Redox. : H 3 C - CH 2 - OH Ethanol + Cu. O Kupfer(II)-oxid H 3 C – CHO Ethanal + Cu Kupfer + H 2 O

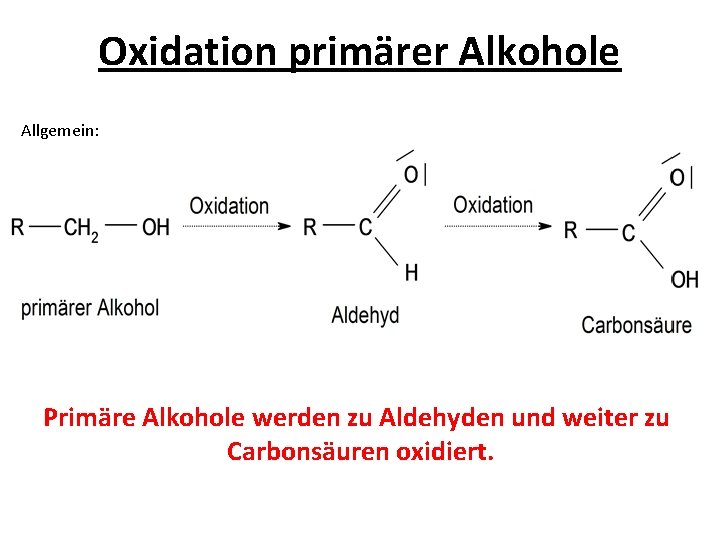
Oxidation primärer Alkohole Allgemein: Primäre Alkohole werden zu Aldehyden und weiter zu Carbonsäuren oxidiert.