Kleine Unterschiede groe Folgen Funktionelle Gruppen Teil 1






- Slides: 15

Kleine Unterschiede – große Folgen: Funktionelle Gruppen Teil 1: Alkanole, Alkanale, Alkanone, Carbonsäuren (Übersicht) 11/22/2020 © Manfred Amann Seite 1

Es muss nicht immer CH sein – SCHON geht auch! Alkan-Moleküle bestehen – wie wir bereits wissen – nur aus Kohlenstoff- und Wasserstoff-Atomen (C und H). Beispiel links: Methan, CH 4 Organische Verbindungen können aber (grundsätzlich) alle Elemente enthalten. Die Wichtigsten: Sauerstoff (O), Stickstoff (N) und Schwefel (S). Mit C und H ein Merkwort: SCHON! Einfaches Beispiel zum O-Atom: „Trink-Alkohol“ = Ethanol, CH 3 CH 2 OH 11/22/2020 © Manfred Amann Seite 2

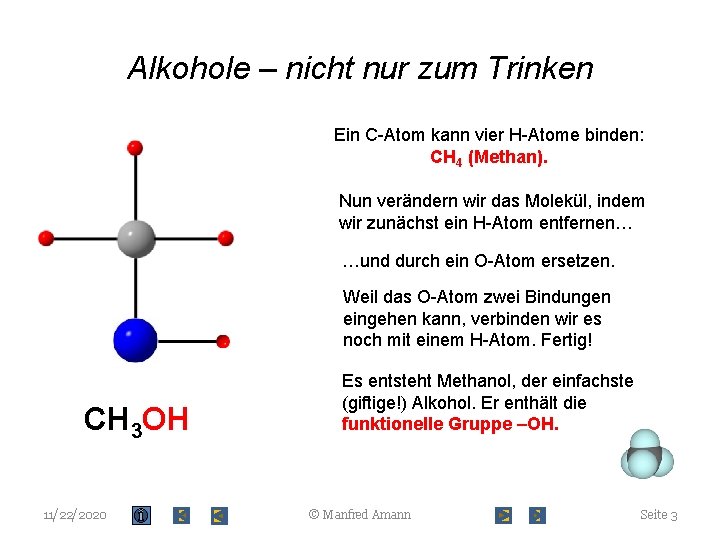
Alkohole – nicht nur zum Trinken Ein C-Atom kann vier H-Atome binden: CH 4 (Methan). Nun verändern wir das Molekül, indem wir zunächst ein H-Atom entfernen… …und durch ein O-Atom ersetzen. Weil das O-Atom zwei Bindungen eingehen kann, verbinden wir es noch mit einem H-Atom. Fertig! CH 3 OH 11/22/2020 Es entsteht Methanol, der einfachste (giftige!) Alkohol. Er enthält die funktionelle Gruppe –OH. © Manfred Amann Seite 3

Noch mehr Alkohole: CH 3 CH 2 OH oder C 2 H 5 OH Ethanol („Ethylalkohol“) CH 3 CH 2 OH oder C 3 H 7 OH Propanol („Propylalkohol“) CH 3 CH 2 CH 2 OH oder C 4 H 9 OH Butanol („Butylalkohol“) Diese Alkohole können von den entsprechenden Alkanen abgeleitet werden. Deshalb nennen wir sie korrekt Alkanole. Sie bilden – wie die Alkane, Alkene und Alkine – eine Homologe Reihe mit der allgemeinen Formel Cn. H 2 n+1 OH Es gibt aber auch Alkohole mit mehreren OH-Gruppen – Alkandiole, Alkantriole usw. Bekanntestes Beispiel: Glycerin (Propantriol, 3 C-Atome - 3 OH-Gruppen). Grundsätzlich kann also jedes C-Atom der Kette (maximal!) eine OH-Gruppe binden. Auch andere, z. B. ungesättigte Verbindungen können OH-Gruppen enthalten. Beispiel: C 6 H 5 OH (Phenol, aromatischer Alkohol). 11/22/2020 © Manfred Amann Seite 4

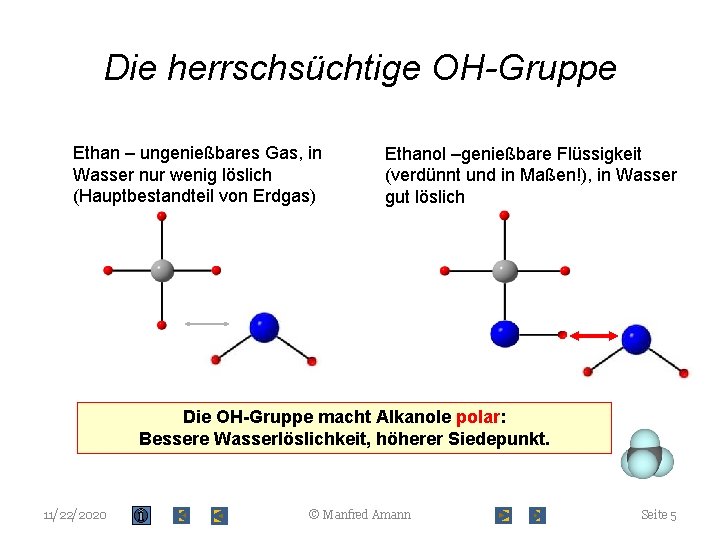
Die herrschsüchtige OH-Gruppe Ethan – ungenießbares Gas, in Wasser nur wenig löslich (Hauptbestandteil von Erdgas) Ethanol –genießbare Flüssigkeit (verdünnt und in Maßen!), in Wasser gut löslich Die OH-Gruppe macht Alkanole polar: Bessere Wasserlöslichkeit, höherer Siedepunkt. 11/22/2020 © Manfred Amann Seite 5

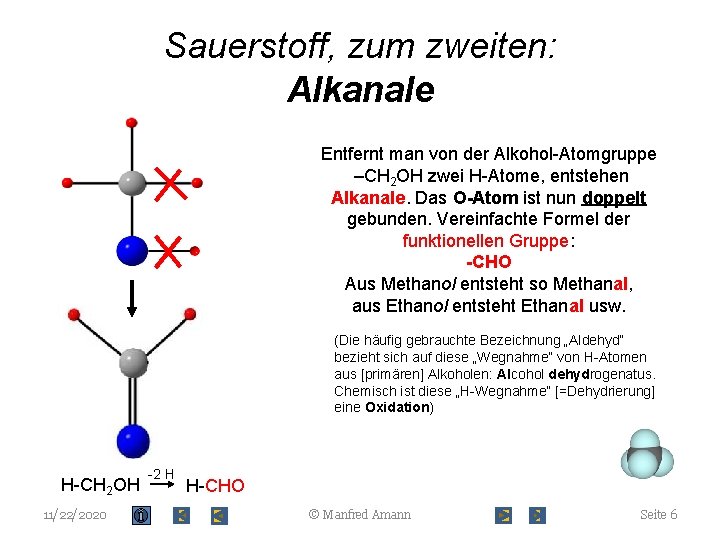
Sauerstoff, zum zweiten: Alkanale Entfernt man von der Alkohol-Atomgruppe –CH 2 OH zwei H-Atome, entstehen Alkanale. Das O-Atom ist nun doppelt gebunden. Vereinfachte Formel der funktionellen Gruppe: -CHO Aus Methanol entsteht so Methanal, aus Ethanol entsteht Ethanal usw. (Die häufig gebrauchte Bezeichnung „Aldehyd“ bezieht sich auf diese „Wegnahme“ von H-Atomen aus [primären] Alkoholen: Alcohol dehydrogenatus. Chemisch ist diese „H-Wegnahme“ [=Dehydrierung] eine Oxidation) H-CH 2 OH 11/22/2020 -2 H H-CHO © Manfred Amann Seite 6

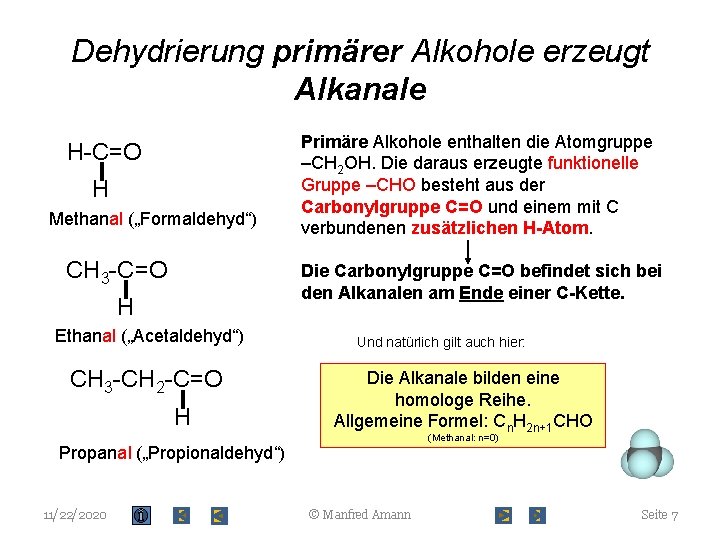
Dehydrierung primärer Alkohole erzeugt Alkanale H-C=O H Methanal („Formaldehyd“) CH 3 -C=O Primäre Alkohole enthalten die Atomgruppe –CH 2 OH. Die daraus erzeugte funktionelle Gruppe –CHO besteht aus der Carbonylgruppe C=O und einem mit C verbundenen zusätzlichen H-Atom. Die Carbonylgruppe C=O befindet sich bei den Alkanalen am Ende einer C-Kette. H Ethanal („Acetaldehyd“) CH 3 -CH 2 -C=O H Und natürlich gilt auch hier: Die Alkanale bilden eine homologe Reihe. Allgemeine Formel: Cn. H 2 n+1 CHO (Methanal: n=0) Propanal („Propionaldehyd“) 11/22/2020 © Manfred Amann Seite 7

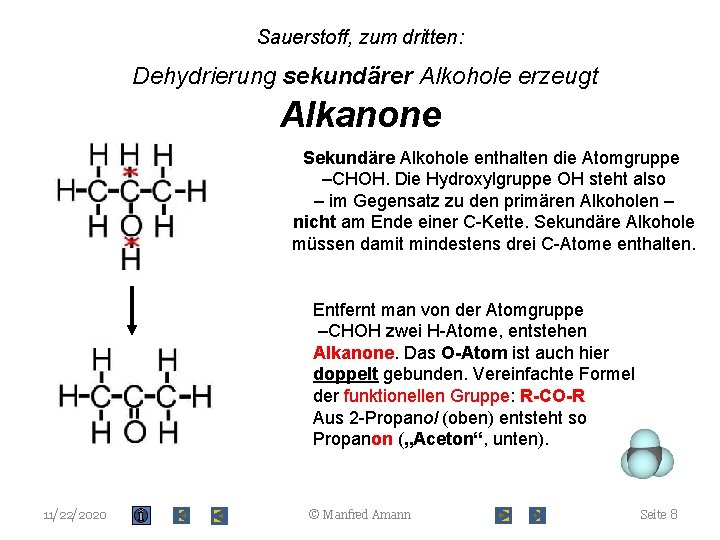
Sauerstoff, zum dritten: Dehydrierung sekundärer Alkohole erzeugt Alkanone Sekundäre Alkohole enthalten die Atomgruppe –CHOH. Die Hydroxylgruppe OH steht also – im Gegensatz zu den primären Alkoholen – nicht am Ende einer C-Kette. Sekundäre Alkohole müssen damit mindestens drei C-Atome enthalten. Entfernt man von der Atomgruppe –CHOH zwei H-Atome, entstehen Alkanone. Das O-Atom ist auch hier doppelt gebunden. Vereinfachte Formel der funktionellen Gruppe: R-CO-R Aus 2 -Propanol (oben) entsteht so Propanon („Aceton“, unten). 11/22/2020 © Manfred Amann Seite 8

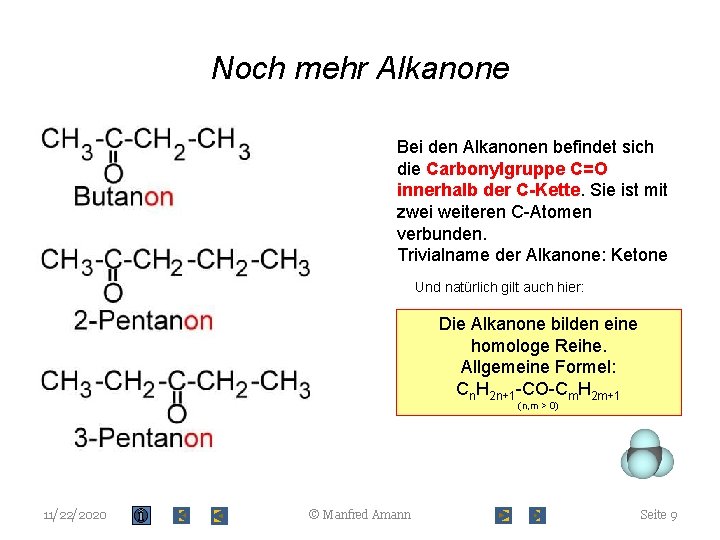
Noch mehr Alkanone Bei den Alkanonen befindet sich die Carbonylgruppe C=O innerhalb der C-Kette. Sie ist mit zwei weiteren C-Atomen verbunden. Trivialname der Alkanone: Ketone Und natürlich gilt auch hier: Die Alkanone bilden eine homologe Reihe. Allgemeine Formel: Cn. H 2 n+1 -CO-Cm. H 2 m+1 (n, m > 0) 11/22/2020 © Manfred Amann Seite 9

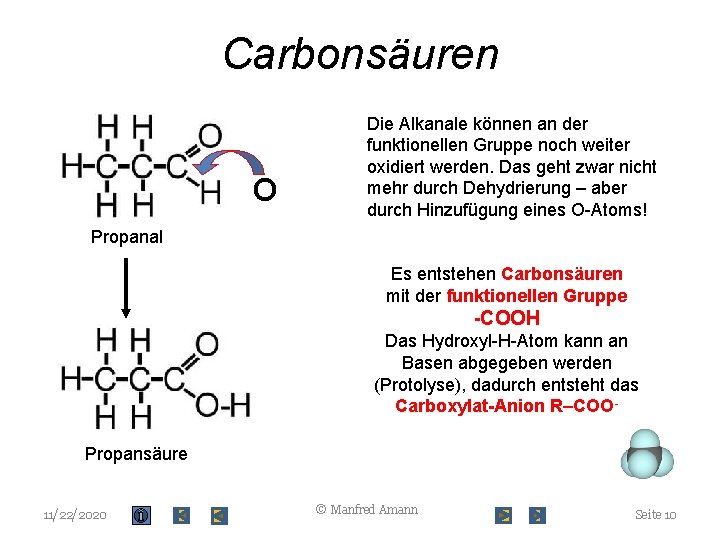
Carbonsäuren O Die Alkanale können an der funktionellen Gruppe noch weiter oxidiert werden. Das geht zwar nicht mehr durch Dehydrierung – aber durch Hinzufügung eines O-Atoms! Propanal Es entstehen Carbonsäuren mit der funktionellen Gruppe -COOH Das Hydroxyl-H-Atom kann an Basen abgegeben werden (Protolyse), dadurch entsteht das Carboxylat-Anion R–COOPropansäure 11/22/2020 © Manfred Amann Seite 10

Noch mehr Carbonsäuren… H-COOH CH 3 -COOH C 3 H 7 COOH C 15 H 31 COOH Methansäure (Ameisensäure) Ethansäure (Essigsäure) Butansäure (Buttersäure) Hexadecansäure (Palmitinsäure) Die Carbonsäuren (in unseren Beispielen: Alkansäuren) bilden ebenfalls eine homologe Reihe. Allgemeine Formel der Alkansäuren: Cn. H 2 n+1 COOH Methansäure: n=0 Es gibt auch Carbonsäuren mit mehreren Carboxylgruppen COOH, z. B. die Citronensäure (drei Carboxylgruppen) oder die Oxalsäure (sie besteht sogar ausschließlich aus zwei Carboxylgruppen). Außer den Alkansäuren können auch andere, z. B. ungesättigte organische Verbindungen Carboxylgruppen enthalten. Beispiel: C 6 H 5 COOH (Benzoesäure). 11/22/2020 © Manfred Amann Seite 11

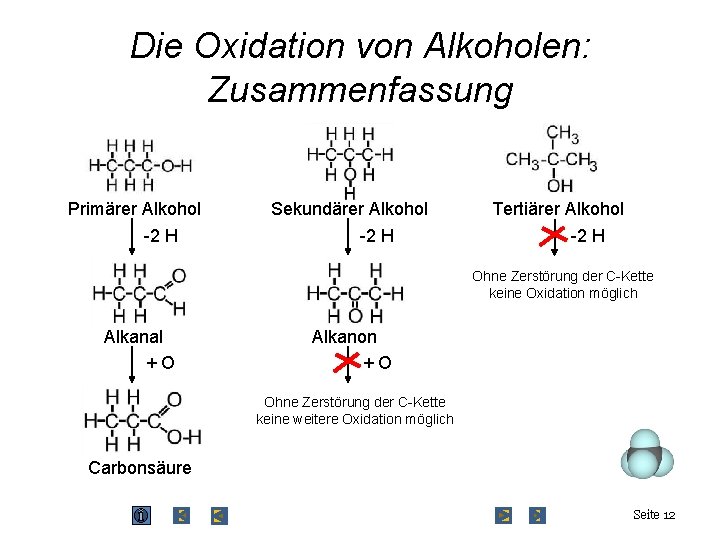
Die Oxidation von Alkoholen: Zusammenfassung Primärer Alkohol -2 H Sekundärer Alkohol -2 H Tertiärer Alkohol -2 H Ohne Zerstörung der C-Kette keine Oxidation möglich Alkanal +O Alkanon +O Ohne Zerstörung der C-Kette keine weitere Oxidation möglich Carbonsäure Seite 12

Aufgaben: Warum sind Alkohole und Carbonsäuren in Wasser erheblich besser löslich als Alkane mit der gleichen Zahl von C-Atomen? Weil sie die Atomgruppe OH enthalten. Diese ist polar und ähnelt der OHGruppe im Wassermolekül („Gleiches löst sich in Gleichem“) Geben Sie die vereinfachten Strukturformeln von 1 -Hexanol, 2 -Heptanol, Butanal, 3 -Hexanon und Pentansäure an. C 6 H 13 OH, CH 3 -CHOH-C 5 H 11, C 3 H 7 CHO, C 2 H 5 -CO-C 3 H 7, C 4 H 9 COOH Geben Sie in derselben Reihenfolge die Verbindungen an, die durch höchstmögliche Oxidation (ohne Zerstörung der C-Kette) aus den folgenden Verbindungen entstehen: 1 -Pentanol, 4 -Octanol, Ethanal, Methanol, 2 -Pentanon, Hexanal, 2 -Methyl-2 -Butanol. Pentansäure, 4 -Octanon, Ethansäure, Methansäure, keine Oxidation möglich, Hexansäure, keine Oxidation möglich. Warum können Alkanone nicht zu den entsprechenden Alkansäuren, tertiäre Alkohole nicht zu den entsprechenden Alkanalen oxidiert werden? Weil für diese Oxidation Bindungen zwischen den C-Atomen gelöst werden müssten. 11/22/2020 © Manfred Amann Seite 13

Übersicht Alkohole Start Alkanale Ende Alkanone Zurück Carbonsäuren Oxidation: Zusammenfassung Aufgaben 11/22/2020 © Manfred Amann Seite 14

Vielen Dank. Empfehlung für Ihre Aufmerksamkeit!. . . und noch eine Buchempfehlung in eigener Sache: Manfred Amann: Chemie für Kids bhv-Verlag, 312 Seiten, € 17, 95 / s. FR 31, 80 ISBN 3 -8266 -1639 -6 Aus dem Klappentext: „Ab 10 Jahre, aber auch für Erwachsene, die eine wirklich einfache Einführung suchen und ihr Wissen auffrischen möchten. “ 11/22/2020 © Manfred Amann Seite 15
 Funktionelle gruppen
Funktionelle gruppen Funktionelle gruppen
Funktionelle gruppen Funktionelle gruppen chemie
Funktionelle gruppen chemie Teil 1 teil 2
Teil 1 teil 2 Sarah groe
Sarah groe Michael groe
Michael groe Weltwirtschaftskrise 1929 ursachen und folgen
Weltwirtschaftskrise 1929 ursachen und folgen Schutzeinrichtungen an maschinen beispiel
Schutzeinrichtungen an maschinen beispiel Begegnen dativ oder akk
Begegnen dativ oder akk Ameisenstaat aufbau
Ameisenstaat aufbau Aldehyde und ketone
Aldehyde und ketone Unterschiede moschee und kirche
Unterschiede moschee und kirche Literatur der jahrhundertwende autoren
Literatur der jahrhundertwende autoren Kulturelle unterschiede deutschland finnland
Kulturelle unterschiede deutschland finnland Kulturelle unterschiede china deutschland
Kulturelle unterschiede china deutschland Zapfkopf unterschiede
Zapfkopf unterschiede