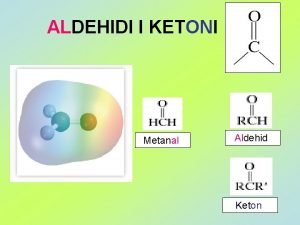
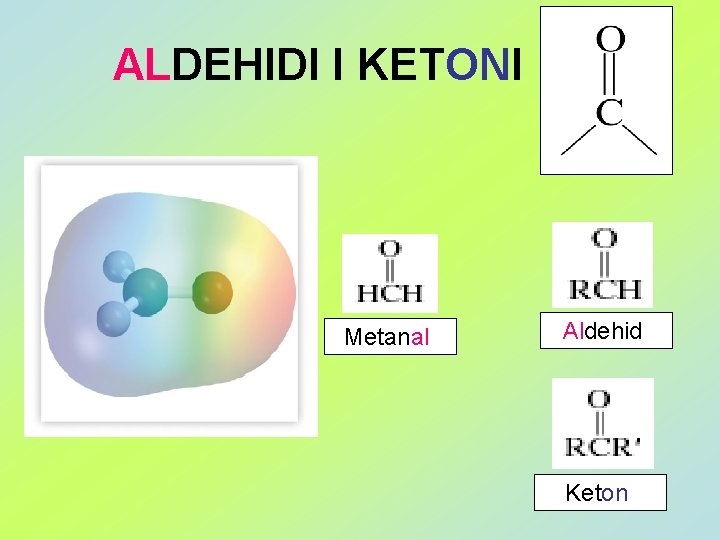
ALDEHIDI I KETONI Metanal Aldehid Keton Metanal Etanal





- Slides: 43

ALDEHIDI I KETONI Metanal Aldehid Keton

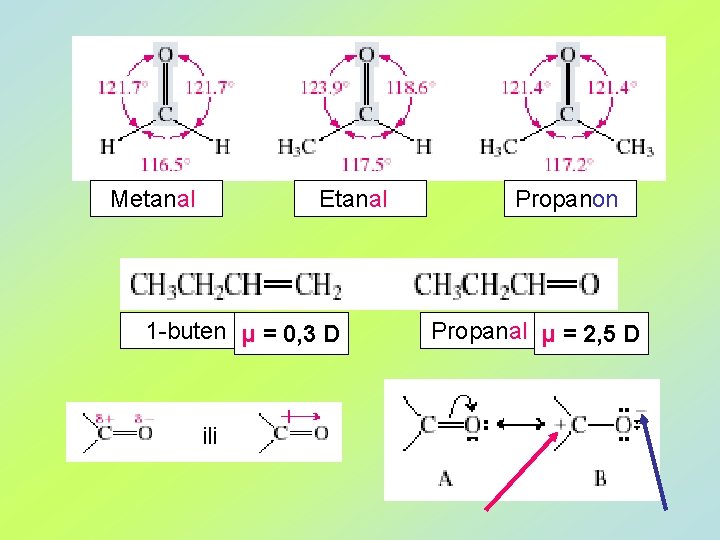
Metanal Etanal 1 -buten μ = 0, 3 D ili Propanon Propanal μ = 2, 5 D

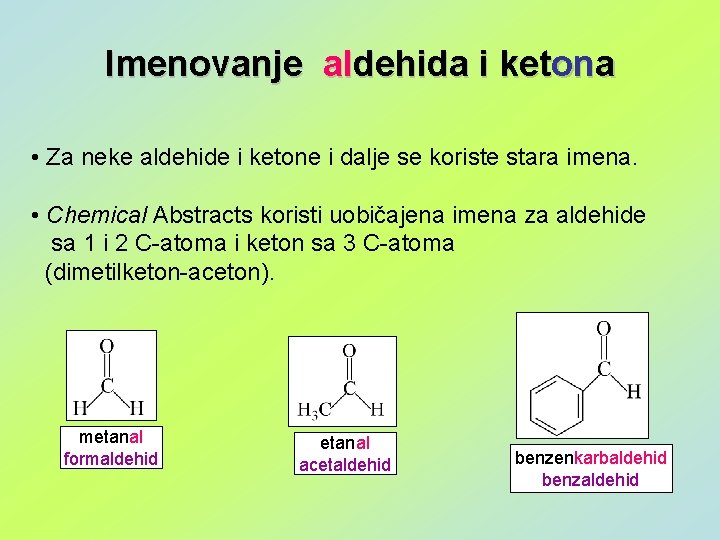
Imenovanje aldehida i ketona • Za neke aldehide i ketone i dalje se koriste stara imena. • Chemical Abstracts koristi uobičajena imena za aldehide sa 1 i 2 C-atoma i keton sa 3 C-atoma (dimetilketon-aceton). metanal formaldehid etanal acetaldehid benzenkarbaldehid benzaldehid

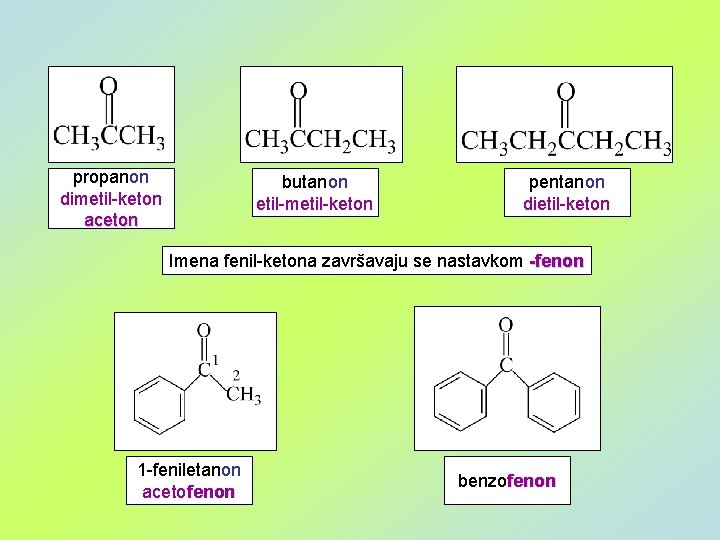
propanon dimetil-keton aceton butanon etil-metil-keton pentanon dietil-keton Imena fenil-ketona završavaju se nastavkom -fenon 1 -feniletanon acetofenon benzofenon

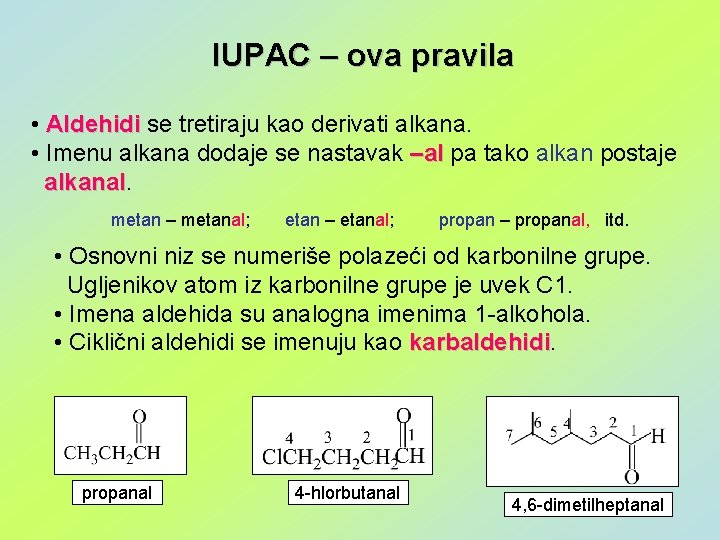
IUPAC – ova pravila • Aldehidi se tretiraju kao derivati alkana. • Imenu alkana dodaje se nastavak –al pa tako alkan postaje alkanal metan – metanal; etan – etanal; propan – propanal, itd. • Osnovni niz se numeriše polazeći od karbonilne grupe. Ugljenikov atom iz karbonilne grupe je uvek C 1. • Imena aldehida su analogna imenima 1 -alkohola. • Ciklični aldehidi se imenuju kao karbaldehidi propanal 4 -hlorbutanal 4, 6 -dimetilheptanal

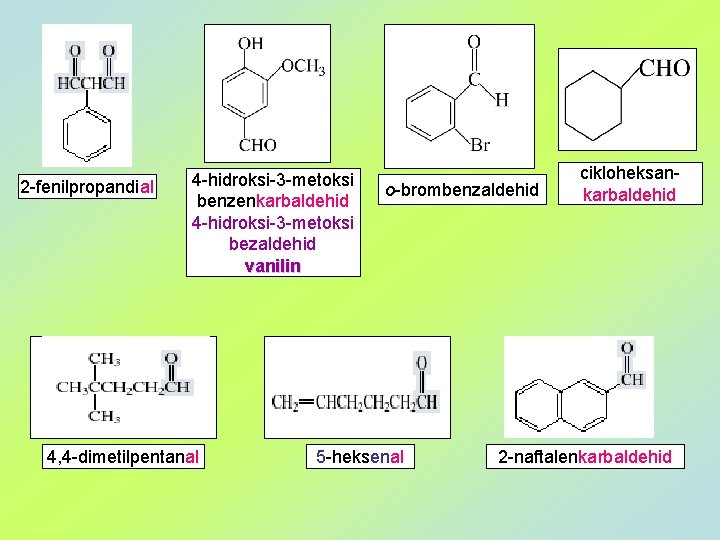
2 -fenilpropandial 4 -hidroksi-3 -metoksi benzenkarbaldehid 4 -hidroksi-3 -metoksi bezaldehid vanilin 4, 4 -dimetilpentanal o-brombenzaldehid 5 -heksenal cikloheksankarbaldehid 2 -naftalenkarbaldehid

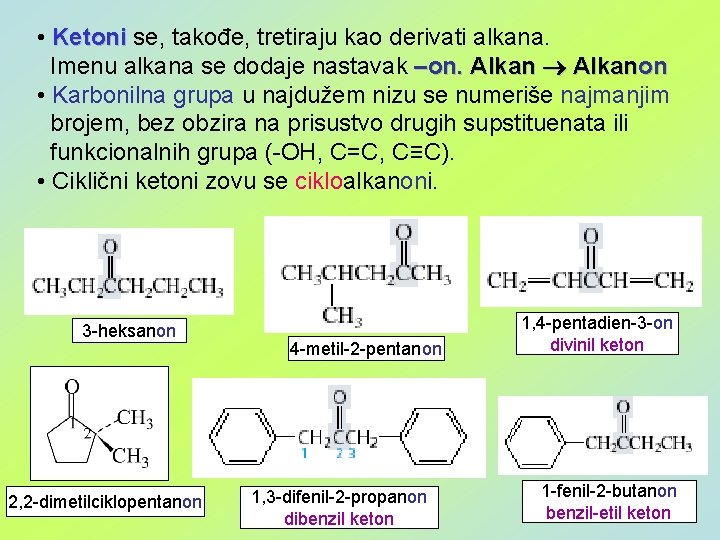
• Ketoni se, takođe, tretiraju kao derivati alkana. Imenu alkana se dodaje nastavak –on. Alkanon • Karbonilna grupa u najdužem nizu se numeriše najmanjim brojem, bez obzira na prisustvo drugih supstituenata ili funkcionalnih grupa (-OH, C=C, C≡C). • Ciklični ketoni zovu se cikloalkanoni. 3 -heksanon 2, 2 -dimetilciklopentanon 4 -metil-2 -pentanon 1, 3 -difenil-2 -propanon dibenzil keton 1, 4 -pentadien-3 -on divinil keton 1 -fenil-2 -butanon benzil-etil keton

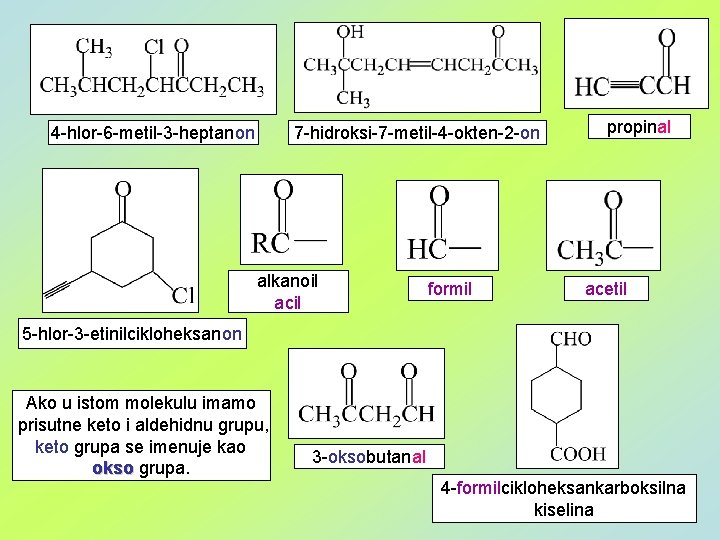
4 -hlor-6 -metil-3 -heptanon 7 -hidroksi-7 -metil-4 -okten-2 -on alkanoil acil formil propinal acetil 5 -hlor-3 -etinilcikloheksanon Ako u istom molekulu imamo prisutne keto i aldehidnu grupu, keto grupa se imenuje kao okso grupa. 3 -oksobutanal 4 -formilcikloheksankarboksilna kiselina

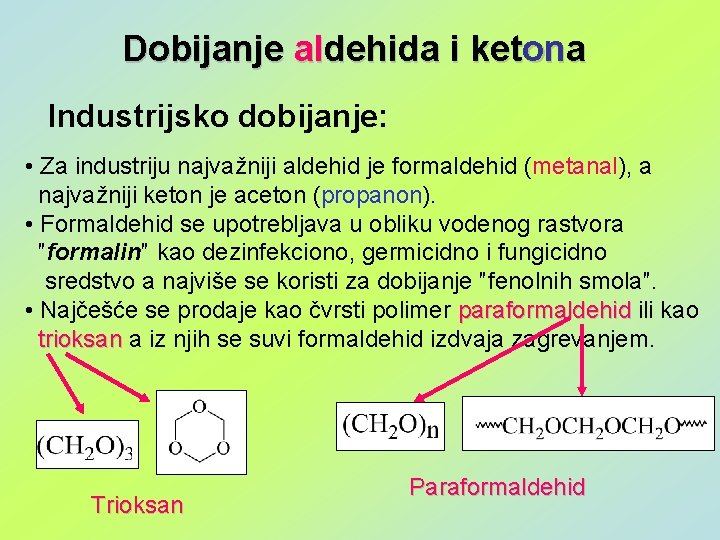
Dobijanje aldehida i ketona Industrijsko dobijanje: • Za industriju najvažniji aldehid je formaldehid (metanal), a najvažniji keton je aceton (propanon). • Formaldehid se upotrebljava u obliku vodenog rastvora ″formalin″ kao dezinfekciono, germicidno i fungicidno sredstvo a najviše se koristi za dobijanje ″fenolnih smola″. • Najčešće se prodaje kao čvrsti polimer paraformaldehid ili kao trioksan a iz njih se suvi formaldehid izdvaja zagrevanjem. Trioksan Paraformaldehid

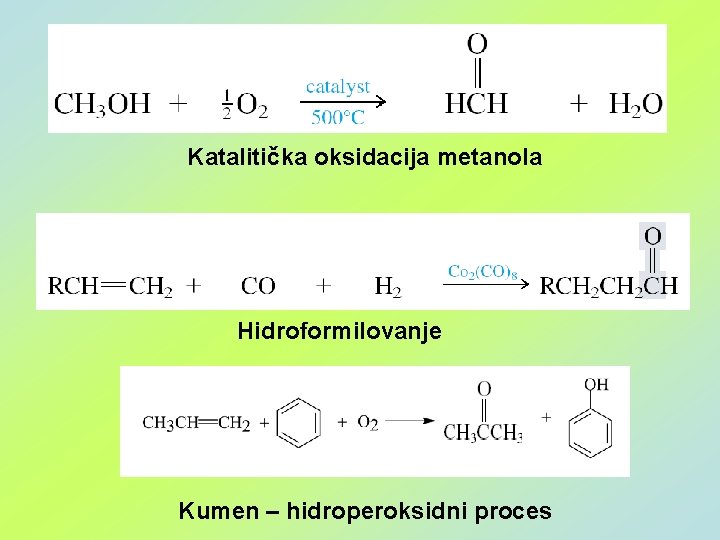
Katalitička oksidacija metanola Hidroformilovanje Kumen – hidroperoksidni proces

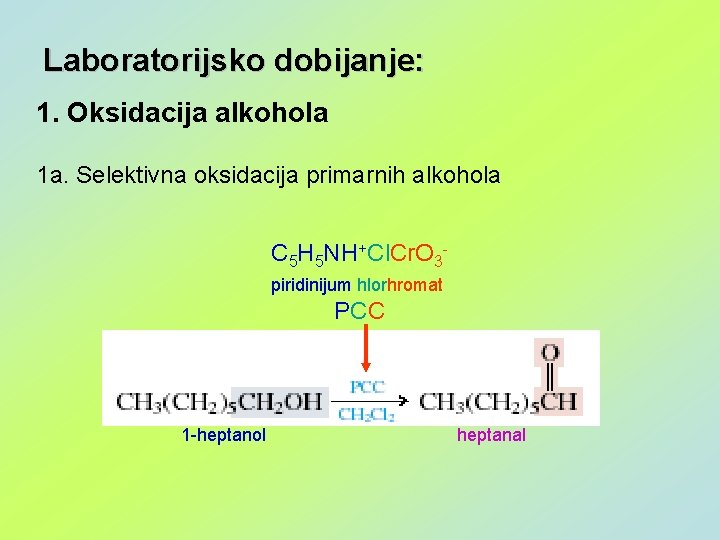
Laboratorijsko dobijanje: 1. Oksidacija alkohola 1 a. Selektivna oksidacija primarnih alkohola C 5 H 5 NH+Cl. Cr. O 3 piridinijum hlorhromat PCC 1 -heptanol heptanal

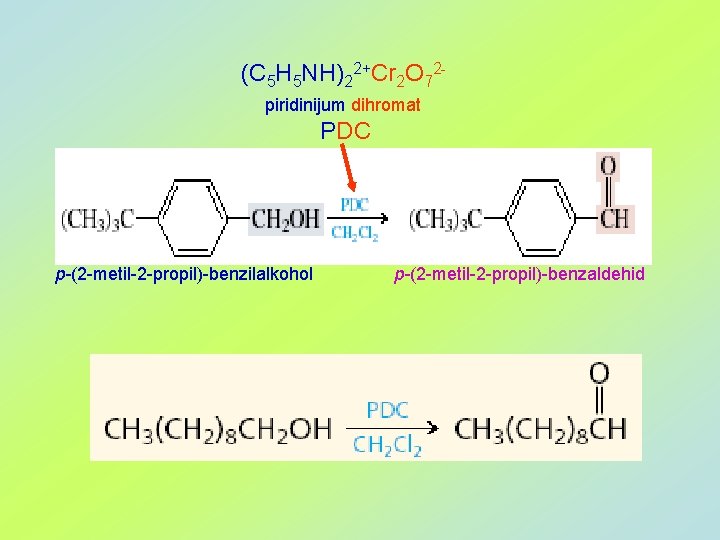
(C 5 H 5 NH)22+Cr 2 O 72 piridinijum dihromat PDC p-(2 -metil-2 -propil)-benzilalkohol p-(2 -metil-2 -propil)-benzaldehid

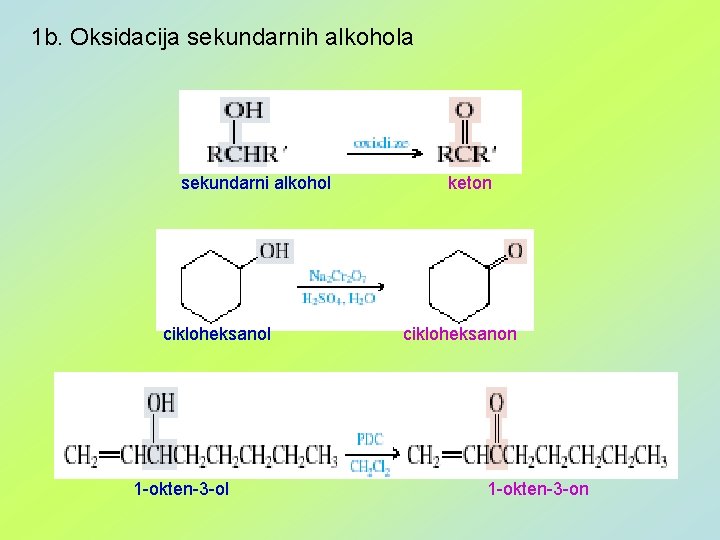
1 b. Oksidacija sekundarnih alkohola sekundarni alkohol cikloheksanol 1 -okten-3 -ol keton cikloheksanon 1 -okten-3 -on

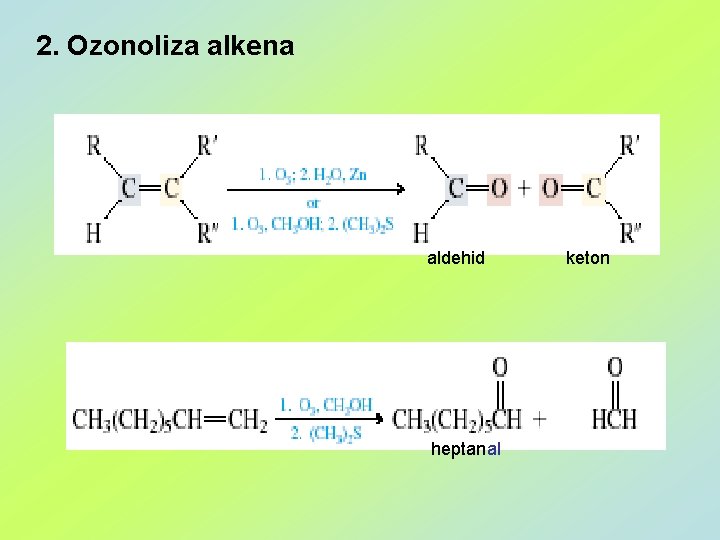
2. Ozonoliza alkena aldehid heptanal keton

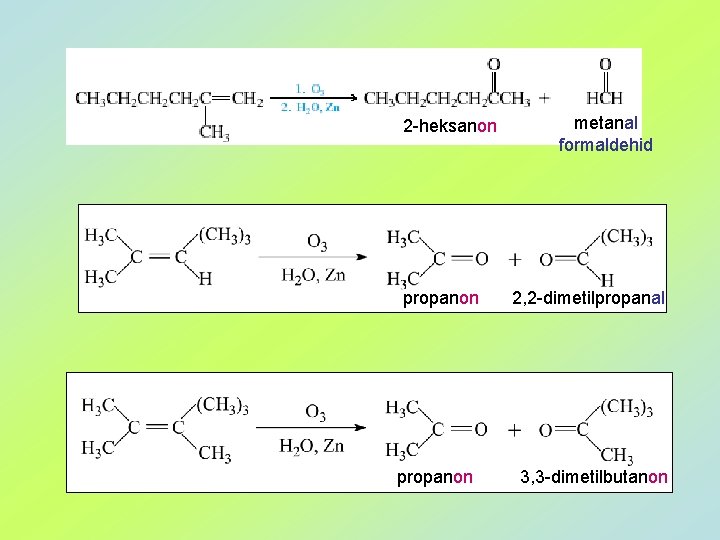
2 -heksanon propanon metanal formaldehid 2, 2 -dimetilpropanal 3, 3 -dimetilbutanon

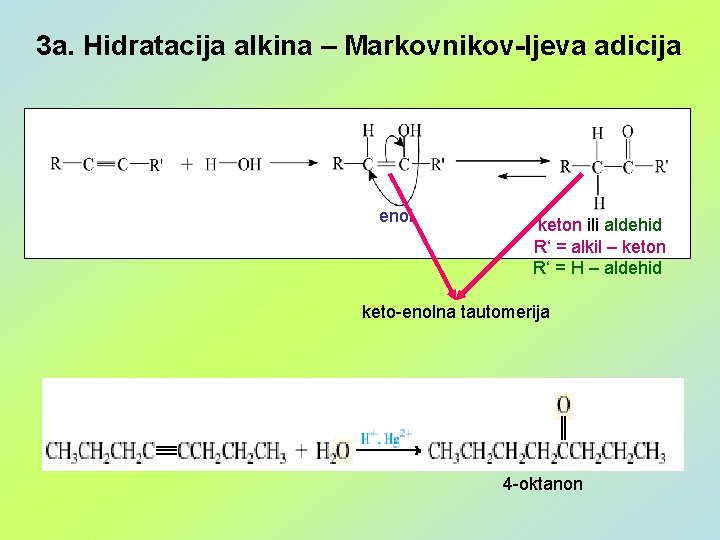
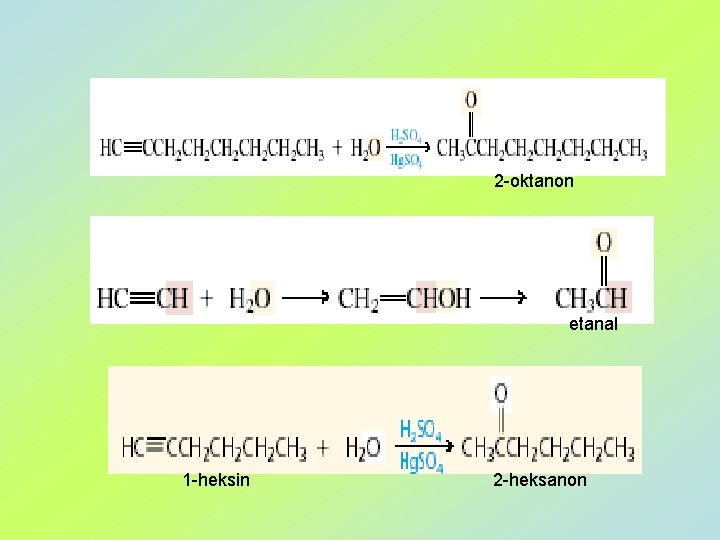
3 a. Hidratacija alkina – Markovnikov-ljeva adicija enol keton ili aldehid R‘ = alkil – keton R‘ = H – aldehid keto-enolna tautomerija 4 -oktanon

2 -oktanon etanal 1 -heksin 2 -heksanon

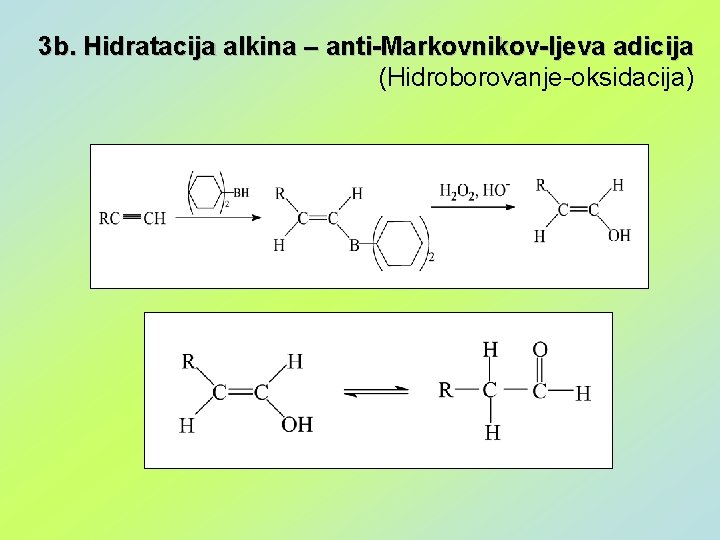
3 b. Hidratacija alkina – anti-Markovnikov-ljeva adicija (Hidroborovanje-oksidacija)

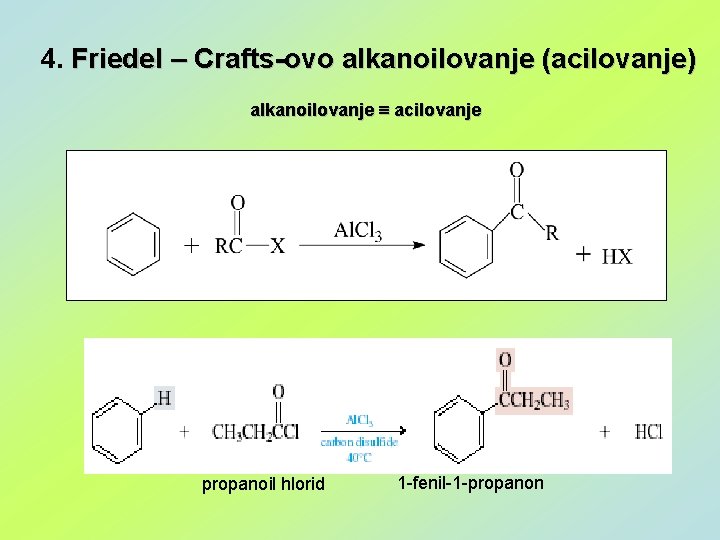
4. Friedel – Crafts-ovo alkanoilovanje (acilovanje) alkanoilovanje acilovanje propanoil hlorid 1 -fenil-1 -propanon

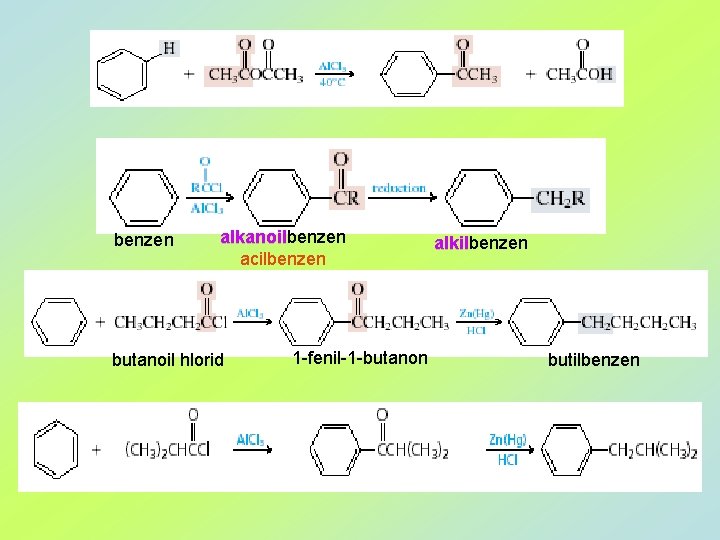
benzen alkanoil acilbenzen butanoil hlorid 1 -fenil-1 -butanon alkilbenzen alkil butilbenzen

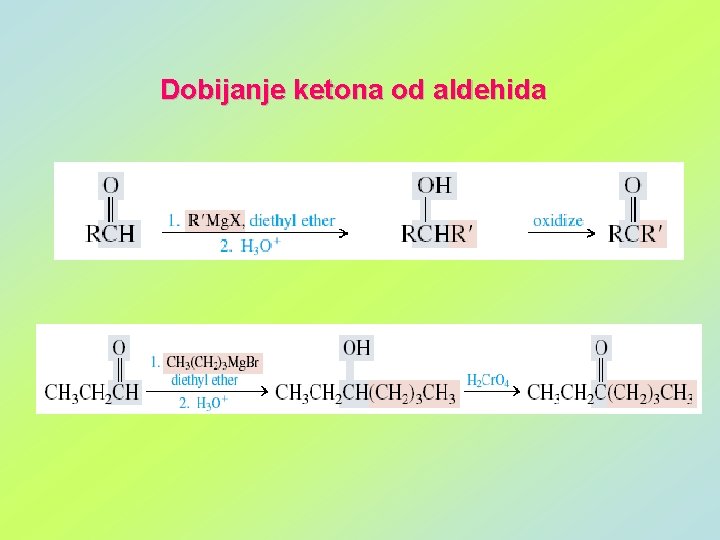
Dobijanje ketona od aldehida

Fizičke osobine aldehida i ketona • Aldehidi i ketoni su polarna jedinjenja, zbog prisustva polarne karbonilne grupe. • Imaju relativno visoke tačke ključanja u poređenju sa nepolarnim jedinjenjima slične molekulske mase. • Ne mogu da grade vodonične veze i zbog toga imaju niže tačke ključanja od odgovarajućih alohola i karboksilnih kiselina. • Niži aldehidi i ketoni (metanal, propanal, propanon) se dobro rastvaraju u vodi i polarnim rastvaračima. • Aldehidi i ketoni sa 5 i više C atoma se slabo rastvaraju u polarnim rastvaračima i vodi, dominira nepolarni – R ostatak.

formula T. T. K. Rastvorljivost g/100 g H 2 O Veoma rastvoran Slabo rastvoran

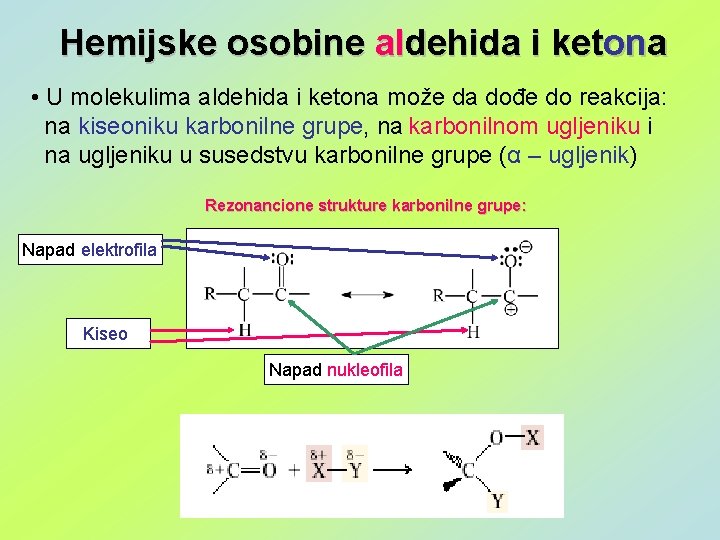
Hemijske osobine aldehida i ketona • U molekulima aldehida i ketona može da dođe do reakcija: na kiseoniku karbonilne grupe, na karbonilnom ugljeniku i na ugljeniku u susedstvu karbonilne grupe (α – ugljenik) Rezonancione strukture karbonilne grupe: Napad elektrofila Kiseo Napad nukleofila

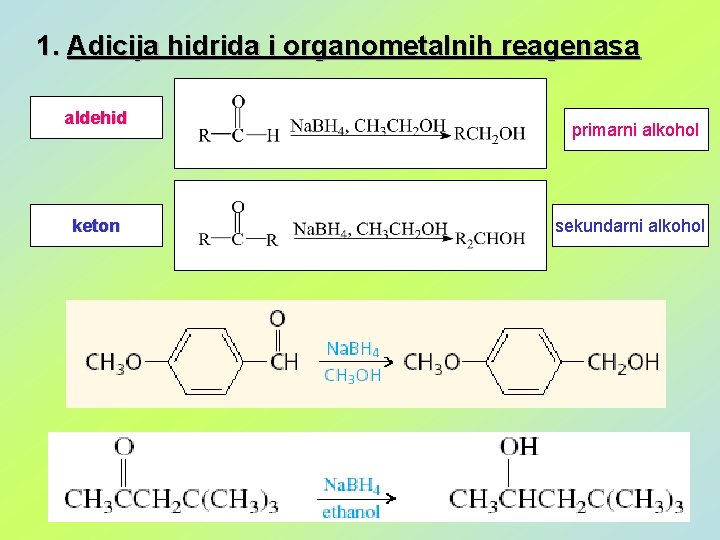
1. Adicija hidrida i organometalnih reagenasa aldehid keton primarni alkohol sekundarni alkohol

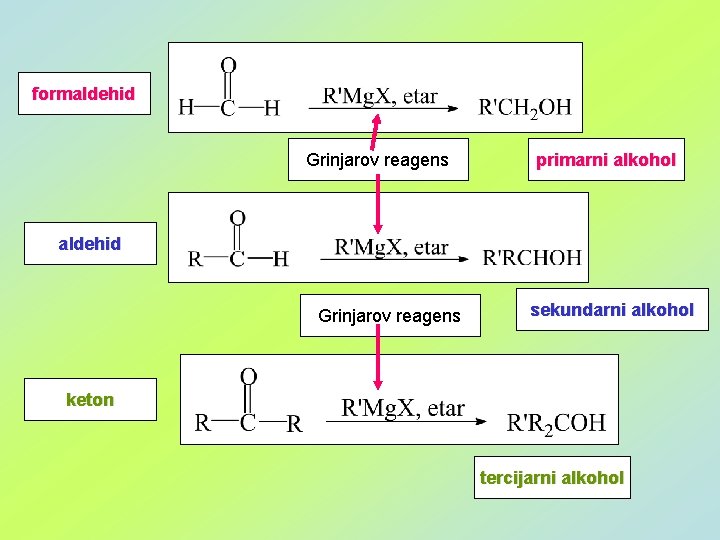
formaldehid Grinjarov reagens primarni alkohol aldehid Grinjarov reagens sekundarni alkohol keton tercijarni alkohol



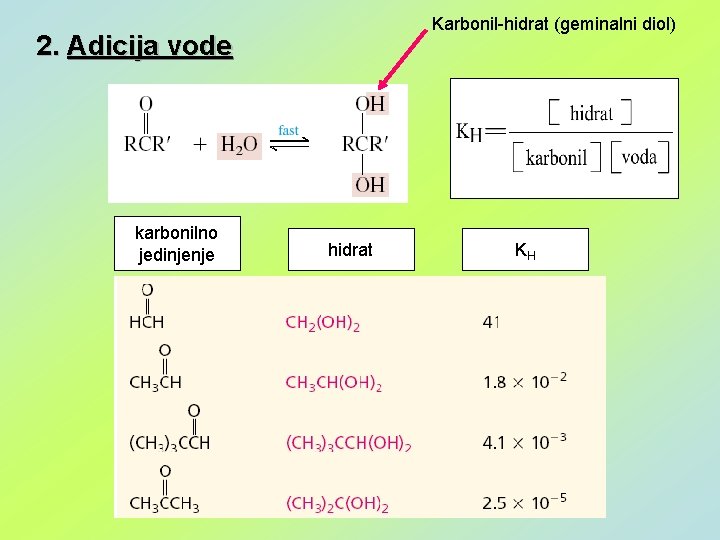
Karbonil-hidrat (geminalni diol) 2. Adicija vode karbonilno jedinjenje hidrat KH

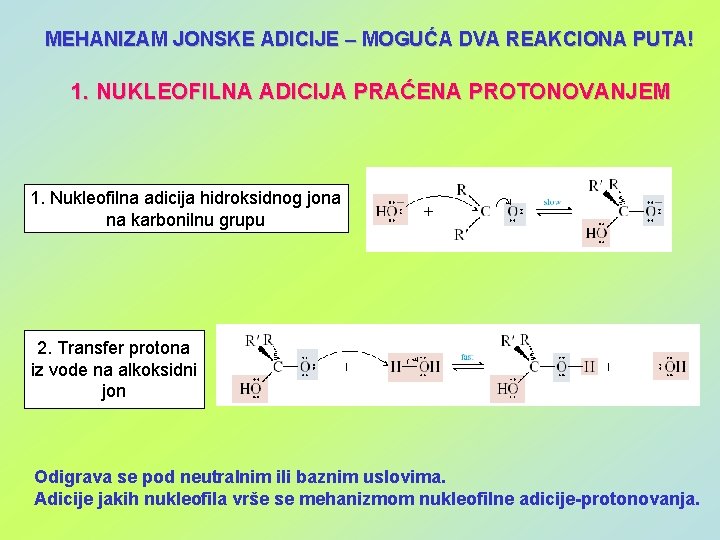
MEHANIZAM JONSKE ADICIJE – MOGUĆA DVA REAKCIONA PUTA! 1. NUKLEOFILNA ADICIJA PRAĆENA PROTONOVANJEM 1. Nukleofilna adicija hidroksidnog jona na karbonilnu grupu 2. Transfer protona iz vode na alkoksidni jon Odigrava se pod neutralnim ili baznim uslovima. Adicije jakih nukleofila vrše se mehanizmom nukleofilne adicije-protonovanja.

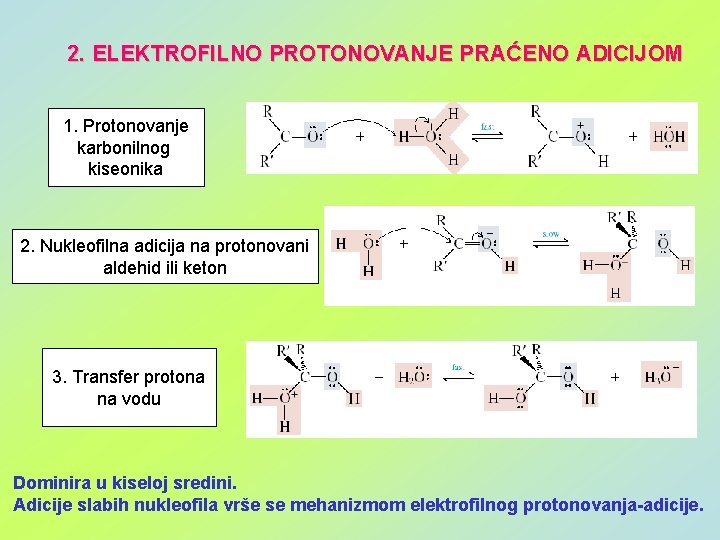
2. ELEKTROFILNO PROTONOVANJE PRAĆENO ADICIJOM 1. Protonovanje karbonilnog kiseonika 2. Nukleofilna adicija na protonovani aldehid ili keton 3. Transfer protona na vodu Dominira u kiseloj sredini. Adicije slabih nukleofila vrše se mehanizmom elektrofilnog protonovanja-adicije.

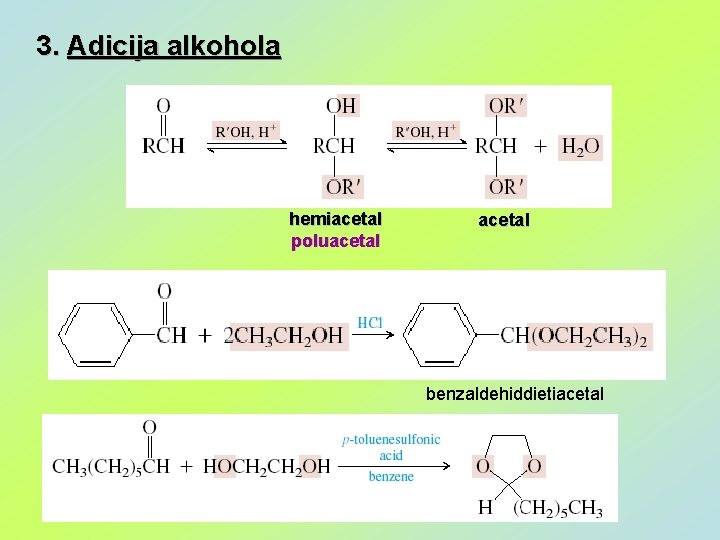
3. Adicija alkohola hemiacetal poluacetal benzaldehiddietiacetal

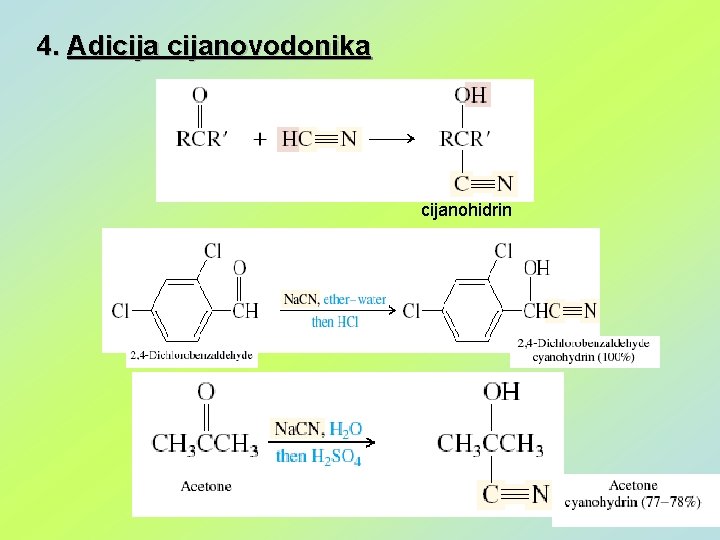
4. Adicijanovodonika cijanohidrin

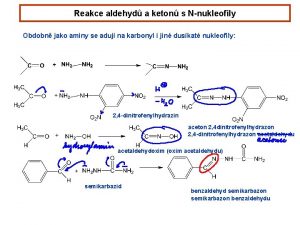
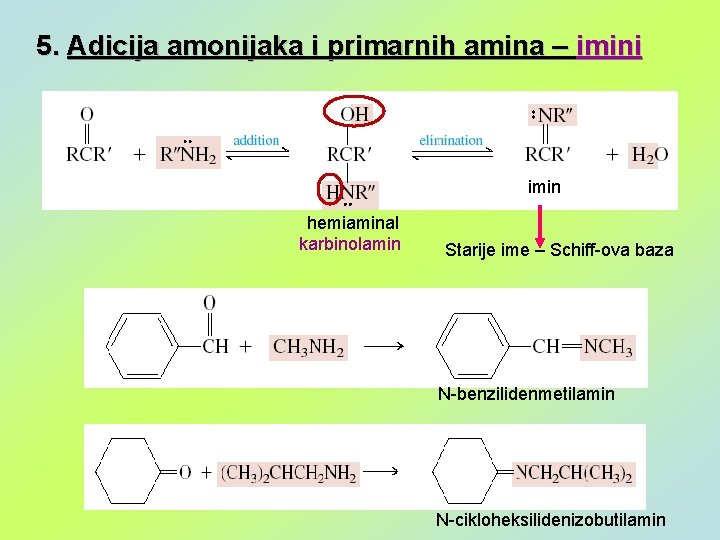
5. Adicija amonijaka i primarnih amina – imini imin hemiaminal karbinolamin Starije ime – Schiff-ova baza N-benzilidenmetilamin N-cikloheksilidenizobutilamin

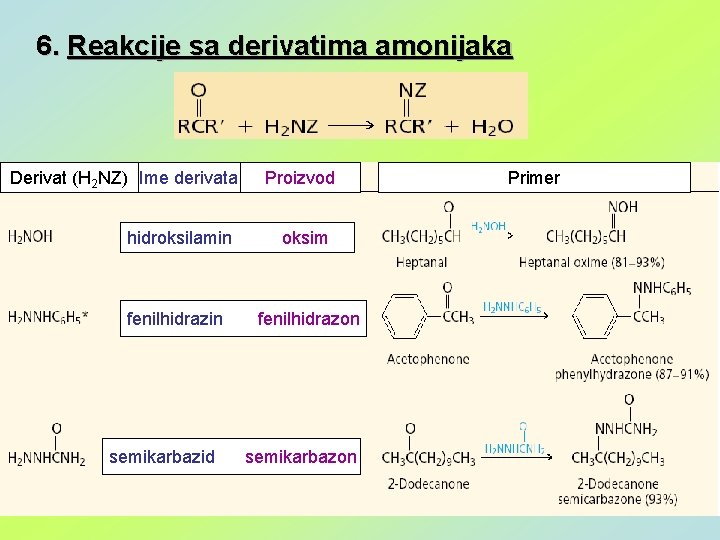
6. Reakcije sa derivatima amonijaka Derivat (H 2 NZ) Ime derivata Proizvod hidroksilamin oksim fenilhidrazin fenilhidrazon semikarbazid semikarbazon Primer

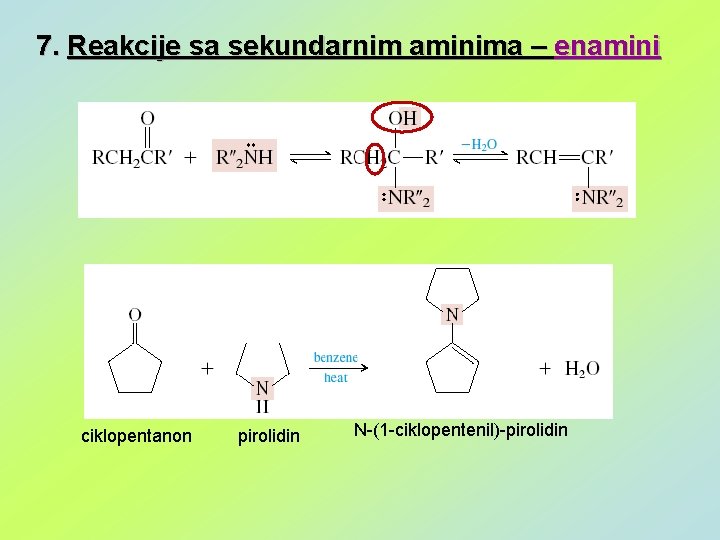
7. Reakcije sa sekundarnim aminima – enamini ciklopentanon pirolidin N-(1 -ciklopentenil)-pirolidin

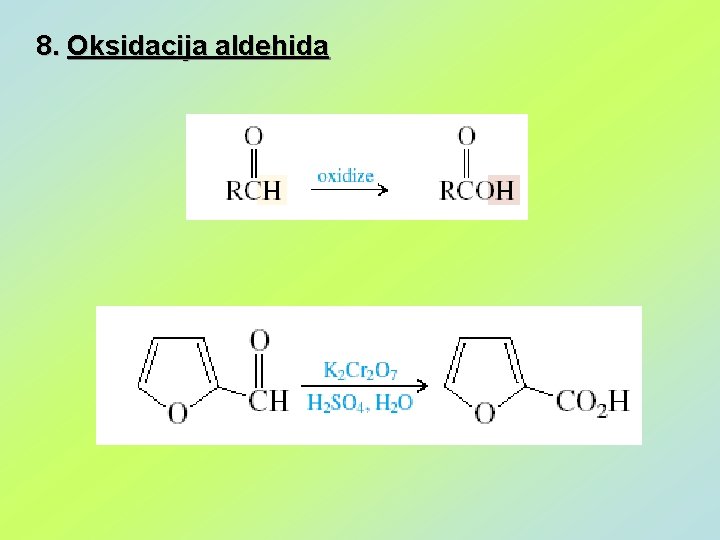
8. Oksidacija aldehida

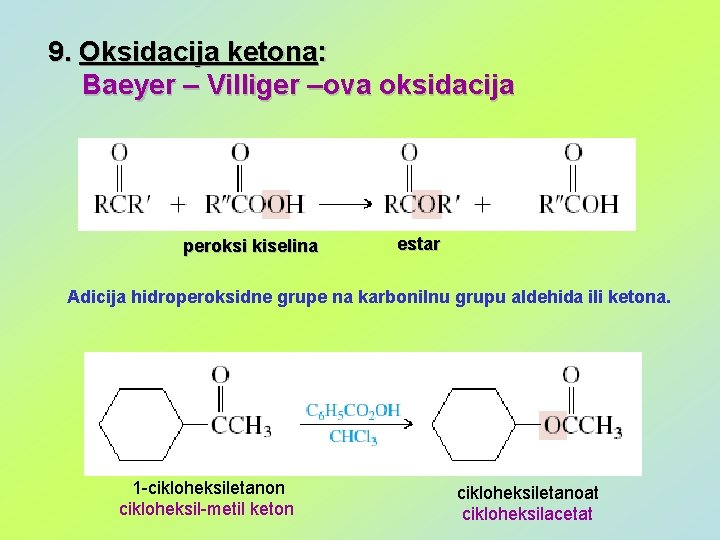
9. Oksidacija ketona: Baeyer – Villiger –ova oksidacija peroksi kiselina estar Adicija hidroperoksidne grupe na karbonilnu grupu aldehida ili ketona. 1 -cikloheksiletanon cikloheksil-metil keton cikloheksiletanoat cikloheksilacetat

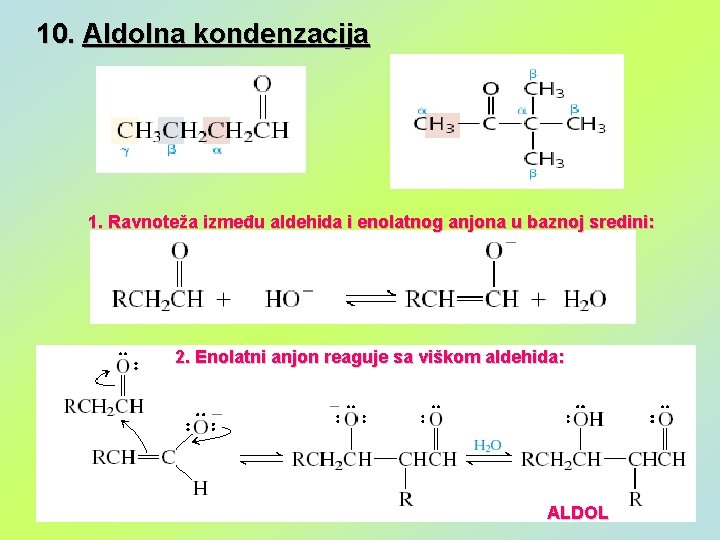
10. Aldolna kondenzacija 1. Ravnoteža između aldehida i enolatnog anjona u baznoj sredini: 2. Enolatni anjon reaguje sa viškom aldehida: ALDOL

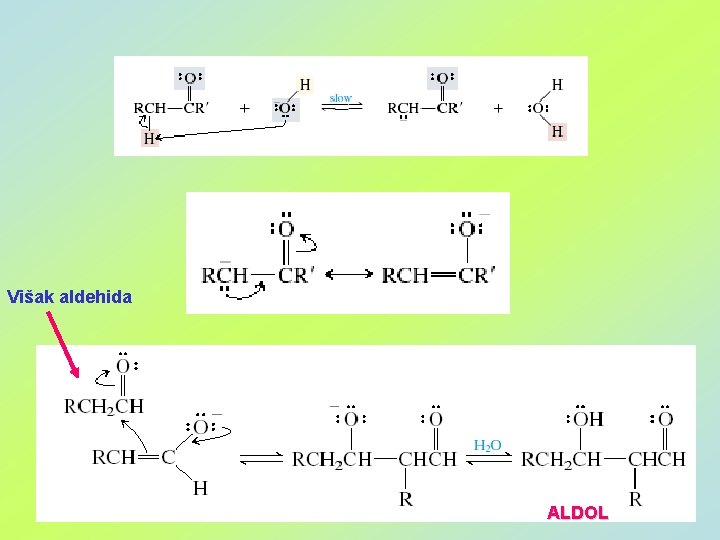
Višak aldehida ALDOL


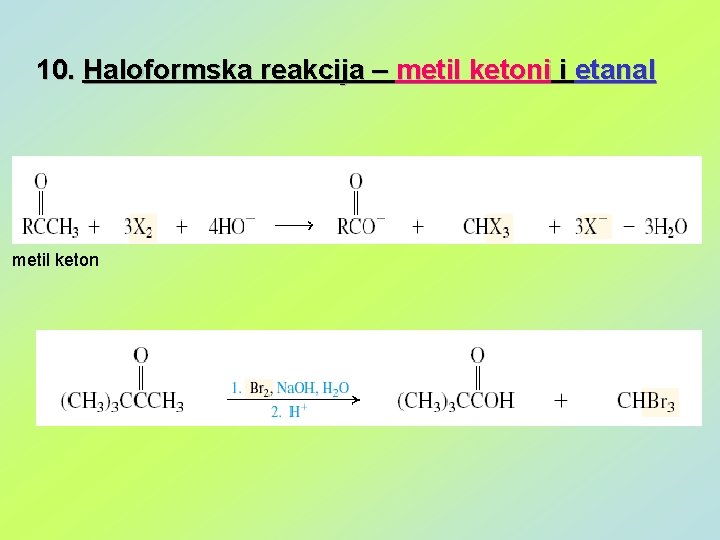
10. Haloformska reakcija – metil ketoni i etanal metil keton

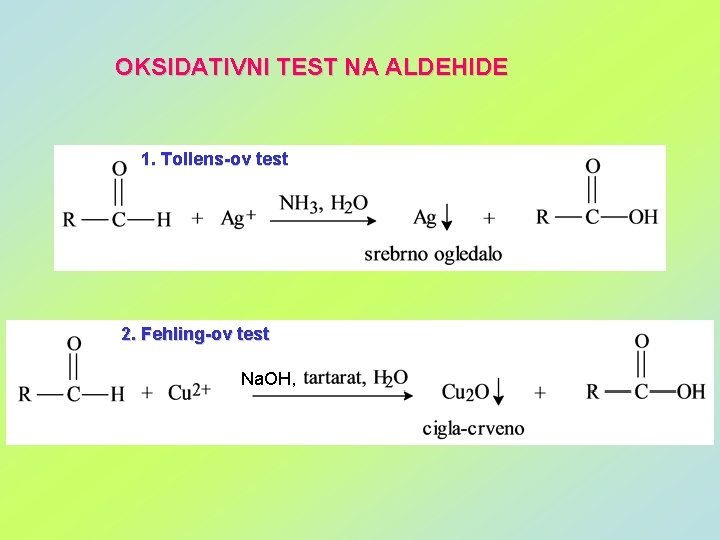
OKSIDATIVNI TEST NA ALDEHIDE 1. Tollens-ov test 2. Fehling-ov test Na. OH,
 Redukcija aldehida
Redukcija aldehida Metanal
Metanal Struktur formaldehid
Struktur formaldehid Keton dan aldehid
Keton dan aldehid Ketoni funkcionalna grupa
Ketoni funkcionalna grupa Aldehidi formula
Aldehidi formula Salicilaldehid
Salicilaldehid Aldehyde ending
Aldehyde ending Rumus molekul aldehid
Rumus molekul aldehid Nama senyawa ch3 - ch(ch3) - o - ch2 - ch3.
Nama senyawa ch3 - ch(ch3) - o - ch2 - ch3. Glikozaminoglikanlar
Glikozaminoglikanlar Metanal nazwa zwyczajowa
Metanal nazwa zwyczajowa Metanal
Metanal Metanal wzor polstrukturalny
Metanal wzor polstrukturalny Jackowsk
Jackowsk Aldehyde und ketone
Aldehyde und ketone Carbonyl group
Carbonyl group Nevrotik sindromlar
Nevrotik sindromlar Aril keton
Aril keton Einfachstes keton
Einfachstes keton Fenyl methyl keton
Fenyl methyl keton Nama lain asetofenon
Nama lain asetofenon Keton reduktion
Keton reduktion Açlıkta keton cisimleri
Açlıkta keton cisimleri Keton siklik
Keton siklik Reaksi formalin dengan pereaksi schiff
Reaksi formalin dengan pereaksi schiff Kegunaan senyawa keton
Kegunaan senyawa keton Tiyolaz
Tiyolaz Keton struktur
Keton struktur Keton tanachalari
Keton tanachalari Aldehyde nomenklatur
Aldehyde nomenklatur