Precorsi Test AMMISSIONE Medicina e Chirurgia Professioni Sanitarie





























- Slides: 97

Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Modulo di Chimica Pier Luigi Orvietani Magdalena Davidescu Anno Accademico 2018 -19

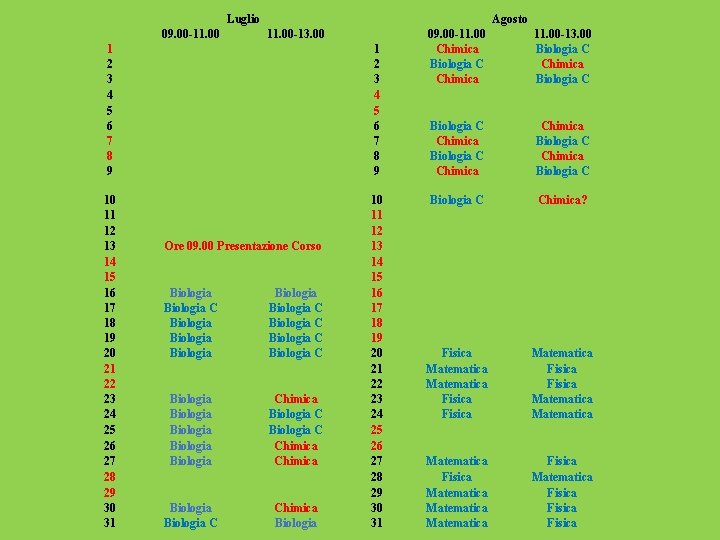
Luglio 09. 00 -11. 00 Agosto 11. 00 -13. 00 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Ore 09. 00 Presentazione Corso Biologia C Biologia Biologia Biologia Chimica Biologia C Chimica Biologia 09. 00 -11. 00 Chimica Biologia C Chimica 11. 00 -13. 00 Biologia C Chimica Biologia C Chimica? Fisica Matematica Fisica Matematica Matematica Fisica Fisica

Modulo di Chimica Programma • Chimica Generale • Chimica Organica -Struttura atomica e Tavola periodica -Costituzione della materia -Nomenclatura Sostanze inorganiche -Reazioni chimiche e stechiometria -Legami chimici -Legge dei Gas -Soluzioni -ACIDI e BASI -Cinetica Chimica e Catalisi -Ossidazione e Riduzione -IDROCARBURI -ALCOLI e ETERI -AMMINE -ALDEIDI e CHETONI -ACIDI CARBOSSILICI -ESTERI -AMMIDI -STEREOISOMERIA • Cenni su Macromolecole Biologiche ZUCCHERI LIPIDI

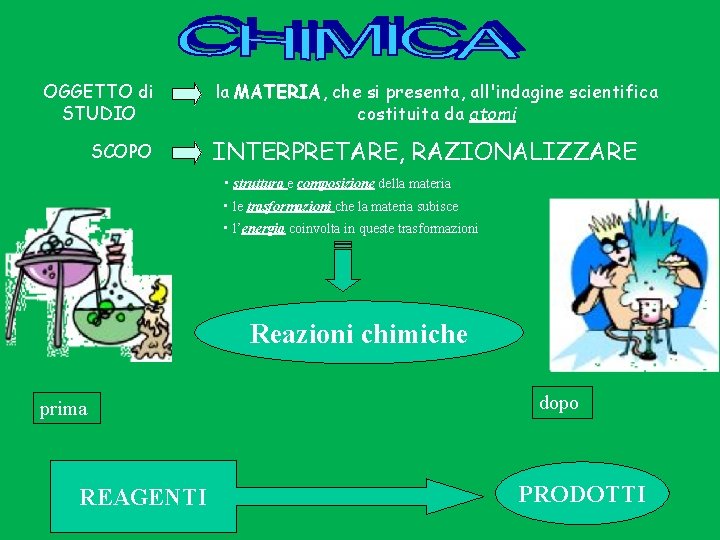
OGGETTO di STUDIO SCOPO la MATERIA, che si presenta, all'indagine scientifica costituita da atomi INTERPRETARE, RAZIONALIZZARE • struttura e composizione della materia • le trasformazioni che la materia subisce • l’energia coinvolta in queste trasformazioni Reazioni chimiche prima REAGENTI dopo PRODOTTI

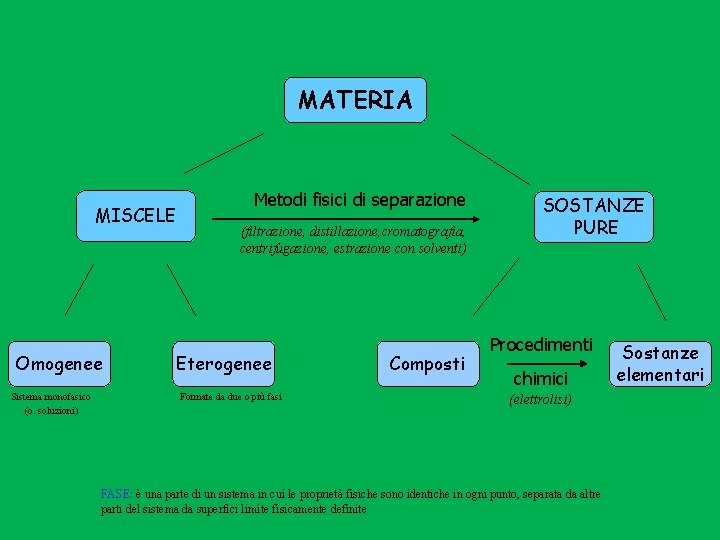
MATERIA MISCELE Omogenee Sistema monofasico (o. soluzioni) Metodi fisici di separazione (filtrazione, distillazione, cromatografia, centrifugazione, estrazione con solventi) Eterogenee Formate da due o più fasi Composti SOSTANZE PURE Procedimenti chimici (elettrolisi) FASE: è una parte di un sistema in cui le proprietà fisiche sono identiche in ogni punto, separata da altre parti del sistema da superfici limite fisicamente definite Sostanze elementari

SOSTANZE costituite da ATOMI sono caratterizzate da: COMPOSIZIONE: tipo di atomo tipi di atomo e loro rapporto numerico SOSTANZE ELEMENTARI COMPOSTI STRUTTURA: modo in cui gli atomi sono legati tra di loro STATO di AGGREGAZIONE: consistenza fisica: SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO (Volume e forma indefiniti)

TEORIA CINETICO-CORPUSCOLARE della materia n n Tutti i corpi materiali sono costituiti da particelle (molecole) dotate di energia cinetica e soggette a reciproche forze di attrazione I 3 stati fisici dipendono dal rapporto tra l’energia cinetica media e l’intensità delle forze di attrazione reciproca massa Energia cinetica (Ec) ½ m v 2 velocità

I 3 STATI FISICI n Stato gassoso alta energia cinetica, deboli o nulle forze di attrazione • Stato liquido media energia cinetica, forze di attrazione sufficienti a tenere vicine le particelle ma non ferme • Stato solido bassa energia cinetica , forti o fortissime forze di attrazione struttura cristallina

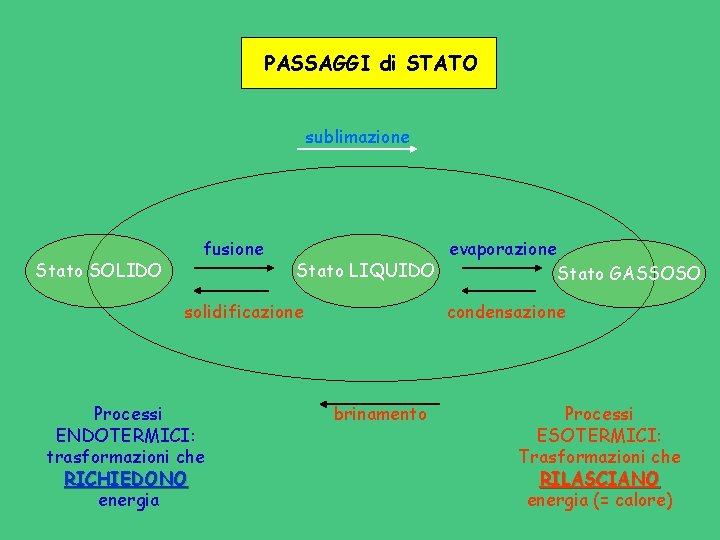
PASSAGGI di STATO sublimazione Stato SOLIDO fusione evaporazione Stato LIQUIDO Stato GASSOSO solidificazione Processi ENDOTERMICI: trasformazioni che RICHIEDONO energia condensazione brinamento Processi ESOTERMICI: Trasformazioni che RILASCIANO energia (= calore)

PROPRIETA’ della SOSTANZA PROPRIETA’ INTENSIVE: dipendono dalla NATURA delle sostanze e NON dalla loro quantità o dimensioni composizione, struttura, stato di aggregazione densità, conducibilità elettrica, o termica, calore specifico, temperatura, … PROPRIETA’ ESTENSIVE: dipendono dalla QUANTITA’ di sostanza e da esse NON si può individuare una sostanza massa, volume, entalpia, entropia, concentrazione….

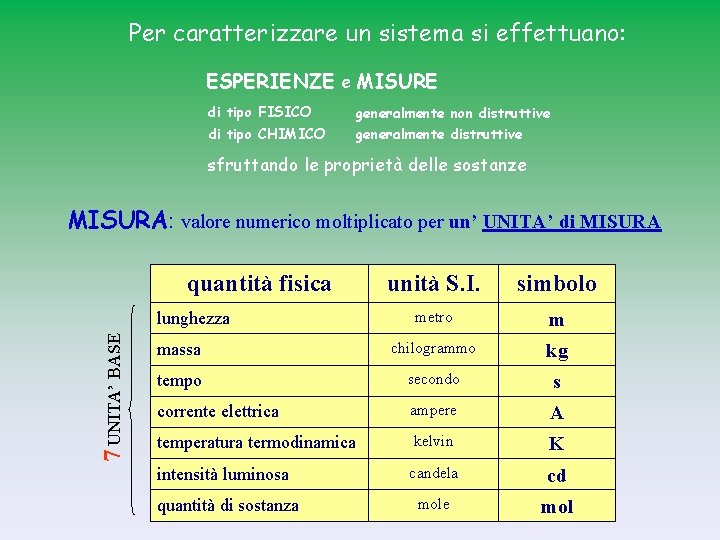
Per caratterizzare un sistema si effettuano: ESPERIENZE e MISURE di tipo FISICO generalmente non distruttive di tipo CHIMICO generalmente distruttive sfruttando le proprietà delle sostanze MISURA: valore numerico moltiplicato per un’ UNITA’ di MISURA quantità fisica unità S. I. simbolo metro m massa chilogrammo kg tempo secondo s corrente elettrica ampere A temperatura termodinamica kelvin K intensità luminosa candela cd mole mol 7 UNITA’ BASE lunghezza quantità di sostanza

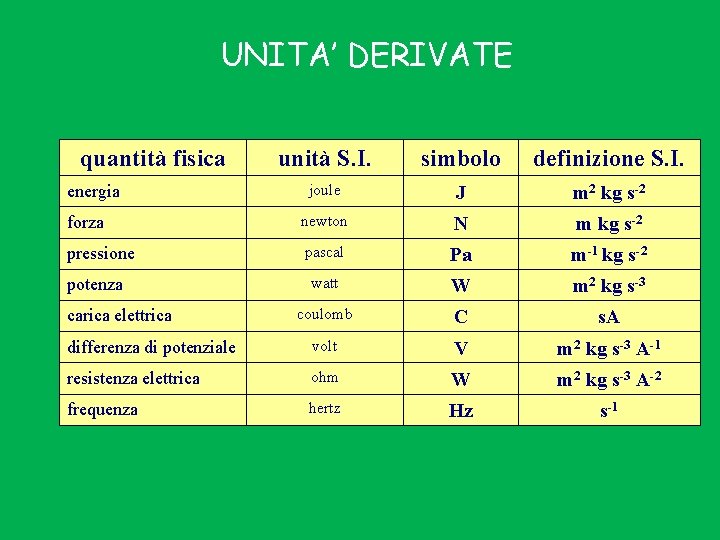
UNITA’ DERIVATE quantità fisica unità S. I. simbolo definizione S. I. joule J m 2 kg s-2 forza newton N m kg s-2 pressione pascal Pa m-1 kg s-2 watt W m 2 kg s-3 coulomb C s. A differenza di potenziale volt V m 2 kg s-3 A-1 resistenza elettrica ohm W m 2 kg s-3 A-2 frequenza hertz Hz s-1 energia potenza carica elettrica

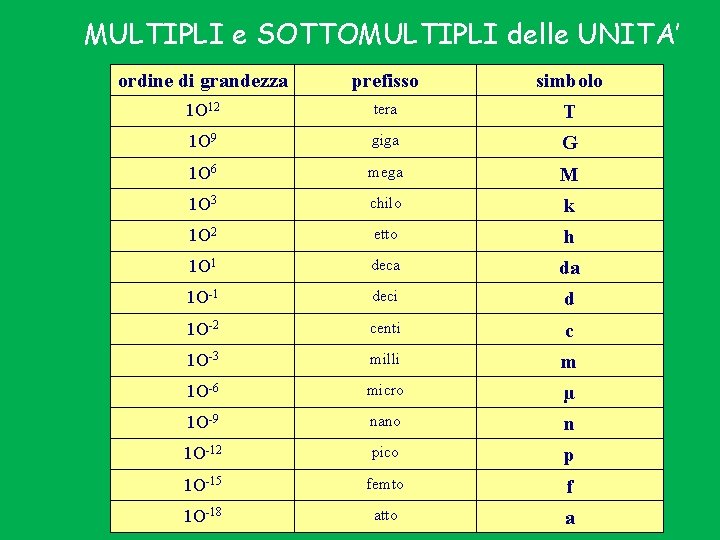
MULTIPLI e SOTTOMULTIPLI delle UNITA’ ordine di grandezza prefisso simbolo 1 O 12 tera T 1 O 9 giga G 1 O 6 mega M 1 O 3 chilo k 1 O 2 etto h 1 O 1 deca da 1 O-1 deci d 1 O-2 centi c 1 O-3 milli m 1 O-6 micro µ 1 O-9 nano n 1 O-12 pico p 1 O-15 femto f 1 O-18 atto a

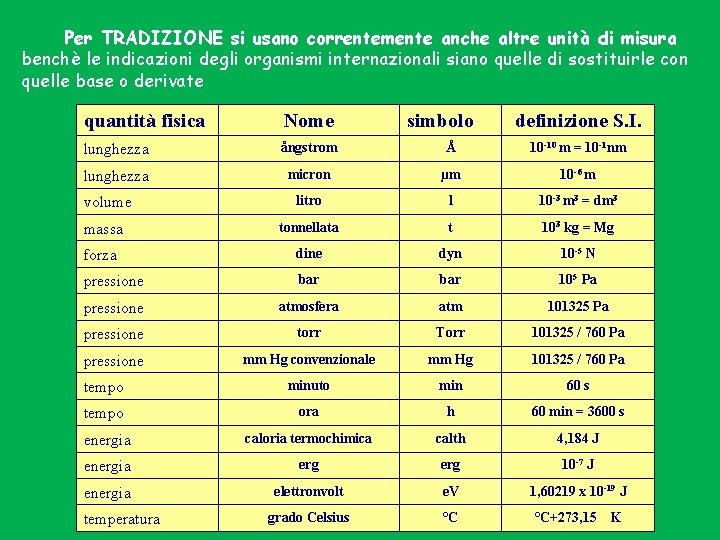
Per TRADIZIONE si usano correntemente anche altre unità di misura benchè le indicazioni degli organismi internazionali siano quelle di sostituirle con quelle base o derivate quantità fisica Nome lunghezza ångstrom Å 10 -10 m = 10 -1 nm lunghezza micron µm 10 -6 m litro l 10 -3 m 3 = dm 3 massa tonnellata t 103 kg = Mg forza dine dyn 10 -5 N pressione bar 105 Pa pressione atmosfera atm 101325 Pa pressione torr Torr 101325 / 760 Pa pressione mm Hg convenzionale mm Hg 101325 / 760 Pa tempo minuto min 60 s tempo ora h 60 min = 3600 s energia caloria termochimica calth 4, 184 J energia erg 10 -7 J energia elettronvolt e. V 1, 60219 x 10 -19 J grado Celsius °C volume temperatura simbolo definizione S. I. °C+273, 15 K

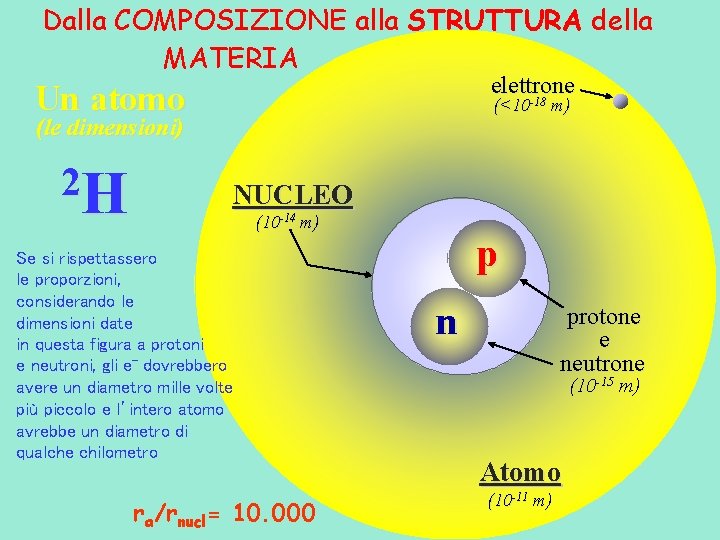
Dalla COMPOSIZIONE alla STRUTTURA della MATERIA elettrone -18 Un atomo (<10 (le dimensioni) 2 H m) NUCLEO (10 -14 m) Se si rispettassero le proporzioni, considerando le dimensioni date in questa figura a protoni e neutroni, gli e- dovrebbero avere un diametro mille volte più piccolo e l’intero atomo avrebbe un diametro di qualche chilometro ra/rnucl= 10. 000 p (<10 -18 m) n protone e neutrone (10 -15 m) Atomo (10 -11 m)

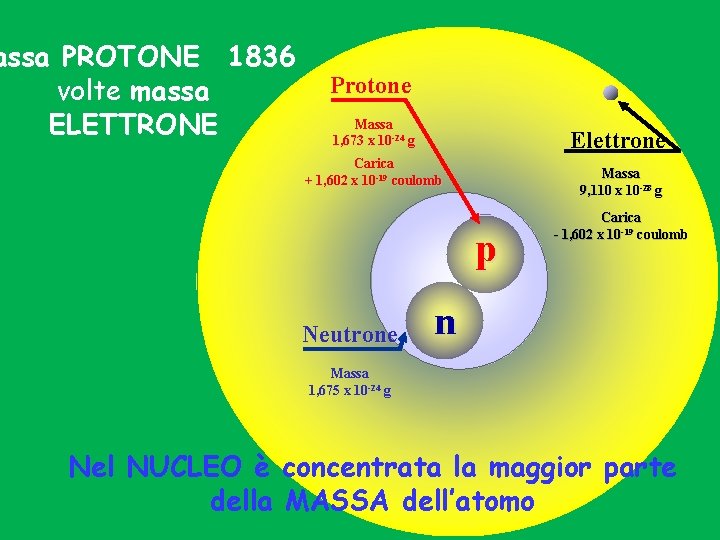
assa PROTONE 1836 volte massa ELETTRONE Protone Massa 1, 673 x 10 -24 g Elettrone Carica + 1, 602 x 10 -19 coulomb Massa 9, 110 x 10 -28 g p Neutrone Carica - 1, 602 x 10 -19 coulomb n Massa 1, 675 x 10 -24 g Nel NUCLEO è concentrata la maggior parte della MASSA dell’atomo

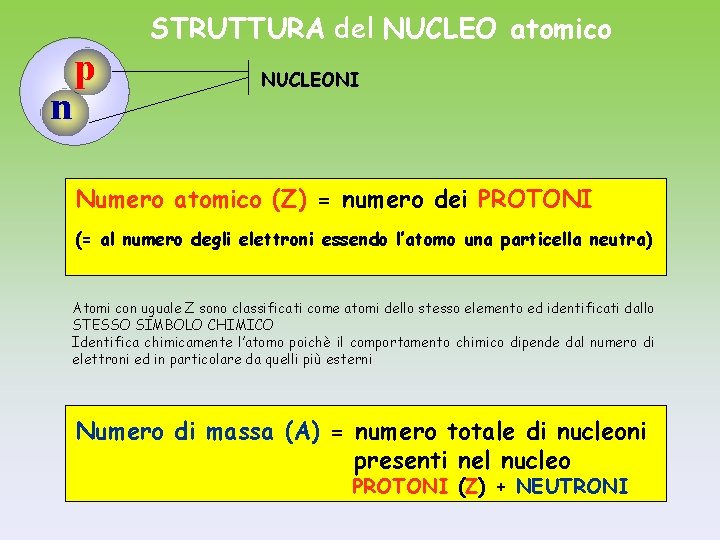
p n STRUTTURA del NUCLEO atomico NUCLEONI Numero atomico (Z) = numero dei PROTONI (= al numero degli elettroni essendo l’atomo una particella neutra) Atomi con uguale Z sono classificati come atomi dello stesso elemento ed identificati dallo STESSO SIMBOLO CHIMICO Identifica chimicamente l’atomo poichè il comportamento chimico dipende dal numero di elettroni ed in particolare da quelli più esterni Numero di massa (A) = numero totale di nucleoni presenti nel nucleo PROTONI (Z) + NEUTRONI

CARTA d’IDENTITA’ di un ATOMO NUCLIDE = specie atomica definita in modo univoco da un numero atomico e da un numero di massa Per identificare un nuclide occorre specificare: - simbolo dell’elemento - Z (in basso a sinistra) - A (in alto a sinistra) A Z X

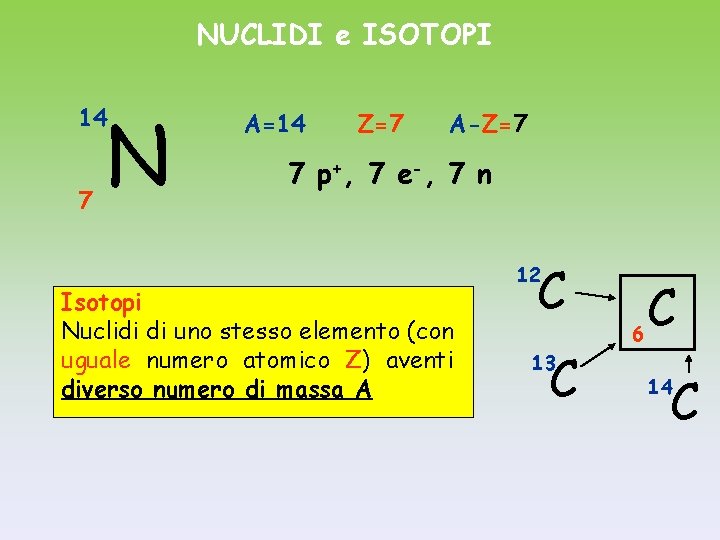
NUCLIDI e ISOTOPI N 14 7 A=14 Z=7 A-Z=7 7 p +, 7 e -, 7 n Isotopi Nuclidi di uno stesso elemento (con uguale numero atomico Z) aventi diverso numero di massa A C 12 C 13 C 6 C 14

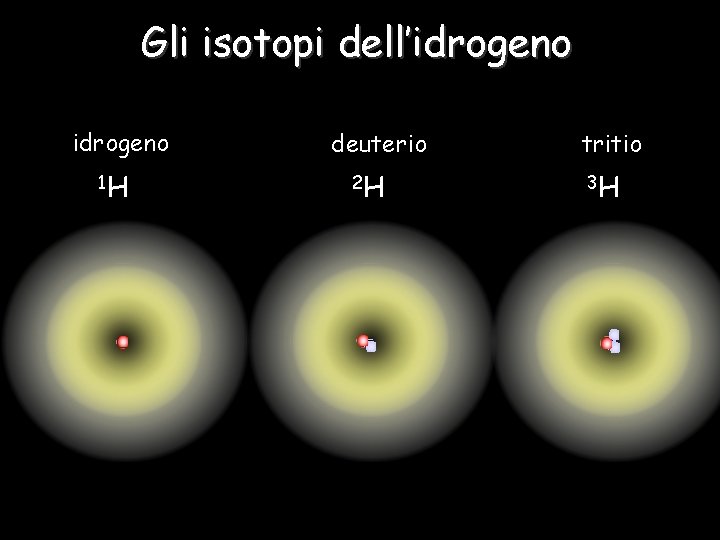
Gli isotopi dell’idrogeno 1 H deuterio 2 H tritio 3 H

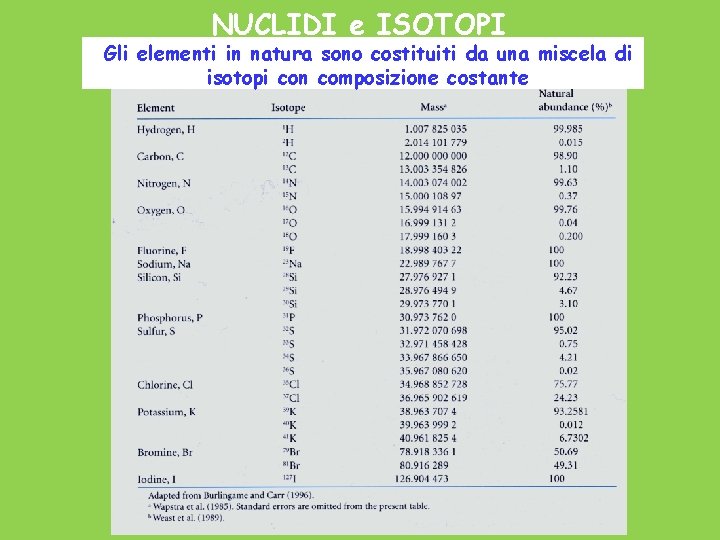
NUCLIDI e ISOTOPI Gli elementi in natura sono costituiti da una miscela di isotopi con composizione costante

Modello atomico di Rutherford Atomo NUCLEARE Ernest Rutherford (1871 -1937) Nobel per la Chimica 1908 • Nel 1899 inizia a studiare la natura delle radiazione α e β emesse da elementi radioattivi • Particelle β sono gli elettroni - e- • Particelle α sono nuclei di elio con due cariche positive - He++ - b- e- + + α

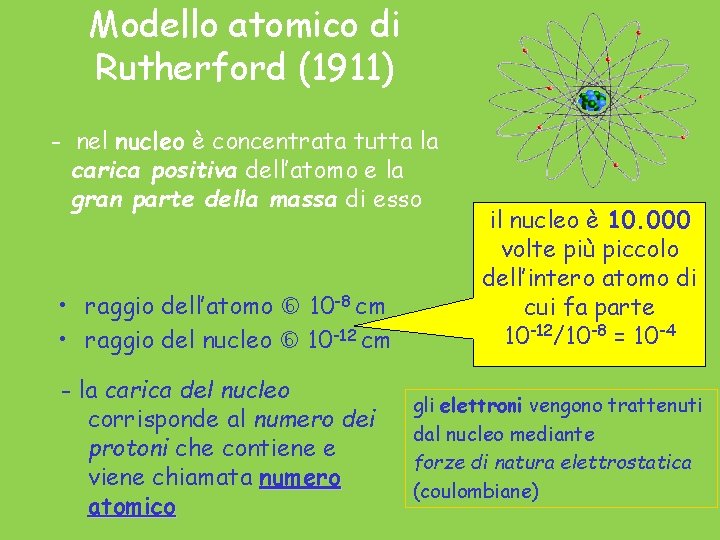
Modello atomico di Rutherford (1911) - nel nucleo è concentrata tutta la carica positiva dell’atomo e la gran parte della massa di esso • raggio dell’atomo 10 -8 cm • raggio del nucleo 10 -12 cm - la carica del nucleo corrisponde al numero dei protoni che contiene e viene chiamata numero atomico il nucleo è 10. 000 volte più piccolo dell’intero atomo di cui fa parte 10 -12/10 -8 = 10 -4 gli elettroni vengono trattenuti dal nucleo mediante forze di natura elettrostatica (coulombiane)

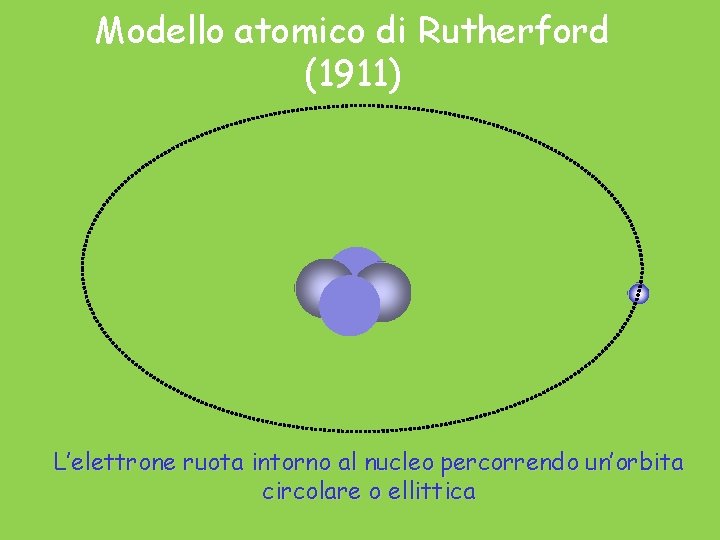
Modello atomico di Rutherford (1911) L’elettrone ruota intorno al nucleo percorrendo un’orbita circolare o ellittica

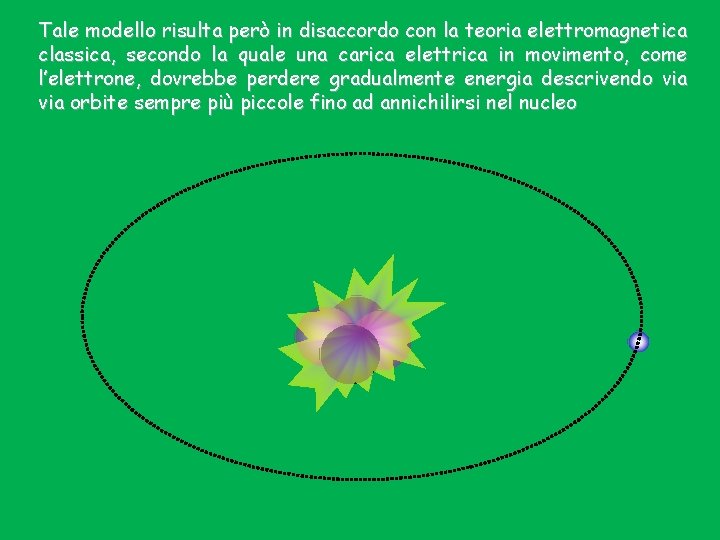
Tale modello risulta però in disaccordo con la teoria elettromagnetica classica, secondo la quale una carica elettrica in movimento, come l’elettrone, dovrebbe perdere gradualmente energia descrivendo via orbite sempre più piccole fino ad annichilirsi nel nucleo

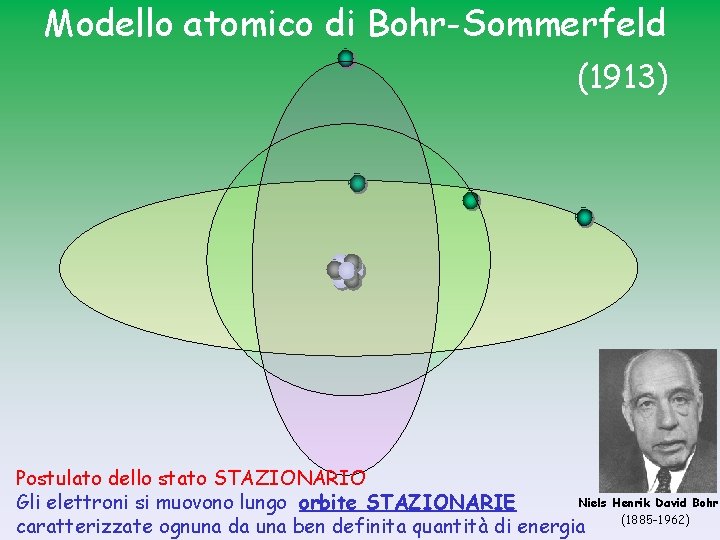
Modello atomico di Bohr-Sommerfeld (1913) Postulato dello stato STAZIONARIO Niels Henrik David Bohr Gli elettroni si muovono lungo orbite STAZIONARIE (1885 -1962) caratterizzate ognuna da una ben definita quantità di energia

Postulato dello stato STAZIONARIO Un elettrone appartiene ad un’orbita stazionaria (non emette energia) se il valore del suo momento angolare mvr è un multiplo intero di h/2 p (h= costante di Plank, 6, 625 x 10 -34 Js) mvr = n x h 2 p quantizzazione del raggio delle orbite e dell’ energia totale dell’elettrone n = 1, 2, 3 , ……numero quantico principale • gli elettroni si muovono su orbite stazionarie caratterizzate da livelli di energia definiti • non sono possibili posizioni “intermedie” • l’elettrone che si muove sul “suo” livello (quello più vicino possibile al nucleo) non perde energia e quindi non cade sul nucleo

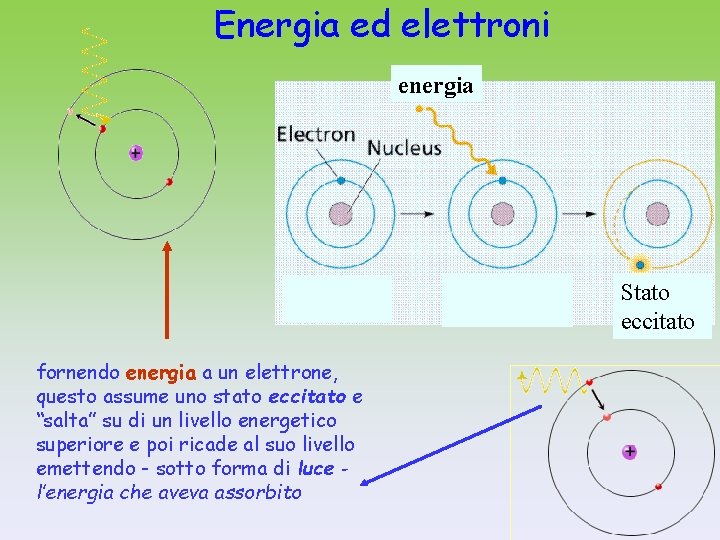
Energia ed elettroni energia Stato eccitato fornendo energia a un elettrone, questo assume uno stato eccitato e “salta” su di un livello energetico superiore e poi ricade al suo livello emettendo - sotto forma di luce l’energia che aveva assorbito

Modello atomico di Bohr (1913) Niels Henrik David Bohr (1885 -1962) Postulato dello stato STAZIONARIO Gli elettroni si muovono lungo orbite STAZIONARIE caratterizzate ognuna da una ben definita quantità di energia Postulato dello stato ECCITATO Quando un elettrone salta da un’orbita stazionaria ad energia minore ad una ad energia maggiore si verificano assunzione di energia e quando ritorna allo stato stazionario si verifica emissione di energia sotto forma di onde elettromagnetiche.

Elettrone: onda o particella? Modello di De Broglie (1924) Se l’onda elettromagnetica si può comportare da particella (quanto , da cui dipende anche l’effetto fotoelettrico = emissione di e- da parte di una superficie metallica, Na o K, colpita da una radiazione elettromagnetica di opportuna frequenza), la particella – elettrone - si può comportare come onda elettromagnetica (descritta dall’ equazione di Schrödinger-1926) L'energia di un fotone è proporzionale alla sua frequenza (equazione Di Planck) Al fotone è associata una massa proporzionale alla sua energia (equazione di Einstein) e=h • n h = 6, 626 • 10 -34 J. s mc 2 = h • e = m • c 2 h • n = m • c 2 c c = 2, 998 • 108 m. s-1 h m= • c

Duplice natura dell’elettrone (particella e onda elettromagnetica) All’elettrone di massa m che ruota nella sua orbita con velocità v è associata un’onda elettrica di lunghezza l h = m • v Principe Louis-Victor de Broglie (1892 -1987) Nobel per la Fisica nel 1929

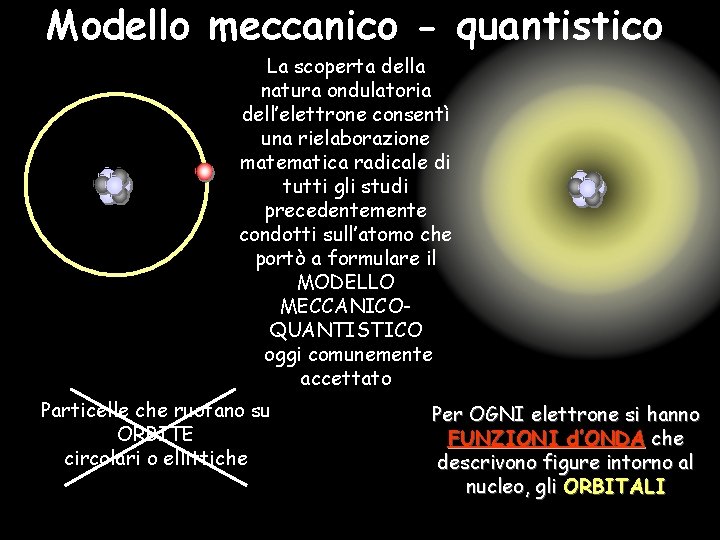
Modello meccanico - quantistico La scoperta della natura ondulatoria dell’elettrone consentì una rielaborazione matematica radicale di tutti gli studi precedentemente condotti sull’atomo che portò a formulare il MODELLO MECCANICOQUANTISTICO oggi comunemente accettato Particelle che ruotano su ORBITE circolari o ellittiche Per OGNI elettrone si hanno FUNZIONI d’ONDA che descrivono figure intorno al nucleo, gli ORBITALI

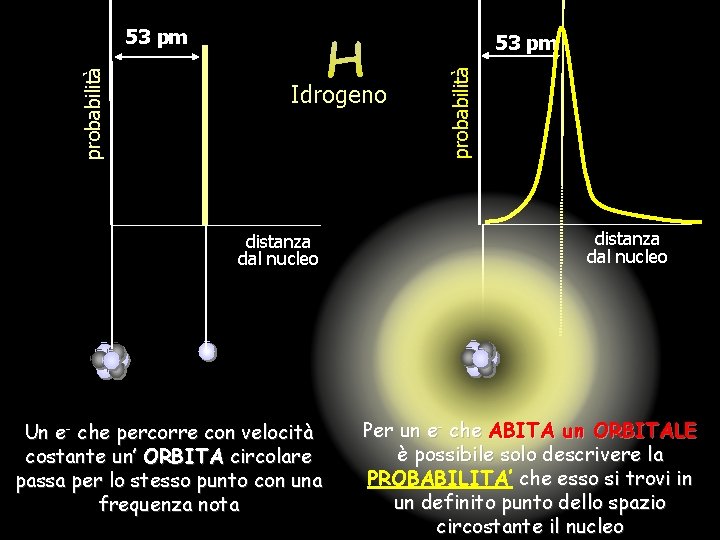
53 pm Idrogeno distanza dal nucleo Un e- che percorre con velocità costante un’ ORBITA circolare passa per lo stesso punto con una frequenza nota probabilità 53 pm distanza dal nucleo Per un e- che ABITA un ORBITALE è possibile solo descrivere la PROBABILITA’ che esso si trovi in un definito punto dello spazio circostante il nucleo

Modello meccanico - quantistico Al concetto di orbita si sostituisce il concetto di ORBITALE REGIONE di SPAZIO IN CUI é MASSIMA LA PROBABILITA’ DI TROVARE L’ ELETTRONE IN UN DATO ISTANTE Principio di indeterminazione di Heisenberg (1927) E’ impossibile conoscere simultaneamente e con precisione grande posizione e velocità di una particella il movimento dell’elettrone intorno al nucleo può essere rappresentato solo ricorrendo al concetto di PROBABILITA’ l’e- si trova confinato in regioni di spazio (orbitali) nelle quali non è identificabile come particella fisica poichè si comporta come se fosse una nuvola elettronica più o meno densa

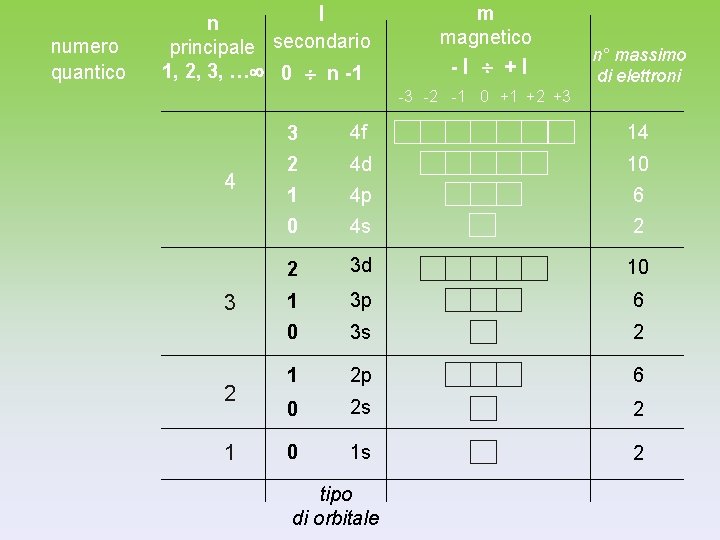
Ogni orbitale è identificato da una funzione matematica, detta FUNZIONE d’ ONDA , un’ equazione differenziale la cui soluzione non è un unica funzione, (x), ma una famiglia di funzioni d’onda (AUTOFUNZIONI) che si distinguono per diversi valori di alcuni parametri (numeri quantici), n, , m (x). n : numero quantico principale l : numero quantico secondario m : numero quantico magnetico I numeri quantici possono assumere solamente valori che rispettino le seguenti regole: n = 1, 2, 3, 4, . . . l = 0, 1, 2, 3, …, n-1 m = 0, ± 1, ± 2, ± 3, …, ±l

NUMERI QUANTICI Numero quantico principale: n (= 1, …, ∞) Definisce l’ ENERGIA e la DIMENSIONE dell’orbitale Numero quantico secondario o azimutale: l (= 0, 1, …, n-1) Indica il momento angolare dell’elettrone e definisce la FORMA dell’orbitale Numero quantico magnetico: m (= -l, …, 0, . . , +l) Determina l’ ORIENTAMENTO SPAZIALE dell’orbitale quando l’atomo è inserito in un campo magnetico

NUMERI QUANTICI I diversi tipi di ORBITALI vengono designati usando un NUMERO e una LETTERA Il NUMERO definisce il valore di n La LETTERA definisce il valore l l = 0 vengono indicati con s (sharp) l = 1 vengono indicati con p (principal) l = 2 vengono indicati con d (diffuse) l = 3 vengono indicati con f (fundamental)

numero quantico l n principale secondario 1, 2, 3, … 0 n -1 m magnetico -l +l n° massimo di elettroni -3 -2 -1 0 +1 +2 +3 4 3 2 1 3 4 f 14 2 4 d 10 1 4 p 6 0 4 s 2 2 3 d 10 1 3 p 6 0 3 s 2 1 2 p 6 0 2 s 2 0 1 s 2 tipo di orbitale

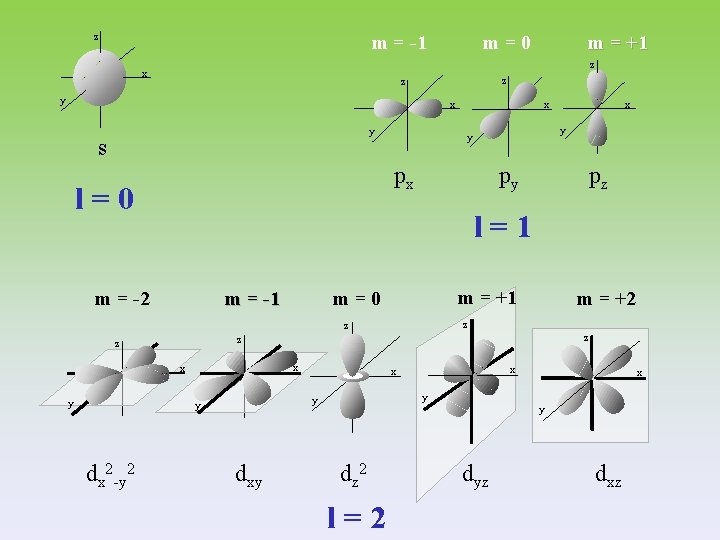
z m=0 m = -1 z x z z y x x y s py pz l=1 m = -2 m = -1 m = +1 m=0 m = +2 z z z x x dxy x x x y y y dx 2 -y 2 x y y px l=0 y m = +1 y dz 2 l=2 dyz dxz

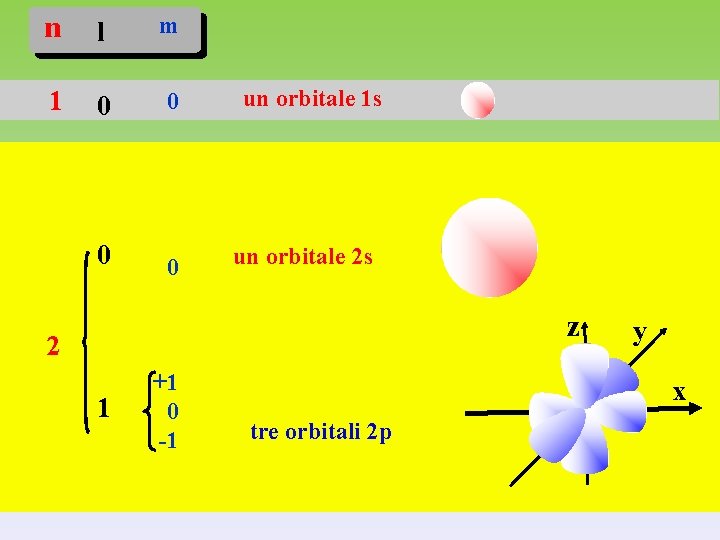
n l m 1 0 0 un orbitale 1 s un orbitale 2 s z 2 1 +1 0 -1 y x tre orbitali 2 p

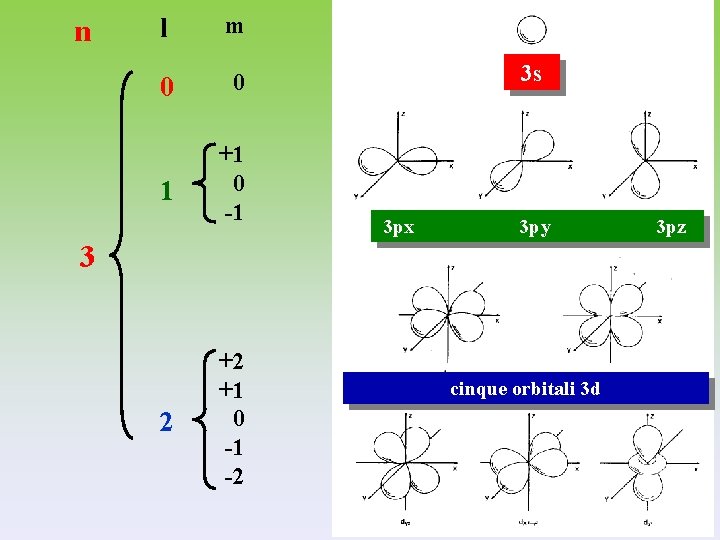
n l m 0 0 1 +1 0 -1 3 s 3 px 3 py 3 2 +2 +1 0 -1 -2 cinque orbitali 3 d 3 pz

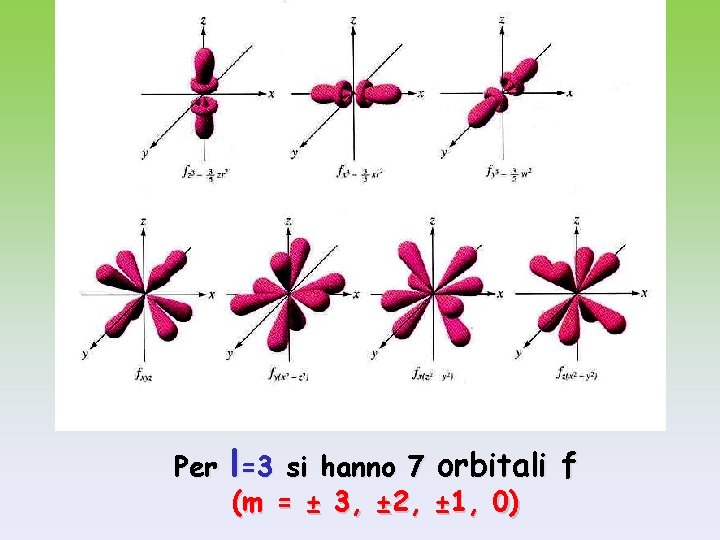
Per l=3 si hanno 7 orbitali f (m = ± 3, ± 2, ± 1, 0)

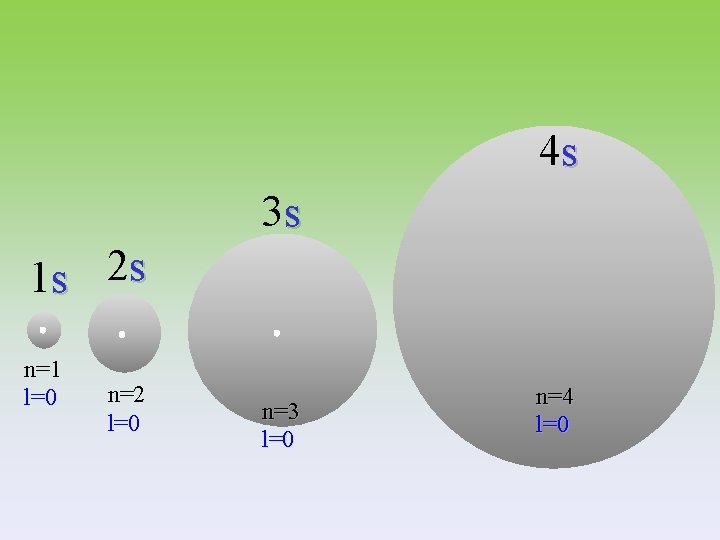
4 s 3 s 1 s 2 s n=1 l=0 n=2 l=0 n=3 l=0 n=4 l=0

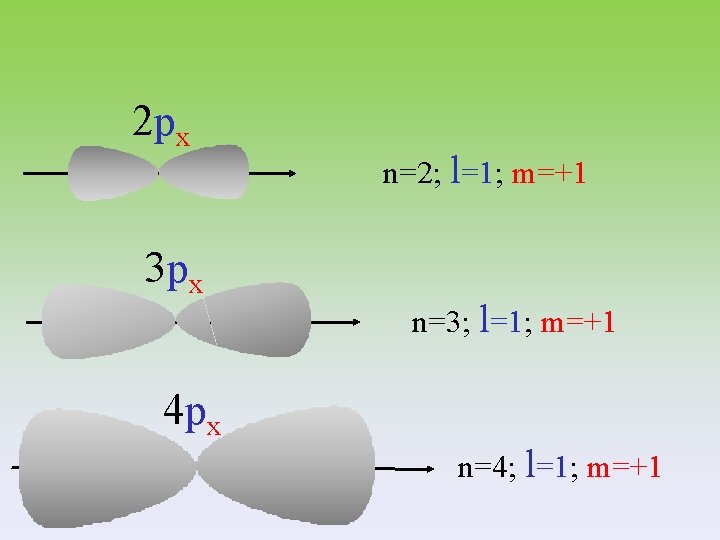
2 px 3 px n=2; l=1; m=+1 n=3; l=1; m=+1 4 px n=4; l=1; m=+1

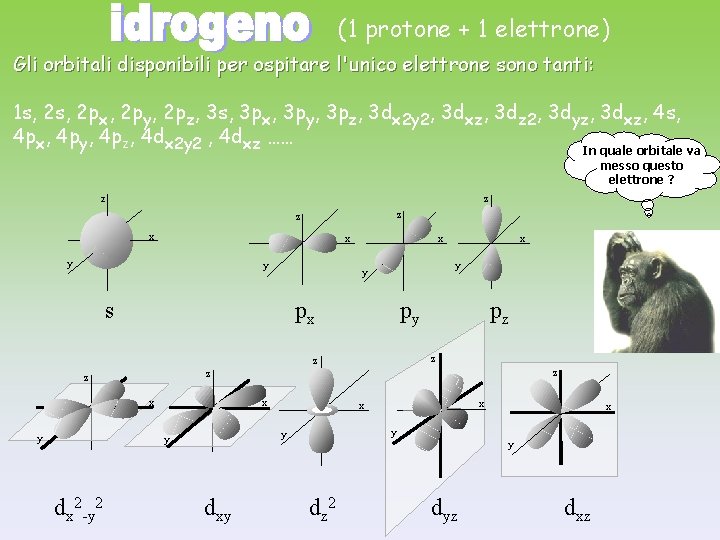
(1 protone + 1 elettrone) Gli orbitali disponibili per ospitare l'unico elettrone sono tanti: 1 s, 2 px, 2 py, 2 pz, 3 s, 3 px, 3 py, 3 pz, 3 dx 2 y 2, 3 dxz, 3 dz 2, 3 dyz, 3 dxz, 4 s, 4 px, 4 py, 4 pz, 4 dx 2 y 2 , 4 dxz …… In quale orbitale va messo questo elettrone ? z z x x x y y s px py z z z x x dxy x x x y y y dx 2 -y 2 pz z z y x y dz 2 dyz dxz

AUFBAU Il termine AUFBAU significa in tedesco “costruzione” e rappresenta per noi la costruzione della configurazione elettronica degli atomi, ovvero la distribuzione degli elettroni nei vari livelli e sottolivelli energetici di un atomo Per scrivere correttamente la configurazione elettronica occorre conoscere l’ordine con cui sono riempiti i vari orbitali

AUFBAU In un atomo, come si distribuiscono gli elettroni nei vari livelli energetici? Regole: 1. L'elettrone occupa l'orbitale a più bassa energia disponibile 2. Principio di Pauli: un orbitale può essere vuoto oppure abitato da uno o, al massimo, da due elettroni. Due elettroni che occupano lo stesso orbitale hanno spin antiparallelo. ms, numero quantico di spin: senso di rotazione dell’ e- intorno al proprio asse (ms = + 1/2; ms =-1/2) Valori opposti di ms SPIN ANTIPARALLELI Valori uguali di ms SPIN PARALLELI 3. Principio di Hund: il riempimento di un orbitale degenere si ha soltanto se gli altri orbitali degeneri sono già occupati da un elettrone.

La successione degli orbitali 1 n 5 2 l 3 5 s 4 p E N 4 3 d 4 s 3 p E R 3 3 s G 2 p I 2 2 s A 1 1 s 6 s. . 5 s 5 p 5 d 5 f. . . 4 s 4 p 4 d 4 f 3 s 3 p 3 d 2 s 2 p 1 s

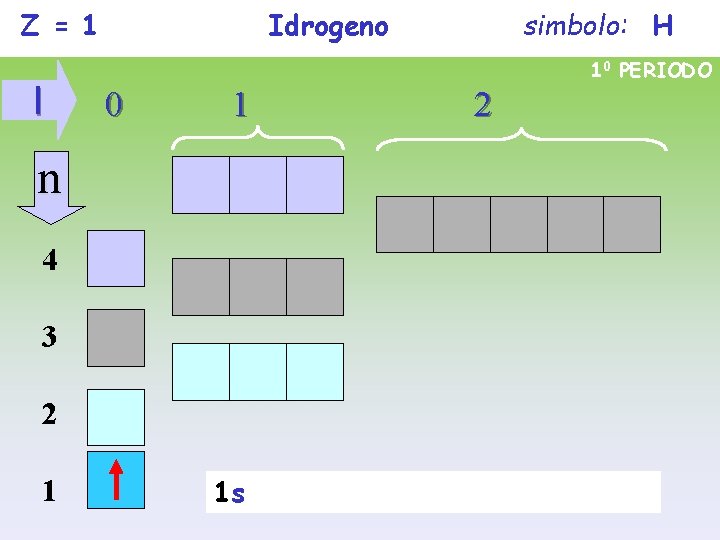
Z = 1 l Idrogeno 10 PERIODO 0 1 n 4 3 2 1 simbolo: H 1 s 2

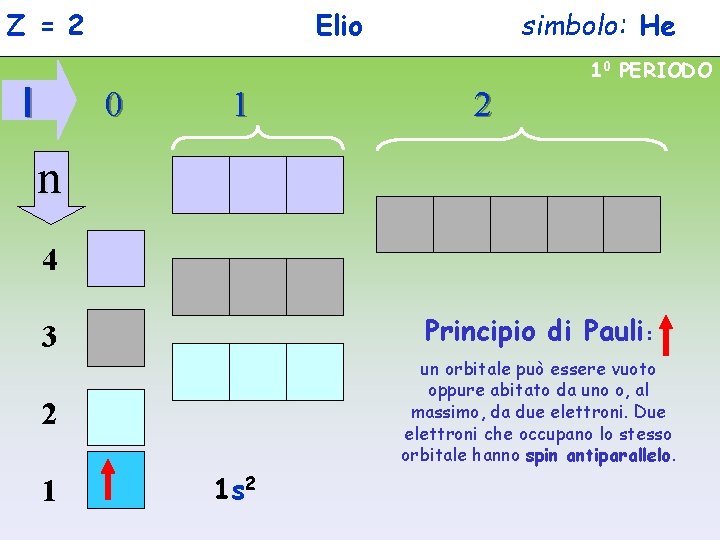
Z = 2 Elio simbolo: He 10 PERIODO l 0 1 2 n 4 3 Principio di Pauli: 2 un orbitale può essere vuoto oppure abitato da uno o, al massimo, da due elettroni. Due elettroni che occupano lo stesso orbitale hanno spin antiparallelo. 1 1 s 2

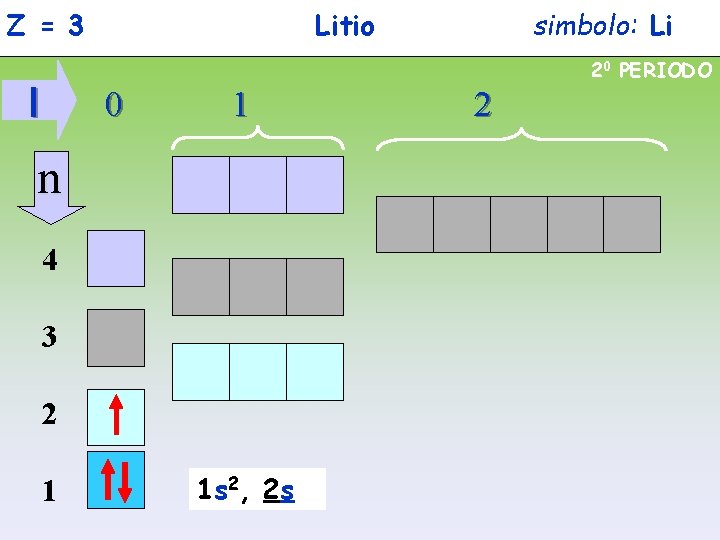
Z = 3 Litio simbolo: Li 20 PERIODO l 0 1 n 4 3 2 1 1 s 2, 2 s 2

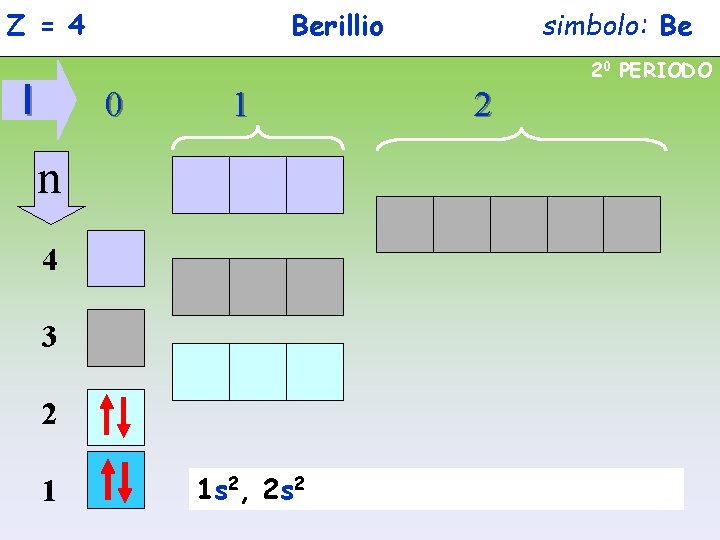
Z = 4 Berillio simbolo: Be 20 PERIODO l 0 1 n 4 3 2 1 1 s 2, 2 s 2 2

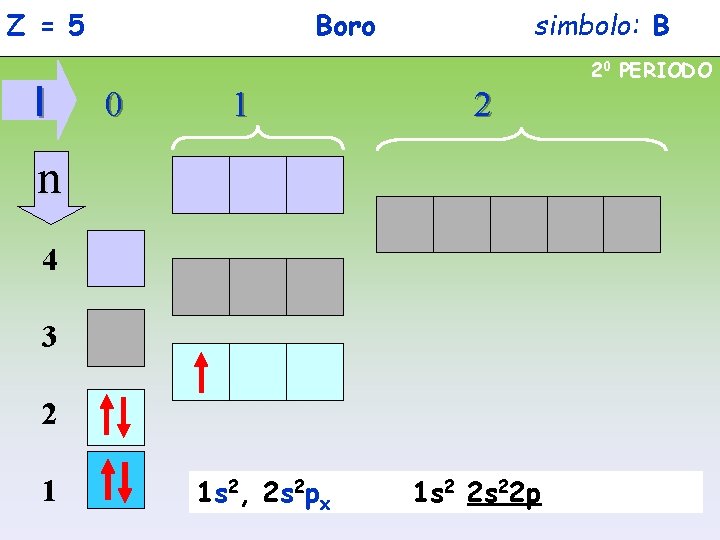
Z = 5 l Boro simbolo: B 20 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 1 s 2 2 s 22 p

Z = 6 l Carbonio simbolo: C 20 PERIODO 0 1 2 n 4 Principio di Hund 3 il riempimento di un orbitale degenere si ha soltanto se gli altri orbitali degeneri sono già occupati da un elettrone. 2 1 1 s 2, 2 s 2 px, py 1 s 2 2 s 22 p 2

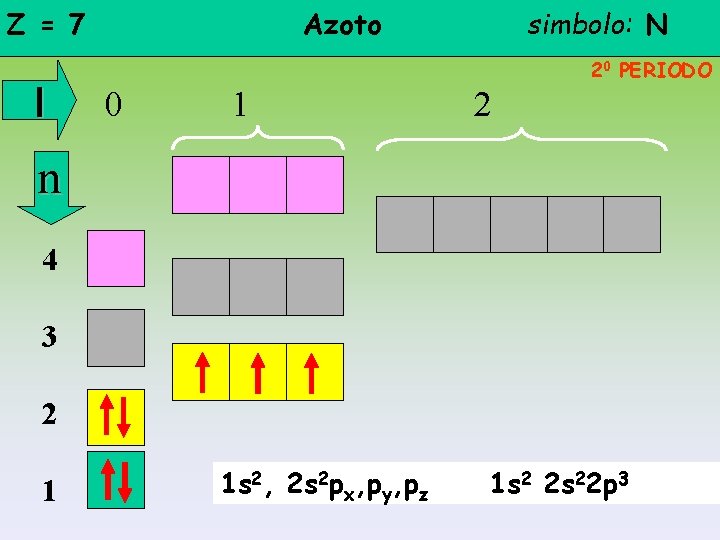
Z = 7 l Azoto simbolo: N 20 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px, py, pz 1 s 2 2 s 22 p 3

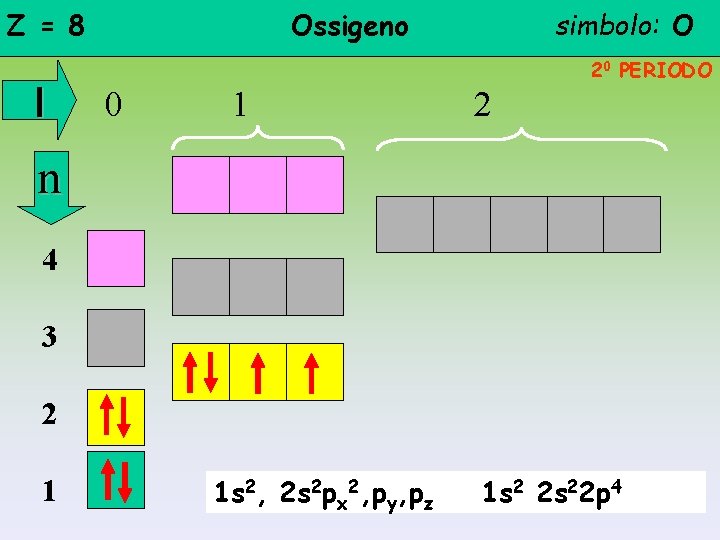
Z = 8 l Ossigeno simbolo: O 20 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py, pz 1 s 2 2 s 22 p 4

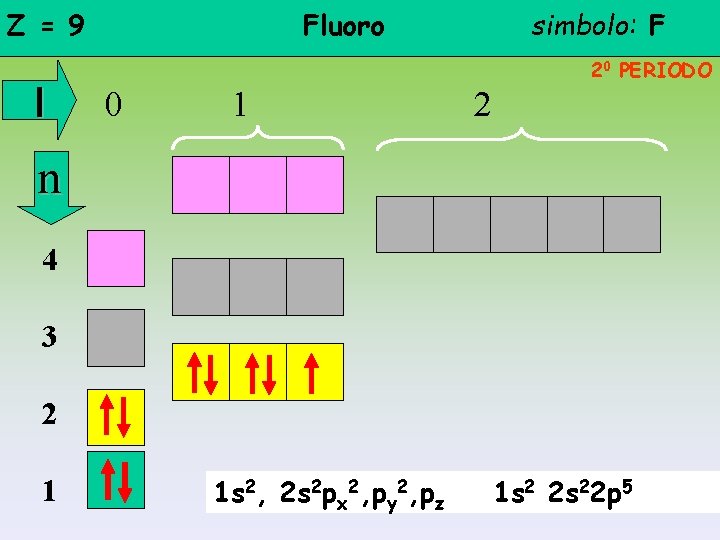
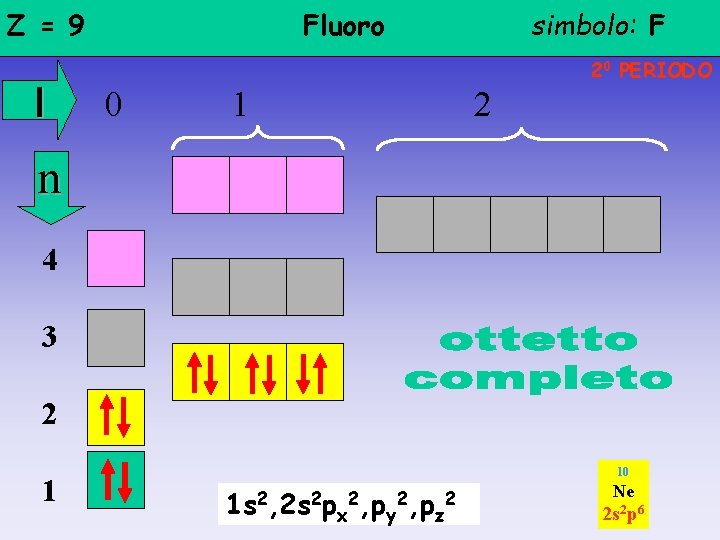
Z = 9 l Fluoro simbolo: F 20 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 1 s 2 2 s 22 p 5

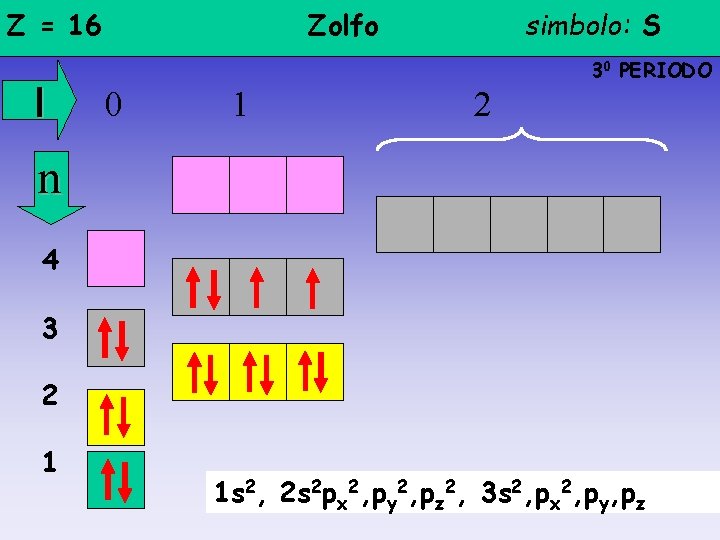
Z = 16 l Zolfo simbolo: S 30 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2, px 2, py, pz

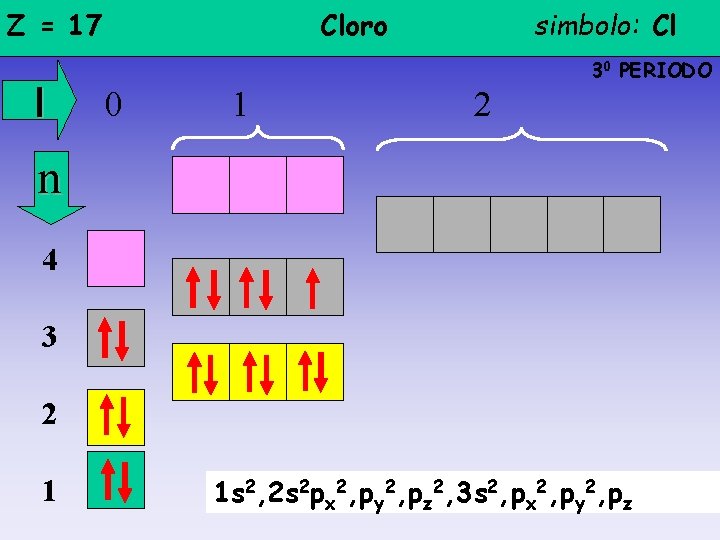
Z = 17 l Cloro simbolo: Cl 30 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2, px 2, py 2, pz

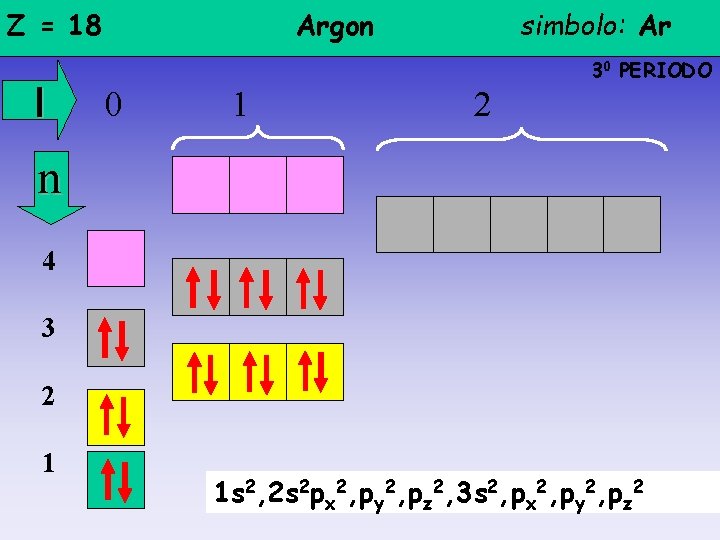
Z = 18 l Argon simbolo: Ar 30 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2, px 2, py 2, pz 2

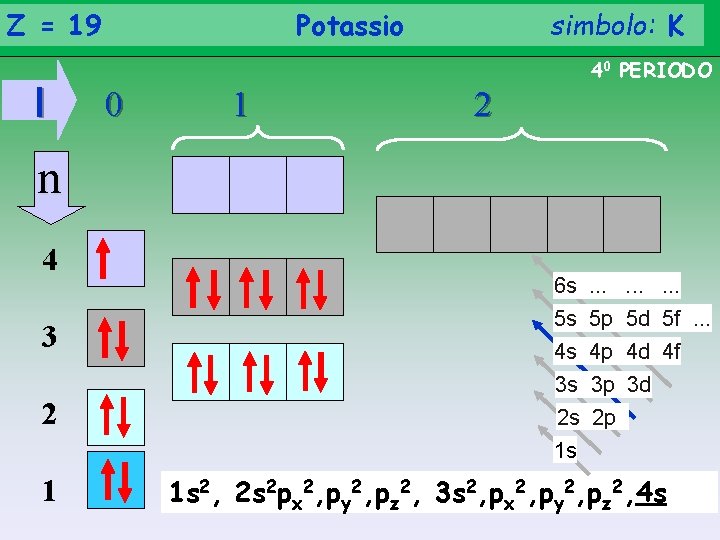
Z = 19 l Potassio simbolo: K 40 PERIODO 0 1 2 n 4 3 2 1 6 s. . 5 s 5 p 5 d 5 f. . . 4 s 4 p 4 d 4 f 3 s 3 p 3 d 2 s 2 p 1 s 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2, px 2, py 2, pz 2, 4 s

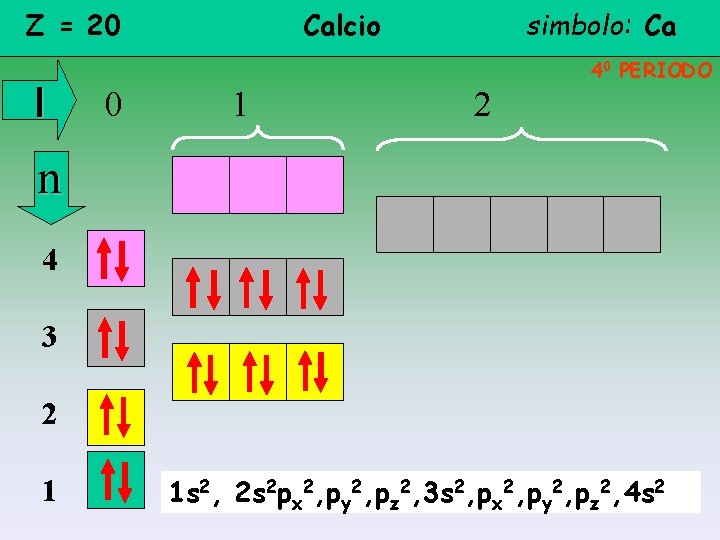
Z = 20 l Calcio simbolo: Ca 40 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2, px 2, py 2, pz 2, 4 s 2

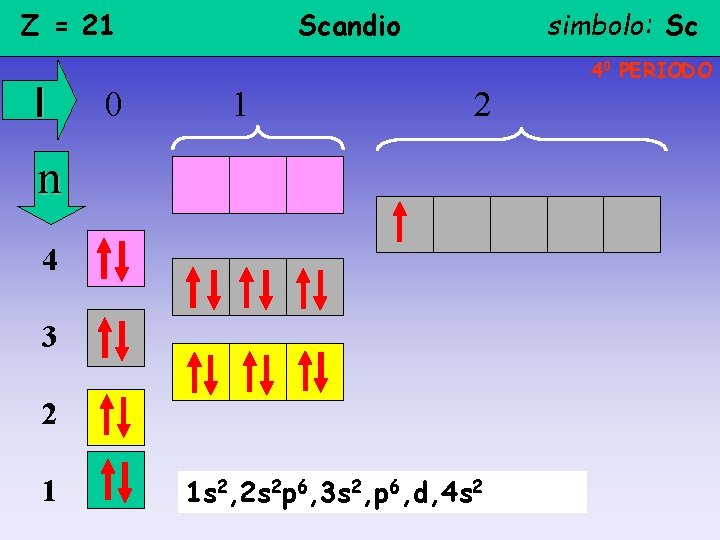
Z = 21 l Scandio simbolo: Sc 40 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 p 6, 3 s 2, p 6, d, 4 s 2

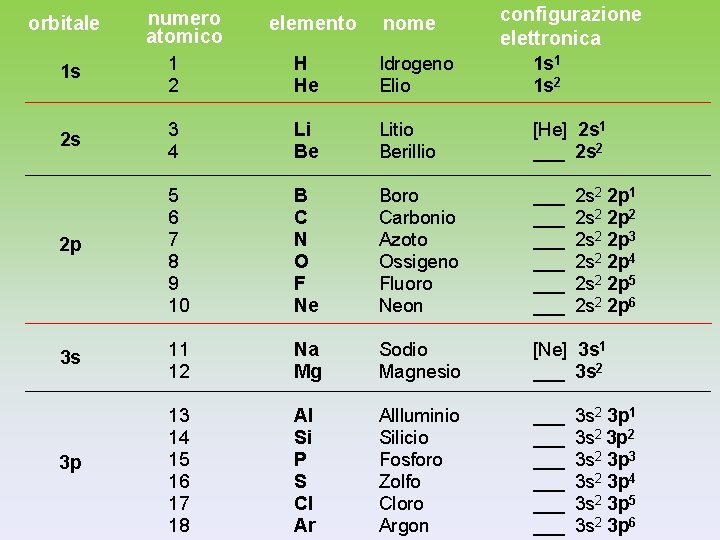
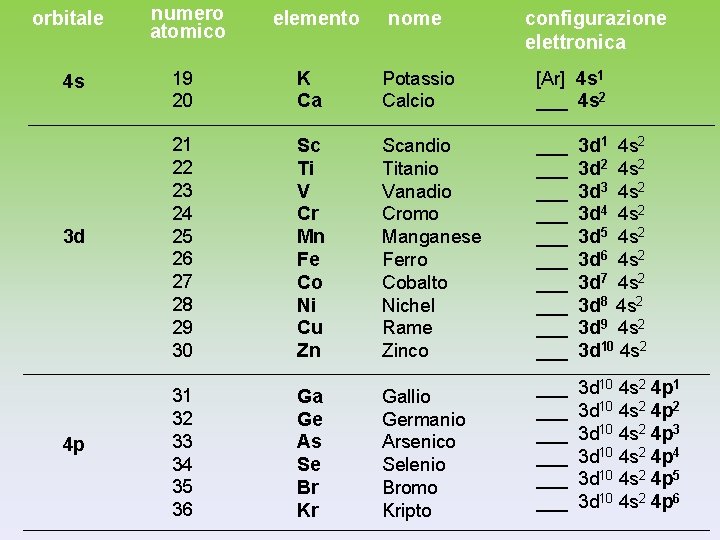
orbitale numero atomico elemento nome configurazione elettronica 1 s 1 2 H He Idrogeno Elio 1 s 1 1 s 2 2 s 3 4 Li Be Litio Berillio [He] 2 s 1 ___ 2 s 2 2 p 5 6 7 8 9 10 B C N O F Ne Boro Carbonio Azoto Ossigeno Fluoro Neon ___ ___ ___ 3 s 11 12 Na Mg Sodio Magnesio [Ne] 3 s 1 ___ 3 s 2 3 p 13 14 15 16 17 18 Al Si P S Cl Ar Allluminio Silicio Fosforo Zolfo Cloro Argon ___ ___ ___ 2 s 2 2 p 1 2 s 2 2 p 2 2 s 2 2 p 3 2 s 2 2 p 4 2 s 2 2 p 5 2 s 2 2 p 6 3 s 2 3 p 1 3 s 2 3 p 2 3 s 2 3 p 3 3 s 2 3 p 4 3 s 2 3 p 5 3 s 2 3 p 6

orbitale 4 s 3 d 4 p numero atomico elemento nome configurazione elettronica 19 20 K Ca Potassio Calcio [Ar] 4 s 1 ___ 4 s 2 21 22 23 24 25 26 27 28 29 30 Sc Ti V Cr Mn Fe Co Ni Cu Zn Scandio Titanio Vanadio Cromo Manganese Ferro Cobalto Nichel Rame Zinco ___ ___ ___ 3 d 1 4 s 2 3 d 2 4 s 2 3 d 3 4 s 2 3 d 4 4 s 2 3 d 5 4 s 2 3 d 6 4 s 2 3 d 7 4 s 2 3 d 8 4 s 2 3 d 9 4 s 2 3 d 10 4 s 2 31 32 33 34 35 36 Ga Ge As Se Br Kr Gallio Germanio Arsenico Selenio Bromo Kripto ___ ___ ___ 3 d 10 4 s 2 4 p 1 3 d 10 4 s 2 4 p 2 3 d 10 4 s 2 4 p 3 3 d 10 4 s 2 4 p 4 3 d 10 4 s 2 4 p 5 3 d 10 4 s 2 4 p 6

Mendeleev, Dmitri Ivanovitch 1834 - 1907 Julius Lothar Meyer 1830 -1895 Tavola periodica degli elementi (1860) Elementi organizzati in base al numero atomico e alle loro caratteristiche chimico-fisiche

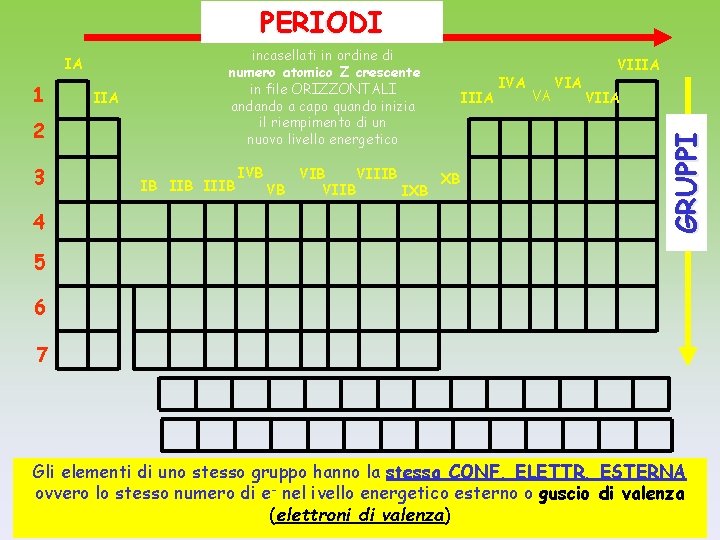
PERIODI 1 2 3 4 IIA incasellati in ordine di numero atomico Z crescente in file ORIZZONTALI andando a capo quando inizia il riempimento di un nuovo livello energetico IB IIIB IVB VB VIIIB XB VIIB IXB IIIA IVA VA VIIIA VIIA GRUPPI IA 5 6 7 Gli elementi di uno stesso gruppo hanno la stessa CONF. ELETTR. ESTERNA ovvero lo stesso numero di e- nel ivello energetico esterno o guscio di valenza (elettroni di valenza)

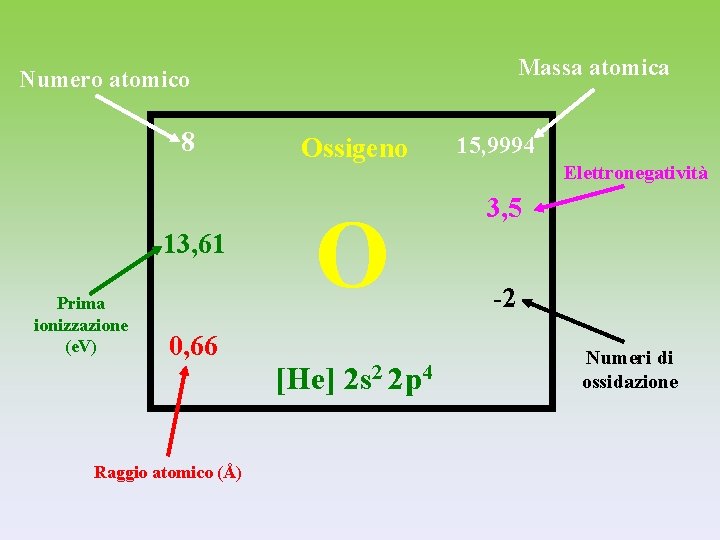
Massa atomica Numero atomico 8 13, 61 Prima ionizzazione (e. V) 0, 66 Raggio atomico (Å) Ossigeno O [He] 2 s 2 2 p 4 15, 9994 Elettronegatività 3, 5 -2 Numeri di ossidazione

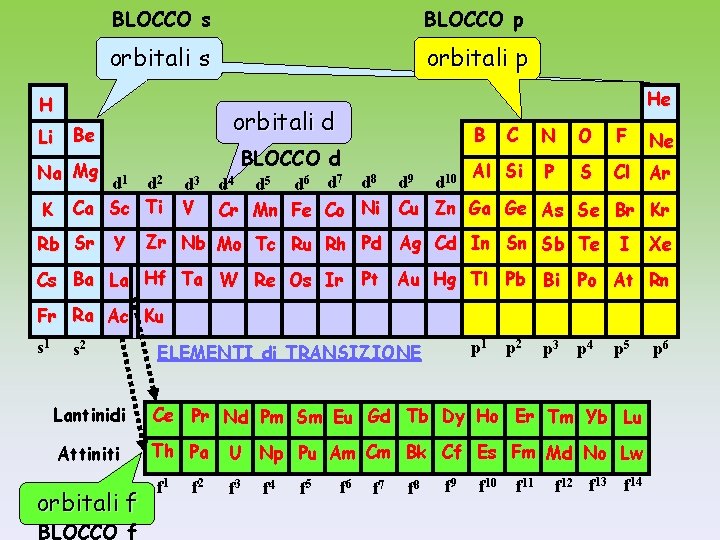
BLOCCO s BLOCCO p orbitali s orbitali p H Li orbitali d Be d 1 d 2 Ca Sc Ti Rb Sr B BLOCCO d Na Mg K He Y d 3 V C N O F Ne Al Si P S Cl Ar d 4 d 5 d 6 d 7 d 8 d 9 d 10 Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Ku s 1 s 2 p 1 ELEMENTI di TRANSIZIONE p 2 p 3 p 4 p 5 Lantinidi Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Attiniti Th Pa orbitali f BLOCCO f f 1 f 2 U Np Pu Am Cm Bk Cf Es Fm Md No Lw f 3 f 4 f 5 f 6 f 7 f 8 f 9 f 10 f 11 f 12 f 13 f 14 p 6

I VIII H He III IV V VI VII Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Ga Ge As Se Br Kr Rb Sr In Sn Sb Te I Xe Cs Ba Tl Pb Bi Po At Rn Elementi di transizione II

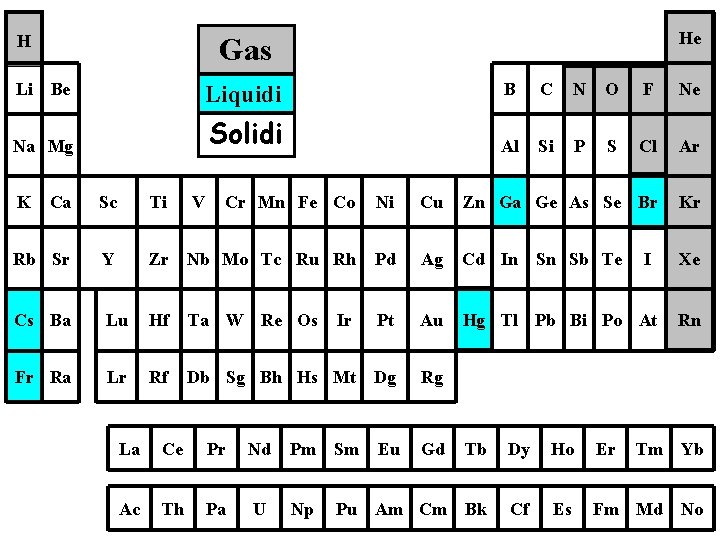
H He Gas Li Be Liquidi B C N O F Ne Na Mg Solidi Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te Xe Cs Ba Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Lr Rf Db Sg Bh Hs Mt Dg Rg I La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Ac Th Pa U Np Am Cm Bk Cf Es Fm Md No Pu

Da ricordare il nome CRISTALLOGENI gli elementi del 14° gruppo (IVA) Da ricordare il nome CALCOGENI gli elementi del 16° gruppo (VIA)


0 18 1 H 1 s (8°) GRUPPO GAS NOBILI 2 He 1 s 2 5 B 6 C 7 N 8 O 9 F 10 Ne 2 s 2 p 2 2 s 2 p 3 2 s 2 p 4 2 s 2 p 5 2 s 2 p 6 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 3 s 3 s 2 p 2 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 3 s 2 p 6 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 2 3 d 6, 4 s 2 3 d 7, 4 s 2 3 d 8, 4 s 2 3 d 10, 4 s 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 5 s 5 s 2 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 4 d 6, 5 s 2 4 d 7, 5 s 2 4 d 8, 5 s 2 4 d 10, 5 s 2 3 Li 4 Be 2 s n s 2 p 6 31 32 32 33 33 34 34 35 35 36 Kr Ga Ge Ge As As Se Se Br Br Kr Ga 4 s p 4 s p 2 2 2 3 2 4 2 5 2 6 4 s 2 p 2 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 4 s 2 p 6 5 s 2 p 2 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5 5 s 2 p 6 2 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe

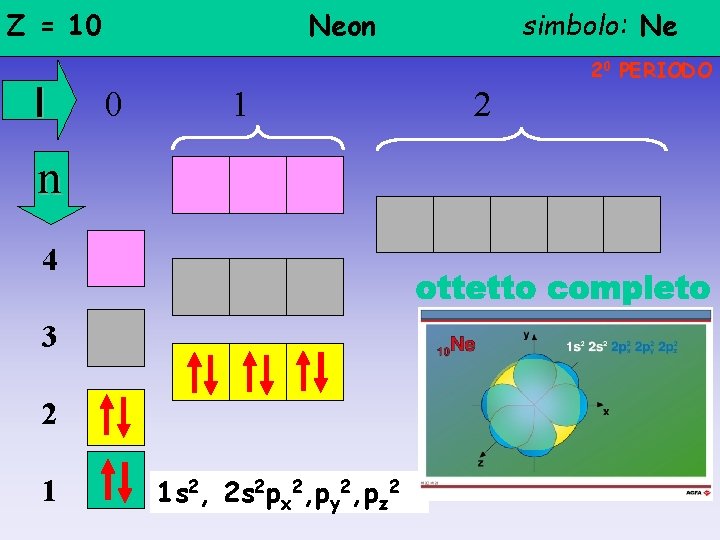
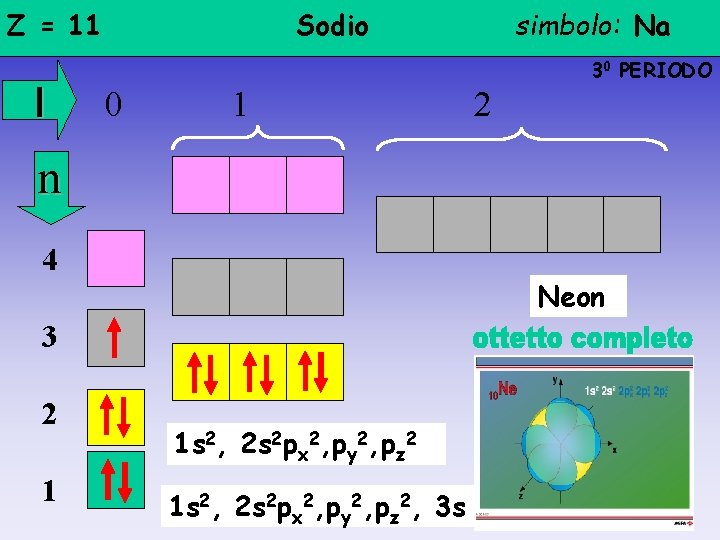
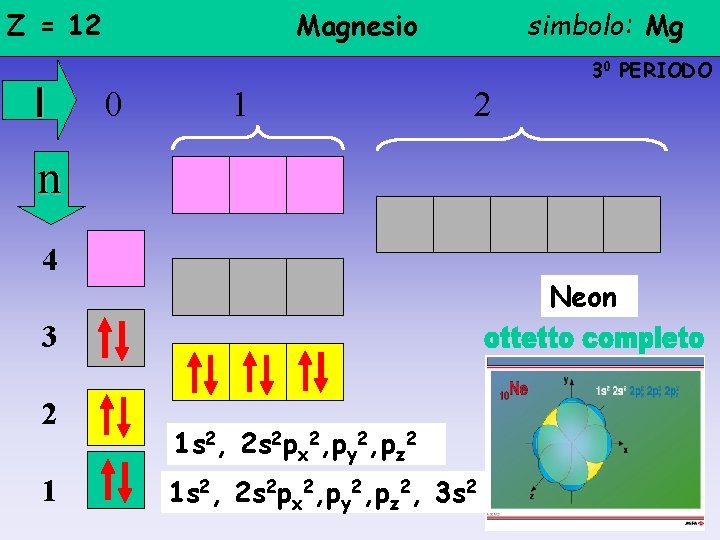
Z = 10 l Neon 20 PERIODO 0 1 n 4 3 2 1 simbolo: Ne 1 s 2, 2 s 2 px 2, py 2, pz 2 2

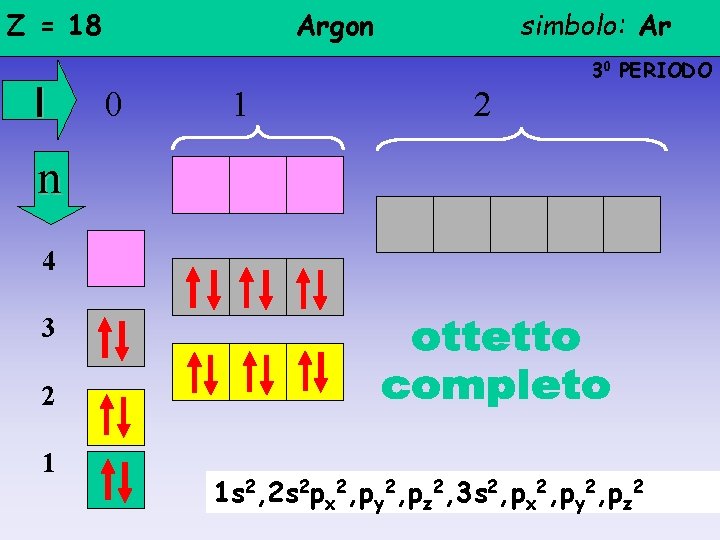
Z = 18 l Argon simbolo: Ar 30 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2, px 2, py 2, pz 2

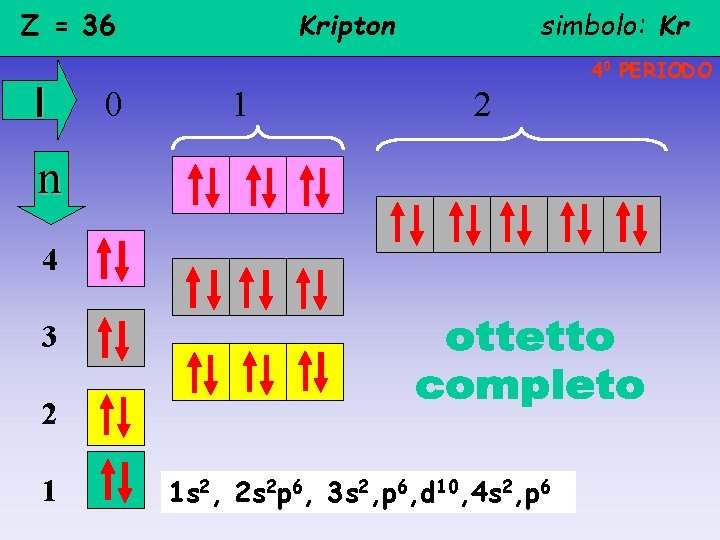
Z = 36 l Kripton simbolo: Kr 40 PERIODO 0 1 2 n 4 3 2 1 1 s 2, 2 s 2 p 6, 3 s 2, p 6, d 10, 4 s 2, p 6

Regola dell’OTTETTO • Il livello più esterno -qualunque esso sia, escluso il 1°- non può ospitare più di 8 elettroni • Gli elettroni periferici si distribuiscono tra l’orbitale s e i 3 orbitali p (esclusi H e He, livello 1°: un orbitale s) • un atomo tende a raggiungere la stabilità di un gas nobile ossia a mostrare un livello esterno completo Gli atomi - dello stesso elemento o di elementi diversi- si avvicinano ed attirano reciprocamente i rispettivi elettroni periferici per raggiungere l’ottetto E’ per questo che gli elementi dell’ XVIII GRUPPO vengono definiti GAS NOBILI (avendo l’ottetto completo non reagiscono: He e non He 2, …)

Z = 11 l Sodio simbolo: Na 30 PERIODO 0 1 2 n 4 Neon 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s

10 1 H GRUPPO 2 He METALLI ALCALINI 1 s 1 s 2 3 Li 4 Be 2 s 2 s 2 11 Na 12 Mg 3 s 3 s 2 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 2 3 d 6, 4 s 2 3 d 7, 4 s 2 3 d 8, 4 s 2 3 d 10, 4 s 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 5 s 5 s 2 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 4 d 6, 5 s 2 4 d 7, 5 s 2 4 d 8, 5 s 2 4 d 10, 5 s 2 n s 1 Elementi appartenenti allo stesso gruppo hanno caratteristiche chimiche simili X Li+ Na+ 5 B 6 C 7 N 8 O 9 F 10 Ne 2 s 2 p 2 2 s 2 p 3 2 s 2 p 4 2 s 2 p 5 2 s 2 p 6 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 3 s 2 p 2 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 3 s 2 p 6 31 32 32 33 33 34 34 35 35 36 Kr Ga Ge Ge As As Se Se Br Br Kr Ga 4 s p 4 s p 2 2 2 3 2 4 2 5 2 6 4 s 2 p 2 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 4 s 2 p 6 5 s 2 p 2 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5 5 s 2 p 6 2 49 In 50 Sn 51 Sb X+ + 1 e. K+ Rb+ 52 Te 53 I 54 Xe

Z = 12 l Magnesio simbolo: Mg 30 PERIODO 0 1 2 n 4 Neon 3 2 1 1 s 2, 2 s 2 px 2, py 2, pz 2, 3 s 2

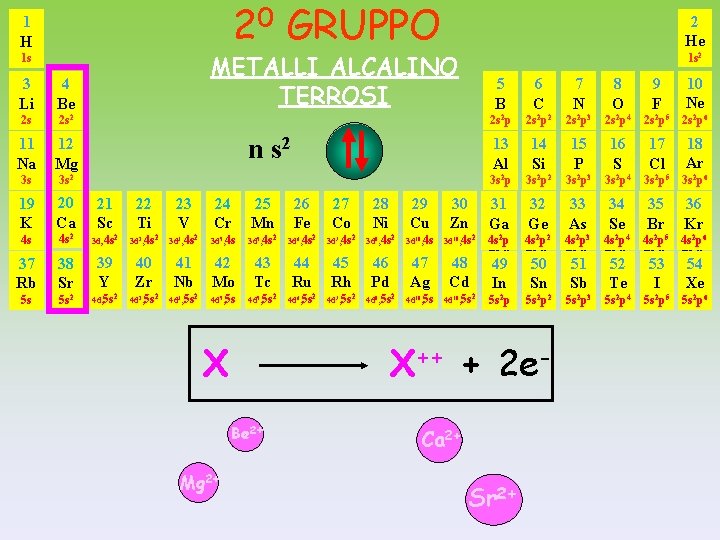
20 GRUPPO 1 H 2 He METALLI ALCALINO TERROSI 1 s 1 s 2 3 Li 4 Be 2 s 2 s 2 11 Na 12 Mg 3 s 3 s 2 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 2 3 d 6, 4 s 2 3 d 7, 4 s 2 3 d 8, 4 s 2 3 d 10, 4 s 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 5 s 5 s 2 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 4 d 6, 5 s 2 4 d 7, 5 s 2 4 d 8, 5 s 2 4 d 10, 5 s 2 n s 2 X 6 C 7 N 8 O 9 F 10 Ne 2 s 2 p 2 2 s 2 p 3 2 s 2 p 4 2 s 2 p 5 2 s 2 p 6 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 3 s 2 p 2 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 3 s 2 p 6 31 32 32 33 33 34 34 35 35 36 Kr Ga Ge Ge As As Se Se Br Br Kr Ga 4 s p 4 s p 2 2 2 3 2 4 2 5 2 6 4 s 2 p 2 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 4 s 2 p 6 5 s 2 p 2 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5 5 s 2 p 6 2 49 In 50 Sn X++ + 2 e. Be 2+ Mg 2+ 5 B Ca 2+ Sr 2+ 51 Sb 52 Te 53 I 54 Xe

Z = 9 l Fluoro simbolo: F 20 PERIODO 0 1 2 n 4 3 2 1 10 1 s 2, 2 s 2 px 2, py 2, pz 2 Ne 2 s 2 p 6

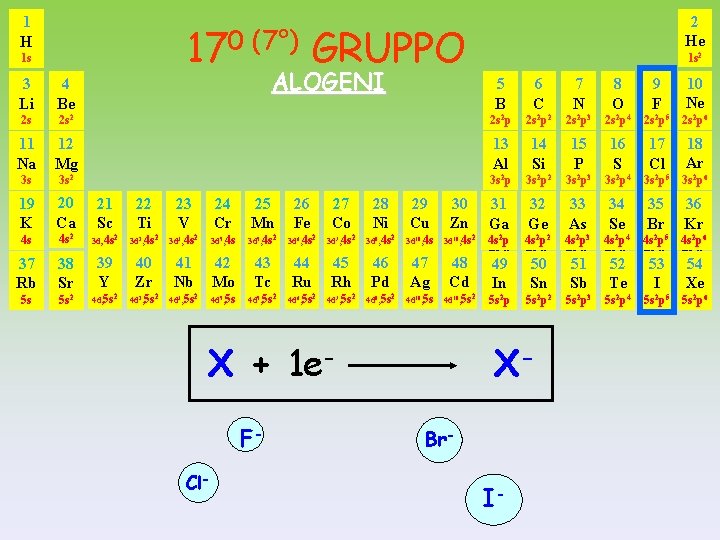
1 H 2 He 170 (7°) GRUPPO 1 s ALOGENI 1 s 2 5 B 6 C 7 N 8 O 9 F 10 Ne 2 s 2 p 2 2 s 2 p 3 2 s 2 p 4 2 s 2 p 5 2 s 2 p 6 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 3 s 3 s 2 p 2 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 3 s 2 p 6 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 2 3 d 6, 4 s 2 3 d 7, 4 s 2 3 d 8, 4 s 2 3 d 10, 4 s 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 5 s 5 s 2 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 4 d 6, 5 s 2 4 d 7, 5 s 2 4 d 8, 5 s 2 4 d 10, 5 s 2 3 Li 4 Be 2 s X + 1 e. FCl- 31 36 31 32 32 33 33 34 34 35 35 36 Kr Ga Ge Ge As As Se Se Br Br Kr Ga 4 s p 4 s p 2 2 2 3 2 4 2 5 2 6 4 s 2 p 2 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 4 s 2 p 6 5 s 2 p 2 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5 5 s 2 p 6 2 49 In 50 Sn XBr- I- 51 Sb 52 Te 53 I 54 Xe

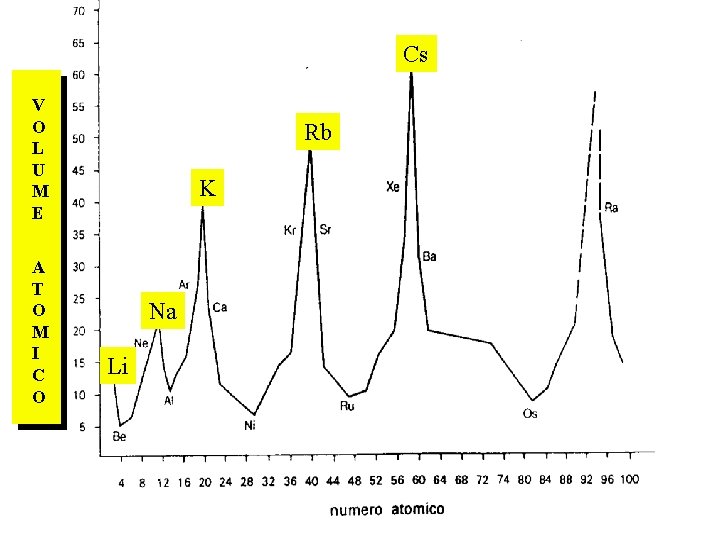
PERIODICITA’ delle proprietà fisiche e chimiche Volume atomico Energia di ionizzazione Affinità elettronica Elettronegatività Carattere metallico

Volume atomico AUMENTA nel GRUPPO DIMINUISCE nel PERIODO

Cs V O L U M E A T O M I C O Rb K Na Li

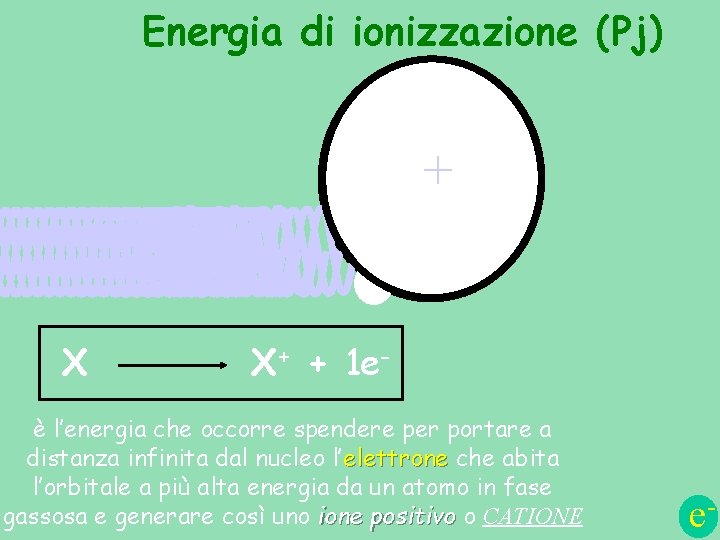
Energia di ionizzazione (Pj) ++ e. X X+ + 1 e- è l’energia che occorre spendere per portare a distanza infinita dal nucleo l’elettrone che abita l’orbitale a più alta energia da un atomo in fase gassosa e generare così uno ione positivo o CATIONE e-

Energia di prima ionizzazione degli elementi diminuisce H 1312 aumenta He 2371 Li Be 520 899 B C N O F Ne 801 1086 1402 1314 1681 2081 Na Mg 496 738 Al Si P S Cl Ar 578 786 1012 1000 1251 1521 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 419 599 631 658 650 652 717 759 758 757 745 906 579 762 947 941 1140 1351 Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te Rb Sr I Xe 403 550 617 661 664 685 702 711 720 804 731 868 558 709 834 869 1008 1170 Pt Au Hg Tl Pb Bi Po At Rn Cs Ba La Hf Ta W Re Os Ir 377 503 538 681 761 770 760 840 880 870 890 1007 589 715 703 812 890 1037

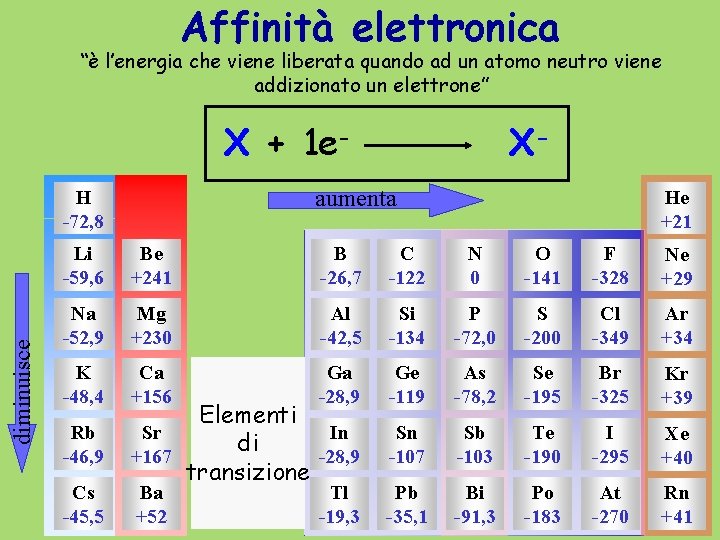
Affinità elettronica “è l’energia che viene liberata quando ad un atomo neutro viene addizionato un elettrone” X + 1 eaumenta H -72, 8 diminuisce XHe +21 Li -59, 6 Be +241 B -26, 7 C -122 N 0 O -141 F -328 Ne +29 Na -52, 9 Mg +230 Al -42, 5 Si -134 P -72, 0 S -200 Cl -349 Ar +34 K -48, 4 Ca +156 Ga -28, 9 Ge -119 As -78, 2 Se -195 Br -325 Kr +39 Sn -107 Sb -103 Te -190 I -295 Xe +40 Pb -35, 1 Bi -91, 3 Po -183 At -270 Rn +41 Rb -46, 9 Cs -45, 5 Elementi Sr In di +167 -28, 9 transizione Ba +52 Tl -19, 3

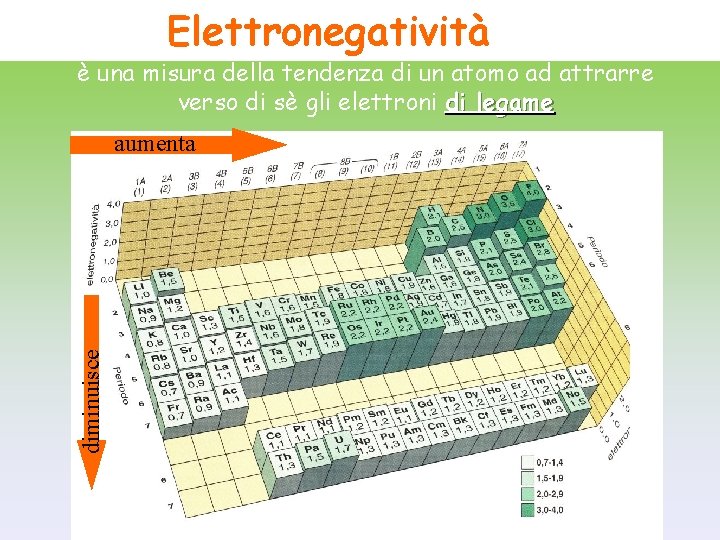
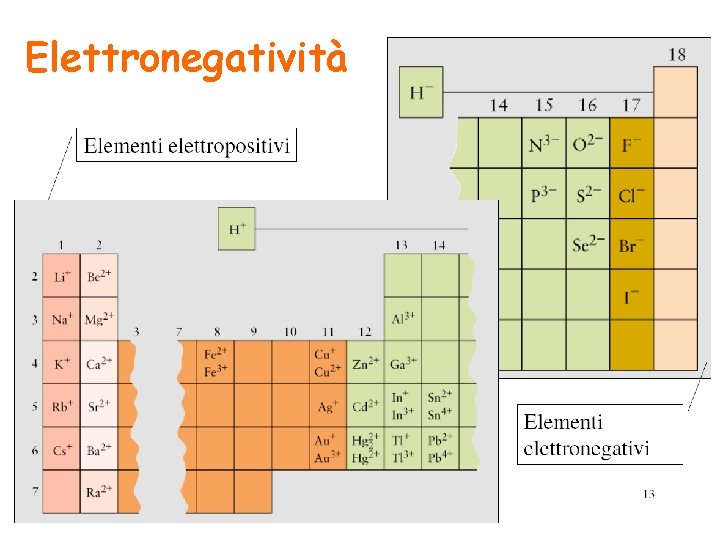
Elettronegatività è una misura della tendenza di un atomo ad attrarre verso di sè gli elettroni di legame diminuisce aumenta

Elettronegatività

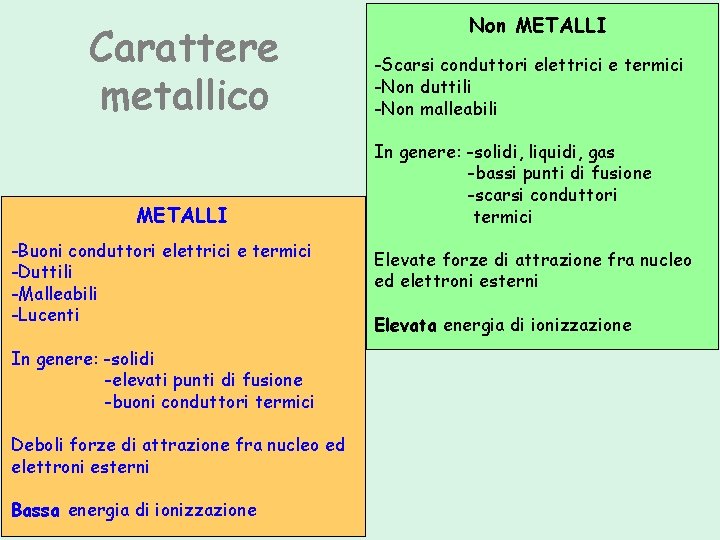
Carattere metallico METALLI -Buoni conduttori elettrici e termici -Duttili -Malleabili -Lucenti In genere: -solidi -elevati punti di fusione -buoni conduttori termici Deboli forze di attrazione fra nucleo ed elettroni esterni Bassa energia di ionizzazione Non METALLI -Scarsi conduttori elettrici e termici -Non duttili -Non malleabili In genere: -solidi, liquidi, gas -bassi punti di fusione -scarsi conduttori termici Elevate forze di attrazione fra nucleo ed elettroni esterni Elevata energia di ionizzazione

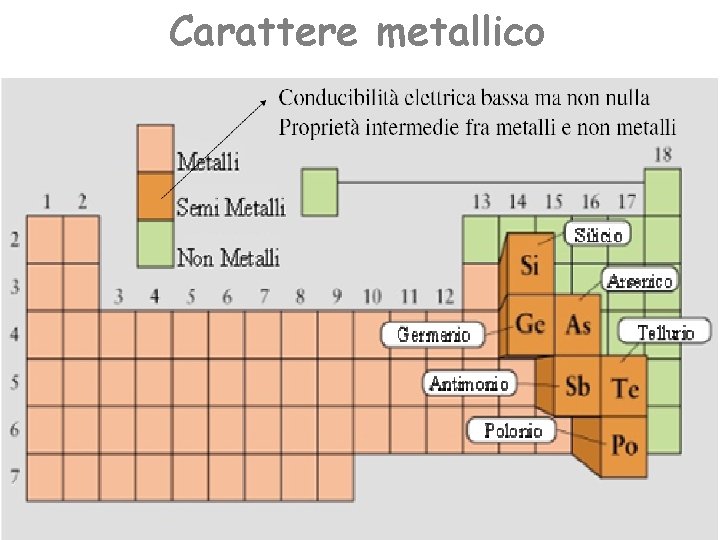
Carattere metallico

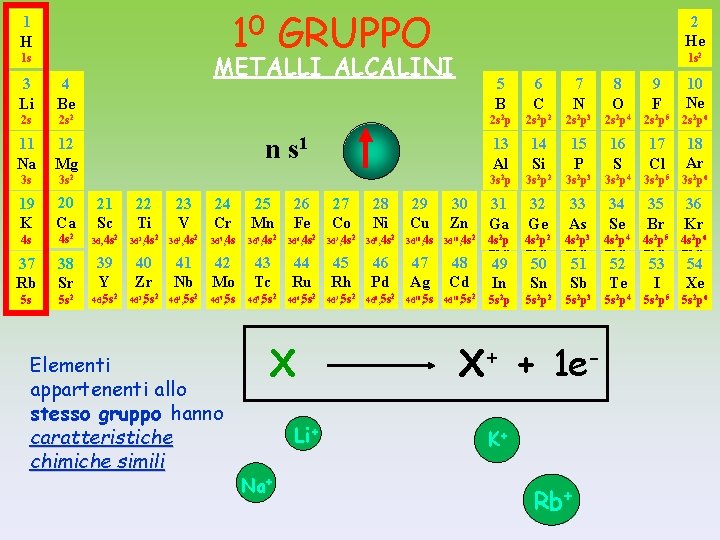
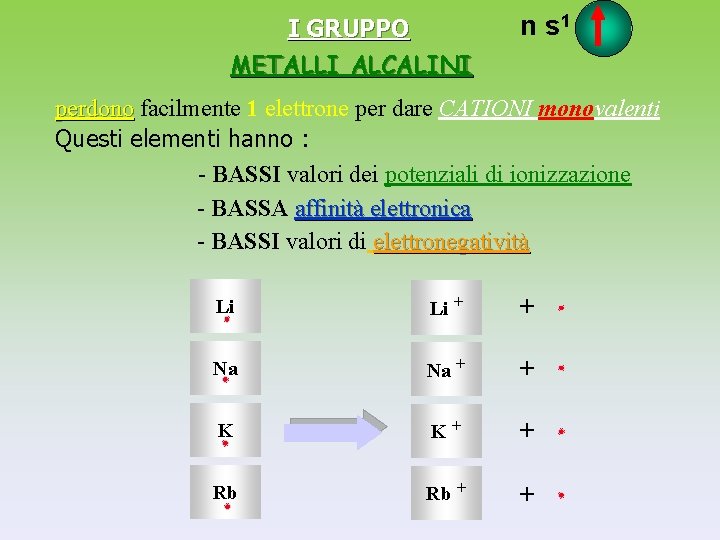
I GRUPPO METALLI ALCALINI n s 1 perdono facilmente 1 elettrone per dare CATIONI monovalenti Questi elementi hanno : - BASSI valori dei potenziali di ionizzazione - BASSA affinità elettronica - BASSI valori di elettronegatività Li Li + + Na Na + + K K+ + Rb Rb + +

II GRUPPO n s 2 METALLI ALCALINO TERROSI perdono facilmente 2 elettroni per dare CATIONI bivalenti Questi elementi hanno : - BASSI valori dei potenziali di ionizzazione - BASSA affinità elettronica - BASSI valori di elettronegatività Be Be 2+ + 2 Mg Mg 2+ + 2 Ca Ca 2+ + 2 Sr Sr 2+ + 2

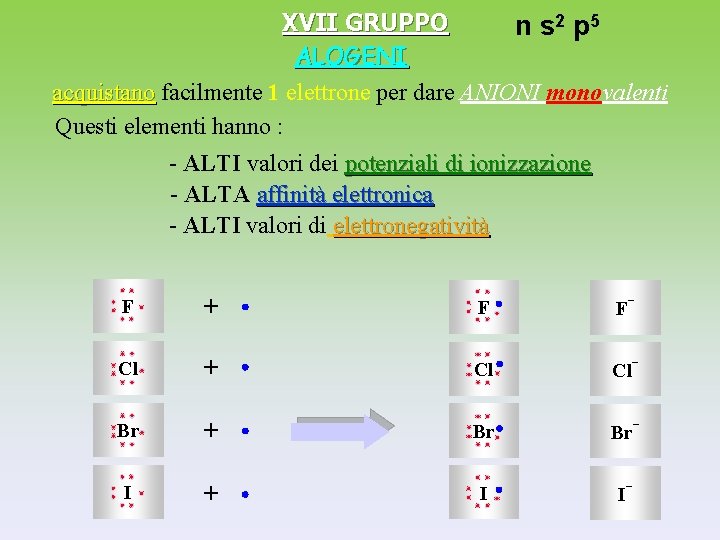
XVII GRUPPO n s 2 p 5 ALOGENI acquistano facilmente 1 elettrone per dare ANIONI monovalenti Questi elementi hanno : - ALTI valori dei potenziali di ionizzazione - ALTA affinità elettronica - ALTI valori di elettronegatività F + F F- Cl + Cl Cl- Br + Br Br- I + I I-
 Breastfeeding assessment score
Breastfeeding assessment score Medicina e chirurgia pisa
Medicina e chirurgia pisa Lettere moderne unipd
Lettere moderne unipd Pdta chirurgia bariatrica
Pdta chirurgia bariatrica Objaw chełmońskiego
Objaw chełmońskiego Lembo di scorrimento
Lembo di scorrimento Chirurgia toracica monza
Chirurgia toracica monza Edmonton obesity staging system
Edmonton obesity staging system Ittero ostruttivo chirurgia
Ittero ostruttivo chirurgia Carta delle professioni museali
Carta delle professioni museali Carta delle professioni museali
Carta delle professioni museali Isfol professioni
Isfol professioni Ms en medicina
Ms en medicina Sensibilidad y especificidad medicina
Sensibilidad y especificidad medicina Universitatea de medicina timisoara
Universitatea de medicina timisoara Facoltà medicina cagliari
Facoltà medicina cagliari Sonda cantor o harris
Sonda cantor o harris Universidad mayor de san simon medicina
Universidad mayor de san simon medicina Universidad austral medicina
Universidad austral medicina Universidad austral de chile facultad de medicina
Universidad austral de chile facultad de medicina Signo de babinski
Signo de babinski Sintec ltda
Sintec ltda P
P Ivn medicina
Ivn medicina Nulla est medicina sine lingua latina
Nulla est medicina sine lingua latina Nulla est medicina sine lingua latina
Nulla est medicina sine lingua latina Unidad docente medicina familiar y comunitaria madrid
Unidad docente medicina familiar y comunitaria madrid Criofobia
Criofobia Fisica in medicina
Fisica in medicina Parafasia fonemica
Parafasia fonemica Eco cus
Eco cus Invia est in medicina via sine lingua latina
Invia est in medicina via sine lingua latina Disegna nel piano quadrettato un rettangolo
Disegna nel piano quadrettato un rettangolo Fevi medicina normal
Fevi medicina normal Instituto de medicina legal dr. roberto masferrer
Instituto de medicina legal dr. roberto masferrer Rmi medicina
Rmi medicina La hora dorada de la sepsis
La hora dorada de la sepsis Heridas cortantes medicina legal
Heridas cortantes medicina legal Gib medicina
Gib medicina Tu medicina, por favor, para que te cures pronto.
Tu medicina, por favor, para que te cures pronto. Fizika ljudskog organizma
Fizika ljudskog organizma Evaluacion preanestesica
Evaluacion preanestesica Helsinška deklaracija
Helsinška deklaracija Npp y npt
Npp y npt Codici classroom unife medicina corsi a scelta
Codici classroom unife medicina corsi a scelta Medicina di gruppo cornedo
Medicina di gruppo cornedo Especificidad y sensibilidad
Especificidad y sensibilidad Studenti prof uniti per
Studenti prof uniti per Que es eso?
Que es eso? Rcu medicina
Rcu medicina Babesuniversity
Babesuniversity Tat in laboratorio
Tat in laboratorio Universitatea de medicină și farmacie victor babeș
Universitatea de medicină și farmacie victor babeș Universidad veracruzana campus minatitlán
Universidad veracruzana campus minatitlán Signo de puño percusion
Signo de puño percusion Medicina u austral
Medicina u austral O que é traumatologia forense
O que é traumatologia forense Sexologia forense conceito
Sexologia forense conceito Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Nc medicina
Nc medicina Erasmus uab medicina
Erasmus uab medicina Notas de peso para medicina
Notas de peso para medicina Medicina sociale definizione
Medicina sociale definizione Matematica e medicina
Matematica e medicina Master medicina trasfusionale
Master medicina trasfusionale Puntos ben shen emociones
Puntos ben shen emociones Nutrición en la biblia
Nutrición en la biblia Objetivo de la medicina familiar
Objetivo de la medicina familiar Vmd medicina
Vmd medicina Semejna medicina
Semejna medicina Rcu medicina
Rcu medicina Yatrofisica
Yatrofisica Sistema henry dactiloscopia
Sistema henry dactiloscopia Uab erasmus
Uab erasmus Rcu medicina
Rcu medicina Sociedad vasca de medicina del trabajo
Sociedad vasca de medicina del trabajo Applicazioni intelligenza artificiale in medicina
Applicazioni intelligenza artificiale in medicina Ale mc
Ale mc Nenad roso
Nenad roso Uam medicina erasmus
Uam medicina erasmus Universitatea de stat de medicina si farmacie
Universitatea de stat de medicina si farmacie Medicina universidad pedro de valdivia
Medicina universidad pedro de valdivia Medicina espe
Medicina espe Holtler
Holtler Alas peruanas medicina costo
Alas peruanas medicina costo Medicina di laboratorio federici
Medicina di laboratorio federici Qoa medicina
Qoa medicina Power point tesis doctoral medicina
Power point tesis doctoral medicina Società italiana di medicina ambientale
Società italiana di medicina ambientale Sportski lekarski pregled
Sportski lekarski pregled Etapele anamnezei
Etapele anamnezei Medicina dello sport coni roma
Medicina dello sport coni roma Don luis hidalgo y carpio
Don luis hidalgo y carpio Examen de cosmetologia 2015
Examen de cosmetologia 2015 Agua embotellada sin fluor
Agua embotellada sin fluor Nero medicina
Nero medicina Enfermedad de addison
Enfermedad de addison Aoe medicina
Aoe medicina

























































































































