Precorsi Test AMMISSIONE Medicina e Chirurgia Professioni Sanitarie












































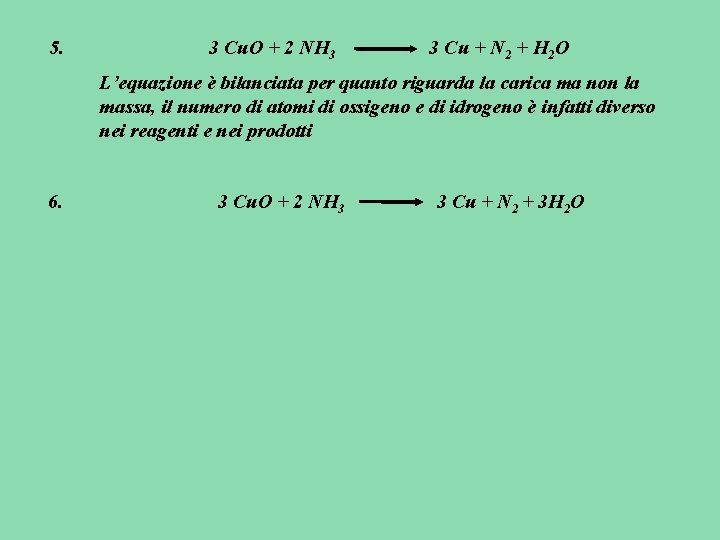


- Slides: 71

Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a. a. 2018 -19

NOMENCLATURA International Union of Pure and Applied Chemisty Scopo: razionalizzare i nomi dei composti in modo che vi sia una correlazione univoca fra la formula e il nome del composto stesso La nomenclatura IUPAC utilizza la definizione di numero di ossidazione e il concetto di elettronegatività Elettronegatività: misura della tendenza di un atomo ad attrarre su di sè gli e- di legame no di ossidazione: La carica che formalmente un atomo acquisterebbe se gli elettroni di legame venissero attribuiti all’atomo più elettronegativo (composti covalenti) Nei composti ionici (monoatomici) coincide in valore e in carica con la sua carica ionica

Ioni monoatomici Ioni positivi (CATIONI) IUPAC: Ione + nome del metallo + numero di ox tradizionale: suffisso –oso (n ox più basso) -ico (n ox più alto) IUPAC tradizionale

Ioni monoatomici Ioni negativi (ANIONI) Ione + nome dell’elemento+ desinenza -uro Eccezioni:

NUMERO DI OSSIDAZIONE Significato formale, viene stabilito in funzione della carica che un atomo ha “apparentemente” in un composto, ammettendo tutti i legami di natura ionica È LA DIFFERENZA TRA IL NUMERO DEGLI ELETTRONI DI VALENZA E QUELLI NEL LEGAME

REGOLE : 1. Per le sostanze elementari, non essendoci differenza di elettronegatività tra gli atomi di uno stesso elemento (legami covalenti puri) si assume uguale a 0 2. Per ioni il n. o. è uguale alla carica dello ione (1°gruppo n. o. =+1; 2°gruppo n. o. =+2; Cl- n. o. =-1) 3. H in un composto è +1 , tranne nei composti con gli elementi dei primi tre gruppi (= idruri) dove è -1 4. O in un composto è -2 (nei perossidi H 2 O 2: -1; nei superossidi HO 2: -1/2; in F 2 O: +2) 5. F ha sempre n. o. =-1. Cl, Br, I hanno n. o. =-1 positivo) (eccetto che negli ossidi dove hanno n. o. 6. Per una molecola neutra la somma algebrica dei n. o di tutti isuoi atomi deve essere uguale a 0 Per uno ione poliatomico la somma dei n. o. di tutti i suoi atomi deve essere uguale alla carica netta dello ione 7. Il n° massimo di ossidazione corrisponde al gruppo al quale appartiene.

Composti BINARI sostanze chimiche a composizione costante formate da due specie elementari

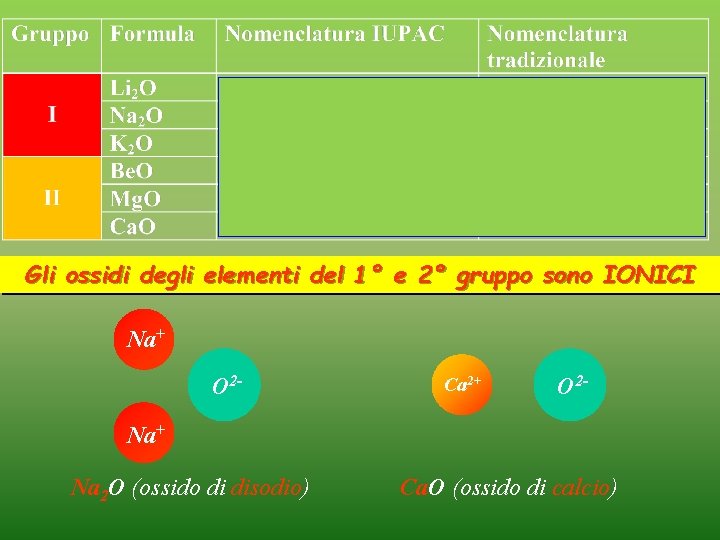
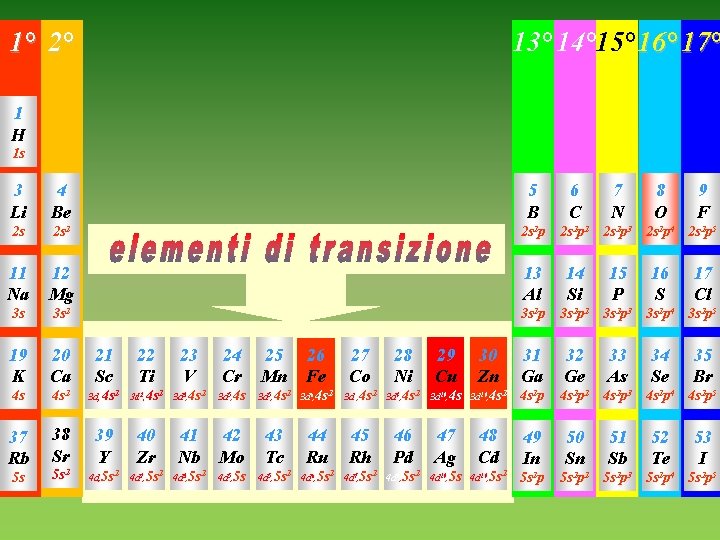
OSSIDI 1° 2° 1 H 1 s 3 Li 4 Be 2 s 13° 14° 15° 16° 17° Gli ossidi sono i composti di combinazione degli elementi con l’ossigeno 5 B 6 C 2 s 2 p 2 11 Na 12 Mg 13 Al 14 Si 3 s 3 s 2 p 2 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 31 Ga 32 Ge 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 2 p 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 49 In 50 Sn 5 s 5 s 2 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 p 2 26 Fe 27 Co 3 d 6, 4 s 2 3 d 7, 4 s 2 44 Ru 45 Rh 4 d 6, 5 s 2 4 d 7, 5 s 2 28 Ni 3 d 8, 4 s 2 46 Pd 4 d 8, 5 s 2 29 Cu 30 Zn 3 d 10, 4 s 2 47 Ag 48 Cd 4 d 10, 5 s 2 7 N 8 O 9 F 2 s 2 p 3 2 s 2 p 4 2 s 2 p 5 15 P 16 S 17 Cl 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 33 As 34 Se 35 Br 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 51 Sb 52 Te 53 I 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5

OSSIDI Gli ossidi sono i composti di combinazione degli elementi con l’OSSIGENO L’ ossigeno negli ossidi ha SEMPRE numero di ossidazione -2 numero di ossidazione= differenza tra il numero degli elettroni di valenza e il numero degli n. o. elettroni di legame ELETTRONEGATIVITA’ Elementi elettro. POSITIVI n. o. positivi Elementi elettro. NEGATIVI n. o. negativi

Gli ossidi degli elementi del 1° e 2° gruppo sono IONICI Na+ O 2 - Ca 2+ O 2 - Na+ Na 2 O (ossido di disodio) Ca. O (ossido di calcio)

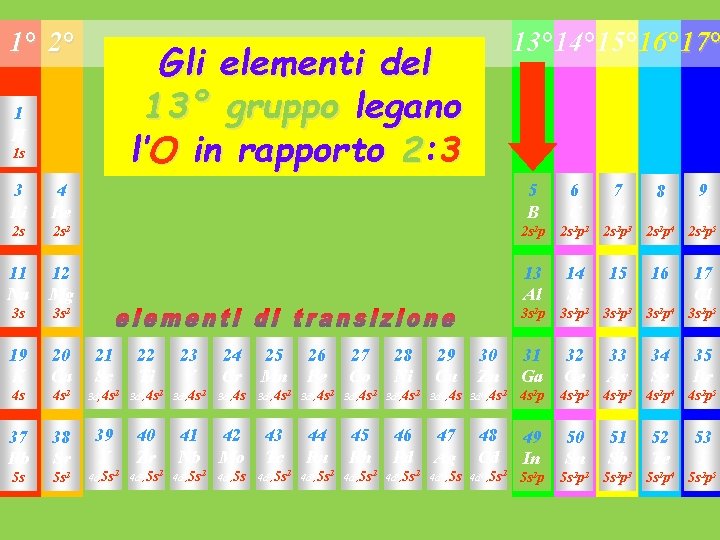
1° 2° 13° 14° 15° 16° 17° Gli elementi del 13° gruppo legano l’O in rapporto 2: 3 1 H 1 s 3 Li 4 Be 5 B 6 C 7 N 2 s 2 s 2 p 2 2 s 2 p 3 11 Na 12 Mg 13 Al 14 Si 15 P 3 s 3 s 2 p 2 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 31 Ga 32 Ge 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 2 p 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 49 In 50 Sn 5 s 5 s 2 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 p 2 26 Fe 27 Co 3 d 6, 4 s 2 3 d 7, 4 s 2 44 Ru 45 Rh 4 d 6, 5 s 2 4 d 7, 5 s 2 28 Ni 3 d 8, 4 s 2 46 Pd 4 d 8, 5 s 2 29 Cu 30 Zn 3 d 10, 4 s 2 47 Ag 48 Cd 4 d 10, 5 s 2 8 O 9 F 2 s 2 p 4 2 s 2 p 5 16 S 17 Cl 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 33 As 34 Se 35 Br 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 51 Sb 52 Te 53 I 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5

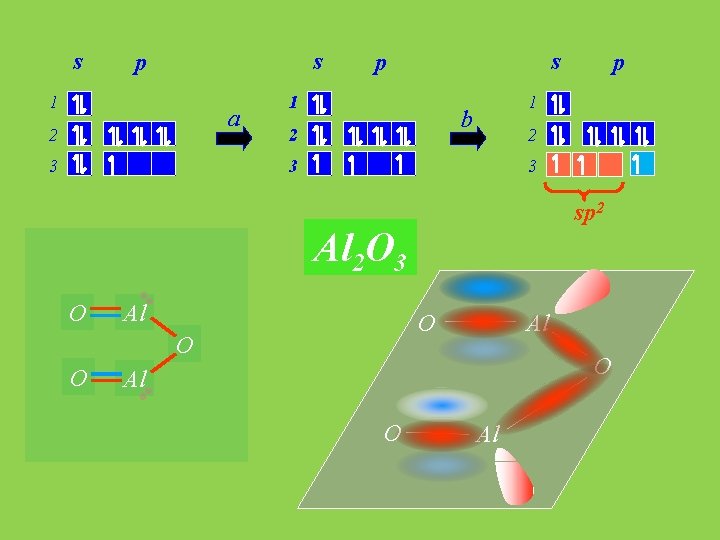
s s p 1 a 2 3 s p 1 1 b 2 p 2 3 3 sp 2 Al 2 O 3 O Al O O O Al

Gli elementi del 13° gruppo legano l’O in rapporto 2: 3 Gli elementi del 14° gruppo si legano all’ O rapporto stechiometrico 1: 2 (non nel monossido di carbonio)

O=C=O xz p O xy s C ss O p promozione s px py pz ibridazione s px py pz sp pz py

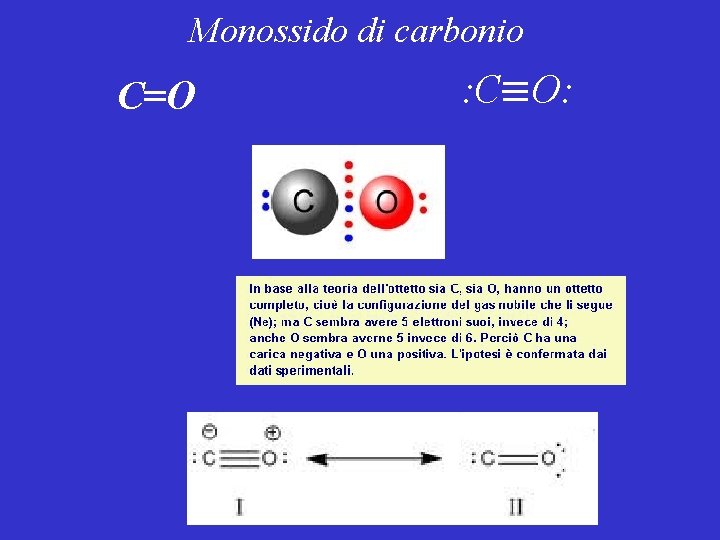
Monossido di carbonio C=O : C O:


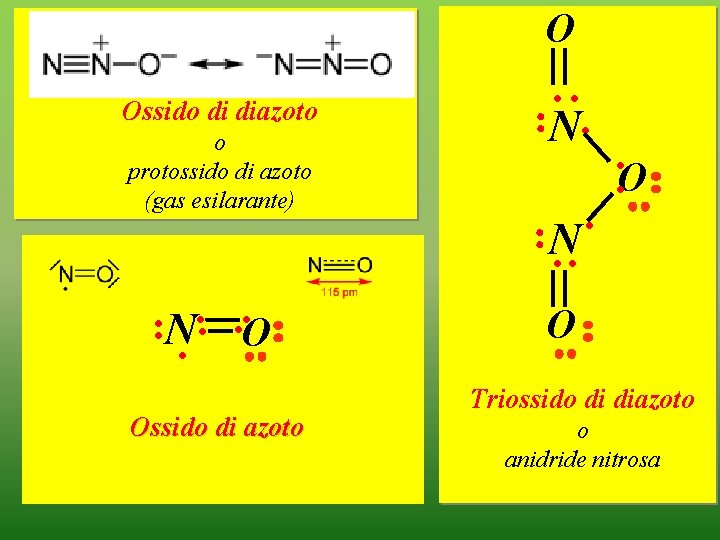
O Ossido di diazoto o protossido di azoto (gas esilarante) ·N·· ··O Ossido di azoto ··N·· ··O ··N·· O Triossido di diazoto o anidride nitrosa

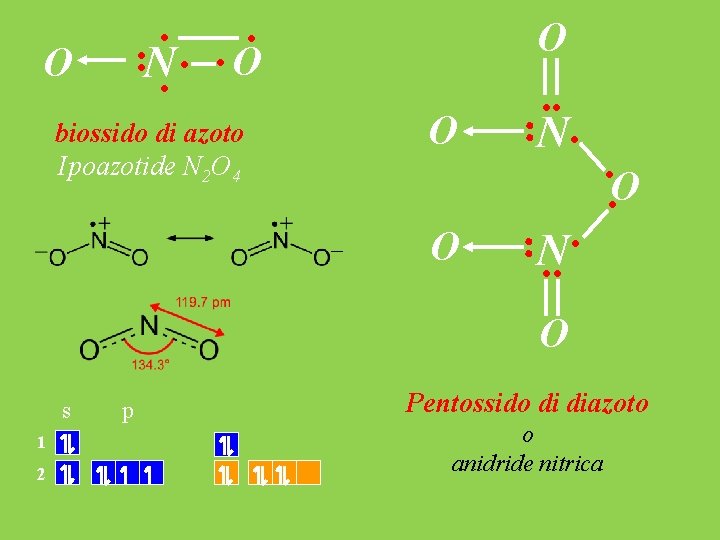
O · · O ·N· · · biossido di azoto Ipoazotide N 2 O 4 O O O ··N·· ··O ···N· O s 1 2 p Pentossido di diazoto o anidride nitrica

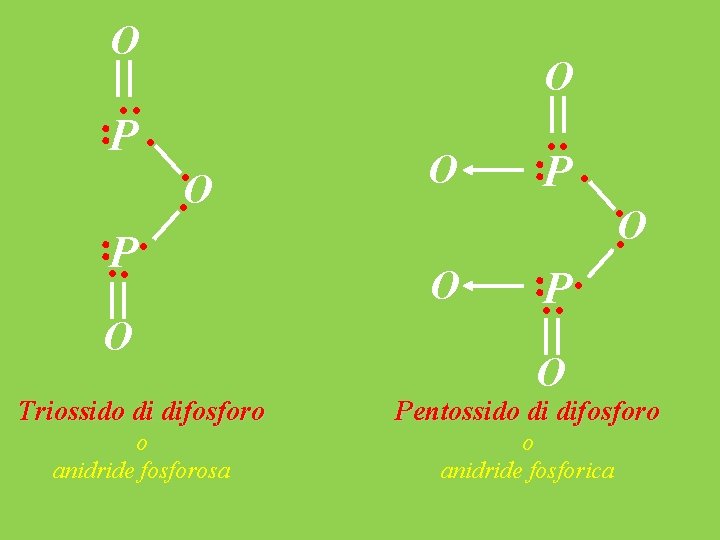
O ·· ·P · ··O ···P· O O ··P· · ··O ···P· O Triossido di difosforo Pentossido di difosforo o anidride fosforosa o anidride fosforica

S O O biossido di zolfo (anidride solforosa) O S O O triossido di zolfo (anidride solforica)

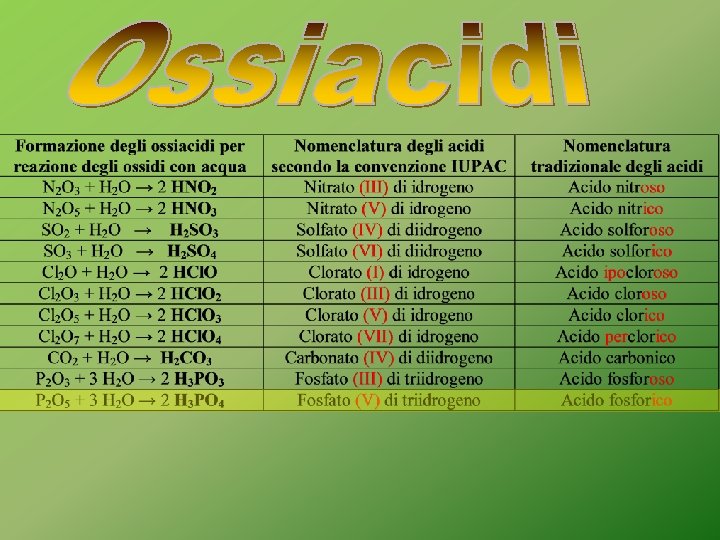
Nella nomenclatura tradizionale, se i numeri di ossidazione sono più di due si ricorre ai prefissi: -Ipo per il N. O. più basso -Per per il N. O. più alto n. o. +1 n. o. +3 n. o. +5 n. o. +7 n. o. +1 n. o. +5 n. o. +7

1° 2° 13° 14° 15° 16° 17° 1 H 1 s 3 Li 4 Be 5 B 6 C 2 s 2 s 2 p 2 11 Na 12 Mg 13 Al 14 Si 3 s 3 s 2 p 2 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 31 Ga 32 Ge 4 s 4 s 2 3 d, 4 s 2 3 d 2, 4 s 2 3 d 3, 4 s 2 3 d 5, 4 s 4 s 2 p 2 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 5 s 2 49 In 50 Sn 4 d, 5 s 2 4 d 2, 5 s 2 4 d 3, 5 s 2 4 d 5, 5 s 2 p 2 5 s 25 Mn 26 Fe 3 d 5, 4 s 2 3 d 6, 4 s 2 44 Ru 27 Co 28 Ni 3 d 7, 4 s 2 3 d 8, 4 s 2 45 Rh 46 Pd 4 d 6, 5 s 2 4 d 7, 5 s 2 4 d 8, 5 s 2 29 Cu 30 Zn 3 d 10, 4 s 2 47 Ag 48 Cd 4 d 10, 5 s 2 7 N 8 O 9 F 2 s 2 p 3 2 s 2 p 4 2 s 2 p 5 15 P 16 S 17 Cl 3 s 2 p 3 3 s 2 p 4 3 s 2 p 5 33 As 34 Se 35 Br 4 s 2 p 3 4 s 2 p 4 4 s 2 p 5 51 Sb 52 Te 53 I 5 s 2 p 3 5 s 2 p 4 5 s 2 p 5

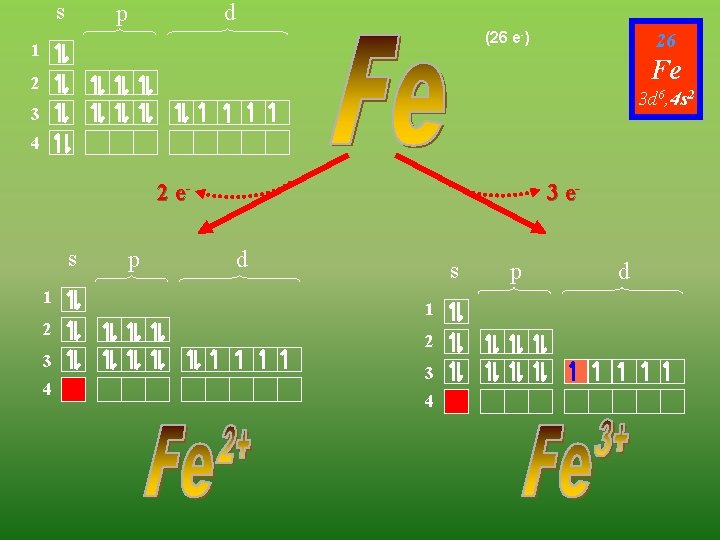
s d p (26 e-) 1 26 Fe 2 3 d 6, 4 s 2 3 4 2 es 1 2 3 4 p 3 ed s 1 2 3 4 p d

s d p 29 (29 e-) 1 Cu 2 3 d 10, 4 s 3 4 es p 2 es d 1 1 2 2 3 3 4 4 p d

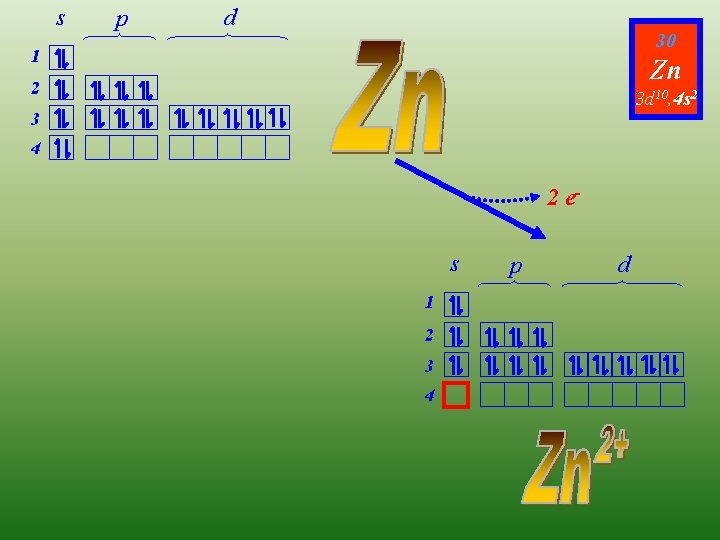
s p d 30 1 Zn 2 3 d 10, 4 s 2 3 4 2 es 1 2 3 4 p d

n. o. +2 n. o. +3 n. o. +1 n. o. +2


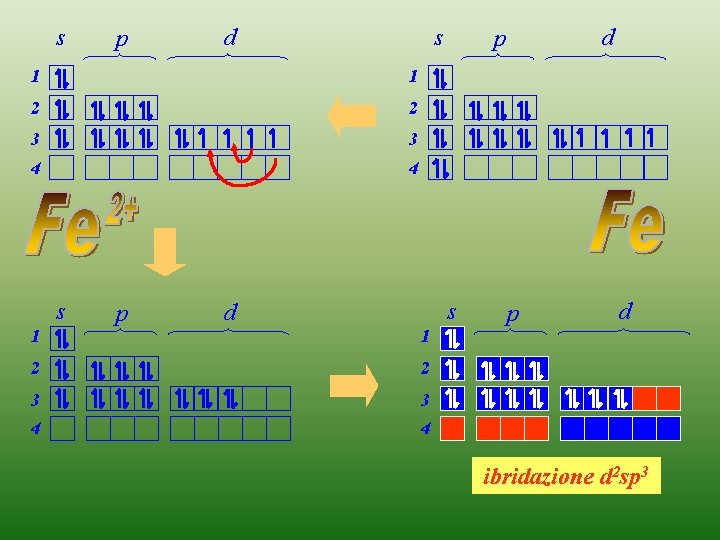
s p s d 1 1 2 2 3 3 4 4 s 1 p s d 1 2 2 3 3 4 4 d p p d ibridazione d 2 sp 3

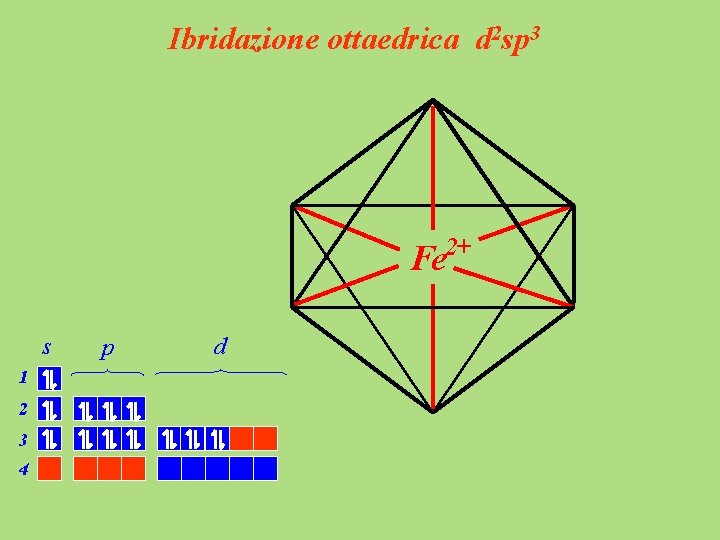
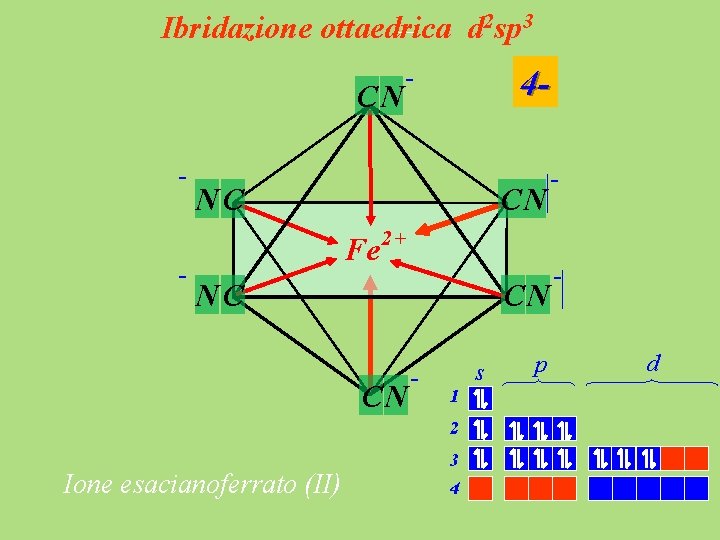
Ibridazione ottaedrica d 2 sp 3 2+ Fe s 1 2 3 4 p d

Ibridazione ottaedrica d 2 sp 3 CN - - 4 - NC CN Fe 2+ NC CN CN - s 1 2 Ione esacianoferrato (II) - 3 4 p d

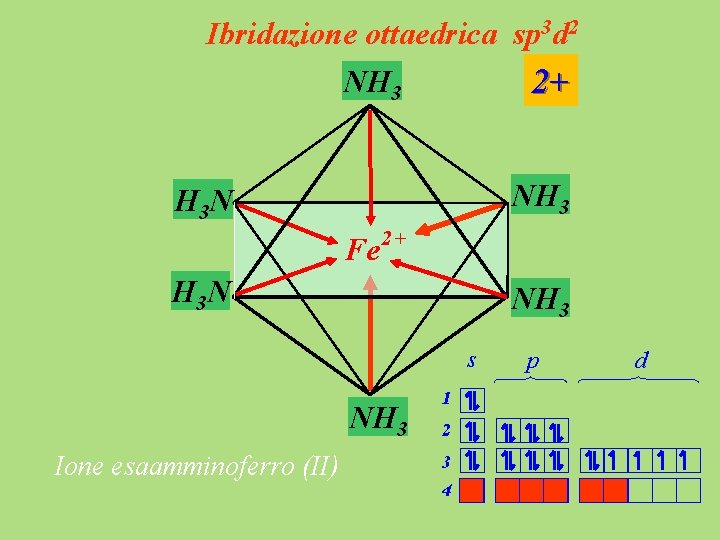
Ibridazione ottaedrica sp 3 d 2 NH 3 2+ NH 3 H 3 N Fe 2+ H 3 N NH 3 s NH 3 Ione esaamminoferro (II) 1 2 3 4 p d

1 2 2 3 3 4 4 NH 3 NH 3 esaamminoferro (II) (paramagnetico) ibridazione sp 3 d 2 p d CNCN- 1 s CNCNCN- d p CN- s esacianoferrato (II) (diamagnetico) ibridazione d 2 sp 3

Si formano per reazione con acqua di un ossido metallico

SO 3 + H 2 O → H 2 SO 4 Acido solforico oppure Solfato (VI) di diidrogeno Si formano per reazione con acqua dell’ossido di un non-metallo

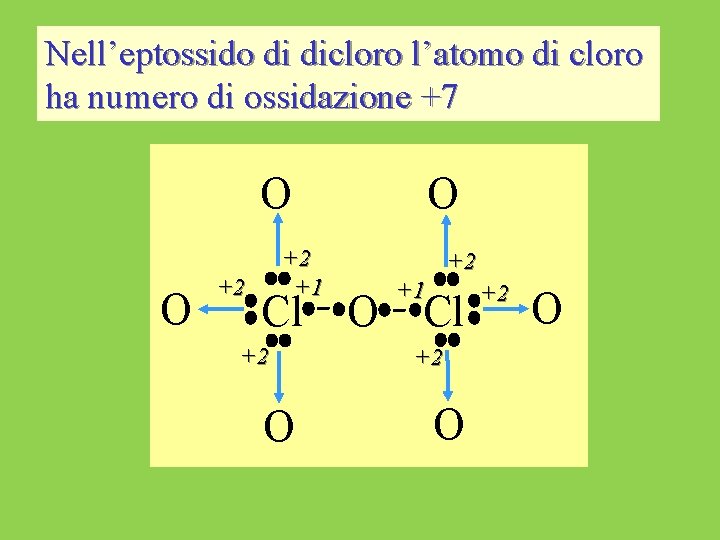
Nell’eptossido di dicloro l’atomo di cloro ha numero di ossidazione +7 O O +2 +2 +1 Cl +2 O O +2 O +1 Cl +2 O

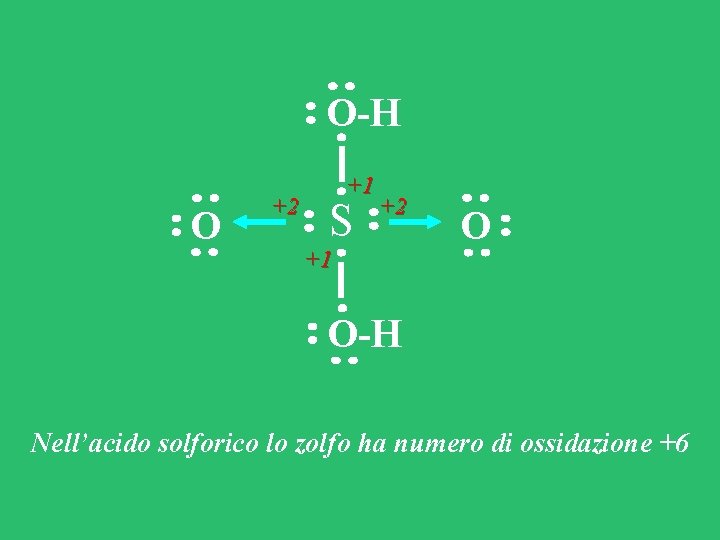
O-H O +2 +1 S +2 +1 O O-H Nell’acido solforico lo zolfo ha numero di ossidazione +6



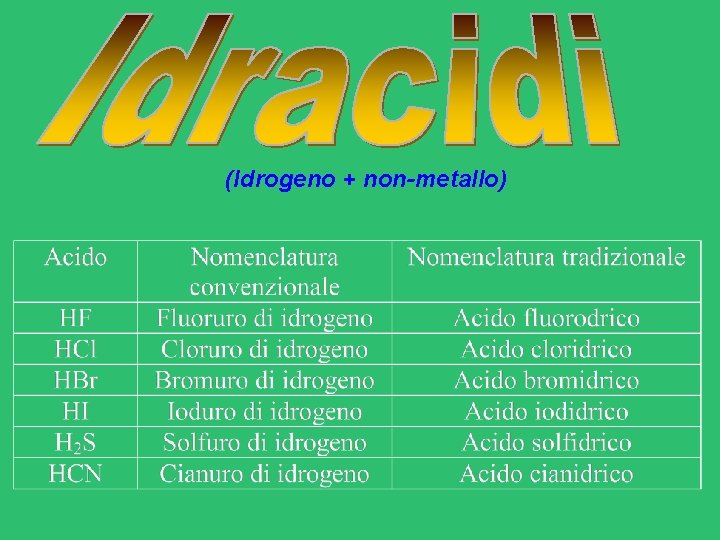
(Idrogeno + non-metallo)



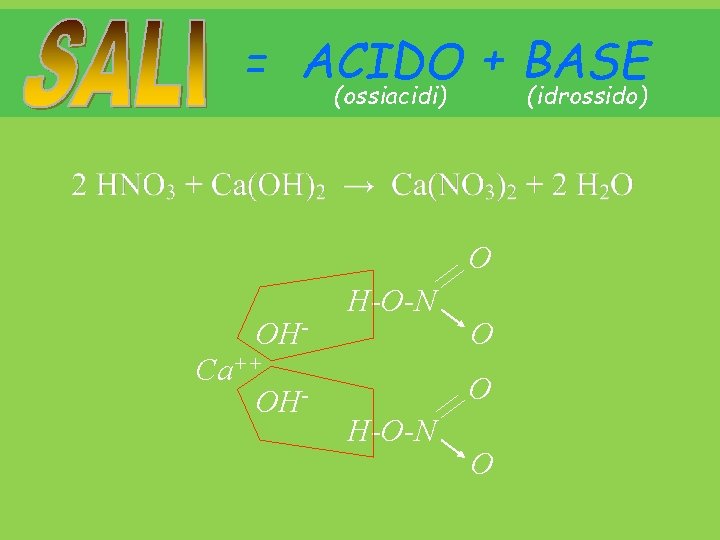
= ACIDO + BASE (ossiacidi) (idrossido) O OHCa++ OH- H-O-N O O H-O-N O

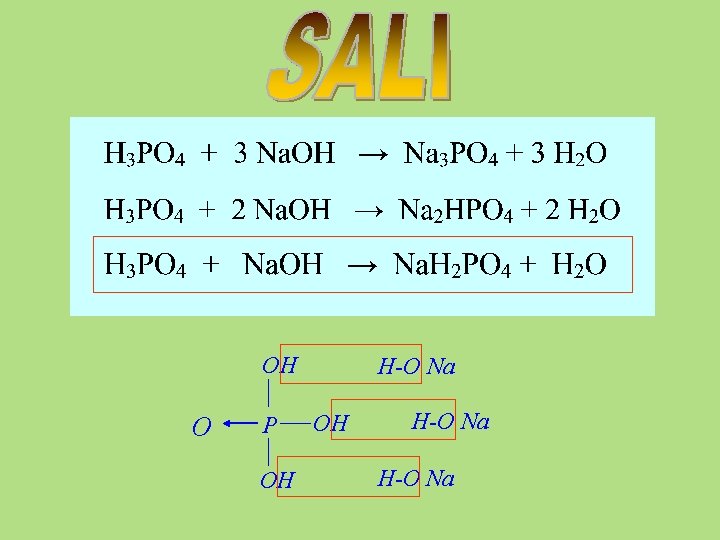
OH O P OH H-O Na


H–O–O–H O 2 -- Perossido di idrogeno n. o. = -1 -. . O. . . . superossido di sodio n. o. = -1/2 . . . O. . perossido di sodio Na+ -. . O. . . + O Na. . . Na+ -. . O. . (acqua ossigenata) O 2 - ione superossido


Una reazione chimica rappresenta un processo di trasformazioni in cui si rompono e si formano legami chimici A + B C + D - A e B: reagenti - C e D: prodotti - , , e : coefficienti stechiometrici

La forma più completa della reazione indica lo stato fisico dei reagenti e dei prodotti C(s) + O 2(g) CO 2(g) Reazione omogenea: i reagenti si trovano nello stesso stato di aggregazione Reazione eterogenea: i reagenti si trovano in stati di aggregazione diversi

Reazione a decorso completo: i reagenti si trasformano quantitativamente nei prodotti: A+B C+D Reazione di equilibrio: i reagenti non si trasformano completamente nei prodotti, ma c’è la contemporanea presenza di reagenti e prodotti: A+B C+D

Stechiometria * La stechiometria di una reazione è la descrizione quantitativa della reazione studiata *La stechiometria studia i rapporti ponderali tra gli elementi nei composti e le relazioni ponderali tra i reagenti e i prodotti in una reazione chimica

I calcoli stechiometrici si basano sull’osservazione dell’ equazione chimica bilanciata, che può essere letta in quattro modi diversi: - numero di unità elementari; - numero di moli; - massa; - volume, solo se i reagenti e i prodotti sono gas e la reazione avviene in condizioni normali (0°C e 1 atm) o se i gas sono nelle stesse condizioni di temperatura e pressione

N 2(g) + 3 H 2(g) 2 NH 3(g) 1 molecola 3 molecole 1 mole 3 moli 28 g 3 x 2 g 2 x 17 g 3 x 22, 4 l* 2 molecole 2 moli *1 mole di gas in condizioni normali, cioè 1 atm e 0°C (273. 16°K), occupa un volume di 22, 4 l che si ricava dall’equazione generale dei gas: PV = n. RT

I coefficienti stechiometrici che compaiono nell’equazione chimica indicano il numero di unità elementari di ogni specie chimica che partecipano alla reazione (atomi, molecole, ioni), ma anche il numero di moli, quindi (noto il peso molecolare delle diverse specie chimiche) la massa e, se i reagenti e i prodotti sono gas e si trovano nelle stesse condizioni di temperatura e di pressione, il volume.

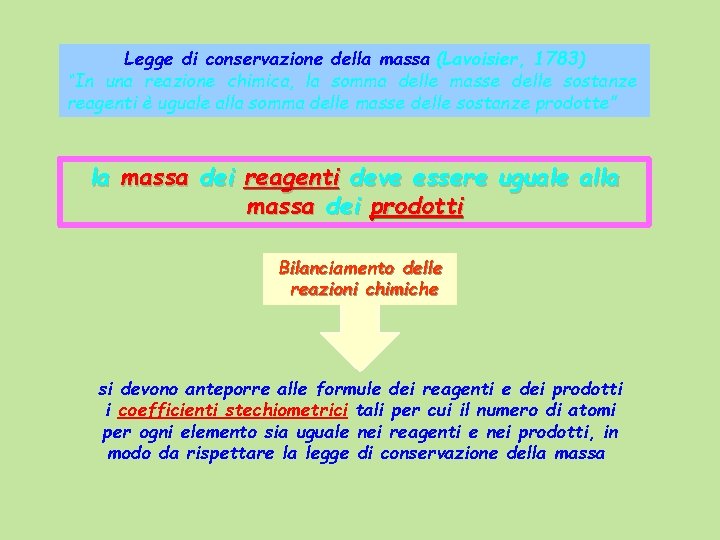
Legge di conservazione della massa (Lavoisier, 1783) “In una reazione chimica, la somma delle masse delle sostanze reagenti è uguale alla somma delle masse delle sostanze prodotte” la massa dei reagenti deve essere uguale alla massa dei prodotti Bilanciamento delle reazioni chimiche si devono anteporre alle formule dei reagenti e dei prodotti i coefficienti stechiometrici tali per cui il numero di atomi per ogni elemento sia uguale nei reagenti e nei prodotti, in modo da rispettare la legge di conservazione della massa

Per bilanciare un’equazione è opportuno seguire le seguenti regole: 1. Contare il numero di atomi di un dato elemento presente nel lato dei reagenti e nel lato dei prodotti; se il numero non è lo stesso aggiungere i coefficienti stechiometrici tali da renderlo uguale in entrambi i lati dell’equazione; 2. ripetere questa operazione per ogni elemento che compare nell’ equazione; 3. è opportuno cominciare a bilanciare da elementi diversi da O e H perché questi elementi compaiono spesso in più di due composti; 4. il coefficiente 1 non si indica; 5. tutti i coefficienti devono avere il minimo valore intero possibile.

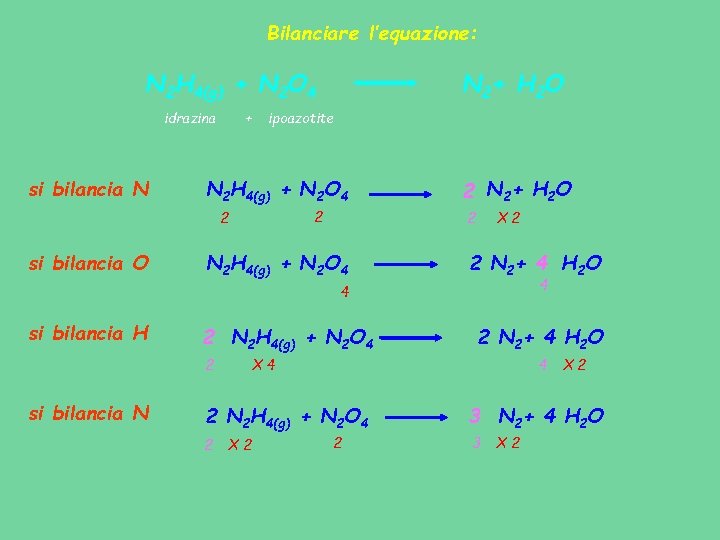
Bilanciare l’equazione: N 2 H 4(g) + N 2 O 4 idrazina si bilancia N + ipoazotite N 2 H 4(g) + N 2 O 4 2 2 si bilancia O N 2+ H 2 O 2 N 2 H 4(g) + N 2 O 4 X 2 2 N 2+ 4 H 2 O 4 4 si bilancia H 2 N 2 H 4(g) + N 2 O 4 2 si bilancia N 4 X 4 2 N 2 H 4(g) + N 2 O 4 2 2 N 2+ 4 H 2 O X 2 2 X 2 3 N 2+ 4 H 2 O 3 X 2

Classificazione delle Reazioni chimiche

Reazioni di sintesi: H 2+ I 2 2 HI Reazione di decomposizione: (un composto si scinde) Ca. CO 3 Ca. O + CO 2 Reazione di dissociazione: (un composto si dissocia liberando ioni) Mg. Cl 2 Mg 2+ + 2 Cl- Reazione di ionizzazione: (un composto reagisce con l’acqua formando ioni positivi e negativi) HCl + H 2 O H 3 O+ Cl-

Reazione di neutralizzazione: (un acido reagisce con una base formando un sale e acqua) Na. OH + HNO 3 Na. NO 3 + H 2 O Reazione di sostituzione: Fe + 2 HCl Fe. Cl 2 + H 2 Reazione di doppio scambio: Ba. Cl 2 + Na 2 SO 4 Ba. SO 4 + Na. Cl

Reazione di combustione: CH 4 + 2 O 2 CO 2 + 2 H 2 O E’ una reazione di ossidoriduzione in cui una sostanza (combustibile) si ossida a opera di una seconda sostanza (comburente), di solito ossigeno, con sviluppo di energia termica

Reazioni chimiche si compiono con il trasferimento di elettroni da un elemento, ione o radicale a un altro

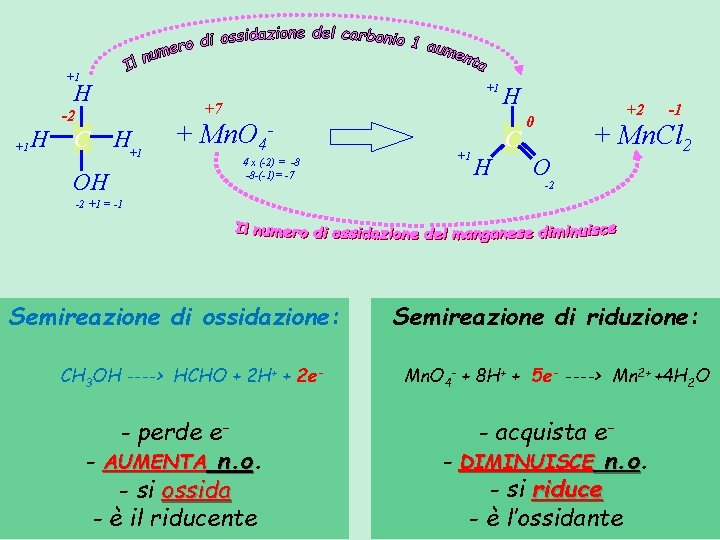
REAZIONI DI OSSIDO-RIDUZIONE Rid 1 + Ox 2 Semireazione di ossidazione: Rid 1 ----> Ox 1 + ne- perde e- AUMENTA n. o - si ossida - è il riducente Ox 1 + Rid 2 Semireazione di riduzione: Ox 2 + ne- ----> Rid 2 - acquista e- DIMINUISCE n. o - si riduce - è l’ossidante

+1 H +1 +7 -2 +1 H C H+1 OH + Mn. O 44 x (-2) = -8 -8 -(-1)= -7 +1 H C H +2 0 O -1 + Mn. Cl 2 -2 -2 +1 = -1 Semireazione di ossidazione: CH 3 OH ----> HCHO + 2 H+ + 2 e- - perde e- AUMENTA n. o - si ossida - è il riducente Semireazione di riduzione: Mn. O 4 - + 8 H+ + 5 e- ----> Mn 2+ +4 H 2 O - acquista e- DIMINUISCE n. o - si riduce - è l’ossidante

Non possono esistere processi di ossidazione se non necessariamente accompagnati da processi di riduzione

Bilanciamento di reazioni redox

1. Calcolare i numeri di ossidazione di tutti gli elementi; 2. Identificare, quindi, in base alla variazione del numero di ossidazione, la specie che si ossida e quella che si riduce; 3. Scrivere le due semireazioni; 4. Bilanciare le cariche elettriche moltiplicando ciascuna delle due semireazioni per un coefficiente stechiometrico tale per cui il numero di elettroni ceduti dal riducente sia uguale a quello degli elettroni acquistati dall’ossidante; 5. Scrivere i coefficienti così calcolati nell’equazione di reazione e verificare che sia completamente bilanciata;

(+2) (-2) 1. (-3) (+1) (0) 3 Cu O + 2 NH 3 (0) 3 Cu + N 2 + 3 H 2 O 2. Cu si riduce perché il suo N. O. diminuisce passando da +2 a 0; N si ossida per che il suo N. O. aumenta passando da -3 a 0; 3. Le due semireazioni sono: (+2) (0) Cu + 2 e- Cu (-3) riduzione (0) N N + 3 e- ossidazione 4. Occorre quindi moltiplicare per 3 la semireazione di riduzione e per 2 la semireazione di ossidazione per cui: (+2) 3 x ( Cu + 2 e- (0) Cu ) e (-3) 2 x(N (0) N + 3 e-)
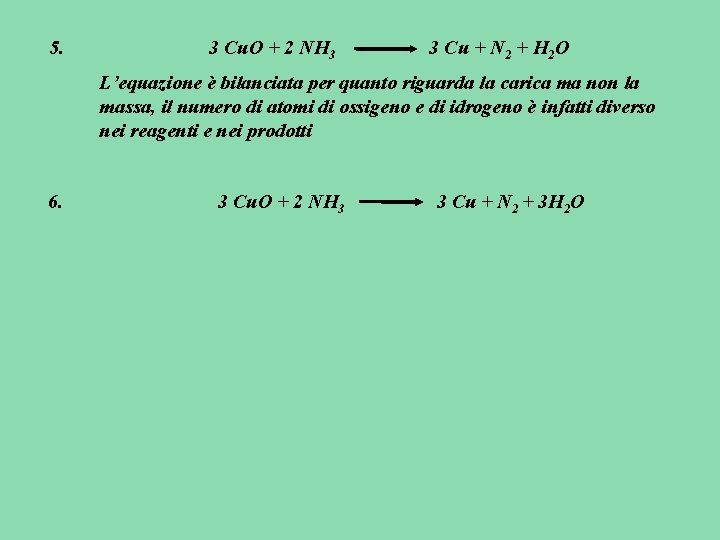
5. 3 Cu. O + 2 NH 3 3 Cu + N 2 + H 2 O L’equazione è bilanciata per quanto riguarda la carica ma non la massa, il numero di atomi di ossigeno e di idrogeno è infatti diverso nei reagenti e nei prodotti 6. 3 Cu. O + 2 NH 3 3 Cu + N 2 + 3 H 2 O
Calcoli stechiometrici

Calcolare il numero di moli di NH 3 prodotte dalla reazione di 6, 33 moli di H 2: La reazione di sintesi dell’ammoniaca (NH 3) è: N 2 + 3 H 2 2 NH 3 3 mol H 2 : 2 mol NH 3 = 6, 33 mol H 2 : x mol NH 3 x = 2 mol NH 3 x 6, 33 mol H 2 = 4, 22 mol NH 3

Calcolare i grammi di NH 3 (PM= 17 g/mol) ottenuti da 2, 3 mol di N 2: N 2 + 3 H 2 2 NH 3 1 mol N 2 : 2 mol NH 3 = 2, 3 mol N 2 : x mol NH 3 x= Moli = 2 mol NH 3 x 2, 3 mol N 2 grammi PM (NH 3) 1 mol N 2 = 4, 6 mol NH 3 grammi = 4, 6 mol x 17 g/mol = 78 g NH 3
 Breastfeeding assessment score
Breastfeeding assessment score Medicina e chirurgia pisa
Medicina e chirurgia pisa Avvisi ammissione unipd
Avvisi ammissione unipd Chirurgia bariatrica varese
Chirurgia bariatrica varese Zapalenie przyczepka sieciowego leczenie
Zapalenie przyczepka sieciowego leczenie Autonomizzazione lembo
Autonomizzazione lembo Chirurgo toracico monza e brianza
Chirurgo toracico monza e brianza Eoss edmonton obesity staging system
Eoss edmonton obesity staging system Epaticodigiunostomia
Epaticodigiunostomia Carta nazionale delle professioni museali 2020
Carta nazionale delle professioni museali 2020 Carta delle professioni museali
Carta delle professioni museali Isfol professioni
Isfol professioni Ms en medicina
Ms en medicina Sensibilidad y especificidad medicina
Sensibilidad y especificidad medicina Universitatea de medicina timisoara
Universitatea de medicina timisoara Facoltà di medicina cagliari
Facoltà di medicina cagliari Sonda nasogastrica ewald
Sonda nasogastrica ewald Universidad mayor de san simon medicina
Universidad mayor de san simon medicina Universidad austral medicina
Universidad austral medicina Casosclinicosnn
Casosclinicosnn Rueda dentada medicina
Rueda dentada medicina Sintec
Sintec Soba medicina
Soba medicina Ulcera neuroisquemica
Ulcera neuroisquemica Nulla est medicina sine lingua latina
Nulla est medicina sine lingua latina Invia est in medicina via sine lingua latina
Invia est in medicina via sine lingua latina Unidad docente medicina familiar y comunitaria madrid
Unidad docente medicina familiar y comunitaria madrid Criofobia
Criofobia Fisica in medicina
Fisica in medicina Parafasia fonemica
Parafasia fonemica Cus ecografia
Cus ecografia Invia est in medicina via sine
Invia est in medicina via sine Disegna nel piano quadrettato un rettangolo
Disegna nel piano quadrettato un rettangolo Fevi normal
Fevi normal Instituto de medicina legal dr. roberto masferrer
Instituto de medicina legal dr. roberto masferrer Rmi medicina
Rmi medicina Hora dorada medicina
Hora dorada medicina Armas atipicas
Armas atipicas Gib medicina
Gib medicina Tu medicina, por favor, para que te cures pronto.
Tu medicina, por favor, para que te cures pronto. Fizika u medicini 1
Fizika u medicini 1 Asa medicina
Asa medicina Helsinška deklaracija medicina
Helsinška deklaracija medicina Npt y npp
Npt y npp Codici classroom unife medicina corsi a scelta
Codici classroom unife medicina corsi a scelta Medicina di gruppo cornedo
Medicina di gruppo cornedo Especificidad y sensibilidad
Especificidad y sensibilidad Studenti e prof uniti per
Studenti e prof uniti per Rr2tss definicion
Rr2tss definicion Dpdk rcu
Dpdk rcu University of medicine and pharmacy timisoara
University of medicine and pharmacy timisoara Tat medicina
Tat medicina Universitatea de medicină și farmacie victor babeș
Universitatea de medicină și farmacie victor babeș Universidad veracruzana minatitlan
Universidad veracruzana minatitlan Puño percusion positiva
Puño percusion positiva Universidad austral de chile facultad de medicina
Universidad austral de chile facultad de medicina Espectro de legrand du saulle
Espectro de legrand du saulle Sexologia forense
Sexologia forense Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Nc medicina
Nc medicina Intercanvis medicina uab
Intercanvis medicina uab Notas de peso para medicina
Notas de peso para medicina Medicina sociale cosa studia
Medicina sociale cosa studia Matematica e medicina
Matematica e medicina Master medicina trasfusionale
Master medicina trasfusionale Las 7 emociones medicina china
Las 7 emociones medicina china Que tu alimento sea tu medicina biblia
Que tu alimento sea tu medicina biblia Objetivo de la medicina familiar
Objetivo de la medicina familiar Vmd medicina
Vmd medicina Semejna medicina
Semejna medicina Rcu medicina
Rcu medicina Yatrofisica
Yatrofisica































































































