Precorsi Test AMMISSIONE Medicina e Chirurgia Professioni Sanitarie
































![2 O 3 3 O 2 K= [O 2]3 [O 3]2 = 2, 5 2 O 3 3 O 2 K= [O 2]3 [O 3]2 = 2, 5](https://slidetodoc.com/presentation_image_h/3445b676e50deed99bdb7270befdb4ce/image-48.jpg)

![Na. Cl Na+ (aq) + Cl- (aq) (s) [Na+ (aq)] · [Cl- (aq)] Na. Na. Cl Na+ (aq) + Cl- (aq) (s) [Na+ (aq)] · [Cl- (aq)] Na.](https://slidetodoc.com/presentation_image_h/3445b676e50deed99bdb7270befdb4ce/image-52.jpg)













- Slides: 76

Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a. a. 2017 -18

Stati della materia Le interazioni che possono stabilirsi fra le molecole di una sostanza ne determinano lo stato fisico. Se la forza di legame intermolecolare supera le energie cinetiche possedute dalle molecole, la sostanza si trova allo stato solido Se l’energia cinetica posseduta dalle molecole è superiore alla forza dei legami intermolecolari, la sostanza si trova allo stato gassoso Se le due forze si bilanciano la sostanza si trova allo stato liquido

L’ energia cinetica delle molecole aumenta con la temperatura Lo stato fisico di una sostanza dipende quindi dalla temperatura

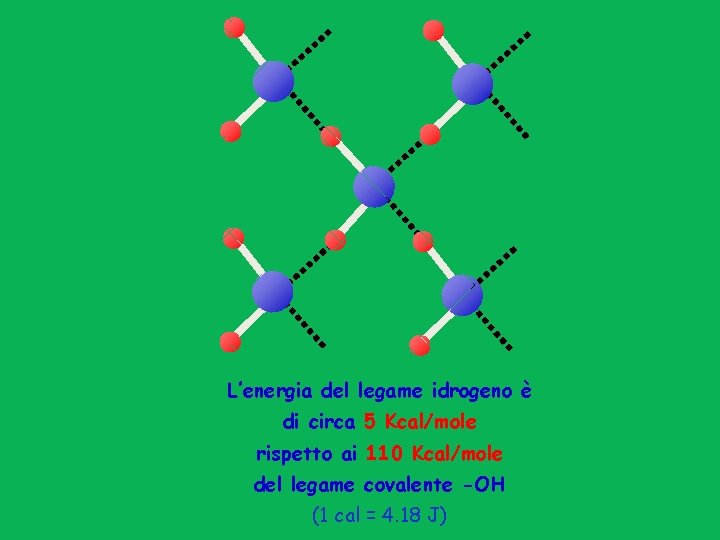
L’energia del legame idrogeno è di circa 5 Kcal/mole rispetto ai 110 Kcal/mole del legame covalente -OH (1 cal = 4. 18 J)

acqua punto di fusione punto di ebollizione 0°C 100°C metanolo -98°C 65°C acetone -95°C 56°C etanolo -117°C 78°C

Punto di ebollizione (a 760 mm. Hg): l'acqua bolle a 100 °C (in assenza di legami a idrogeno, il punto di ebollizione dovrebbe essere di ca − 80 °C). Ciò significa che occorre fornire alle molecole di acqua una grande quantità di energia per rompere i legami a idrogeno e farle passare allo stato aeriforme. Punto di fusione o di solidificazione (a 760 mm. Hg): l'acqua fonde (o solidifica) a 0 °C (in assenza di legami a idrogeno il punto di fusione dovrebbe essere di ca − 95 °C). Il ghiaccio ha un elevato calore latente di fusione: occorre molta energia per rompere i legami tra le molecole di acqua che nel ghiaccio sono disposte secondo una struttura cristallina in cui, inoltre, occupano un volume maggiore che non nell'acqua liquida: il ghiaccio, quindi, avendo una densità minore, galleggia. Ciò è di fondamentale importanza per la vita acquatica (che può proseguire anche se la superficie dell'acqua solidifica) ed è connesso al particolare andamento della densità dell'acqua in funzione della temperatura.

L’acqua possiede inusuali proprietà solventi Questa proprietà è un riflesso del carattere dipolare delle molecole dell’acqua e della capacità dell’acqua di formare legami idrogeno con le molecole in essa disciolte

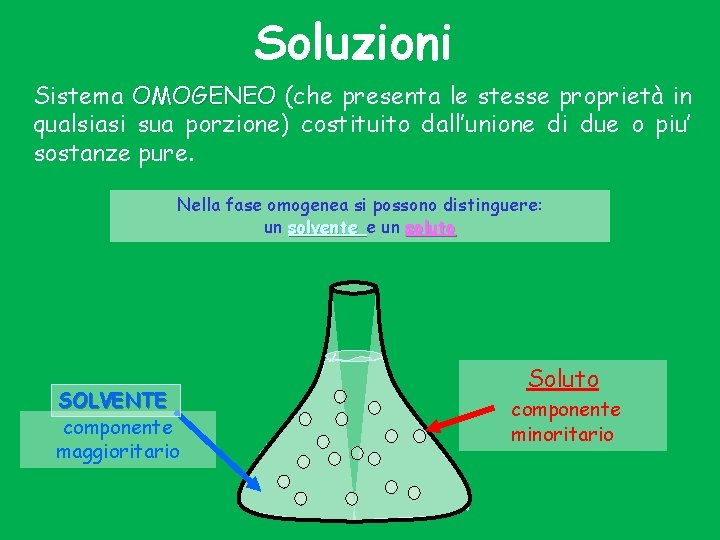
Soluzioni Sistema OMOGENEO (che presenta le stesse proprietà in qualsiasi sua porzione) costituito dall’unione di due o piu’ sostanze pure. Nella fase omogenea si possono distinguere: un solvente e un soluto SOLVENTE componente maggioritario Soluto componente minoritario

Soluzioni gassose: le miscele gassose sono sempre omogenee, formano sempre una soluzione Soluzioni Solide : Leghe metalliche: miscela omogenea solida di più metalli. Es: Ottone (rame + zinco) Bronzo (rame + stagno) Ottenute solubilizzando in un Soluzioni Liquide : liquido, gas, solidi o altri liquidi.

Soluzioni Nelle soluzioni acquose il solvente è l’acqua ed i soluti sono ioni o molecole in grado di interagire con le molecole d’acqua

Il passaggio di una specie in soluzione si ha quando tra i componenti si stabiliscono forze di attrazione della stessa natura di quelle che esistono tra i componenti puri (il simile scioglie simile)

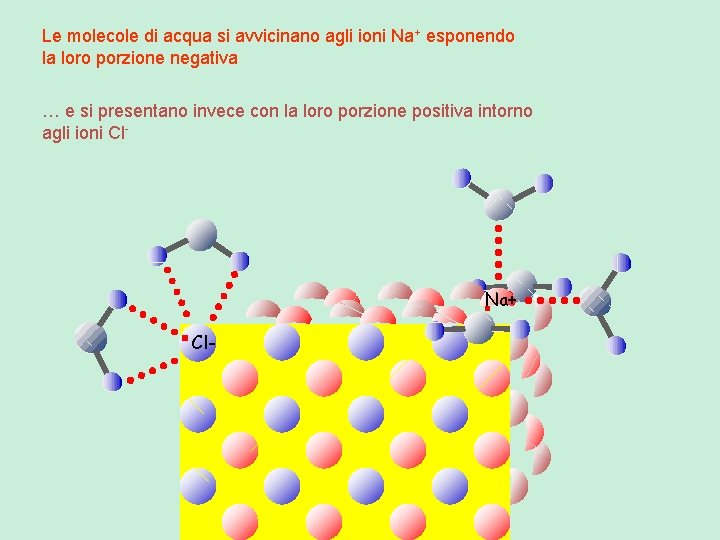
Le molecole di acqua si avvicinano agli ioni Na+ esponendo la loro porzione negativa … e si presentano invece con la loro porzione positiva intorno agli ioni Cl- Na+ Cl-

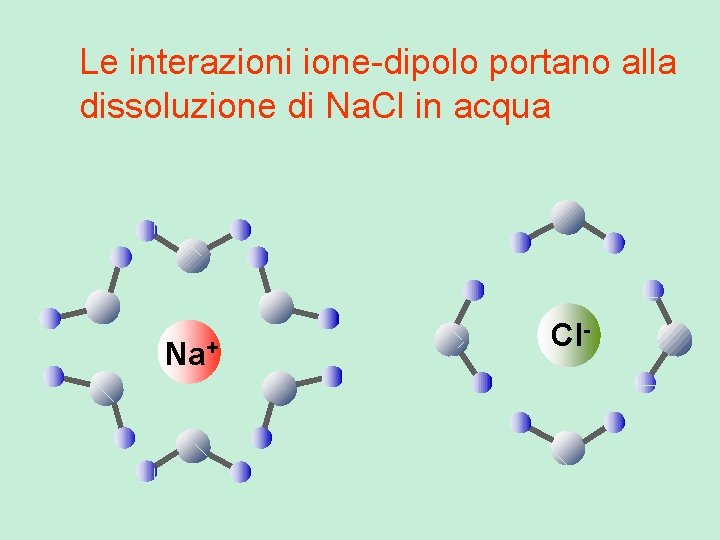
Le interazioni ione-dipolo portano alla dissoluzione di Na. Cl in acqua Na+ Cl-

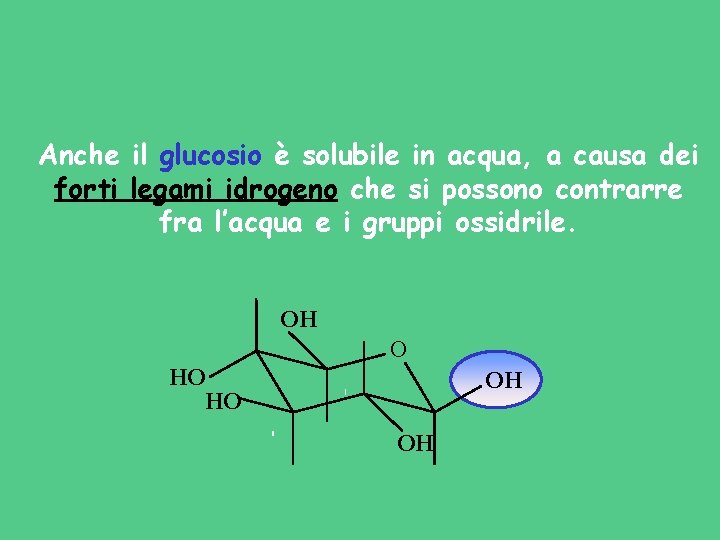
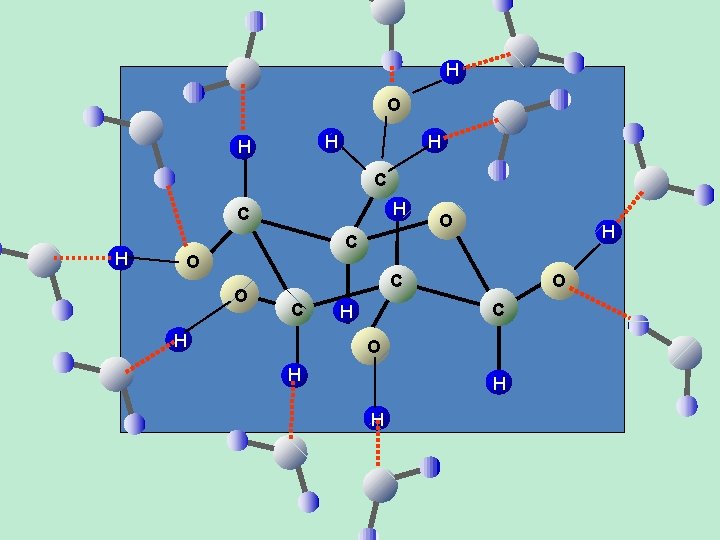
Anche il glucosio è solubile in acqua, a causa dei forti legami idrogeno che si possono contrarre fra l’acqua e i gruppi ossidrile. OH O HO HO OH OH

H O H H H C H C O O H O C C H O H H H

SOLUBILITA’ DEL GLUCOSIO SI NO

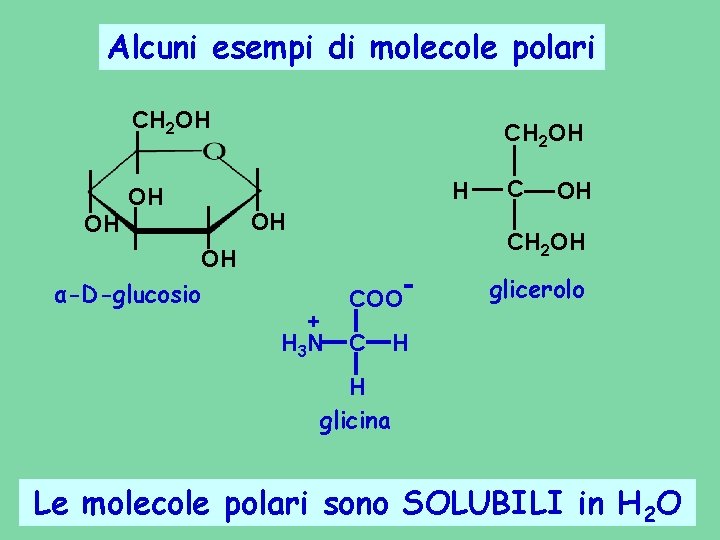
Alcuni esempi di molecole polari CH 2 OH H OH OH CH 2 OH OH α-D-glucosio C + H 3 N COO C - glicerolo H H glicina Le molecole polari sono SOLUBILI in H 2 O

Le molecole apolari non sono solubili in acqua, ma sono solubili in solventi organici, come cloroformio o benzene. Il colesterolo è una molecola apolare

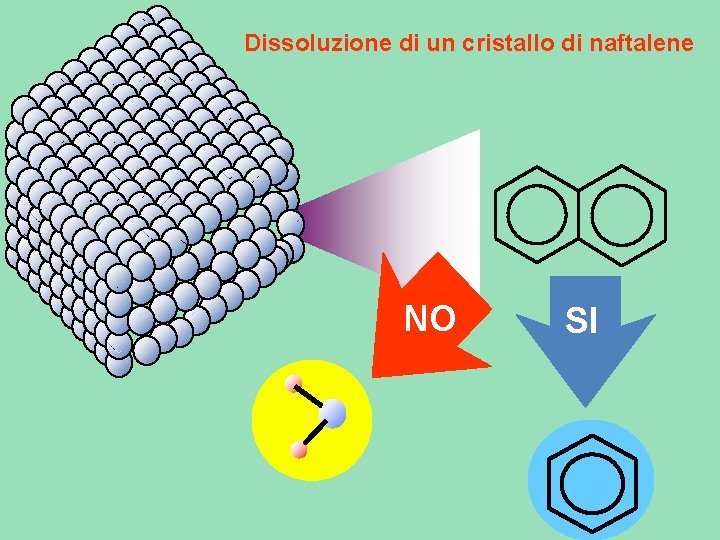
Dissoluzione di un cristallo di naftalene NO SI

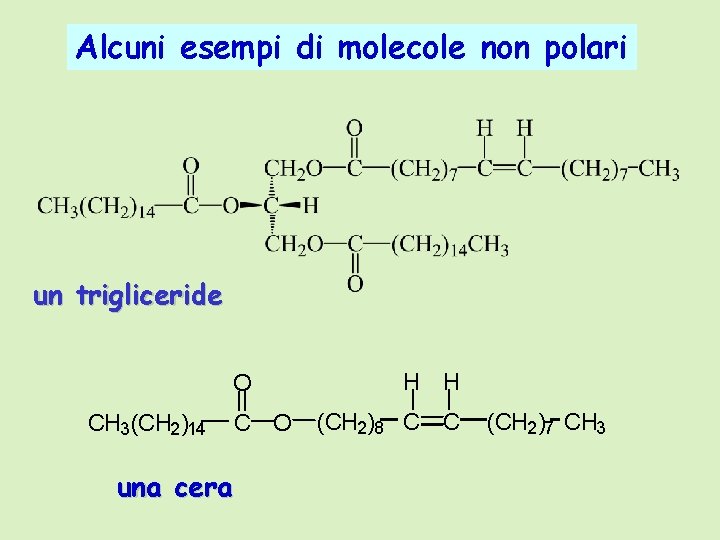
Alcuni esempi di molecole non polari un trigliceride O CH 3(CH 2)14 C O una cera H H (CH 2)8 C C (CH 2)7 CH 3

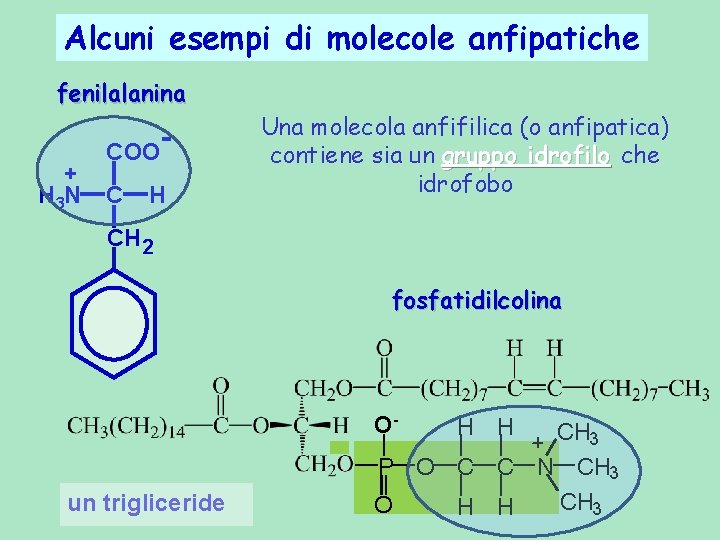
Alcuni esempi di molecole anfipatiche fenilalanina + H 3 N COO C H Una molecola anfifilica (o anfipatica) contiene sia un gruppo idrofilo che idrofobo CH 2 fosfatidilcolina Oun trigliceride H H CH 3 P O C C N CH 3 O H H

Concentrazione delle Soluzioni Esprime il rapporto: C= Quantità di Soluto Quantità di Solvente in una soluzione Queste due grandezze possono essere espresse in varie unità di misura (grammi, chilogrammi, litri, millilitri, moli, …. . ) da cui si possono definire vari tipi di unità di concentrazione

Unità fisiche % P/P Percento Peso/Peso % P/V Percento Peso/Volume % V/V Percento Volume/Volume grammi di Soluto per 100 grammi di Soluzione grammi di Soluto per 100 ml di Soluzione ml di Soluto per 100 ml di Soluzione

Percento in peso Dire che una soluzione acquosa di Na. Cl è al 2% in peso significa che in 100 g della soluzione ci sono 2 g di Na. Cl (e 98 g di acqua). La soluzione fisiologica di Na. Cl ha una concentrazione dello 0. 9% in peso. Questo significa che in 1 kg di soluzione sono contenuti 9 g di Na. Cl In 1 kg di una soluzione acquosa di saccarosio al 10% sono contenuti 100 g di saccarosio.

Molarità moli di soluto contenute in un litro di soluzione M = moli di soluto Volume di soluzione (L) M = n V = mol/ L

MOLE Le reazioni chimiche osservabili sperimentalmente coinvolgono un numero enorme di atomi, molecole o ioni E’ conveniente definire una nuova grandezza che rappresenta un NUMERO GRANDE E FISSO di PARTICELLE e comparabile alle quantità utilizzate in un esperimento reale Mole (mol) Quantità di sostanza che contiene tante entità elementari (atomi, molecole o ioni) quanti sono gli ATOMI di 12 C contenuti in 12 g esatti di 12 C. Numero di Avogadro NA= 6, 022 x 1023 mol-1

MOLE Una MOLE rappresenta quindi la quantità di un elemento (o composto) il cui peso, espresso in g, è pari al peso ATOMICO (o MOLECOLARE) Una mole di qualsiasi sostanza contiene 6, 022 x 1023 unità elementari di quella sostanza.

180, 0 g 18, 0 g glucosio acqua 1 mole

Dire che una soluzione di glucosio è 1 M significa che in un litro di soluzione è dissolta una mole di glucosio Glucosio C 6 H 12 O 6 PM glucosio : C H O 6 x 12 + 12 x 1 + 6 x 16 = 180 1 litro 180 g In 1 litro di soluzione 1 M sono disciolti 180 g di glucosio

MOLARITA' M = n/V N° di moli di soluto disciolte in un litro di soluzione n = 1 mole n = 0, 5 moli A B V=1 l V = 500 ml Le tre soluzioni di glucosio hanno concentrazione 1 M n = 0, 25 moli C V = 250 ml

Esercizio Una soluzione è ottenuta sciogliendo 25, 00 g di KCl (PM = 74, 557) in 200 g di acqua. Sapendo che la densità della soluzione è d = 1, 2 g/m. L, calcolare la molarità. Calcolo il peso della soluzione: g soluzione = g sol + g solv = 25 g + 200 g = 225 g Calcolo il volume occupato dalla soluzione: volume = massa/ densità = 225 g / 1. 2 g m. L-1= 187. 5 ml M = n mol/ L = V(L) Calcolo il numero di moli di soluto: n= g sol / PM= 25 g / 74. 557 g mol -1= 0. 33 mol M= 0. 33 mol 187. 5 x 10 -3 L = 1. 76 mol/L

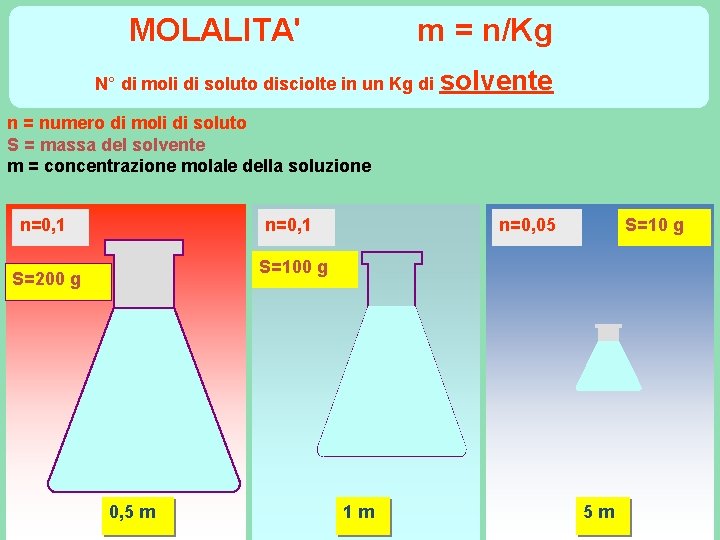
Molalità moli di soluto aggiunte in un kg di solvente m = moli di soluto 1 kg di solvente n m= massa solvente (Kg) = mol/ Kg

Dire che una soluzione acquosa di glucosio è 1 m significa che in un kg di acqua è dissolta una mole di glucosio. Glucosio C 6 H 12 O 6 PM glucosio : 6 x 12. 0112 + 12 x 1. 008 + 6 x 15, 994 = 180. 1272 Per preparare una soluzione acquosa 1 m di glucosio, 1 mole (180, 1272 g) di glucosio viene dissolta con 1 kg di acqua = 1 L d = m / V m = V x d V = m / d

MOLALITA' m = n/Kg N° di moli di soluto disciolte in un Kg di solvente n = numero di moli di soluto S = massa del solvente m = concentrazione molale della soluzione n=0, 1 n=0, 05 S=10 g S=100 g S=200 g 0, 5 m 1 m 5 m

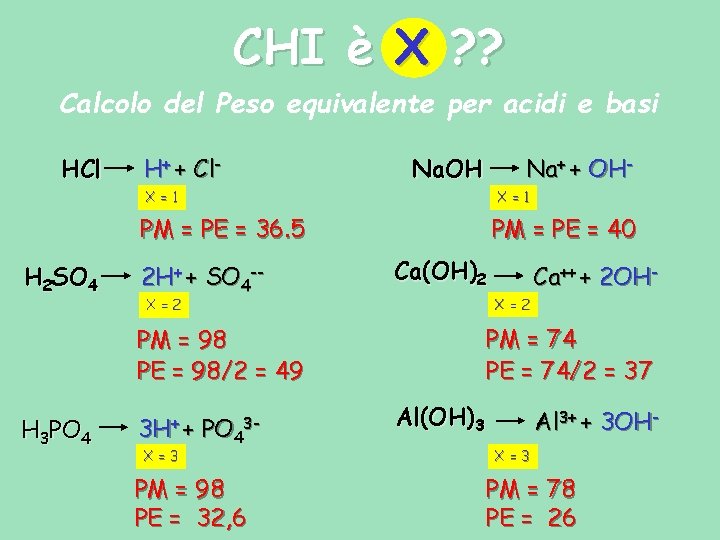
Normalità N = n°Eq/V “N° di equivalenti di soluto in un litro di soluzione” Equivalente chimico: “Peso in grammi di una specie chimica che, a seconda della natura di questa, può fornire, combinarsi, ossidare o ridurre (direttamente o indirettamente) un grammo atomo H o un grammo ione H+, H-“. grammi N° equivalenti = Peso Equivalente PE(g/eq) = PM(g/mol) X

CHI è X ? ? Mentre una mole è una quantità definita e costante di materia (contenente un numero di Avogadro di particelle), l’equivalente è una quantità variabile, definita di volta in volta dall’equazione chimica perché dipende dal tipo di sostanza considerata ACIDO ioni H+ frazione di mole che cede una mole di ioni H+ dissociandosi BASE ioni OH- frazione di mole che cede una mole di ioni OH- dissociandosi Ox (o Rid) n° degli elettroni frazione di mole che cede o acquista una mole di elettroni in una reazione di ossidoriduzione

CHI è X ? ? Calcolo del Peso equivalente per acidi e basi HCl H+ + Cl- Na. OH Na+ + OH- X=1 PM = PE = 36. 5 H 2 SO 4 2 H+ + SO 4 -- PM = PE = 40 Ca(OH)2 X=2 PM = 74 PE = 74/2 = 37 PM = 98 PE = 98/2 = 49 H 3 PO 4 3 H+ + X=3 PO 43 - PM = 98 PE = 32, 6 Ca++ + 2 OH- Al(OH)3 Al 3+ + 3 OHX=3 PM = 78 PE = 26

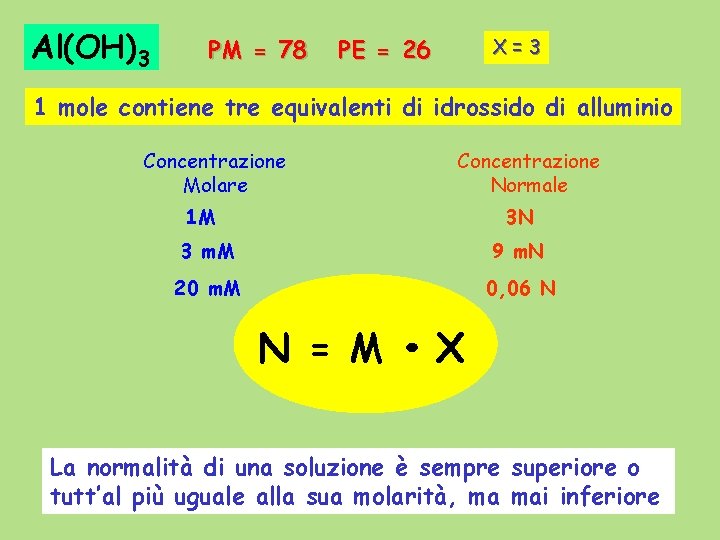
Al(OH)3 PM = 78 PE = 26 X=3 1 mole contiene tre equivalenti di idrossido di alluminio Concentrazione Molare Concentrazione Normale 1 M 3 N 3 m. M 20 m. M 9 m. N = M X 0, 06 N La normalità di una soluzione è sempre superiore o tutt’al più uguale alla sua molarità, ma mai inferiore

Peso equivalente per i sali Il numero di equivalenti contenuti in una mole di un sale che si dissocia in ioni corrisponde al numero di cariche positive o negative che il sale libera dissociandosi Na. Cl Cu. SO 4 Na+ Cl- X=1 Cu++ X=2 PE = SO 4 -- PF N° cariche

Peso equivalente nelle ossidoriduzioni Mn. O 4 - + 8 H+ + 5 e- Mn 2+ + 5 H 20 Una mole di Mn. O 4 - in questa specifica reazione scambia 5 elettroni quindi: PE = PF N° elettroni PE = 119 g/mol 5 = 23, 8 g/eq

Peso equivalente di acidi e basi: È dato dal rapporto tra il peso formula della specie e il numero di H+ che essa può cedere (acido) o accettare (base). Es: H 2 SO 4 p. f. /2 = 98, 08/2 = 49, 04 Ca(OH)2 = p. f. /2 = 74/2 = 37 Peso equivalente di elettroliti: È dato dal rapporto tra il peso formula della specie e il numero totale di cariche di stesso segno che si hanno nella dissociazione Es: Na. Cl p. f. /1 = PE = 58, 45 Fe 2(SO 4)3 = p. f. /6 = 399, 9/6 = 66, 65 Peso equivalente di ossidanti e riducenti: È dato dal rapporto tra peso formula della specie e il numero di elettroni da essa messi in giuoco nella reazione redox considerata.

Frazione molare “Si definisce frazione molare di un componente il rapporto fra il numero di moli di quel componente ed il numero totale di moli presenti nella miscela” Frazione molare di A = xa = na na + nb + nc + , , , + nz La somma delle frazioni molari è uguale a 1

Frazione molare Una soluzione è costituita da 36 g di acqua (PM 18) e 64 g di metanolo a) 36 g di acqua (PM 18) corrispondono a 2 moli di acqua b) 64 g di metanolo (PM 32) corrispondono a 2 moli dell’alcole La frazione molare dell’acqua si calcola come segue: x. H O = 2 2 2 + 2 = 0. 5

DILUIZIONE Una soluzione diluita può essere preparata aggiungendo acqua a una soluzione concentrata; diluendo la soluzione concentrata il numero di moli non varia per cui: Mconc x Vconc = Mdil x Vdil Ncon x Vconc = Ndil x Vdil C 0 x V 0 = C f x V f moli (n) INIZIALI moli (n) FINALI


L’Equilibrio Chimico Nella maggior parte delle reazioni chimiche i reagenti non vengono convertiti completamente in prodotti a. A+b. B reagenti v 1 c. C+d. D v 2 prodotti • la velocità delle reazioni diretta e inversa è costante • la concentrazione delle varie specie è costante All’equilibrio, ad una data temperatura, è costante il rapporto fra il prodotto delle concentrazioni dei prodotti e il prodotto delle concentrazioni dei reagenti, ciascuno elevato al proprio coefficiente stechiometrico.

a A + b B c. C+d. D reagenti prodotti Legge di azione delle masse Esprime il rapporto tra prodotti e reagenti quando una reazione ha raggiunto l’equilibrio Keq= [C]c [D]d [A]a [B]b Keq= costante di equilibrio è funzione solo di T La parentesi [ ] indica la concentrazione molare dei componenti
![2 O 3 3 O 2 K O 23 O 32 2 5 2 O 3 3 O 2 K= [O 2]3 [O 3]2 = 2, 5](https://slidetodoc.com/presentation_image_h/3445b676e50deed99bdb7270befdb4ce/image-48.jpg)
2 O 3 3 O 2 K= [O 2]3 [O 3]2 = 2, 5 1012 M L’equilibrio è molto spostato a destra O 2 2 O K= [O]2 [O 2] = 3, 2 10 -9 M L’equilibrio è molto spostato a sinistra

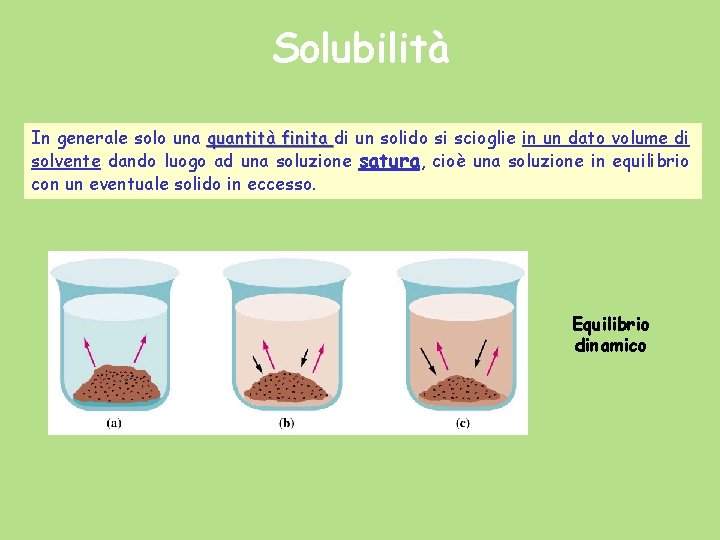
Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con un eventuale solido in eccesso. Equilibrio dinamico

A 20°C, in 100 g di acqua si sciolgono soltanto 35 g (0. 6 moli) di Na. Cl (PM= 58 g/mol).

I Sali sono elettroliti forti e in acqua sono completamente dissociati, però alcuni sali pur essendo elettroliti forti in soluzione sono poco solubili in acqua A 20°C, in 100 g di acqua si sciolgono soltanto 35 g (0. 6 moli) di Na. Cl (PM= 58 g/mol). Na. Cl Na+ + Cl- Oltre i 35 g si forma un corpo di fondo Na. Cl(s) e si stabilisce un equilibrio fra il corpo di fondo rimasto indisciolto e la quantità di Na. Cl (aq) che passa in soluzione Na. Cl (s) Na. Cl (aq) Na+ (aq) + Cl- (aq)
![Na Cl Na aq Cl aq s Na aq Cl aq Na Na. Cl Na+ (aq) + Cl- (aq) (s) [Na+ (aq)] · [Cl- (aq)] Na.](https://slidetodoc.com/presentation_image_h/3445b676e50deed99bdb7270befdb4ce/image-52.jpg)
Na. Cl Na+ (aq) + Cl- (aq) (s) [Na+ (aq)] · [Cl- (aq)] Na. Cl essendo [Na. Cl (s) =K Equilibrio eterogeneo costante, si può scrivere: ] (s) [Na+ (aq)] · [Cl- (aq)] = Kps (= 36 M 2) s= Kps s · s = Kps (= 36 M 2) =6 M [s = solubilità dello ione in moli/L] 6 moli in 1 L 0. 6 moli in 100 ml La concentrazione di un solido puro è determinata esclusivamente dalla sua densità che è una proprietà intensiva che non dipende dalla quantità di materia presa in considerazione, per cui non varia a temperatura costante

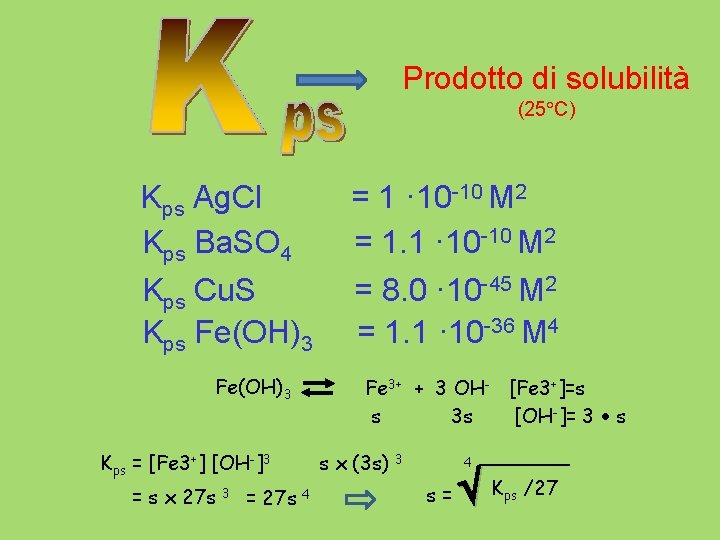
Prodotto di solubilità (25 C) Kps Ag. Cl Kps Ba. SO 4 Kps Cu. S Kps Fe(OH)3 Fe 3+ + 3 OH- [Fe 3+]=s s 3 s [OH-]= 3 s Kps = [Fe 3+] [OH-]3 = s x 27 s 3 = 27 s = 1 · 10 -10 M 2 = 1. 1 · 10 -10 M 2 = 8. 0 · 10 -45 M 2 = 1. 1 · 10 -36 M 4 s x (3 s) 4 3 4 s= K ps /27

Principio di Le Chatelier Il principio stabilisce che quando si applica una sollecitazione a un sistema all’equilibrio, le condizioni di equilibrio si spostano in modo da annullare le sollecitazioni stesse; se varia uno dei parametri, questo reagisce in modo da controbilanciare tale variazione. La variazione della temperatura comporta una variazione della costante di equilibrio. Il principio di Le Chatelier permette di prevedere qualitativamente la variazione della costante di equilibrio Keq al variare della temperatura: N 2(g) + 3 H 2(g) Keq = [NH 3]2 [N 2] [H 2]3 2 NH 3(g) La reazione di sintesi dell’ammoniaca è esotermica, per cui quando la temperatura aumenta, Keq diminuisce perchè l’equilibrio si sposta a sinistra

NELLE REAZIONI ENDOTERMICHE aumentando la temperatura l’equilibrio si sposta verso destra e la Keq aumenta; viceversa, abbassando la temperatura l’equilibrio si sposta a sinistra e diminuisce il valore della costante. NELLE REAZIONI ESOTERMICHE aumentando la temperatura l’equilibrio si sposta verso sinistra e la Keq diminuisce. Al contrario, abbassandosi la temperatura l’equilibrio si sposta a destra e la Keq aumenta.

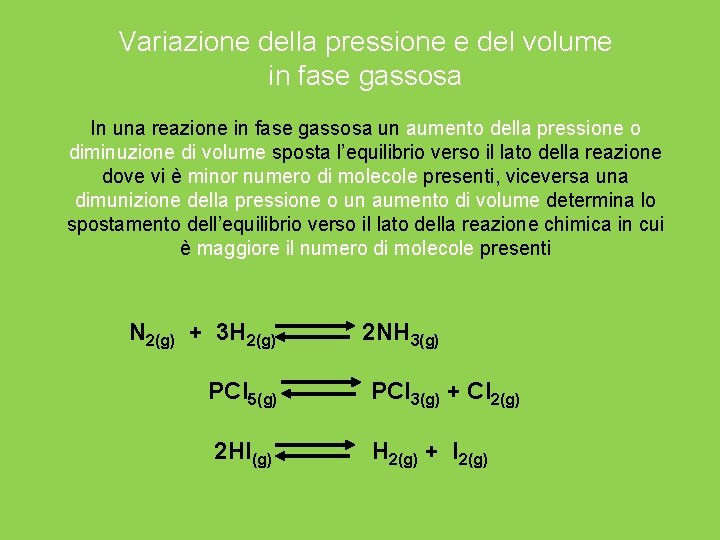
Variazione della pressione e del volume in fase gassosa In una reazione in fase gassosa un aumento della pressione o diminuzione di volume sposta l’equilibrio verso il lato della reazione dove vi è minor numero di molecole presenti, viceversa una dimunizione della pressione o un aumento di volume determina lo spostamento dell’equilibrio verso il lato della reazione chimica in cui è maggiore il numero di molecole presenti N 2(g) + 3 H 2(g) 2 NH 3(g) PCl 5(g) PCl 3(g) + Cl 2(g) 2 HI(g) H 2(g) + I 2(g)

Fattori che influenzano la solubilità 1) Natura del solvente e del soluto • Le sostanze non polari sono solubili in solventi non polari; • Le sostanze ioniche e quelle molecolari polari sono solubili in solventi polari, ad esempio cloruro di sodio e glucosio sono solubili in acqua • le sostanze non polari e quelle polari sono insolubili le une nelle altre 2) Temperatura • La solubilità delle sostanze la cui dissoluzione è un processo endotermico aumenta all’aumentare della temperatura, in accordo con il principio di Le Chatelier; questo vale per la maggior parte dei solidi molecolari polari e per i solidi ionici • La solubilità delle sostanze la cui dissoluzione è un processo esotermico diminuisce all’aumentare della temperatura, ad esempio la dissoluzione di un gas in un liquido.

3) Pressione Questo parametro influenza la solubilità dei gas nei liquidi; la quantità di un gas poco solubile disciolta in un liquido, a temperatura costante è infatti proporzionale alla pressione nella fase gassosa sovrastante la soluzione (legge di Henry): C=Kp La solubilità di un gas dipende dalla pressione che esso esercita sul liquido C: concentrazione molare del gas disciolto p: la pressione parziale del gas K: costante di Henry che dipende solo dalla temperatura ed è specifica per ogni coppia di gas-liquido Quando si stappa una bottiglia di acqua minerale gassata la pressione del gas in superficie cala bruscamente e con essa si riduce anche la solubilità dell’anidride carbonica che abbandona il liquido con la conseguente formazione di bollicine

Fattori che influenzano la velocità di dissoluzione 1) Agitazione 2) Temperatura 3) Grado di suddivisione del soluto: maggiore è la suddivisione del soluto, maggiore è la superficie di contatto tra il soluto e il solvente e quindi maggiore è la velocità di dissoluzione


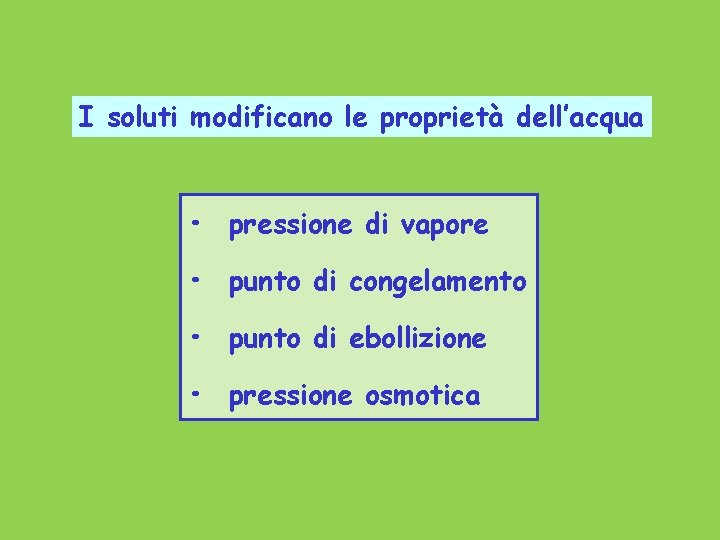
I soluti modificano le proprietà dell’acqua • pressione di vapore • punto di congelamento • punto di ebollizione • pressione osmotica

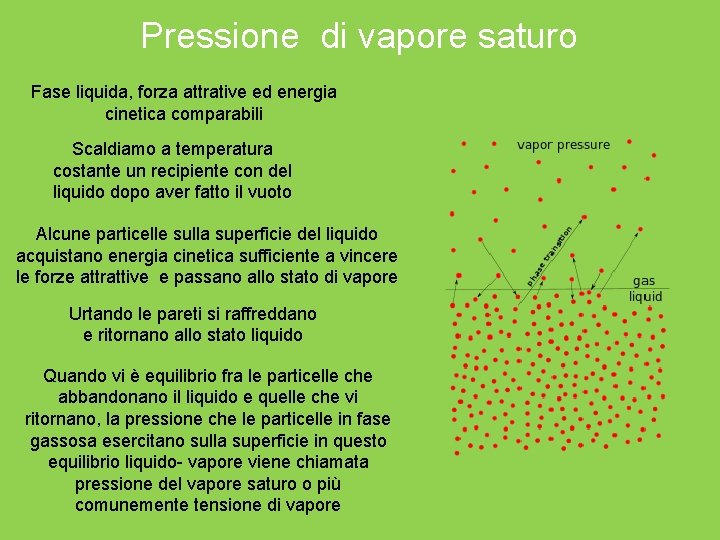
Pressione di vapore saturo Fase liquida, forza attrative ed energia cinetica comparabili Scaldiamo a temperatura costante un recipiente con del liquido dopo aver fatto il vuoto Alcune particelle sulla superficie del liquido acquistano energia cinetica sufficiente a vincere le forze attrattive e passano allo stato di vapore Urtando le pareti si raffreddano e ritornano allo stato liquido Quando vi è equilibrio fra le particelle che abbandonano il liquido e quelle che vi ritornano, la pressione che le particelle in fase gassosa esercitano sulla superficie in questo equilibrio liquido- vapore viene chiamata pressione del vapore saturo o più comunemente tensione di vapore

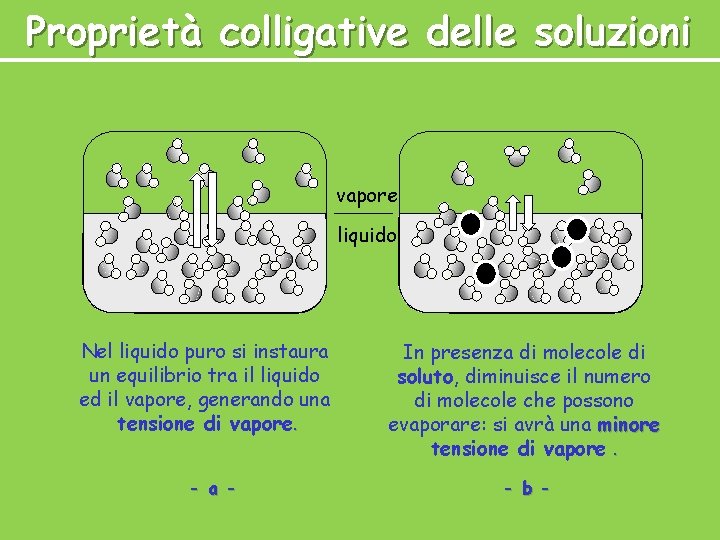
Proprietà colligative delle soluzioni vapore liquido Nel liquido puro si instaura un equilibrio tra il liquido ed il vapore, generando una tensione di vapore. - a - In presenza di molecole di soluto, diminuisce il numero di molecole che possono evaporare: si avrà una minore tensione di vapore. - b -

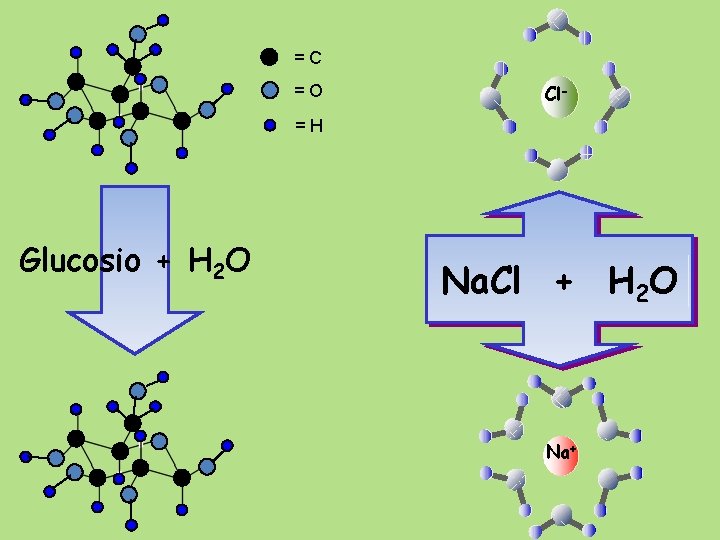
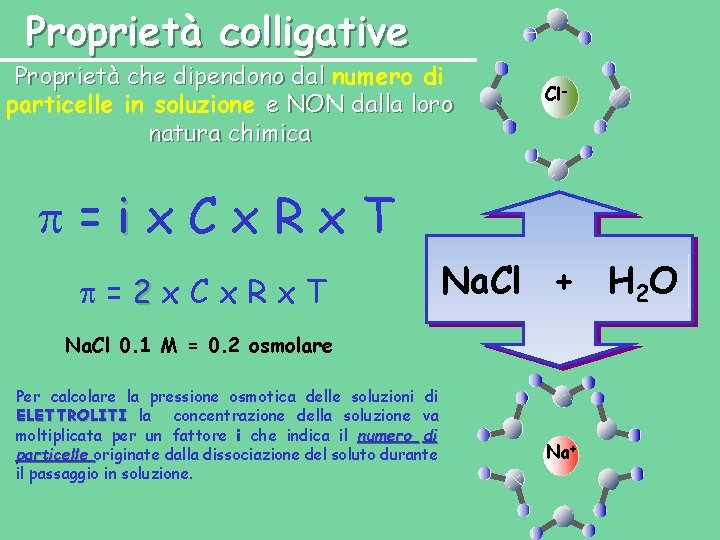
Proprietà colligative delle soluzioni Proprietà che dipendono dal numero di particelle in soluzione e NON dalla loro natura chimica In una soluzione, nei confronti del solvente puro si ha: 1 -abbassamento della pressione di vapore 2 -innalzamento della temperatura di ebollizione 3 -abbassamento della temperatura di congelamento

Proprietà colligative delle soluzioni 4 -PRESSIONE OSMOTICA Coinvolge MEMBRANE SEMIPERMEABILI, SEMIPERMEABILI strati sottili e con fori abbastanza larghi da far passare le molecole di solvente, ma non di soluto, specie di elevato peso molecolare OSMOSI: flusso di molecole di solvente dal solvente puro alla soluzione (in generale dalla soluzione meno concentrata a quella più concentrata)

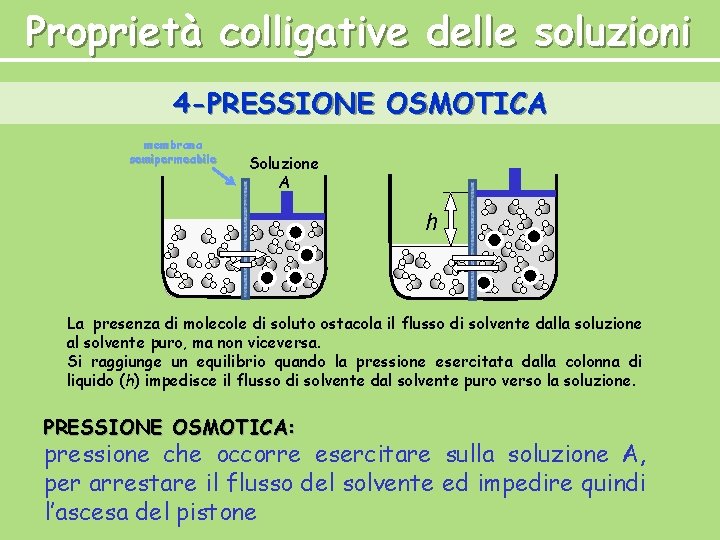
Proprietà colligative delle soluzioni 4 -PRESSIONE OSMOTICA membrana semipermeabile Soluzione A h La presenza di molecole di soluto ostacola il flusso di solvente dalla soluzione al solvente puro, ma non viceversa. Si raggiunge un equilibrio quando la pressione esercitata dalla colonna di liquido (h) impedisce il flusso di solvente dal solvente puro verso la soluzione. PRESSIONE OSMOTICA: pressione che occorre esercitare sulla soluzione A, per arrestare il flusso del solvente ed impedire quindi l’ascesa del pistone

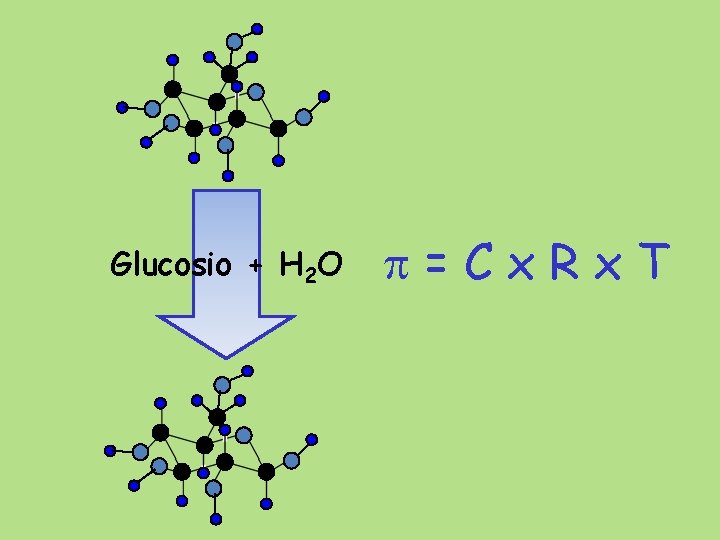
Pressione Osmotica “la pressione che occorre esercitare, ad una data temperatura, su una soluzione, per impedire l’ingresso di solvente puro, quando soluzione e solvente sono separati da una membrana semipermeabile” =Cx. Rx. T C =concentrazione (espressa in molarità) R =costante dei gas ideali (0. 082 atm l/K mol) T =temperatura espressa in Kelvin (K)

Soluzioni di glucosio e sodio cloruro aventi la stessa concentrazione molare hanno diversa pressione osmotica sol. acquosa 0. 1 M di p (atm) a) glucosio 2. 45 b) Na. Cl 4. 90

I soluti delle soluzioni acquose (soluzioni liquide) possono essere divisi in due grandi categorie: - elettroliti: sostanze che, una volta disciolte in acqua, danno luogo a soluzioni che conducono la corrente elettrica (dissociandosi in ioni positivi e negativi) negativi - non-elettroliti: sostanze che, in acqua, non producono ioni e quindi le loro soluzioni non conducono corrente elettrica

ELETTROLITI FORTI completamente ionizzati in soluzione Na. Cl Na 3 PO 4 HCl Na. OH Na+aq + Cl-aq 3 + Na + H aq aq + Na + aq + PO 4 Cl + 3 - aq aq OH aq

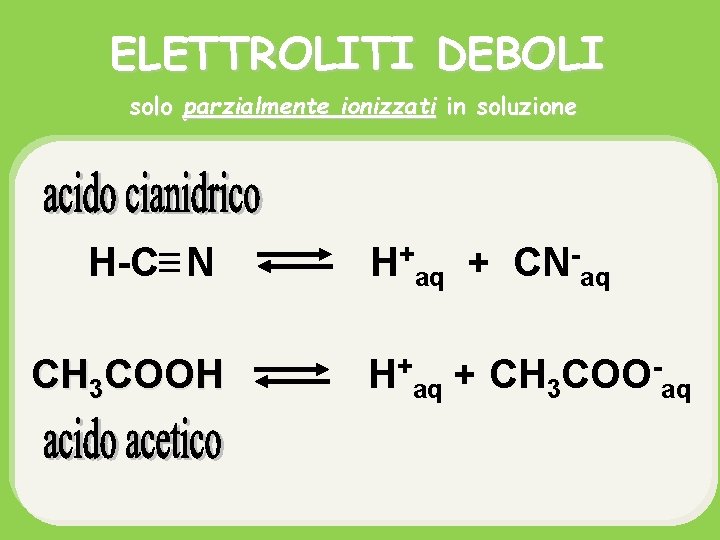
ELETTROLITI DEBOLI solo parzialmente ionizzati in soluzione H-C N CH 3 COOH H+aq + CN-aq H+aq + CH 3 COO-aq

=C =O Cl- =H Glucosio + H 2 O Na. Cl + H 2 O Na+

Glucosio + H 2 O =Cx. Rx. T

Proprietà colligative Proprietà che dipendono dal numero di particelle in soluzione e NON dalla loro natura chimica Cl- =ix. Cx. Rx. T =2 x. Cx. Rx. T Na. Cl + H 2 O Na. Cl 0. 1 M = 0. 2 osmolare Per calcolare la pressione osmotica delle soluzioni di ELETTROLITI la concentrazione della soluzione va moltiplicata per un fattore i che indica il numero di particelle originate dalla dissociazione del soluto durante il passaggio in soluzione. Na+

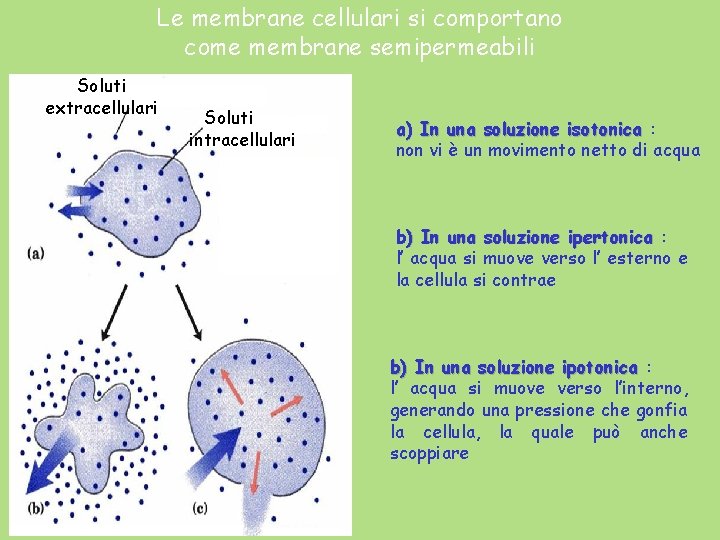
SOLUZIONE ISOTONICA: ISOTONICA soluzione che contiene lo stesso numero di particelle (stessa osmolarità, stessa π) di una soluzione di riferimento. SOLUZIONE IPERTONICA: IPERTONICA soluzione che contiene un maggior numero di particelle (maggiore osmolarità, maggiore π) di una soluzione di riferimento. SOLUZIONE IPOTONICA: IPOTONICA soluzione che contiene un minor numero di particelle (minore osmolarità, minore π) di una soluzione di riferimento.

Le membrane cellulari si comportano come membrane semipermeabili Soluti extracellulari Soluti intracellulari a) In una soluzione isotonica : non vi è un movimento netto di acqua b) In una soluzione ipertonica : l’ acqua si muove verso l’ esterno e la cellula si contrae b) In una soluzione ipotonica : l’ acqua si muove verso l’interno, generando una pressione che gonfia la cellula, la quale può anche scoppiare
 Conferenza permanente professioni sanitarie
Conferenza permanente professioni sanitarie Medicina e chirurgia pisa
Medicina e chirurgia pisa Letteratura latina unipd
Letteratura latina unipd Chirurgia bariatrica tradate
Chirurgia bariatrica tradate Jama brzuszna
Jama brzuszna Lembi random
Lembi random Chirurgia toracica monza
Chirurgia toracica monza Edmonton staging system obesity
Edmonton staging system obesity Epaticodigiunostomia
Epaticodigiunostomia Carta nazionale delle professioni museali 2020
Carta nazionale delle professioni museali 2020 Carta delle professioni museali
Carta delle professioni museali Isfol professioni
Isfol professioni Que es ms en medicina
Que es ms en medicina Sensibilidad y especificidad medicina
Sensibilidad y especificidad medicina Universitatea de medicina timisoara
Universitatea de medicina timisoara Unimed pisa
Unimed pisa Sonda de ewald
Sonda de ewald Universidad mayor de san simon medicina
Universidad mayor de san simon medicina Universidad austral medicina
Universidad austral medicina Hipertrofia pilorica
Hipertrofia pilorica Signo de babinski
Signo de babinski Sintec
Sintec Soba enfermedad
Soba enfermedad Ivn medicina
Ivn medicina Nulla est medicina sine lingua latina
Nulla est medicina sine lingua latina Invia est in medicina via sine lingua latina
Invia est in medicina via sine lingua latina Unidad docente medicina familiar y comunitaria madrid
Unidad docente medicina familiar y comunitaria madrid Acupuntura para que sirve
Acupuntura para que sirve Fisica applicata alla medicina
Fisica applicata alla medicina Afasia medicina definicion
Afasia medicina definicion Eco cus
Eco cus Invia est in medicina via sine lingua latina
Invia est in medicina via sine lingua latina In un rifugio di alta montagna il 31 marzo 2012
In un rifugio di alta montagna il 31 marzo 2012 Fevi medicina normal
Fevi medicina normal Instituto de medicina legal dr. roberto masferrer
Instituto de medicina legal dr. roberto masferrer Rmi medicina
Rmi medicina La hora dorada medicina
La hora dorada medicina Armas contuso cortantes
Armas contuso cortantes Gib medicina
Gib medicina Tu medicina, por favor, para que te cures pronto.
Tu medicina, por favor, para que te cures pronto. Fizika i medicina
Fizika i medicina Asa medicina
Asa medicina Helsinška deklaracija medicina
Helsinška deklaracija medicina Sog en medicina
Sog en medicina Studiare unife my desk
Studiare unife my desk Medicina di gruppo cornedo
Medicina di gruppo cornedo Sensibilidad y especificidad medicina
Sensibilidad y especificidad medicina Studenti prof uniti per
Studenti prof uniti per Anamnesis ejemplo
Anamnesis ejemplo Rcu medicina
Rcu medicina Universitatea de medicina si farmacie victor babes
Universitatea de medicina si farmacie victor babes Tat laboratorio analisi
Tat laboratorio analisi Universitatea de medicină și farmacie victor babeș
Universitatea de medicină și farmacie victor babeș Universidad veracruzana campus minatitlán
Universidad veracruzana campus minatitlán Femenine
Femenine Medicina u austral
Medicina u austral Espectro equimótico
Espectro equimótico Atos carnais
Atos carnais Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Nc medicina
Nc medicina Intercanvis medicina uab
Intercanvis medicina uab Notas de peso para medicina
Notas de peso para medicina Medicina sociale definizione
Medicina sociale definizione Matematica e medicina
Matematica e medicina Master medicina trasfusionale
Master medicina trasfusionale Puntos ben shen emociones
Puntos ben shen emociones Nutrición en la biblia
Nutrición en la biblia Objetivo de la medicina familiar
Objetivo de la medicina familiar Vmd medicina
Vmd medicina Semejna medicina
Semejna medicina Rcu medicina
Rcu medicina Medicina en el barroco
Medicina en el barroco Sistema henry dactiloscopia
Sistema henry dactiloscopia Uab erasmus
Uab erasmus Rcu medicina
Rcu medicina Sociedad vasca de medicina del trabajo
Sociedad vasca de medicina del trabajo Applicazioni intelligenza artificiale in medicina
Applicazioni intelligenza artificiale in medicina




































































































