Hoofdstuk 10 Polymeren Planning Vandaag Theorie hoofdstuk 10
















































































































- Slides: 127

Hoofdstuk 10 Polymeren

Planning • Vandaag: – Theorie hoofdstuk 10 – Huiswerk maken

Hoofdstuk 10 Herhaling: In je bloed zit fibrinogeen, een moleculaire stof die oplosbaar is in water - Hoe kun je aan de formule van een stof zien dat het een moleculaire stof is? - Is fibrinogeen hydrofiel of hydrofoob? - Hoe kun je aan een molecuul zien of deze op kan lossen in water? - Hoe heten de bindingen tussen een oplosbare moleculaire stof en water?

10. 2 van monomeer tot polymeer • Monomeer: grondstof waaruit een polymeer bestaat – Zijn kleine moleculen • Polymeer: een stof die bestaat uit hele lange moleculen – Vaak vast op kamertemperatuur door de vanderwaalsbindingen en H-bruggen die aanwezig zijn

Polymerisatie • Wanneer veel monomeren aan elkaar koppelen krijg je een polymeer • Polymerisatiereactie – Denk aan het rijgen van kralen aan een ketting • Copolymeer: bestaat uit verschillende monomeren • Polymeer: bestaat uit dezelfde monomeren

Polymeren • Synthetische polymeren: – Kunststoffen die in fabrieken worden gemaakt – Bijv: PVC, piepschuim, rubber, nylon • Natuurlijke polymeren: – Komen in de natuur voor – Bijv: eiwitten, cellulose, zetmeel, zijde

Reacties • Polyadditie – Dubbele binding in het monomeer • Polycondensatie – Karakteristieke groepen die met elkaar reageren

Polyadditie • Verlopen niet spontaan – Initiator (stof die de reactie op gang brengt) – Uv-licht • Radicalen – Elke atoombinding bestaat uit 2 elektronen. Onder invloed van uv-licht breekt de binding open. Er ontstaan dan 2 brokstukken die elk een bindingsplaats ter beschikking hebben. Deze zijn erg reactief.

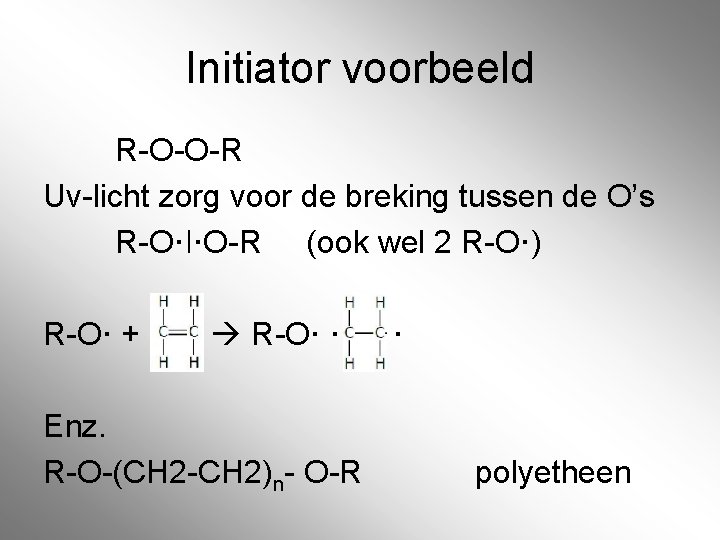
Initiator voorbeeld R-O-O-R Uv-licht zorg voor de breking tussen de O’s R-O·ǀ·O-R (ook wel 2 R-O·) R-O· + R-O· · Enz. R-O-(CH 2 -CH 2)n- O-R · polyetheen

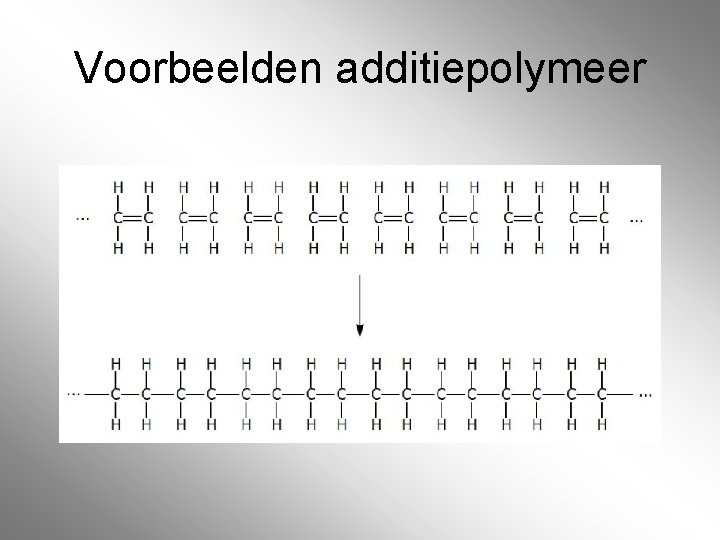
Voorbeelden additiepolymeer

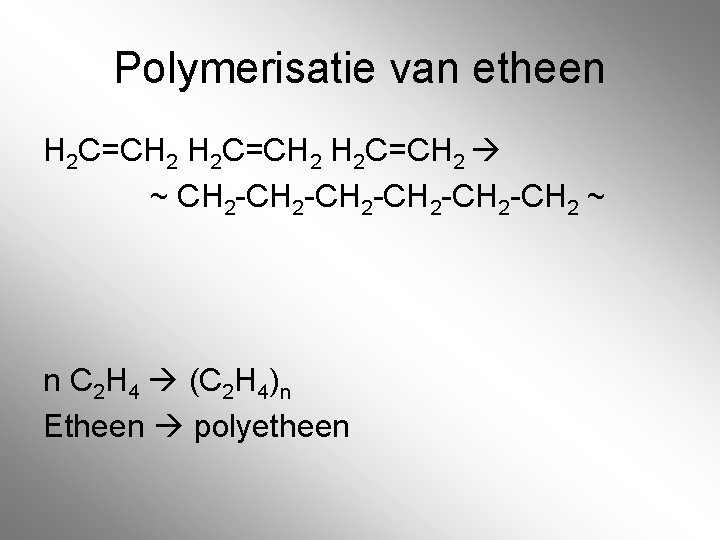
Polymerisatie van etheen H 2 C=CH 2 ~ CH 2 -CH 2 -CH 2 ~ n C 2 H 4 (C 2 H 4)n Etheen polyetheen

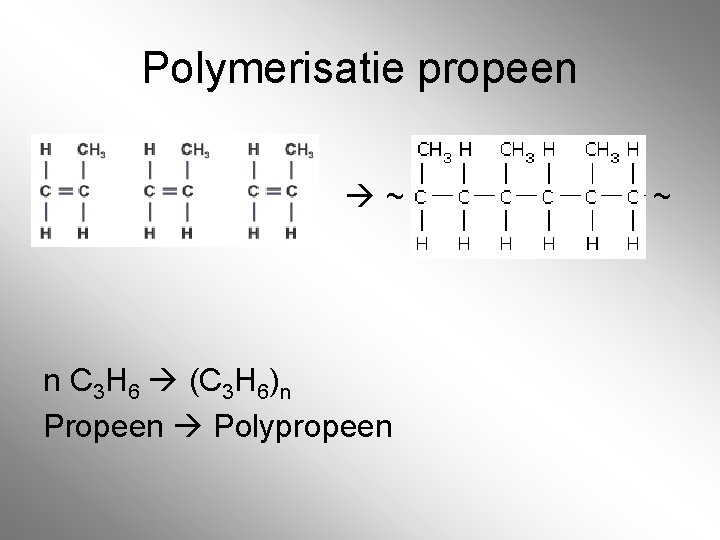
Polymerisatie propeen ~ n C 3 H 6 (C 3 H 6)n Propeen Polypropeen ~

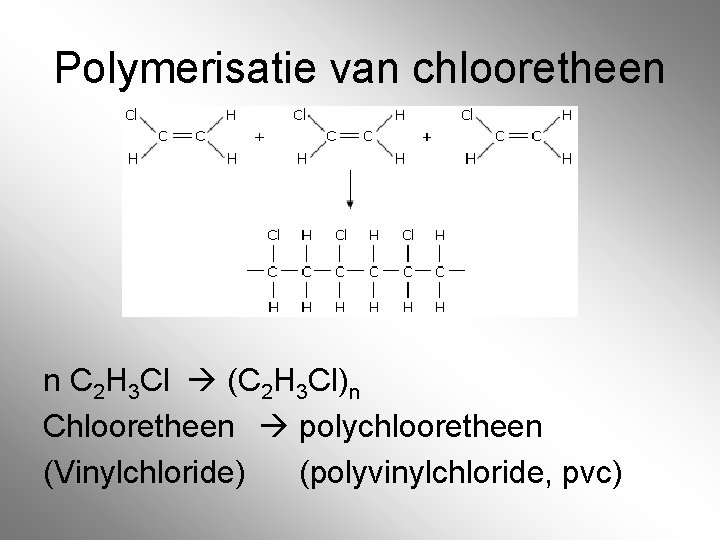
Polymerisatie van chlooretheen n C 2 H 3 Cl (C 2 H 3 Cl)n Chlooretheen polychlooretheen (Vinylchloride) (polyvinylchloride, pvc)

Huiswerk • Maak opdracht 2 t/m 14 Blz 125 • Niet maken opdracht 4, 9 c, 9 d, • Opdracht 5 extra informatie:

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 2. a. Een monomeer is de grondstof waaruit een polymeer kan worden gemaakt b. Een polymeer is een stof die bestaat uit hele lange moleculen c. Een copolymeer is een polymeer dat is ontstaan uit verschillende monomeren d. Een polymerisatiereactie is een reactie waarbij monomeren met elkaar reageren tot een polymeer

3. 5. 6. a. Polyetheen, pvc, piepschuim b. Eiwitten, zijde, natuurlijk rubber c. Polyadditie en polycondensatie a. Er zitten veel OH groepen in cellulose. Deze kunnen H-bruggen vormen. b. Cellulose-OH + HO-C-R Cellulose-O-C-R +H 2 O c. De stof is hydrofoob geworden nu alle OH groepen zijn veresterd a. Een reactie waarbij een dubbele binding tussen 2 C atomen reageert als monomeer

6. b. een dubbele binding c. initiator en UV-licht d. poly en dan de naam van het monomeer e. 7. a. Poly 2 -penteen b. poly-1, 2 -difluor-1 -propeen c. poly-2 -chloor-2 -buteen a. de zwaan dient als initiator b. de mensen achter de zwaan zijn allemaal verschillend 8.

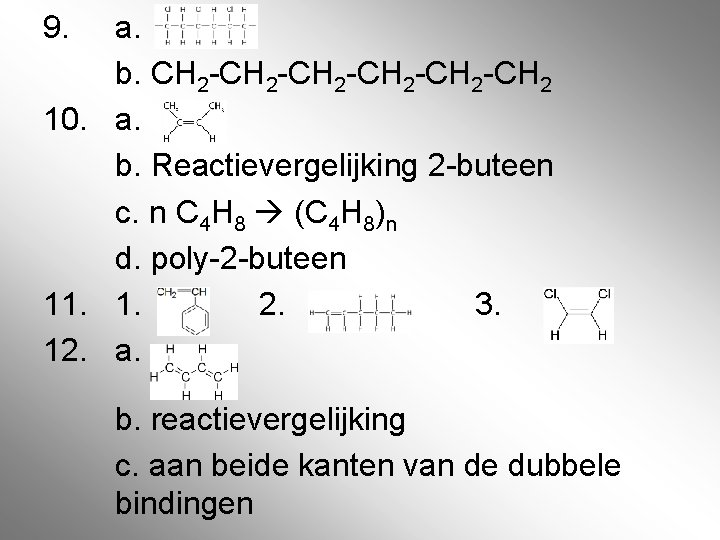
9. a. b. CH 2 -CH 2 -CH 2 10. a. b. Reactievergelijking 2 -buteen c. n C 4 H 8 (C 4 H 8)n d. poly-2 -buteen 11. 1. 2. 3. 12. a. b. reactievergelijking c. aan beide kanten van de dubbele bindingen

13. a. Hoe meer initiator aanwezig is, hoe meer polymeermoleculen er gevormd worden b. omdat de ketens uit verschillende lengtes bestaan 14. a. dichtheid lager, minder moleculen dus afstand groter b. hogere dichtheid, moleculen dichter op elkaar, sterkere vanderwaalskrachten, meer warmte nodig om ze te verbreken

10. 2 polycondensatie • 2 verschillende reacties: – Polycondensatie met 1 monomeer – Polycondensatie met meer monomeren • copolymeer • Groepen die met elkaar kunnen reageren: – Zuur en Alcohol – Zuur en amine

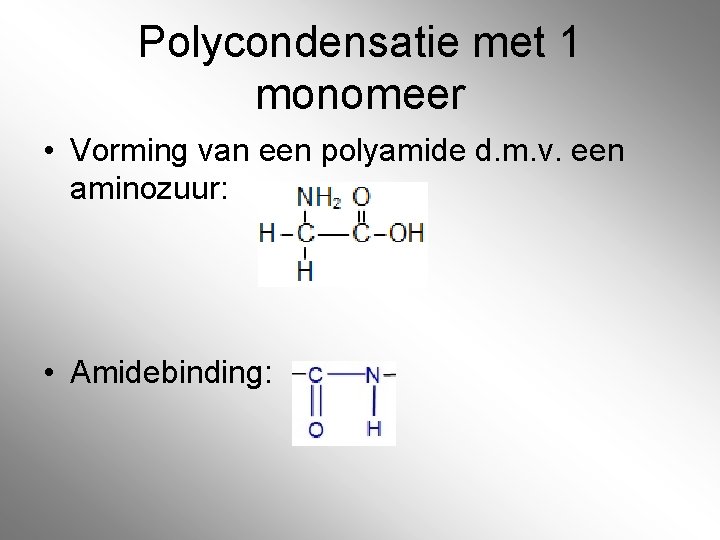
Polycondensatie met 1 monomeer • Vorming van een polyamide d. m. v. een aminozuur: • Amidebinding:

• Reactievergelijking: • Naam: polyaminoethaanzuur

Vorming van polyester • D. m. v. een molecuul met een zuur en een alcohol groep • Reactievergelijking: • Naam: poly-hydroxy-ethaan-zuur

Polycondensatie met 2 monomeren Polyester vorming met 2 monomeren Reactievergelijking:

Vorming van polyamide • Beginstoffen: • Reactievergelijking:

Huiswerk • Maak opdracht 15 t/m 19

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 15. a. Een polycondensatiereactie is een reactie waarbij kleine moleculen waarin karakteristieke groepen voorkomen, met elkaar reageren onder afsplitsen van een klein molecuul zoals water b. zuurgroep en alcoholgroep c. zuurgroep en aminegroep d. beide een amide/peptide binding polyamide heeft twee monomeren en een polypeptide gebruikt aminozuren als monomeer

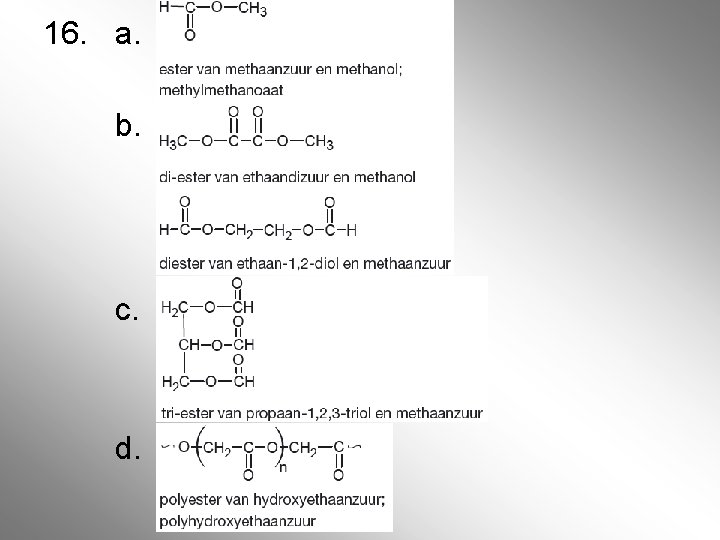
16. a. b. c. d.

17. 18. c. in beide gevallen zijn het copolymeren want beide hebben 2 verschillende beginstoffen

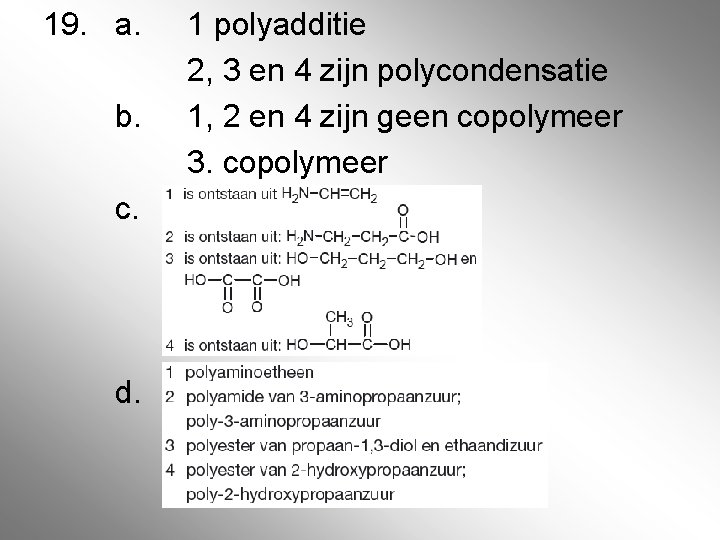
19. a. b. c. d. 1 polyadditie 2, 3 en 4 zijn polycondensatie 1, 2 en 4 zijn geen copolymeer 3. copolymeer

Herhaling naamgeving

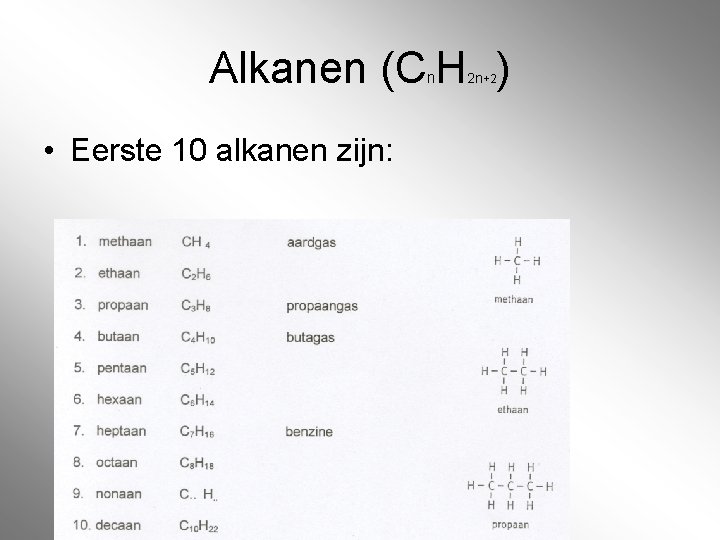
Alkanen (C H ) n • Eerste 10 alkanen zijn: 2 n+2

Naamgeving alkanen 1. Wat is je hoofdketen? Grootste aaneengesloten reeks van C. 2. Vanaf welke kant moet je nummeren Begin met nummeren het dichts bij de vertakking. 3. Benoem de zijgroepen op alfabetische volgorde Komt deze zijgroep vaker voor dan geef je dat aan met het griekse telwoord. (di, tri, tetra, penta, hexa) 4. Geef de naam van de hoofdketen.

Naamgeving alkanen Zijgroepen:

Naamgeving alkenen 1. Wat is je hoofdketen? Grootste aaneengesloten reeks van C. 2. Vanaf welke kant moet je nummeren Begin met nummeren het dichts bij de dubbele binding. 3. Benoem de zijgroepen op alfabetische volgorde Zijgroepen worden hetzelfde weergegeven als bij alkanen. 4. Geef de naam van de hoofdketen - In plaats van –aan eindigt je stamnaam nu op -een - Alkenen met een 2 dubbele bindingen krijgen de uitgang: –dieen - Geef aan op welk C-atoom de dubbele binding zit dmv een nummer.

Halogeenalkanen • Naamgeving 1. Nummer de keten aan de kant met de karakteristieke groep. 2. Geef aan op welk c-atoom de karakteristieke groep zit. 3. Geef de naam van de karakteristieke groep.

Naamgeving – Nummer de koolstofketen. Begin aan de kant waar de karakteristieke groep het dichts bij zit. – Geef de naam aan de langste keten en voeg – ol toe. – Geef aan met een nummer op welk C-atoom de OH-groep zit. – Bij twee OH-groepen geef je dat aan door het griekse telwoord (-diol)

Alkaanzuren • Naamgeving 1. Nummer de langste keten vanuit de karakteristieke groep. 2. Noem de stam hetzelfde als bij de alkanen en zet achter de stamnaam –zuur. Bij meerdere zuurgroepen gebruik je het Griekse telwoord 3. Plaats voor de naam de eventuele zijgroepen.

Aminen • Naamgeving 1. Nummer de langste keten vanaf de karakteristieke groep. 2. Geef aan met een nummer op welk C-atoom de karakteristieke groep zit. 3. Geef de naam aan de langste keten nu met de uitgang –amine. Komt naast de NH 2 -groep een COOH-groep voor dan eindigt de naam met –zuur. De NH 2 -groep krijgt de naam amino.

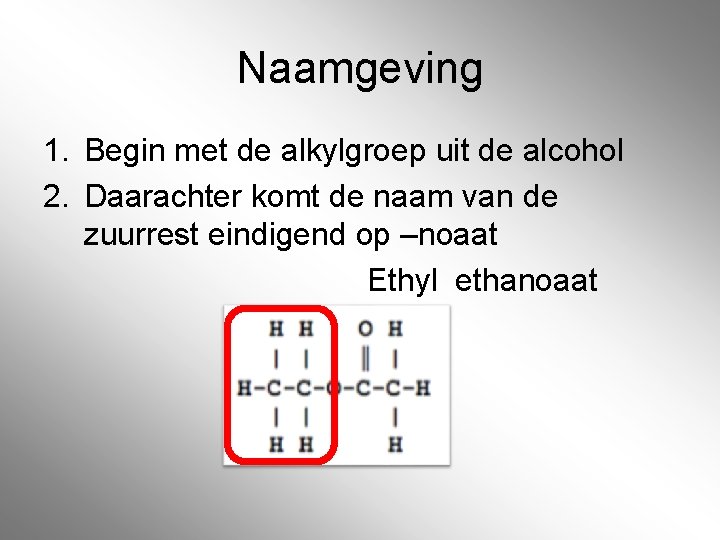
Naamgeving 1. Begin met de alkylgroep uit de alcohol 2. Daarachter komt de naam van de zuurrest eindigend op –noaat Ethyl ethanoaat

Volgorde • • Eerst zuur Dan ester Dan alcohol Dan amine Dan alkenen Dan halogenen Dan alkanen

Huiswerk • Maak het uitgedeelde blaadje

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken • Naamgeving stoffen

10. 3 synthetische polymeren • Alle kunststoffen zoals: – Vliegtuigen, – Auto’s – Matrassen – Weggooibestek – Frisdrankflessen – Kleding – Lijmen – vloerbedekking

Eigenschappen kunststoffen • • • Licht Sterk Kunnen niet roesten Weinig onderhoud Gaan lang mee Allerlei vormen en kleuren

Synthetische polymeren • Worden vaak gemaakt uit aardolie – Dit is niet duurzaam – Tegenwoordig proberen ze “groene” polymeren te maken

Onderverdeling • Op basis van gedrag bij verwarmen: (dit komt door verschillen in structuur) – Thermoplasten – Thermoharders – Elastomeren

Thermoplasten • Kunststoffen die zacht of vloeibaar worden bij verwarmen • Als je ze uitrekt komen ze niet terug in de oorspronkelijke vorm • Bijvoorbeeld: plastic zakje • Structuur is zoals spaghetti draden – Los van elkaar en door elkaar

• Structuur zijn lange draden die door elkaar zitten en niet vast aan elkaar • Worden bijeen gehouden door vanderwaalsbindingen • Verwekingspunt: temperatuur waarbij een kunststof zacht wordt. – Hoe sterker de bindingen hoe hoger het verwekingspunt (H-bruggen)

Thermoharders • • • Kunststoffen die niet zacht worden 2 componenten die samen uitharden Vele dwarsbindingen (crosslinks) Echte atoombindingen!! Zit stevig in elkaar Bij temperatuurverhoging geen beweging ze hebben dus geen verwekingspunt • Bij langdurig verhitten breken de dwarsbindingen de stof ontleedt!

Elastomeren • Op kamertemperatuur flexibel • Na uitrekken weer terug in oorspronkelijke vorm • Allerlei soorten rubber • Structuur: een netwerk van onderling verbonden polymeermoleculen maar minder crosslinks als een thermoharder • Polymeermoleculen liggen gekronkeld zodat er rek in zit • Voorbeeld: elastiekje

• 70% van alle kunststoffen valt onder thermoplasten • De rest zijn thermoharders en elastomeren

Eigenschappen van een kunststof • Weekmakers – Maken stugge kunststoffen soepeler – Tussen de moleculen – Afstand wordt daardoor groter tussen moleculen – Flessen • Blaasmiddelen – Zorgen voor kleine dichtheid – Dampbellen zorgen voor luchtige structuur – Piepschuim

Eigenschappen van een kunststof • Kleurstoffen – Kleur vermengt zich met de moleculen – Kleur kan dus niet slijten • Vulstoffen en harders – Sterker en harder maken – Vulstof is roet bij autobanden – Harder is een stof die zorgt voor meer crosslinks • Vaak zwavel (zwavelbruggen, vulkaniseren)

Eigenschappen van een kunststof • Uv-absorptiemiddelen – In polymeren vaak nog dubbele bindingen of crosslinks – Deze kunnen reageren met uv-stralen – Hierdoor wordt kunststof bros, minder stevig – Zetten uv-licht om in warmte • Vezels – Sterker maken – Bijvoorbeeld glasvezel toevoegen bij scheepsbouw of koolstofvezels bij vliegtuigen

Huiswerk • Maak opdracht 20 t/m 29 • Niet maken: 27 d, 28, 29 b, c, d

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 20. a. alle kunststoffen zijn synthetische polymeren b. plastic, polyesters en polyamiden 21. a. verwarmen, thermoplast wordt vloeibaar en zacht een thermoharder niet b. thermoplast heeft lange moleculen die niet aan elkaar vast zitten Een thermoharder heeft cross-links

21. c. Overeenkomst: netwerk van polymeermoleculen die door cross-links is verbonden. Verschil: elastomeer heeft minder cross-links d. De moleculen liggen gekronkeld. Hierdoor heb je rek 22. a. b. polycondensatiereactie c. d. polyadditiereactie e.

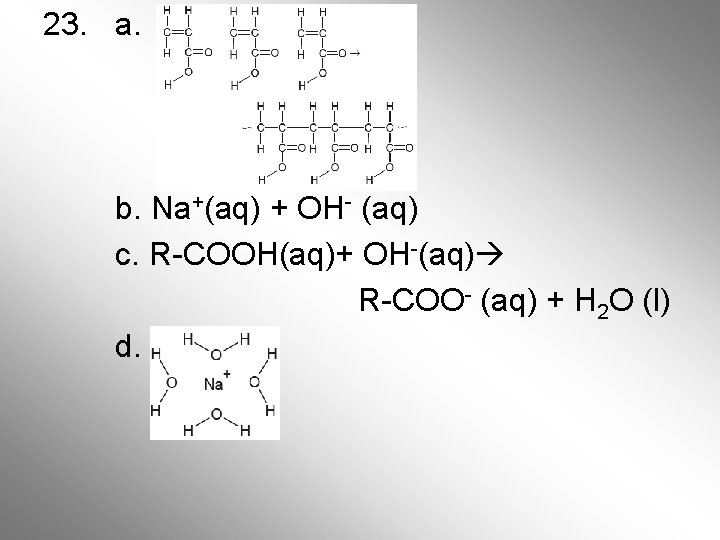
23. a. b. Na+(aq) + OH- (aq) c. R-COOH(aq)+ OH-(aq) R-COO- (aq) + H 2 O (l) d.

24. Weekmakers: maakt kunststof soepel blaasmiddelen: kleine dichtheid kleurstoffen: blijvende kleuring vulstoffen en harders: sterker en harder UV- absorptiemiddelen: cross-links blijven in stand vezels: sterker 25. a. composiet b. zorgen voor cross-links of dwarsbindingen c. thermoharder

26. a. er ontstaan dampbellen. b. hoe meer blaasmiddel, hoe meer bellen, hoe kleiner de dichtheid c. toevoegen van een harder 27. a. aanbrengen van cross-links door middel van zwavel b. door zwavelbruggen wordt rubber minder flexibel en gaat meer op een thermoharder lijken c. de hoeveelheid zwavelbruggen e. endotherm (ontleding door UV f. ontledingsproces verloopt minder snel

29. a. de weekmaker gaat tussen de moleculen zitten waardoor de afstand tussen de moleculen groter wordt.

Verwerking van kunststof • Thermoplasten en thermoharders gedragen zich anders • Dus ook verschil in verwerking

Verwerking van thermoplasten • Worden gemaakt in de vorm van korrels of poeders • Bijv: margarinekuipje of vuilniszak • Belangrijkste techniek: Spuitgieten • Korrels worden verwarmd tot ze zeer zacht of vloeibaar zijn • Dan geperst in een mal

Verwerking van thermoplasten • • Extruderen Bijvoorbeeld: folies of plastic zakken Korrels worden verhit Zacht kunststof wordt door nauwe opening naar buiten geperst

Verwerking van thermoharder • • • Monomeren worden in mal gedaan Meestal harder toegevoegd Mal op hoge temperatuur brengen Polymerisatie vindt plaats Cross-links worden gevormd Er ontstaat een hard product • Meestal hoge druk nodig

kunststofafval • Groot probleem – Bacteriën kunnen ze niet verwerken – Verbranden geeft schadelijke stoffen • 2 oplossingen – Recycling – Biologisch afbreekbaar plastic

Recycling • Plastic apart inzamelen • Sorteren, wassen, vermalen • Korrels worden verwerkt door gespecialiseerde bedrijven • Bijv: visvlonders • Vaak glasvezel en uv-absorptiemiddelen toegevoegd • Maakt ze sterker en weerbestendig

Biologisch afbreekbaar plastic • Ook wel bioplastics • Veel onderzoek naar • Deze kunststoffen kunnen wel afgebroken worden – Compost – Bacteriën uit de natuur

Huiswerk • Maak opdracht 30 t/m 34

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 30. a. spuitgieten en extruderen b. thermoplastkorrel worden verwarmd tot ze zacht of vloeibaar zijn 31. a. monomeren worden in mal gestopt, vaak in aanwezigheid van harder. Mal wordt verhit waarbij polymerisatie plaats vindt b. Thermoharders worden niet zacht als je ze verwarmt

32. a. Verwekingspunt is de temperatuur waarbij een thermoplastisch kunststof zacht wordt b. als het verwekingspunt laag is zijn de bindingen niet sterk. Stof kan gaan smelten c. hoe groter de massa, des te sterker de vanderwaalskracht des te hoger het verwekingspunt 33. a. Thermoplast: 1, 2, 4 Thermoharder: 3 b. molecuul 2 heeft OH groepen dus Hbruggen dus hoger verwekingspunt

33. c. 1 en 2 polyadditie er moet een dubbele binding aanwezig zijn geweest 3 en 4 polycondensatie bij 3 is het monomeer stof 2 bij 4 is een estergroep aanwezig d. 1, 2 en 3 zijn geen copolymeren (maar 1 monomeer), stof 4 is een copolymeer (meerdere monomeren) e.

34. a. veel zwerfafval, verbranding schadelijke stoffen b. plastics recyclen en bioplastics gebruiken c. biologisch afbreekbaar

Natuurlijke polymeren • Alle polymeren die worden gemaakt in een levend organisme – Plantaardig of dierlijk • Polypeptiden – Ontstaan uit het monomeer aminozuren – Deze bestaan uit? ? ?

• Koppelingsplaats: peptide binding • Door polycondensatie • R = restgroep (kan H zijn maar ook meer)

Natuurlijke aminozuren • Er zijn 20 verschillende aminozuren • 11 aminozuren kan ons lichaam zelf maken • 9 krijgen we binnen door voedsel • Essentiële aminozuren • Volgorde bepaalt welke polypeptide


Voorbeelden van eiwitten

Functies van eiwitten • Bouwstof – Noemen we: Structuureiwit – Bijv. haren, huid, tanden en nagels • Enzym – Noemen we: biokatalysator – Zeer specifiek (maar 1 reactie) • Temperatuuroptimum en p. H-optimum – Wanneer enzym het beste werkt • Energievoorziening • Vervoer van stoffen

Huiswerk • Maak opdracht 36 t/m 41 • Niet maken 38 b, 40, 41 c

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 36. a. b. aminozuren c. de volgorde van aminozuren in een polypeptidebinding d. De vorming van H-bruggen en S-bruggen e. bouwstoffen, enzymen, energievoorziening en vervoer van stoffen

36. f. werking is specifiek g. de p. H waarbij het enzym optimaal werkt 37. 38. a. er is een klein verschil in de volgorde van de aminozuren

39. a. een faseverandering kun je terug draaien b. de H-bruggen en S-bruggen c. lichaamstemperatuur dus 37 graden d. dan denatureert het eiwitgedeelte van het enzym. De structuur gaat dus verloren 41. a. eiwitten die het lichaam zelf niet kan maken. Ze moeten dus in je voeding zitten b. Val, Leu, Ile Thr, Met, Phe, Trp, His, Lys

Koolhydraten • Structuur bevat alleen C, H en O atomen • Ook wel sachariden genoemd – Monosacharide (glucose) – Disacharide (lactose) – Polysacharide (zetmeel)

Zetmeel • Polysacharide dat bestaat uit glucose moleculen • Gemaakt door polycondensatie • Door veel OH bindingen kunnen veel cross -links ontstaan. – glycogeen

Functies koolhydraten Zetmeel: • Maakt lichaam niet zelf aan • Energieproductie – Door afbraak zetmeel naar glucose Glycogeen • Maakt lichaam zelf aan • Opgeslagen in lever en spierweefsel • Energiebuffer

Cellulose: • Komt het meest voor op aarde • Bouwstof van celwanden van planten en bomen • Mensen kunnen het niet verteren • Koeien wel – (bacteriën in darmen)

Huiswerk • Opdracht 43 t/m 46 a t/m e • 45 alleen b

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 43. a. Monosacharide: glucose en fructose Disacharide: lactose en sacharose polysacharide: cellulose en zetmeel b. fotosynthese 6 CO 2 + 6 H 2 O C 6 H 12 O 6 + 6 O 2 c. energievoorziening d. energiebuffer e. bouwstof voor celwanden in planten en bomen

44. a. - wassen en in stukken snijden - met water koken en extraheren - filtratie - filtraat indampen b. koken en indampen c. suikermoleculen zijn kleiner en hebben meer OH groepen voor H-bruggen 45. b. (C 6 H 10 O 5)n + n. H 2 O n. C 6 H 12 O 6

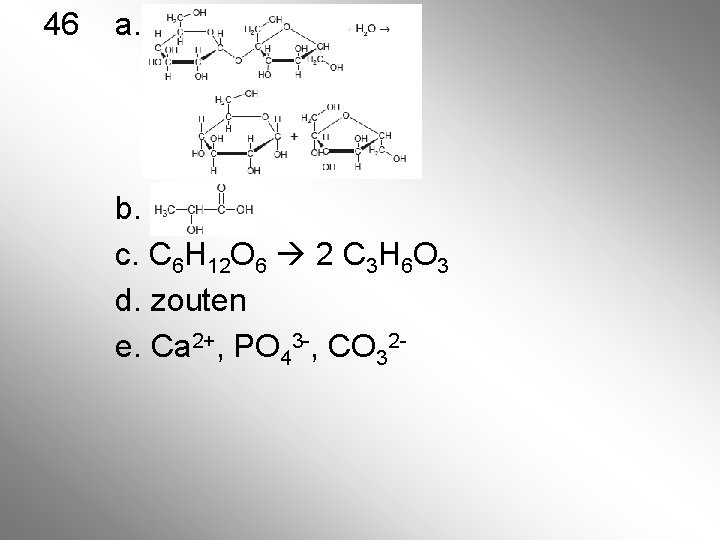
46 a. b. c. C 6 H 12 O 6 2 C 3 H 6 O 3 d. zouten e. Ca 2+, PO 43 -, CO 32 -

10. 5 Je lichaam is een reactievat • Functie van voedsel – Eiwitten – Vetten – Koolhydraten – Mineralen – Vitamines

Eiwitten • Dierlijk – Voornamelijk in vlees, vis en zuivelproducten – Bevatten voldoende essentiële aminozuren • Plantaardig – Voornamelijk in brood, graanproducten, peulvruchten – Hangt af van product of er voldoende essentiële aminozuren in zitten

Eiwitten • Hydrolyse – Tijdens spijsvertering – Hierdoor ontstaan aminozuren – Deze worden gebruikt voor nieuwe eiwitten

Eiwitten • Worden omgezet in glucose wanneer je: – te weinig hebt gegeten – Te weinig koolhydraten binnen krijgt – Te veel eiwitten binnen krijgt • Te veel aminozuren in je lichaam – Afgebroken in lever – Hier ontstaat ureum – Via nieren afgevoerd in urine

Koolhydraten • Krijg je binnen door bijvoorbeeld: – Brood – Aardappelen – Pasta – Rijst • In vorm van: – Glucose – Zetmeel – Sacharose

Koolhydraten • Hydrolyse bij sacharose en zetmeel • Hierbij reageert sacharose of zetmeel met water waarbij glucose ontstaat • Glucose wordt opgenomen in lichaam – Eerst dunne darm – Dan in het bloed – Deel naar lichaamscellen voor verbranding • Energievoorziening – Deel reageert tot glycogeen • Opgeslagen in lever en spierweefsel

• Glycogeen kan weer gehydrolyseerd worden tot glucose waarna deze weer naar cellen gebracht kan worden voor verbranding

Vetten • Tri-esters van glycerol en vetzuren • Dierlijke vetten – Boter, vlees, zuivelproducten – Verzadigd • Plantaardige vetten – Noten, zonnebloemolie – Onverzadigd

Vetten • Door hydrolyse ontstaan vetzuren en glycerol • Vetzuren (vooral onverzadigde) worden gebruikt voor bouw van lichaamscellen • Onverzadigde vetten verlagen cholesterol • Onverzadigde vetzuren worden ook essentiële vetzuren genoemd – Lichaam kan deze niet zelf aanmaken

Te veel vet • Worden in het lichaam opgeslagen als reservebrandstof • Als er geen glucose meer is voor energievoorziening, wordt deze vetvoorraad aangesproken en verbrand

Mineralen • Stoffen waarin de volgende atomen voorkomen: – Kobalt – Calcium – Ijzer – Zwavel – Fosfor - Fluor - Seleen - Jood - Natrium - Kalium

Mineralen • Worden omgebouwd tot allerlei enzymen – Bijv ijzer is nodig voor vorming hemoglobine – Calcium voor botten en tanden • Hoeveelheid is wisselend – Mineralen die je weinig nodig hebt noemen we sporenelementen

Vitamines • Koolstofverbindingen • Lichaam kan ze niet of nauwelijks maken • Versterken de werking van sommige enzymen • Natuurlijk of synthetisch • Erg gevoelig voor invloeden van buitenaf – p. H verandering – Verhitten – Oplossend vermogen – Licht en lucht

Water • Per dag 2, 5 liter nodig • 1 liter zit in voedsel • Beginstof voor alle hydrolyse reacties in je lichaam • Transport • Warmte afvoer

Huiswerk • Opdracht 47 t/m 50 a en 51 b

Polymeren

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 47. a. b. Eiwitten (structuureiwitten), vetten (bouw van lichaamscellen), koolhydraten (energievoorziening), mineralen (enzymen) en vitamines (versterken de werking van enzymen) water (hydrolysereacties, transport) c. vetzuren uit je voedsel omdat het lichaam deze niet kan maken d. atoomsoorten die je in hele kleine hoeveelheden nodig hebt

48. a. Cellulose b. dan worden onvoldoende voedingsstoffen opgenomen in je lichaam 49. a. een of meerdere dubbele bindingen b. broomwater. Dan verdwijnt de bruine kleur door de additie van broom c.

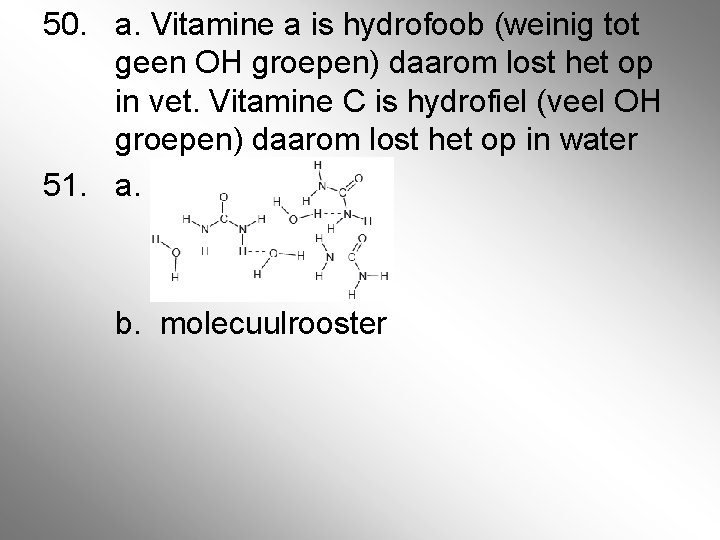
50. a. Vitamine a is hydrofoob (weinig tot geen OH groepen) daarom lost het op in vet. Vitamine C is hydrofiel (veel OH groepen) daarom lost het op in water 51. a. b. molecuulrooster

Herhaling
 Theorie planning
Theorie planning Ik denk aan je vandaag
Ik denk aan je vandaag Wat gaan we doen vandaag
Wat gaan we doen vandaag Ik denk aan je vandaag
Ik denk aan je vandaag Jezus geneest vandaag
Jezus geneest vandaag Surface grinding attachment
Surface grinding attachment Speciale dag vandaag
Speciale dag vandaag Fijne dag vandaag
Fijne dag vandaag Arbo vandaag
Arbo vandaag Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Exploitatiebegroting betekenis
Exploitatiebegroting betekenis Handig tellen
Handig tellen Hoofdstuk in een opera
Hoofdstuk in een opera Energie symbool
Energie symbool Wiskunde 3 havo
Wiskunde 3 havo Hoofdstuk 3
Hoofdstuk 3 De belofte van pisa samenvatting per hoofdstuk
De belofte van pisa samenvatting per hoofdstuk Noughts and crosses chapter 6 summary
Noughts and crosses chapter 6 summary Dominotheorie voor ongevallen
Dominotheorie voor ongevallen Ronald westra
Ronald westra Theorie des graphe
Theorie des graphe Joop berding
Joop berding Nieke 10 ziele
Nieke 10 ziele Kognitive theorie beck
Kognitive theorie beck Rationalitt
Rationalitt Biographie virginia henderson
Biographie virginia henderson Theorie du big bang
Theorie du big bang Polyvagal theorie
Polyvagal theorie Synoptischer befund
Synoptischer befund Theorie mittlerer reichweite
Theorie mittlerer reichweite Kognitive theorie beck
Kognitive theorie beck Wat betekend motivatie
Wat betekend motivatie Théorie de rankine
Théorie de rankine Vesslina
Vesslina Spf theorie
Spf theorie Henri fayol
Henri fayol Sdt theorie
Sdt theorie Sozialpsychologie themen
Sozialpsychologie themen Théorie néoclassique
Théorie néoclassique Present simple o
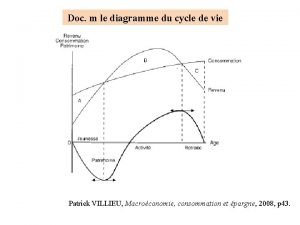
Present simple o Cycle de vie modigliani
Cycle de vie modigliani Théorie des attentes de vroom
Théorie des attentes de vroom Sampc model
Sampc model Théorie bicellulaire
Théorie bicellulaire Theorie van perrow
Theorie van perrow Wachtrijtheorie
Wachtrijtheorie Theorie capital asset pricing model
Theorie capital asset pricing model Theorie
Theorie Act-theorie beispiel
Act-theorie beispiel Les limites de l'école des relations humaines pdf
Les limites de l'école des relations humaines pdf Theorie de nash
Theorie de nash La théorie x et y
La théorie x et y Nancy roper théorie
Nancy roper théorie Dreieckstheorie der liebe nach sternberg (1986)
Dreieckstheorie der liebe nach sternberg (1986) Xy theorie
Xy theorie Min max theorem
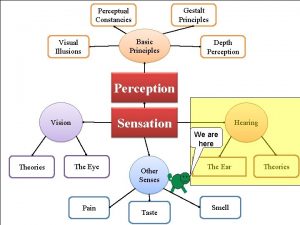
Min max theorem Gestalt théorie
Gestalt théorie Théorie de vroom motivation
Théorie de vroom motivation Dynamische driehoek theorie
Dynamische driehoek theorie Théorie de l'agence
Théorie de l'agence Set point theorie
Set point theorie équilibre de nash
équilibre de nash Keynesianismus
Keynesianismus Theorie der wirtschaftlichen entwicklung
Theorie der wirtschaftlichen entwicklung Snaar theorie
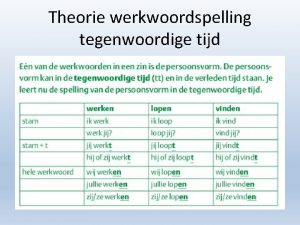
Snaar theorie Werkwoordspelling schema
Werkwoordspelling schema Théorie de skopos
Théorie de skopos Segelflug theorie
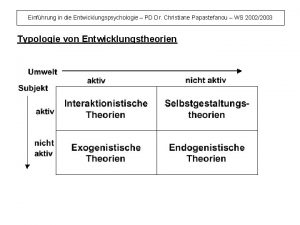
Segelflug theorie Exogenistische theorie
Exogenistische theorie La théorie du polysystème
La théorie du polysystème Begeleidingsmethoden ouderenzorg
Begeleidingsmethoden ouderenzorg La théorie du grand homme leadership
La théorie du grand homme leadership ش4ا
ش4ا Dft dichte funktional theorie
Dft dichte funktional theorie Gelegenheidstheorie
Gelegenheidstheorie 6 postulats de la théorie particulaire
6 postulats de la théorie particulaire Théorie de l'action planifiée
Théorie de l'action planifiée Théorie quantitative de la monnaie
Théorie quantitative de la monnaie La théorie de l'apprentissage social
La théorie de l'apprentissage social Jeux jeuxnjeux
Jeux jeuxnjeux Apprentissage maslow
Apprentissage maslow Short term planning and long term planning
Short term planning and long term planning Examples of aggregate planning
Examples of aggregate planning Scenario planning workforce planning
Scenario planning workforce planning Language policy and planning ppt
Language policy and planning ppt N planning
N planning Aggregate planning is capacity planning for
Aggregate planning is capacity planning for Strategic planning vs tactical planning
Strategic planning vs tactical planning Aggregate planning is capacity planning for
Aggregate planning is capacity planning for Planning balance sheet in urban planning
Planning balance sheet in urban planning Dairy plant management
Dairy plant management Menu types
Menu types Aacu stock price
Aacu stock price Imc planning process
Imc planning process Software project management lectures
Software project management lectures Tt planning
Tt planning Contingent crop planning
Contingent crop planning Events management team structure
Events management team structure Masters in infrastructure planning and management
Masters in infrastructure planning and management Dvhs academic planning
Dvhs academic planning College planning source
College planning source Pierce energy planning
Pierce energy planning Cayenta cis
Cayenta cis Sii il cambiamento che vuoi vedere nel mondo
Sii il cambiamento che vuoi vedere nel mondo Palo alto planning
Palo alto planning Manpower planning process
Manpower planning process Pcmm training
Pcmm training Joint capability areas
Joint capability areas Hyperion strategic finance vs hyperion planning
Hyperion strategic finance vs hyperion planning Incident managers begin planning for the demobilization
Incident managers begin planning for the demobilization Account planning
Account planning Floor planning concept in vlsi ppt
Floor planning concept in vlsi ppt Ercot
Ercot Operational plan examples
Operational plan examples Joint space vs cartesian space
Joint space vs cartesian space Importance of project planning
Importance of project planning Financial planning and forecasting
Financial planning and forecasting Enterprise research planning
Enterprise research planning Example of learning objectives
Example of learning objectives Ubd stage 3 examples
Ubd stage 3 examples Planning for classroom test
Planning for classroom test Wbs human resource management
Wbs human resource management Advanced planning command center
Advanced planning command center Multi channel retailing ppt
Multi channel retailing ppt Ai planning applications
Ai planning applications Master planning parameters ax 2012
Master planning parameters ax 2012 What are some characteristics of a wise money manager
What are some characteristics of a wise money manager