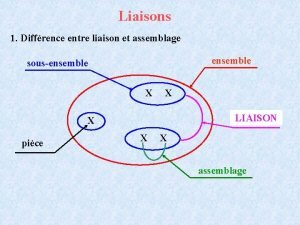
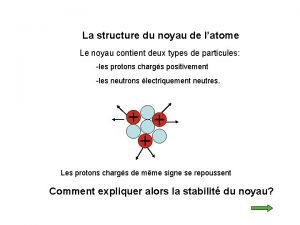
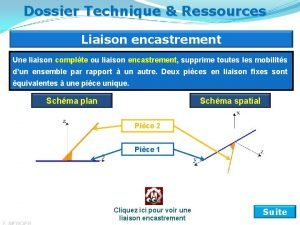
Liaisons chimiques SCH 4 U Liaisons chimiques Liaison









































































































- Slides: 137

Liaisons chimiques SCH 4 U

Liaisons chimiques Liaison ionique

Résultat d’apprentissage Je peux déterminer la polarité de diverses substances par l’analyse de la forme tridimensionnelle et des valeurs d’électronégativité de leurs éléments. 12/2/2020 3

Introduction Liaison chimique = force électrostatique qui unie plusieurs atomes ensemble. Liaison chimique Électrons de valence. Liaison chimique = forces intramoléculaires (atomes entre eux). Forces intermoléculaires: unies les molécules entre elles. Le type de liaison chimique dicte le type de solide et de molécule individuelle. 12/2/2020 4

Introduction Type de liaison chimique: – Ionique Transfert d’électrons, – Covalente (2 types) Partage d’une paire d’électrons, – Métallique Mise en commun des électrons de valence. Le type de liaison dépend de la force avec laquelle les atomes attirent les électrons (électronégativité). 12/2/2020 5

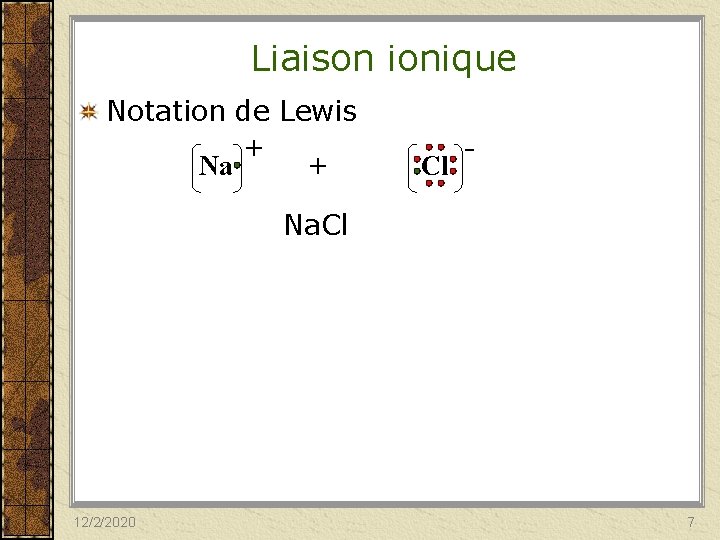
Liaison ionique = attraction électrostatique entre ions de charges opposées. S’établit entre un métal et un non-métal. Na Cl - + Na 12/2/2020 Cl 6

Liaison ionique Notation de Lewis + Na + Cl - Na. Cl 12/2/2020 7

Prédiction liaison ionique Prédiction du caractère ionique: – Calcul de la différence d’électronégativité: ΔÉN≥ 1, 7. • Exemple: Liaison Ca-O • ΔÉN = ÉN(O)–ÉN(Ca) = 3, 44– 1, 00 = 2, 44 – Analyse de la position des atomes dans le tableau périodique. Liaison ionique entre atomes gr 6 et 7 avec atomes du gr 1 et 2. 12/2/2020 8

Structure des composés ioniques Composés ioniques = solide cristallin constitué d’unité répétitive en 3 D appelé maille. Maille = anions et cations liés par attraction électrostatique. 6 Na+ pour 6 Cl(Voir page 216 Chimie 12) 12/2/2020 9

Structure des composés ioniques 12/2/2020 10

Propriétés composés ioniques Lisses et luisants. Durs et cassants. (voir fig. 4. 14 page 218) Non conducteur d’électricité et de chaleur à l’état solide. Conducteur d’électricité lorsque dissout dans l’eau. (voir fig. 4. 15 page 218) Point de fusion élevé et d’ébullition élevé. (voir tableau 4. 2 page 217) Ex. Mg. O (car O 2 - et Mg 2+ se lient plus fortement) Mg. Cl vs Mg. F (car F est plus petit que Cl donc les ions du fluorures de magnésium sont plus proches que ceux du chlorure de magnésium. 12/2/2020 11

Propriétés composés ioniques (suite) Solubilité dans l’eau. La plupart des composés ioniques sont solubles dans l’eau. Il faut que les forces d’attractions entre ses ions et les molécules d’eau soient plus fortes que celles qui s’exercent entre ses ions. Pour l’animation de la dissolution du Na. Cl dans l’eau clique sur ce lien: https: //nouvelon. apprentissageelect roniqueontario. ca/d 2 l/lor/viewer/vi ew. d 2 l? ou=8201&lo. Ident. Id=17643 8 12/2/2020 12

Propriétés composés ioniques (suite) Valeurs de solubilité de quelques composés ioniques courants (page 217 Chimie 12) Composé 12/2/2020 Solubilité à 25 °C (g/100 m. L) Cs. Br (s) 123 Na. I (s) 184 Mg. Cl 2 (s) 56, 0 Na. Cl (s) 36, 0 Mg. F 2 (s) 0, 013 Mg. O (s) Très faible 13

Liaison ionique Lecture des pages 208 -210 et 214 -218 Réponds aux questions de la section Vérifie tes connaissances: # 2 et 3 de la page 211 et au # 13 -18 de la page 218 12/2/2020 14

Liaisons chimiques Liaison covalente

Liaison covalente – Elle s’établit généralement atomes ayant des électronégativités élevés (non-métaux). – Elle résulte d’une mise en commun d’un ou de plusieurs électrons par les atomes impliqués. Cl C 12/2/2020 + + Cl Cl Cl H H HCH H 16

Prédiction liaison covalente Type de liaison covalente: – Covalente légèrement polaire ou non polaire: si ΔÉN < 0, 4, partage symétrique de la paire d’électron impliquée dans la liaison. – Covalente polaire: si 0, 4 ≤ ΔÉN ≤ 1, 7, partage asymétrique de la paire d’électron impliquée dans la liaison. Charge partielle « + » sur l’atome le plus électronégatif 12/2/2020 Dipôle Charge partielle « – » sur l’atome le plus électronégatif 17

Liaison covalente multiple Liaison simple: partage d’une seule paire d’électrons entre deux atomes. Liaison double: partage de deux paires d’électrons par deux atomes. O + O O O Liaison triple: partage de trois paires d’électrons par deux atomes. N 12/2/2020 + N N N 18

Liaison covalente multiple Les liaisons multiples sont plus courtes que les liaisons simples. – Un liaison triple est plus courte qu’une liaison double, elle-même plus courte qu’une liaison simple. La grande densité électronique augmente l’attraction entre les noyaux et les électrons, conduisant à une réduction de la longueur de la liaison. 12/2/2020 19

Liaison covalente multiple Une liaison multiple contient plus d’électrons; ce qui accroît l’attraction exercée par le noyau et donc réduit la longueur de la liaison. 12/2/2020 20

Mécanique quantique et les liaisons p. 220 2 théories pour expliquer les liaisons chimiques Théorie de liaison de valence: basée sur la mécanique quantique qui explique la formation de liaisons covalentes et les formes moléculaires par le recouvrement des orbitales. Fig. 4. 17 Théorie des orbitales moléculaires: basée sur la mécanique quantique qui explique la formation de liaisons covalentes et les formes moléculaires par la formation de nouvelles orbitales 12/2/2020 21 moléculaires. Fig. 4. 17

Mécanique quantique et les liaisons (suite) Principes de la théorie de liaison de valence: 1 -Région de recouvrement des orbitales ne peut avoir qu’un max de 2 électrons de spins opposés. (Principe d’exclusion de Pauli) 2 -Recouvrement des orbitales doit être maximal. (liaison plus forte et stable). L’étendue des orbitales liée à la forme et à la direction de chacune des orbitales impliqués dans la liaison. 3 -Explication des formes de certaines molécules par le concept d’hybridation des orbitales atomiques. (Nouvelles orbitales produites par combinaison). Fig. 4. 17 page 221 du manuel de Chimie 12 12/2/2020 22

Orbitales hybrides (voir fig. 4. 18 page 221) Orbitale formée par la combinaison de 2 ou plusieurs orbitales dans la couche de valence d’un atome. Ex. Le méthane a 4 liaisons identiques. Démonstration-vidéo https: //fr. khanacade my. org/science/orga nic-chemistry/genchem-review/hybridorbitals-jay/v/sp 3 hybridized-orbitalsand-sigma-bonds 12/2/2020 23

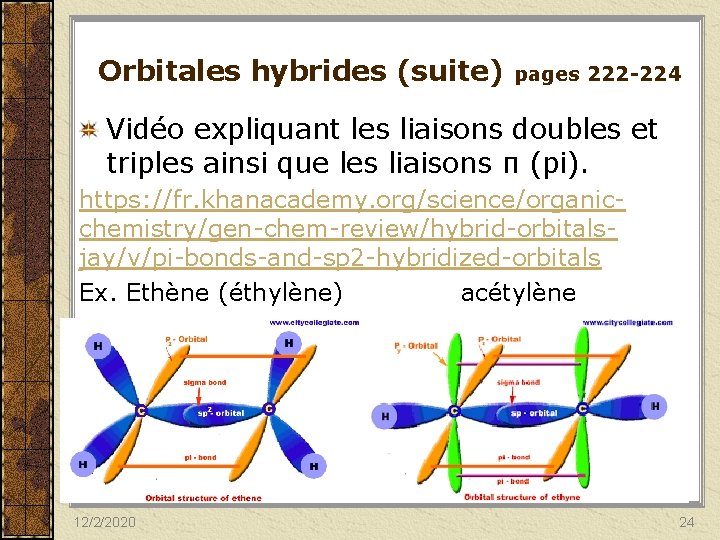
Orbitales hybrides (suite) pages 222 -224 Vidéo expliquant les liaisons doubles et triples ainsi que les liaisons π (pi). https: //fr. khanacademy. org/science/organicchemistry/gen-chem-review/hybrid-orbitalsjay/v/pi-bonds-and-sp 2 -hybridized-orbitals Ex. Ethène (éthylène) acétylène 12/2/2020 24

Vérifie tes connaissances Réponds aux questions 19 -24 de la page 223. 12/2/2020 École catholique Ste-Famille/E. Ganpo 25

Allotropes Définition: Un ou des composés constitués du même élément , mais qui ont des propriétés différentes. 12/2/2020 École catholique Ste-Famille/E. Ganpo 26

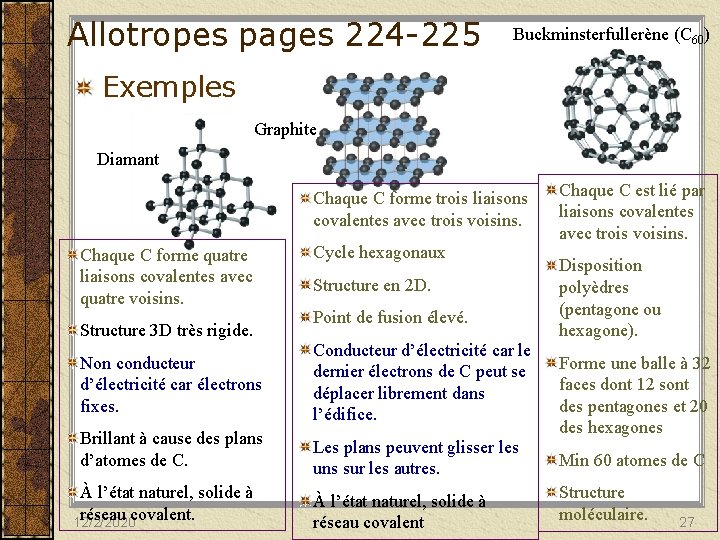
Allotropes pages 224 -225 Buckminsterfullerène (C 60) Exemples Graphite Diamant Chaque C forme trois liaisons covalentes avec trois voisins. Chaque C forme quatre liaisons covalentes avec quatre voisins. Structure 3 D très rigide. Cycle hexagonaux Structure en 2 D. Point de fusion élevé. Non conducteur d’électricité car électrons fixes. Conducteur d’électricité car le dernier électrons de C peut se déplacer librement dans l’édifice. Brillant à cause des plans d’atomes de C. Les plans peuvent glisser les uns sur les autres. À l’état naturel, solide à réseau covalent. 12/2/2020 À l’état naturel, solide à réseau covalent Chaque C est lié par liaisons covalentes avec trois voisins. Disposition polyèdres (pentagone ou hexagone). Forme une balle à 32 faces dont 12 sont des pentagones et 20 des hexagones Min 60 atomes de C Structure moléculaire. 27

Allotropes (pages 224 -225) Autre exemple Nanot nanotube (utilisé en nanotechnologie dans les secteurs microélectronique (LCD, écran tactile) et de la médecine). 12/2/2020 28

Solides à réseau covalent (page 225) Exemple: l’oxyde de silicium (Si. O 2) – Le Si ne forme pas de liaison double avec l’oxygène à cause de sa grande taille. Chaque atome de silicium se lie à quatre atomes d’oxygène pour donner un réseau tétraédrique avec des atomes d’oxygène partagée. 12/2/2020 29

Solides covalents à réseau p. 225 Solides covalents à réseau: les atomes sont liés à leur voisins par des liaisons covalentes. Dans la nature, n’ont pas de début et fin ex. graphite, diamant, silice (dioxyde de silicium) Solides covalents à réseau: – Matériaux durs et rigides, – Points de fusion et d’ébullition élevés, 12/2/2020 30

Liaisons chimiques Liaison métallique

Résultat d’apprentissage Je peux déterminer la polarité de diverses substances par l’analyse de la forme tridimensionnelle et des valeurs d’électronégativité de leurs éléments. 12/2/2020 École catholique Ste-Famille/E. Ganpo 32

Liaison métallique Atomes de métaux ont des valeurs d’électronégativité peu élevées et leur couches de valence sont moins qu’à moitié remplies. Réagissent avec des atomes de même métal ou de métaux différents, sans arriver à attirer et à retenir les électrons d’autres atomes assez efficacement afin de remplir leurs couches de valence. L’attraction de leurs propres électrons à l’état solide ou liquide est si faible que ces électrons peuvent se déplacer plus ou moins librement d’un atome à un autre. (électrons délocalisés) 12/2/2020 33

Liaison métallique Elle lie les métaux ensemble. Un très grand nombre de cations mettent en commun un ou plusieurs électrons qui se trouvent délocalisés. Cations du métal Mer d’électrons partagé par tous les cations 12/2/2020 34

Solides métalliques Les atomes des métaux partagent leurs électrons dans toute la structure ; on dit qu’ils sont délocalisés. La force d’attraction entre les cations et les électrons maintient la structure ensemble. 12/2/2020 35

Points de fusion et d’ébullition des métaux Fig. 4. 5 page 212 Dans un groupe , Pt de fusion et pt d’ébullition diminuent à mesure que numéro atomique augmente. Les é de valence s’éloignent du noyau de haut en bas du groupe. (forces d’attraction plus petites) Dans les périodes 6 ou 7 premiers groupes, Pt de fusion et d’ébullition augmentent de gauche à droite. Plus de protons, plus d’électrons de valence donc plus grande forces d’attraction. Cette tendance n’est pas la même audelà d’un certain point dans une période plus que les orbitales d se remplissent (structure électronique plus complexe). Groupe 12: orbitales d de ce groupe sont pleines. Donc moins des électrons ne peuvent pas se détacher librement de l’atome. Donc moins d’électrons dans la mer d’électrons; pt de fusion et d’ébullition diminuent. 12/2/2020 36

Pratique-toi Arrange ces ensembles en ordre croissant de point de fusion a) Na Li K b) Al Mg Na Réponses a)K Na Li b) Na Mg Al Source: Chemistry for the IB Diploma page 161 #11 12/2/2020 37

Liaison métallique Propriétés des métaux (pages 212 et 213 Chimie 12) – Bons conducteurs de chaleur et d’électricité (libre mouvement des électrons). (page 212) – Malléabilité et ductilité (la liaison métallique est non directionnelle et résulte de l’attraction entre cations et électrons délocalisés, il y a donc possibilité pour les plans de cations de glisser les uns sur les autres). (voir fig 4. 6 page 213) – Dureté: dépend de la taille des grains cristallins du métal. Petits grains cristallin, plus grande surface entre ses joints donc plus dur qu’un métal avec de plus grands grains cristallins avec moins de joints. 12/2/2020 38

Les alliages Définition: Un mélange homogène solide de 2 ou plusieurs types d’atomes métalliques. Dans certains cas, ils contiennent aussi des atomes non-métal (ex. Carbone) Les métaux les plus utilisés. On leur donne des propriétés requises pour des utilisations particulières (ex. plus de résistance à la corrosion, dureté, plus fort, plus de ductilité (fil)) 12/2/2020 39

Alliage (suite) Voir fig. 4. 7 page 214 manuel de Chimie 12 12/2/2020 40

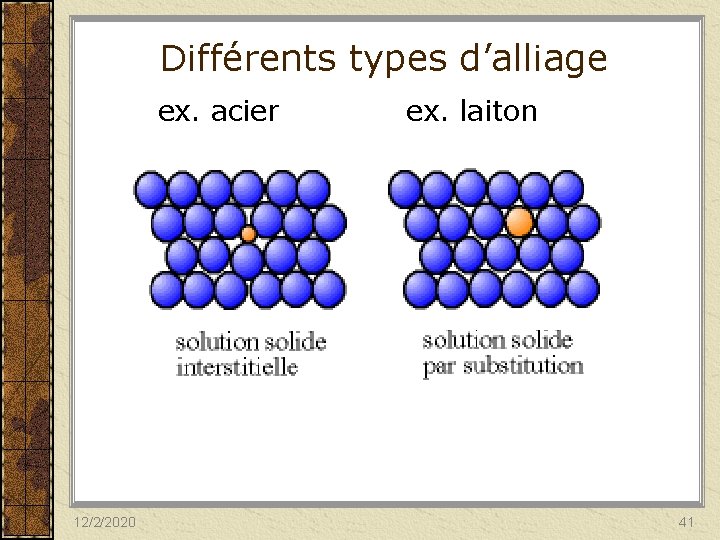
Différents types d’alliage ex. acier ex. laiton 12/2/2020 41

Exemples d’alliage Alliage Composition Usage Laiton Cuivre et zinc Poignée de porte, vis Acier Fer, carbone et Construction de d’autres métaux (ex. ponts, édifices, ponts, édifices tungstène, câbles tungstène, manganèse) Amalgame dentaire Mercure, argent et étain 12/2/2020 École catholique Ste-Famille/E. Ganpo Utiliser par les dentiste pour remplir les dents. 42

Pratique-toi Lecture des pages 211 à 214 du manuel de chimie 12. Réponds aux questions 1 -4 de la page 211 et page 214 des numéros 7 -12 du manuel de Chimie 12 pour le prochain cours. http: //www. texasgateway. org/resource/ chemical-bonding-metallic-bonds 12/2/2020 43

Liaisons chimiques Structure de Lewis des molécules

Résultats d’apprentissage Je peux expliquer comment les propriétés d’un solide ou d’un liquide (p. ex. , dureté, tension superficielle, conductivité électrique) dépendent de la nature de leurs particules ainsi que des forces intramoléculaires et intermoléculaires (p. ex. , liaisons covalentes, forces de Van der Waals, liens d’hydrogène, liaisons métalliques). Je peux utiliser la théorie de la répulsion des paires d’électrons de valence (RPEV) pour expliquer et prédire la forme tridimensionnelle et la polarité de molécules simples. Je peux prédire et illustrer la forme tridimensionnelle de molécules simples en utilisant la théorie de la répulsion des paires d’électrons de valence (RPEV). Je peux déterminer la polarité de diverses substances par l’analyse de la forme tridimensionnelle et des valeurs d’électronégativité de leurs éléments. Je peux prédire le type de solide (ionique, moléculaire, covalent à réseau ou métallique) que formera une substance et en décrire les propriétés. 12/2/2020 45

Résultats d’apprentissage Je peux communiquer oralement et par écrit dans différents contextes en se servant des termes justes dont : orbitale, spectre d’absorption, quanta, photon, dipôle, substance ionique, substance covalente à réseau, substance moléculaire, substance métallique, doublet liant, doublet libre. Je peux présenter des exemples de matériaux créés suite aux recherches sur la structure de la matière, les liaisons chimiques et les propriétés de la matière. Je peux évaluer l’impact social de technologies dont la mise au point repose sur la compréhension des structures atomiques et moléculaires (p. ex. , imagerie par résonnance magnétique, spectroscopie infrarouge, rayons X, médecine nucléaire). 12/2/2020 46

Structure de Lewis des molécules Importance de la structure de Lewis: – Montre la connexion entre les atomes lorsqu’ils forment des molécules ou des ions polyatomiques. – Il permet de prévoir la forme géométrique des molécules ainsi que leur polarité. 12/2/2020 47

Structures de Lewis des molécules et des ions polyatomiques Définition des structures de Lewis Les composantes d ’une structure ou diagramme de Lewis sont des atomes et leurs électrons périphériques. Doublet d’électrons H O H partagé entre deux atomes = doublet de liaison Chaque doublet de liaison est généralement représenté par un tiret. Doublet libre H—O—H

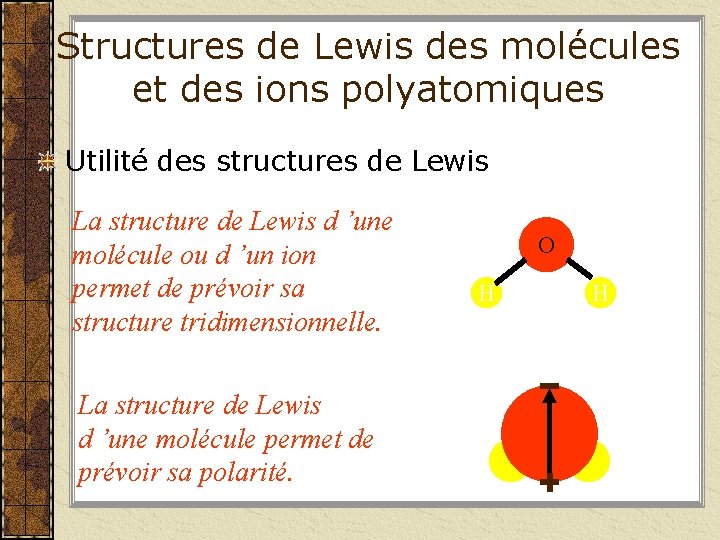
Structures de Lewis des molécules et des ions polyatomiques Utilité des structures de Lewis La structure de Lewis d ’une molécule ou d ’un ion permet de prévoir sa structure tridimensionnelle. La structure de Lewis d ’une molécule permet de prévoir sa polarité. O H H

Élaboration des structures de Lewis : étape 1 (voir page 228 -Chimie 12) Pour écrire une structure de Lewis on doit premièrement déterminer l’arrangement des atomes Dans les molécules ou ions binaires simples, l’atome central est celui présent en plus petit nombre ou celui qui est le moins électronégatif et son symbole apparaît souvent en premier dans la formule SO 2 O S O NO 3 - O N H 2 S O O H S H

Élaboration des structures de Lewis : étape 1 Pour écrire une structure de Lewis on doit premièrement déterminer l’arrangement des atomes N 2 O et N 2 S sont des exceptions L ’atome H ou de F est toujours terminal N 2 O N 2 H 4 N N O H H N N H H

Élaboration des structures de Lewis : étape 1 Pour écrire une structure de Lewis on doit premièrement déterminer l’arrangement des atomes L’atome C est toujours central et fait généralement 4 liaisons CHCl 3 Cl H C Cl Cl CF 2 Br 2 F F C Br Br

Élaboration des structures de Lewis : étape 1 Pour écrire une structure de Lewis on doit premièrement déterminer l’arrangement des atomes Dans de nombreux acides, un atome central est entouré de O et des H sont reliés aux O H 2 SO 4 HSO 3 - O H O S O

Élaboration des structures de Lewis : étape 2 Pour écrire une structure de Lewis on doit calculer le nombre d ’électrons périphériques à répartir dans la molécule ou l’ ion S On trouve le nombre d ’électrons périphériques pour chaque atome dans le tableau périodique On additionne les nombres d ’électrons de chacun des atomes [Ne]3 s 2 p 4 SO 2 6 électrons périphériques 1 S 1 x 6=6é 2 O 2 x 6 = 12 é Total 6 + 12 = 18 é 9 doublets

Élaboration des structures de Lewis : étape 2 Pour écrire une structure de Lewis on doit calculer le nombre d ’électrons périphériques à répartir dans la molécule ou l’ ion Dans le cas d ’un ion on doit soustraire sa charge NO 3 - Total 5 + 18 - (-1) = 24 é 12 doublets

Élaboration des structures de Lewis : étape 3 Pour écrire une structure de Lewis on doit placer des doublets de liaison pour relier les atomes entre eux SO 2 9 doublets O S O O NO 312 doublets H 2 S 4 doublets H S H O N O

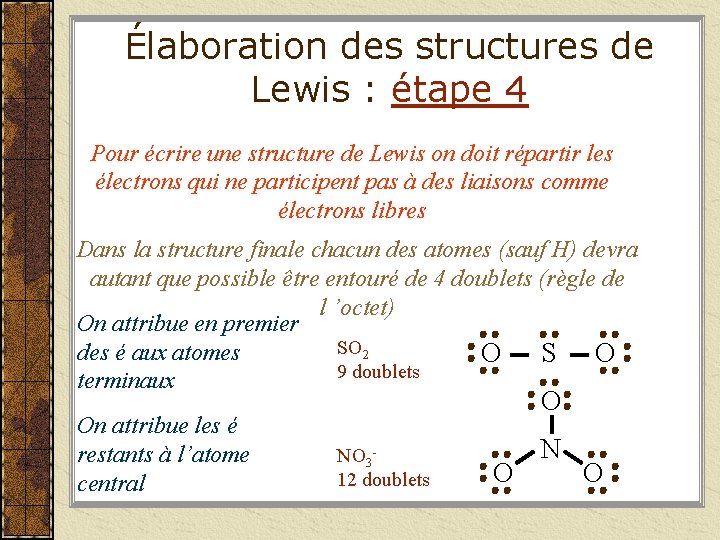
Élaboration des structures de Lewis : étape 4 Pour écrire une structure de Lewis on doit répartir les électrons qui ne participent pas à des liaisons comme électrons libres Dans la structure finale chacun des atomes (sauf H) devra autant que possible être entouré de 4 doublets (règle de l ’octet) On attribue en premier SO 2 des é aux atomes O S O 9 doublets terminaux On attribue les é restants à l’atome central O NO 312 doublets O N O

Élaboration des structures de Lewis : étape 4 Pour écrire une structure de Lewis on doit répartir les électrons qui ne participent pas à des liaisons comme électrons libres Dans la structure finale chacun des atomes (sauf H) devra autant que possible être entouré de 4 doublets (règle de l ’octet) On n ’attribue pas d ’é libres à l ’atome H H 2 S 4 doublets H S H

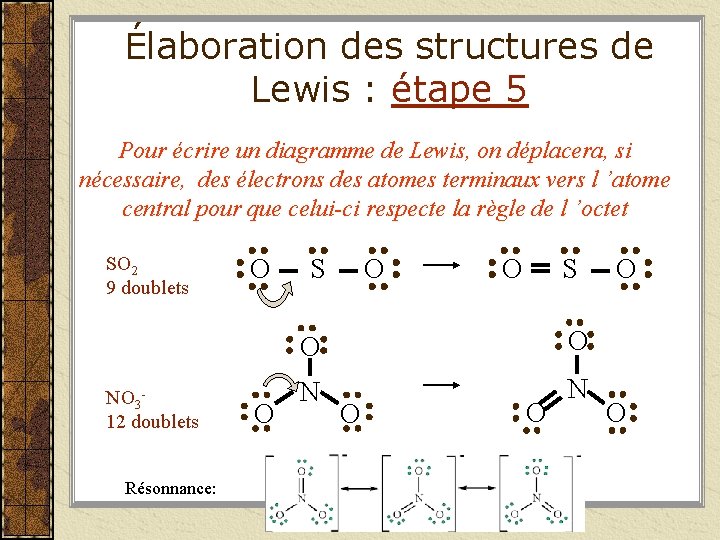
Élaboration des structures de Lewis : étape 5 Pour écrire un diagramme de Lewis, on déplacera, si nécessaire, des électrons des atomes terminaux vers l ’atome central pour que celui-ci respecte la règle de l ’octet SO 2 9 doublets NO 312 doublets Résonnance: O O S O O N N O O

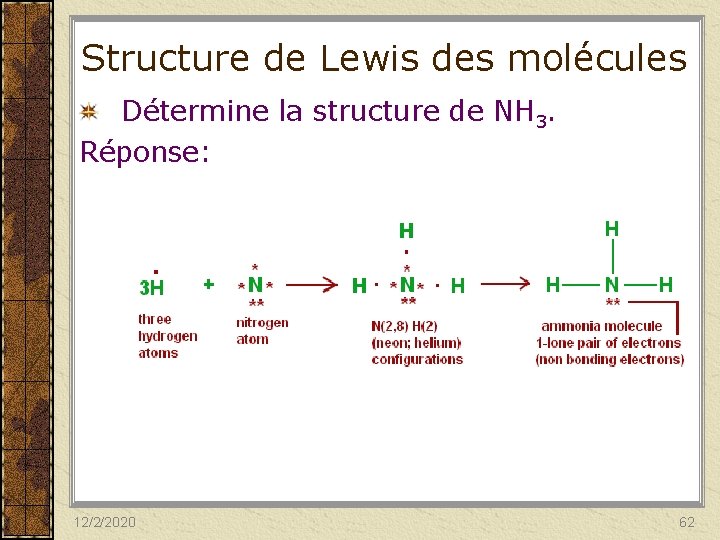
Structure de Lewis des molécules Détermine la structure de NH 3. 1. Détermine le nombre (Nt) d’électrons de valence apportés par chaque atome de la molécule. 2. Détermine le nombre de doublets (liants et non liants) présents dans la molécule. 3. Choisir l’atome central et dispose autour de lui les atomes périphériques. 4. Place les doublets en commençant par ceux des liaisons pour relier les atomes entre eux. 12/2/2020 60

Structure de Lewis des molécules Détermine la structure de NH 3. 5. Répartis les doublets qui ne participent pas à la liaison comme des doublets non liants sur les atomes périphériques. 6. S’il reste des doublet non attribué, mettre sur l’atome central. 7. Si nécessaire, déplace les doublets libres des atomes terminaux vers l’atome central pour que ce dernier respecte la règle de l’octet. 12/2/2020 61

Structure de Lewis des molécules Détermine la structure de NH 3. Réponse: 12/2/2020 62

Exceptions à la règle de l’octet page 229 La règle de l’octet permet la formation d’un maximum de quatre liaisons (huit électrons) autour d’un atome. En se basant sur les énergies des liaisons, certaines molécules s’expliquent mieux par un modèle montrant plus de huit électrons dans le niveau d’énergie de valence de l’atome central. On dit que cet atome central a une hypervalence ou un octet étendu ou niveau d’énergie de valence élargie. Ex: SF 6 (g) (6 orbitales hybrides: sp 3 d 2)

Exceptions dans diagrammes de Lewis La liaison covalente de coordination – L’azote fournit 2 électrons des orbitales remplies car la configuration électronique de l’azote est [He]2 s 2 2 p 3 HNH + H 12/2/2020 H + H HNH H + 64

Exceptions à la règle de l’octet Un octet incomplet: Le bore (B)et le béryllium (Be)sont des métaux particuliers. Ils forment des liaisons covalentes avec des halogènes (F; Cl pour produire du BF 3(g) et du Be. Cl 3(g)) Le bore a 3 électrons de valence et le béryllium en a 2. Le bore et le béryllium ont une valence incomplète. Dans cette structure, le bore a 6 électrons de valence. Le bore a une valence incomplète Dans cette structure, le béryllium a 4 électrons de valence. (Be a une valence incomplète)

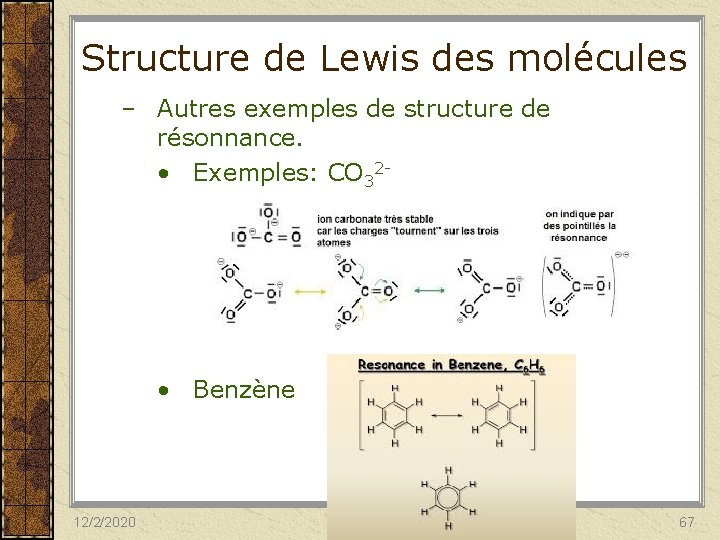
Structure de Lewis des molécules Remarques: – Certaines molécules peuvent posséder plus qu’un atome centrale. • Exemple: N 2 H 4. – Après avoir distribuer les doublets liants, vérifier que la règle de l’octet est respectée. • NB: Il existe des exceptions à la règle de l’octet. – Une molécule peut avoir plus qu’une structure de Lewis; on parle alors de structure de résonnance. • Exemples: O 3. 12/2/2020 66

Structure de Lewis des molécules – Autres exemples de structure de résonnance. • Exemples: CO 32 - • Benzène 12/2/2020 67

Pratique-toi Lecture des pages 228 -231 Exercices 1, 2, 3, 5, 6, 7, 8 et 10, page 232

Liaisons chimiques Forme des molécules

Forme des molécules Les molécules ne sont pas planes. Leurs propriétés et chimiques sont influencées par leur forme. La prédiction de la forme 3 D d’une molécule est basée sur la théorie de la répulsion des paires d’électrons sur la couche de valence (RPEV). 12/2/2020 70

Forme des molécules Principe de la RPEV – Les doublets liants et non liants d’électrons de valence d’un atome s’éloignent le plus possible les uns des autres pour minimiser les forces de répulsion entre eux. Ce faisant, les molécules adoptent une géométrie spécifique correspond à un angle spécifique entre les liaisons. 12/2/2020 71

Formes des molécules Principe de la théorie RPEV Dans une molécule, l ’atome central est entouré par des doublets d ’électrons Doublets de liaisons : X A Doublets libres : E C B

Formes des molécules Principe de la théorie RPEV Ces doublets électriquement chargés se repoussent Ils vont se placer le plus loin possible les uns des autres sur une sphère centrée sur l ’atome central A E X A X X On obtient une figure de répulsion différente selon le nombre de doublets

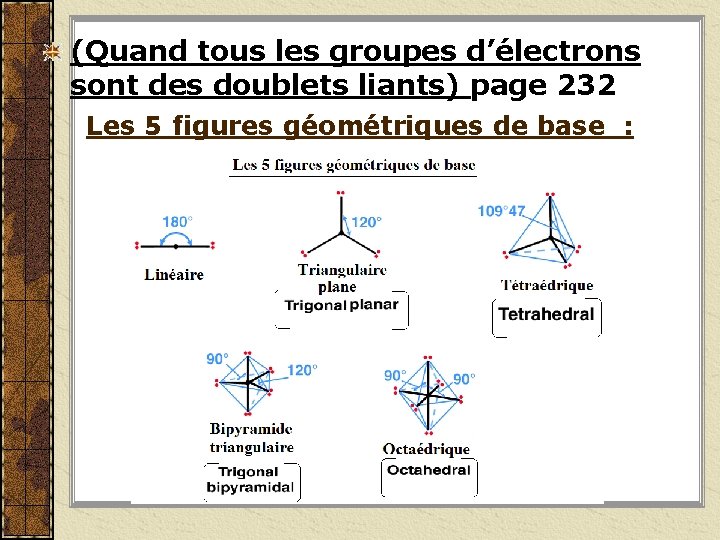
(Quand tous les groupes d’électrons sont des doublets liants) page 232 Les 5 figures géométriques de base :

Formes des molécules voir p. 233 Si atome central de la molécule a seulement des doublets liants. Nombres de groupes d’électrons liants 2 3 4 5 6 Agencement des groupes d’électrons Forme Linéaire Triangulaire plane Tétraédrique Bipyramide triangulaire Octaédrique

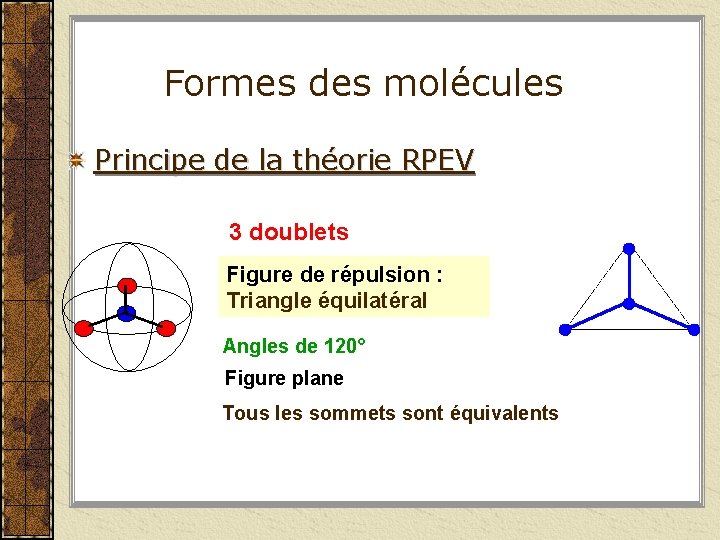
Formes des molécules Principe de la théorie RPEV 3 doublets Figure de répulsion : Triangle équilatéral Angles de 120° Figure plane Tous les sommets sont équivalents

Formes des molécules Principe de la théorie RPEV 4 doublets Figure de répulsion : Tétraèdre Angles de 109, 5° Figure inscrite dans un cube Tous les sommets sont équivalents

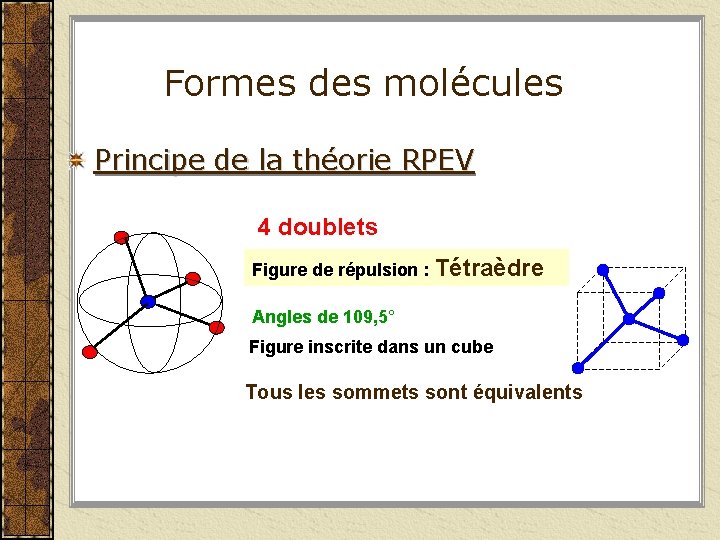
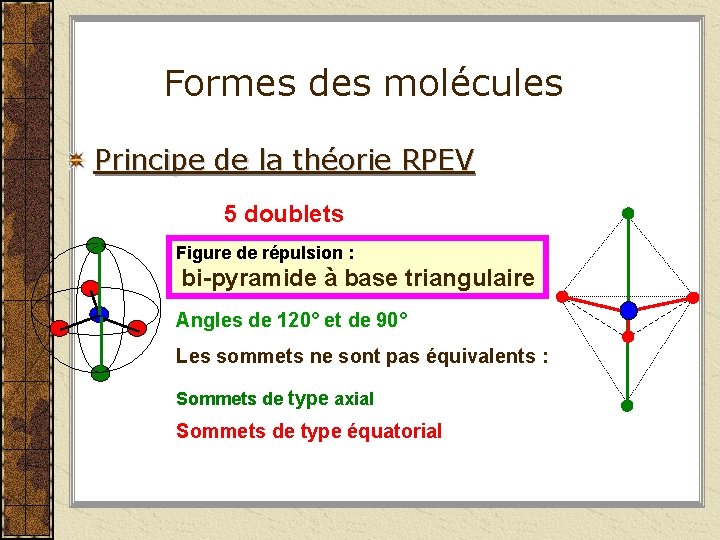
Formes des molécules Principe de la théorie RPEV 5 doublets Figure de répulsion : bi-pyramide à base triangulaire Angles de 120° et de 90° Les sommets ne sont pas équivalents : Sommets de type axial Sommets de type équatorial

Formes des molécules Principe de la théorie RPEV 6 doublets Figure de répulsion : Octaèdre Angles de 90° Tous les sommets sont équivalents

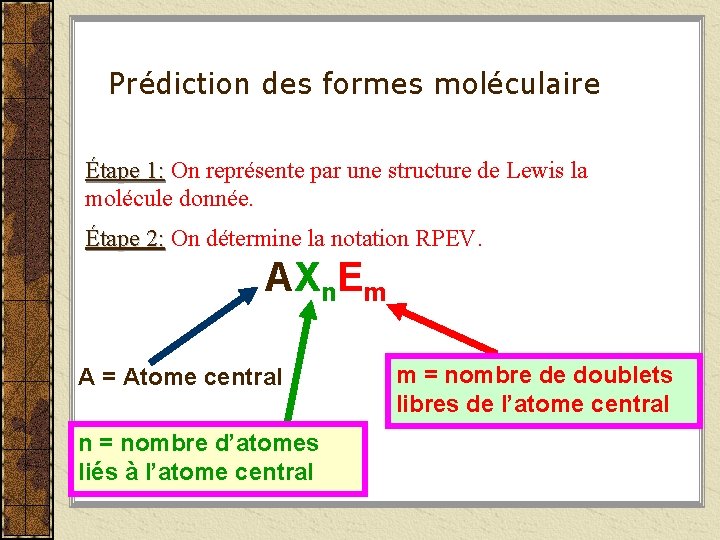
Prédiction des formes moléculaire Étape 1: On représente par une structure de Lewis la molécule donnée. Étape 2: On détermine la notation RPEV. AXn. Em A = Atome central n = nombre d’atomes liés à l’atome central m = nombre de doublets libres de l’atome central

Prédiction des formes moléculaire (page 233) Étape 3: On détermine le nombre de doublet électronique et on prédit la figure géométrique. p = n + m p = 2 Droite p = 3 Triangle équilatéral p = 4 Tétraèdre p = 5 Bi-pyramide à base triangulaire p = 6 Octaèdre où n = nombre d’atomes liés à l’atome central m = nombre de doublets libres de l’atome central p= domaine électronique

Forme des molécules page 233 Si un ou plusieurs groupes d’électrons qui entourent l’atome central sont des doublets libres, la forme de la molécule va changer. Ils existent 3 types de forces de répulsion: entre les paires liantes (PLPL), entre les doublets libres (DL-DL) et entre un doublet libre et une paire liante (DL-PL) Ordre dans lequel les forces de répulsion décroissent: DL-DL> DL-PL > PL-PL 12/2/2020 82

Forme des molécules page 234 Exemples de forme moléculaire – Linéaire: O C O AX 2 12/2/2020 83

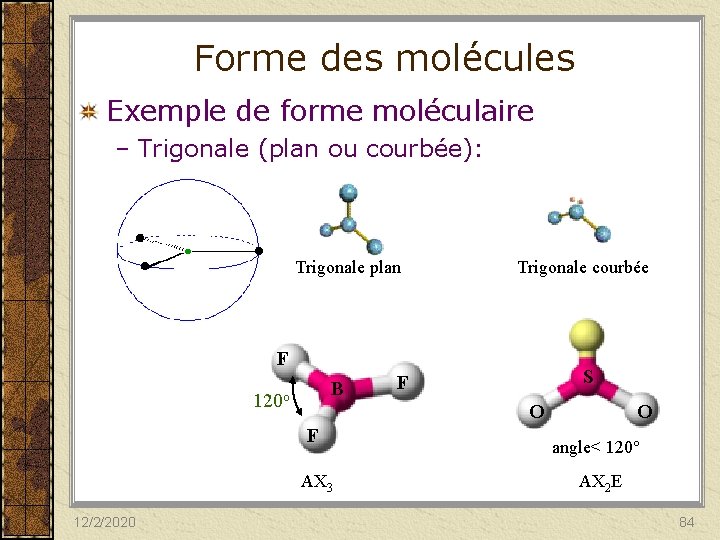
Forme des molécules Exemple de forme moléculaire – Trigonale (plan ou courbée): Trigonale plan Trigonale courbée F B 120 o O F AX 3 12/2/2020 S F O angle< 120° AX 2 E 84

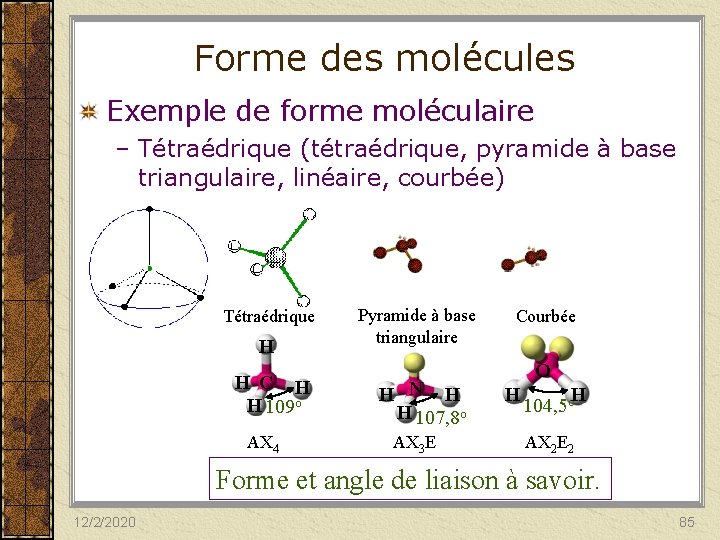
Forme des molécules Exemple de forme moléculaire – Tétraédrique (tétraédrique, pyramide à base triangulaire, linéaire, courbée) Tétraédrique H H C H H 109 o AX 4 Pyramide à base triangulaire H N H H 107, 8 o AX 3 E Courbée O H H 104, 5 o AX 2 E 2 Forme et angle de liaison à savoir. 12/2/2020 85

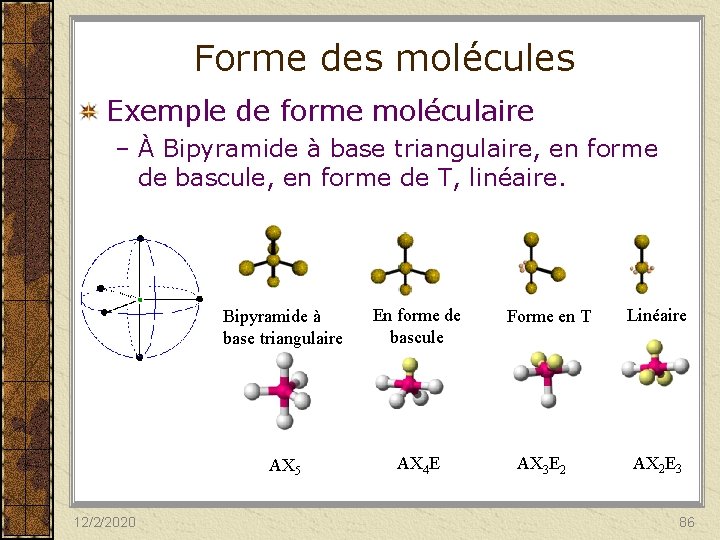
Forme des molécules Exemple de forme moléculaire – À Bipyramide à base triangulaire, en forme de bascule, en forme de T, linéaire. 12/2/2020 Bipyramide à base triangulaire En forme de bascule AX 5 AX 4 E Forme en T AX 3 E 2 Linéaire AX 2 E 3 86

Forme des molécules Pour déterminer la forme d’une molécule, il faut: – Déterminer sa structure de Lewis, – Écrire la molécule sous la forme Atome lié à l’atome Électron non liant central sur l’atome central AXm. En Atome central Nombre d’atome lié à l’atome central 12/2/2020 Nombre de doublet non liant lié à l’atome central 87

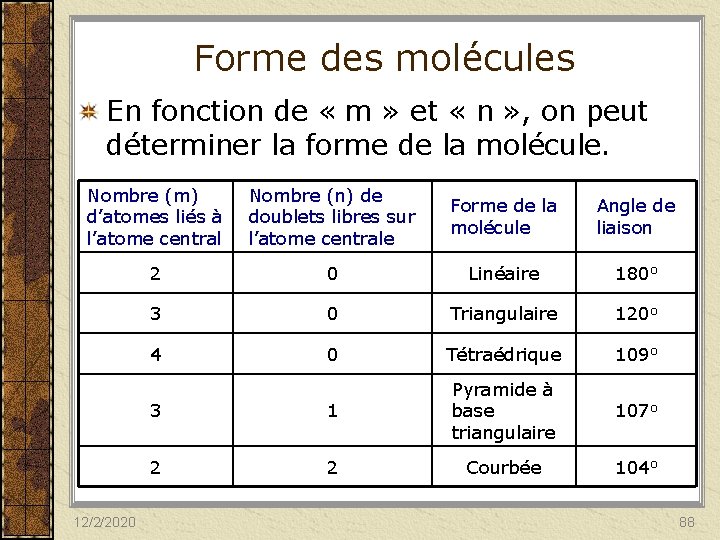
Forme des molécules En fonction de « m » et « n » , on peut déterminer la forme de la molécule. Nombre (m) d’atomes liés à l’atome central Nombre (n) de doublets libres sur l’atome centrale Forme de la molécule Angle de liaison 2 0 Linéaire 180 o 3 0 Triangulaire 120 o 4 0 Tétraédrique 109 o 3 1 Pyramide à base triangulaire 107 o 2 2 Courbée 104 o 12/2/2020 88

Pratique-toi Complète les exercices p. 236 #11 -15 12/2/2020 École catholique Ste-Famille/E. Ganpo 89

Liaisons chimiques Polarité des molécules

Relation entre forme moléculaire et polarité moléculaire. La forme et la polarité d’une molécule sont directement liées. Quel est le facteur qui détermine le type de liaison entre deux atomes ? _____________ Quand dit-on qu’une liaison est covalente polaire ? ___________________ Dans une liaison polaire, le partage des é est inégale entre les deux atomes.

Dipôle de liaison

Relation entre forme moléculaire et polarité moléculaire. Le partage inégale des électrons résulte en l’accumulation d’une charge partielle négative au niveau de l’atome le plus électronégatif et d’une charge partielle positive au niveau de l’atome le moins électronégatif. + H Cl -

Relation entre forme moléculaire et polarité moléculaire. La polarité créée par le partage inégale d’électron dans une liaison s’appelle un dipôle de liaison. Il est représenté par un vecteur qui pointe vers l’élément le plus électronégatif. + H Cl -

Dipôle moléculaire

Une molécule polaire On peut prédire la polarité d’une molécule s’il y a un déséquilibre dans la charge totale de la molécule; (partie charge partielle + et autre -. ) Les molécules ayant des liaisons polaires ne sont pas toutes des molécules polaires Comment le savoir ? il faut connaître 2 choses : – La forme de la molécule – Les dipôles électriques qui la forment.

Polarité des molécules Pour être polaire, une molécule doit: – Avoir des liaisons polaires, – Avoir une forme spatiale tel que la résultante des dipôles de liaison ne s’annule pas (les centres d’action des charges positives et négatives ne sont pas confondus). δO 2δ+ C δO δ+ H En dépit de la présence des liaisons polaires, la molécule est globalement non polaire. 12/2/2020 O 2δ - H Dipôle δ+ moléculaire Les deux dipôles de liaisons ne s’annulent pas et la molécule est polaire. 97

Polarité des molécules Lorsqu’une molécule est polaire, on dit qu’elle possède un dipôle moléculaire. Les molécules qui ne possèdent pas de moment dipolaire nette sont dites nonpolaires. De manière générale, une molécule polaire ne possède pas un centre de symétrie. 12/2/2020 98

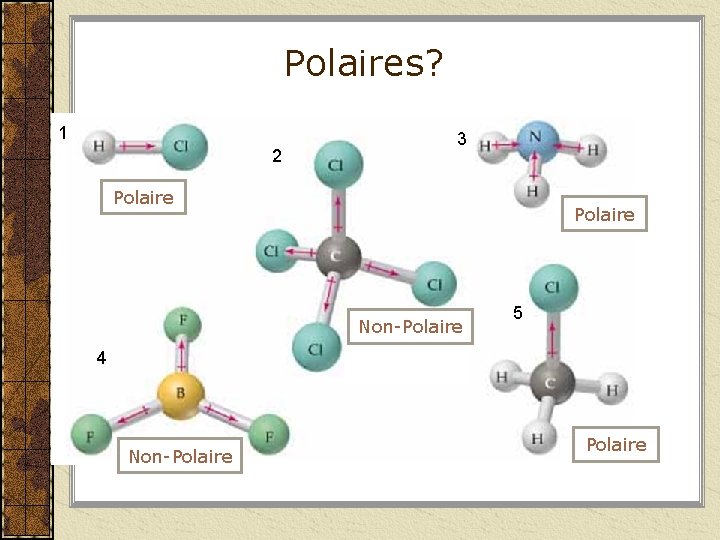
Polaires? 1 2 3 Polaire Non-Polaire 5 4 Non-Polaire

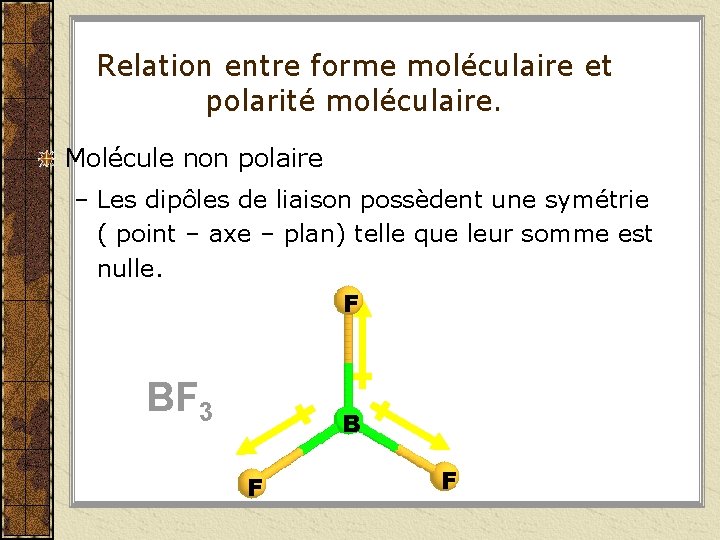
Relation entre forme moléculaire et polarité moléculaire. Molécule non polaire – Les dipôles de liaison possèdent une symétrie ( point – axe – plan) telle que leur somme est nulle. F BF 3 B F F

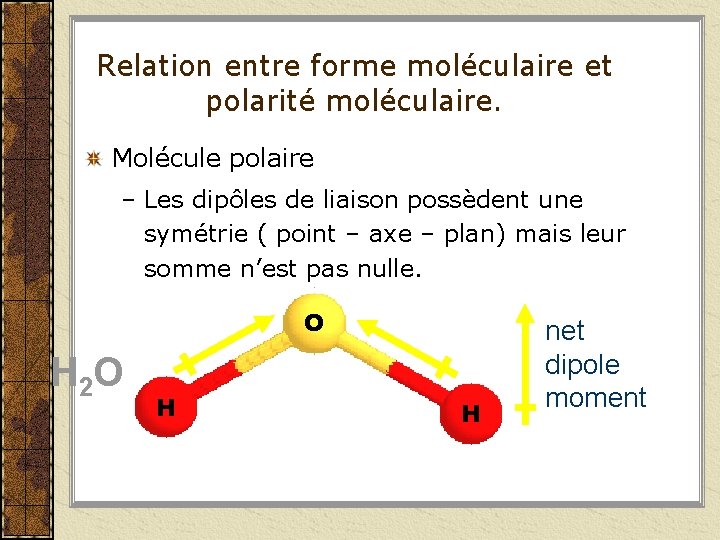
Relation entre forme moléculaire et polarité moléculaire. Molécule polaire – Les dipôles de liaison possèdent une symétrie ( point – axe – plan) mais leur somme n’est pas nulle. O H 2 O H H net dipole moment

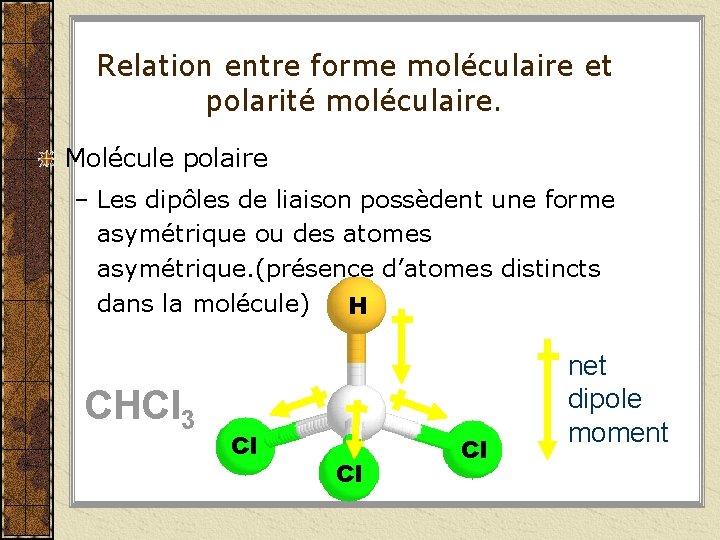
Relation entre forme moléculaire et polarité moléculaire. Molécule polaire – Les dipôles de liaison possèdent une forme asymétrique ou des atomes asymétrique. (présence d’atomes distincts dans la molécule) H CHCl 3 Cl Cl Cl net dipole moment

Polarité des molécules La polarité ou la non polarité d’une molécule explique certaines de ses propriétés physiques (solubilité dans un solvant donné, température d’ébullition, température de fusion, …) 12/2/2020 103

Pratique-toi http: //phet. colorado. edu/sims/html/molec ule-shapes/latest/moleculeshapes_en. html À l’aide de la simulation (voir lien cidessus), complète l’activité 4. 2 de ton manuel aux pages 240 et 241. Attention, les angles de liaison des molécules contenant des doubles d'électrons ne sont pas précis. Tu devras préciser si l’angle sera plus grand ou plus petit. Assure-toi de répondre à toutes les questions. 12/2/2020 104

Liaisons chimiques Forces intermoléculaires

Résultats d’apprentissage Je peux déduire les types de force intermoléculaire présents dans les substances, d’après leur structure et leur formule chimique. Je peux expliquer des propriétés physiques des composés covalents (volatilité, conductivité électrique et solubilité) sur base de leur structure et des forces intermoléculaires. 12/2/2020 École catholique Ste-Famille/E. Ganpo 106

Forces intermoléculaires pages 241 -245 de Chimie 12 Forces intramoléculaires: lient les atomes d’une molécule ensemble. Elles sont présentes à l’intérieur de la molécule. Forces intermoléculaires: elles lient les molécules d’une substance ensemble. Forces intramoléculaires Forces Intermoléculaires 12/2/2020 107

Forces intermoléculaires Forces intramoléculaires sont rompues lors des réactions chimiques. Forces intermoléculaires: responsables des changements physiques (température de fusion, d’ébullition, solubilité, volatilité, densité, …). Sans les forces intermoléculaires, toutes les substances seraient des gaz. Les forces intermoléculaires sont moins fortes que les forces intramoléculaires. 12/2/2020 108

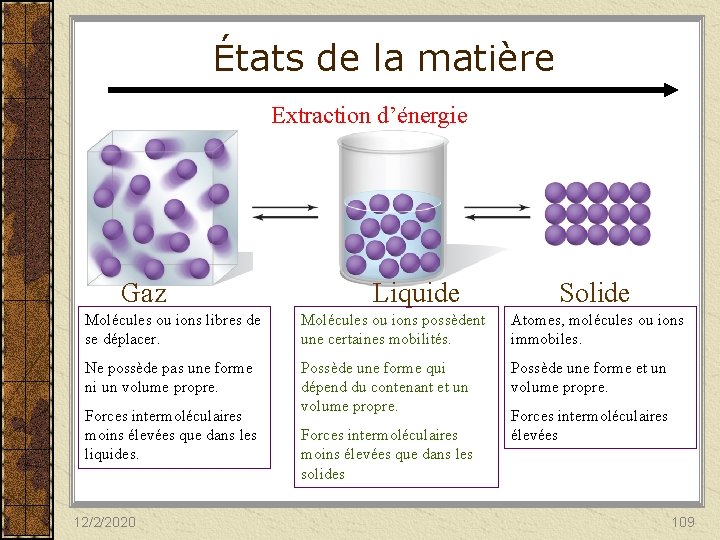
États de la matière Extraction d’énergie Gaz Liquide Solide Molécules ou ions libres de se déplacer. Molécules ou ions possèdent une certaines mobilités. Atomes, molécules ou ions immobiles. Ne possède pas une forme ni un volume propre. Possède une forme qui dépend du contenant et un volume propre. Possède une forme et un volume propre. Forces intermoléculaires moins élevées que dans les liquides. 12/2/2020 Forces intermoléculaires moins élevées que dans les solides Forces intermoléculaires élevées 109

Types de forces intermoléculaires Les forces intermoléculaires sont responsables des changements de phase. Types de forces intermoléculaires ( ou Forces de van der Waals): – Forces de dispersion (forces de London) – Forces dipôles-dipôles – Forces hydrogène – Forces ion-dipôle 12/2/2020 110

Forces de dispersion (Forces de London) Elles sont présentent dans toutes les molécules (polaires et non polaires). Ce sont les seuls forces intermoléculaires qui existent dans les molécules nonpolaires. Les paires des électrons partagés sont toujours en mouvement. Apparition momentanée d’un dipôle qui se propage dans toute la molécule. 12/2/2020 111

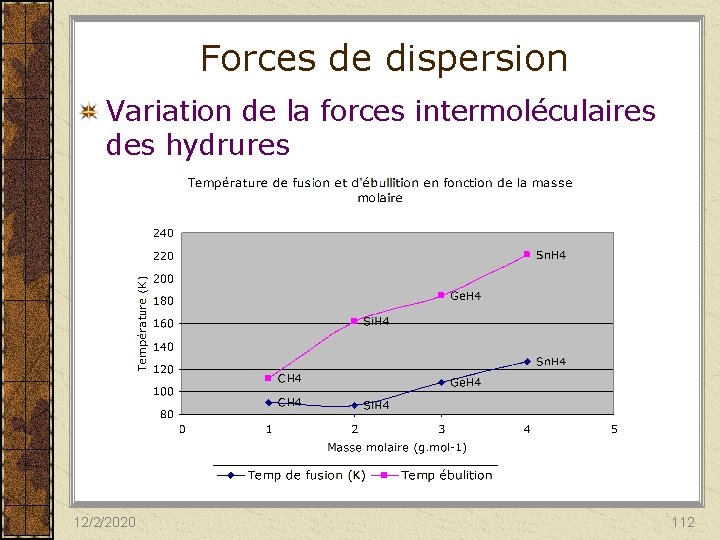
Forces de dispersion Variation de la forces intermoléculaires des hydrures 12/2/2020 112

Forces de dispersion (page 245) Forces de dispersion et forme des molécules. –Forme linéaire; plus grande surface de contact; forces de dispersion plus élevée. –Une forme sphérique réduit la surface de contact entre les molécules; réduisant ainsi les forces de dispersion 12/2/2020 113

Forces de dispersion Elle varient en fonction: – Taille (masse moléculaire) des molécules (l’attraction augmente avec l’augmentation de la masse des molécules car il y a un plus grand nombre d’électrons), – Forme (plus grande surface de contact, forces de dispersion plus élevée) des molécules. Lorsque 2 molécules ont environ le même nombre d’électrons, les forces de London sont plus fortes dans la molécule linéaire) 12/2/2020 114

Forces dipôle-dipôle (ou forces dipolaire) Elles sont plus fortes que les forces de dispersion et résulte de l’attraction entre les charges opposées dans une molécule polaire. – Sa présence augmente l’énergie nécessaire pour séparer les molécules. Attraction entre pôles de charge opposée. Répulsion entre pôles de même charge. 12/2/2020 115

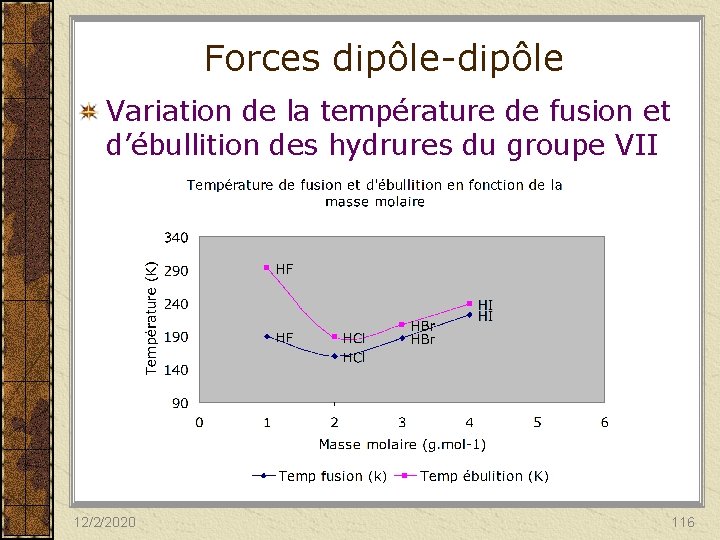
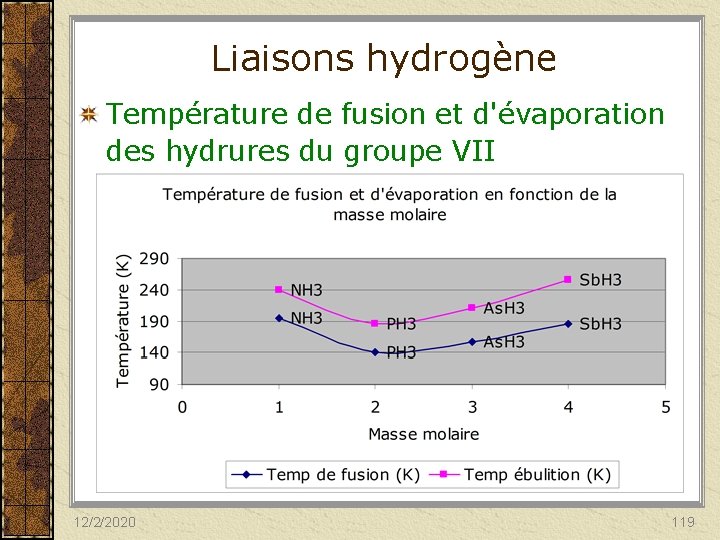
Forces dipôle-dipôle Variation de la température de fusion et d’ébullition des hydrures du groupe VII 12/2/2020 116

Liaisons hydrogène Ce sont les forces intermoléculaires les plus fortes. Elle relie des molécules en impliquant un atome d'hydrogène relié à un élément très électronégatif tel l'azote (N), l'oxygène (O) ou le fluor (F) qui possède au moins une paire d’électrons libres. 12/2/2020 117

Liaisons hydrogène C’est une force de type dipôle-dipôle qui se produit entre l'hydrogène relié à l'élément électronégatif, et les éléments électronégatifs des molécules environnantes. Solubilité des composés covalents polaires dans l’eau (ils forment des liaisons hydrogène avec les molécules d’eau. 12/2/2020 118

Liaisons hydrogène Température de fusion et d'évaporation des hydrures du groupe VII 12/2/2020 119

Forces ion-dipôle C’est une force d’attraction entre un ion et une molécule polaire. – Attraction électrostatique entre l’extrémité négative du dipôle et le cation, l’extrémité positive du dipôle entoure et stabilise l’anion. NB: Les interactions iondipôle avec une cation sont plus importantes à cause du petit rayon du cation. Car les charges du cations sont généralement plus concentrées.

Forces ion-dipôle Elle joue un rôle très important dans la solubilisation des composés ioniques. Exemple: Hydratation de Na. Cl. Animation: http: //www. ostralo. net/3_animations/s wf/dissolution. swf 12/2/2020 121

Forces Intermoléculaires induites L’induction de charges électriques se produit lorsqu’une charge sur un objet cause un changement dans la distribution de charge d’un objet voisin. L’induction implique une absence de contact entre les deux objets. On distingue: – Les forces dipolaires induites par un ion, – Les forces dipolaires induite par un dipôle.

Forces Intermoléculaires induites Les forces dipolaires induites par un ion: – Elle se produit quand un ion, très près d’une molécule non polaire déforme sa densité électronique. La molécule non polaire dévient alors polarisée pendant un moment et les deux espèces s’attirent.

Forces Intermoléculaires induites Les forces dipolaires induites par un dipôle. – Elle se produit lorsque la charge sur une molécule polaire, très près d’une molécule non polaire déforme sa densité électronique. La molécule non polaire dévient alors polarisée pendant un moment et les deux espèces s’attirent.

Conclusion Les composés polaires se dissolvent dans les solvants polaires Les composés non-polaires ne se dissolvent pas dans les solvants non -polaires. « Likes dissolves likes » (Les semblables dissolvent les semblables. )

Prédiction de la solubilité dans l’eau : L’eau est polaire : Les composés polaires et ioniques solubles • À cause des liaisons dipôle-dipôle et ion-dipôle respectivement. https: //nouvelon. apprentissageelectroniqueontario. ca/d 2 l/lor/viewer/view. d 2 l? ou=8201&lo. Ident. Id= 176438 Les composés non-polaires insolubles Les composés non polaires (huiles) ne sont pas solubles dans l'eau. L'attraction entre leurs molécules et les molécules d'eau est bien trop faible pour rompre les liaisons d'hydrogène entre les molécules d'eau.

Les composés covalents solubles : -Certains alcools (hydrocarbures avec OH) sont solubles car ils ont des liaisons polaires (leurs O peuvent former des liaisons H avec l’eau): • Le méthanol et L’éthanol – Certains sucres (ex : sucrose) sont aussi solubles. – Ces composés sont quant même des non-électrolytes (car ils demeurent neutres).

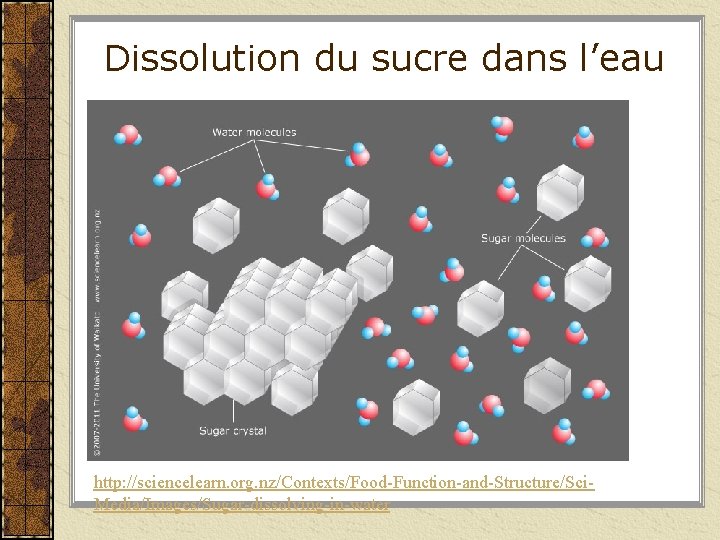
Dissolution du sucre dans l’eau http: //sciencelearn. org. nz/Contexts/Food-Function-and-Structure/Sci. Media/Images/Sugar-dissolving-in-water

Les solides ioniques les solides ioniques sont constitués d’ions maintenus ensemble par des liaisons ioniques (attractions électrostatiques) La structure spécifique d’un cristal dépend des charges et rayons des cations et des anions Exemple: Na. Cl, Ca. CO 3 , K 2 O En général, un solide ionique est dur et cassant, possède un point de fusion élevé et est un mauvais conducteur de chaleur et d’électricité

Les solides moléculaires sont constitués d’atomes ou de molécules maintenus ensemble par des forces de van der Waals (et des liaisons hydrogène, si possible) – Exemple – La glace (où les liaisons hydrogène dominent), – Le SO 2 solide (où les forces dipôle-dipôle dominent), – Le I 2 solide (où les forces de dispersion dominent)

Les solides moléculaires Parce que les forces de van der Waal et les liaisons hydrogènes sont beaucoup plus faibles que les forces ion-ion, en général, les solides moléculaires sont mous et possèdent des points de fusion bas. En général, des solides moléculaires sont des mauvais conducteurs de chaleur et d’électricité.

Les solides covalents Dans un solide covalent, les atomes sont maintenus ensemble seulement par des liaisons covalents dans un réseau tridimensionnel illimité (il n’y a pas de molécules distinctes) Exemple: le diamant, le graphite, le quartz (Si. O 2 ) Diamant Graphite

Les solides covalents En général, un solide covalent est dur et a un point de fusion élevé car chaque atome est fixé dans sa position par des fortes liaisons covalentes. En général, un solide covalent est un mauvais conducteur de chaleur et d’électricité (cependant, le graphite est un bon conducteur d’électricité et le diamant est un bon conducteur de chaleur)

Conclusion En générale, les petites molécules non polaires sont souvent des gaz (ex: CO 2 et CH 4), alors que des molécules polaires, ou très grosses, prennent souvent l’aspect solide (les composés ioniques sont toujours solides. La solubilité d’une substance dans un solvant est aussi très influencée par l’affinité de l’un pour l’autre. Ainsi l’eau, solvant polaire, dissout facilement les produits ioniques ou polaires, alors qu’elle est non miscible avec les substances non polaires.

Vérifie tes connaissances: https: //csdccs. apprentissageelectroniqueontario. ca/content/enforced/7937586 I_sch 4 u_abergeron_1516/unite 1/media/oai/schu 08_oai_1_3_1/index. html? ou=7937586 Complète aussi les exercices de Révision de la section 4. 2 page 247 de ton manuel de Chimie 12.

Résultats d’apprentissage Je peux analyser en laboratoire les propriétés physiques de diverses substances et déterminer la nature de leurs liaisons. Laboratoire 12/2/2020 École catholique Ste-Famille/E. Ganpo 136

Références http: //intro. chem. okstate. edu/1314 f 00/lecture/chapter 10 /vsepr. html http: //www. chemmybear. com/shapes. html http: //www. up. ac. za/academic/chem/mol_geom/mol_ge ometry. htm http: //www. tutorpages. com/Chemistry/Molecular_Geometry/Polar_Or_No npolar. html#problems QCM: http: //chimie. adssys. com/nya/tests_liaisons_chimiques/ geometrie_polarite. htm 12/2/2020 137
 Viewgrade 5 sch
Viewgrade 5 sch Produits chimiques
Produits chimiques Phet colorado equilibrer equations chimiques
Phet colorado equilibrer equations chimiques Valence des corps chimiques
Valence des corps chimiques Pollutions chimiques et gestion environnementale.
Pollutions chimiques et gestion environnementale. Tableau des formules chimiques
Tableau des formules chimiques Modelisation des liaison mecanique
Modelisation des liaison mecanique Liaison interdites
Liaison interdites Tp fiche de liaison
Tp fiche de liaison Liaison with external constituencies
Liaison with external constituencies Couche hybride dentaire definition
Couche hybride dentaire definition Care home liaison nurse
Care home liaison nurse Liaison
Liaison Liaison in phonetics
Liaison in phonetics Liaison appui plan
Liaison appui plan Symbole liaison pivot glissant
Symbole liaison pivot glissant Liaison pivot parfaite
Liaison pivot parfaite Liaison instrument
Liaison instrument énergie de liaison d'un noyau
énergie de liaison d'un noyau Liaison linéaire annulaire
Liaison linéaire annulaire Building liaison
Building liaison La liaison obligatoire
La liaison obligatoire Adverbes de relation logique
Adverbes de relation logique Pont hydrogene
Pont hydrogene Liaison pivot
Liaison pivot Organe de guidage exemple
Organe de guidage exemple Accreditation liaison officer
Accreditation liaison officer Schema it double defaut
Schema it double defaut Liaison phosphoanhydre
Liaison phosphoanhydre Schéma liaison froide
Schéma liaison froide Serp soudure
Serp soudure Fungsi liaison officer
Fungsi liaison officer Force intermoléculaire
Force intermoléculaire Précaution air
Précaution air Liaison encastrement exemple
Liaison encastrement exemple Sachet d'epices and bouquet garni are known as *
Sachet d'epices and bouquet garni are known as * Expert in consultant liaison psychiatrist
Expert in consultant liaison psychiatrist Dimensionnement palier lisse
Dimensionnement palier lisse Fiche de liaison ramed
Fiche de liaison ramed Betty botter
Betty botter Atom electronic pont de l'est
Atom electronic pont de l'est énergie de liaison d'un noyau
énergie de liaison d'un noyau Liaison micheville
Liaison micheville Schéma cinématique coupe tube liaison
Schéma cinématique coupe tube liaison Liaison interdites
Liaison interdites Liaison rotule à doigt
Liaison rotule à doigt Liaison permanente
Liaison permanente Fiche sanitaire de liaison
Fiche sanitaire de liaison Manager or supervisor higher
Manager or supervisor higher Dimensionnement coussinet
Dimensionnement coussinet Kyria liaison
Kyria liaison Appui plan centrage court
Appui plan centrage court Liaison ponctuelle de normale
Liaison ponctuelle de normale Lno liaison officer
Lno liaison officer Liaison démontable
Liaison démontable Medical liaison job description
Medical liaison job description Colle sans clou ni vis
Colle sans clou ni vis Couche liaison modèle osi
Couche liaison modèle osi Liaison and diversion interview questions
Liaison and diversion interview questions Diagramme le principe de la liaison froide réfrigérée
Diagramme le principe de la liaison froide réfrigérée