Hoofdstuk 9 Energieproductie Planning Vandaag Theorie hoofdstuk 9




















































































- Slides: 87

Hoofdstuk 9 Energieproductie

Planning • Vandaag: – Theorie hoofdstuk 9 – Huiswerk maken

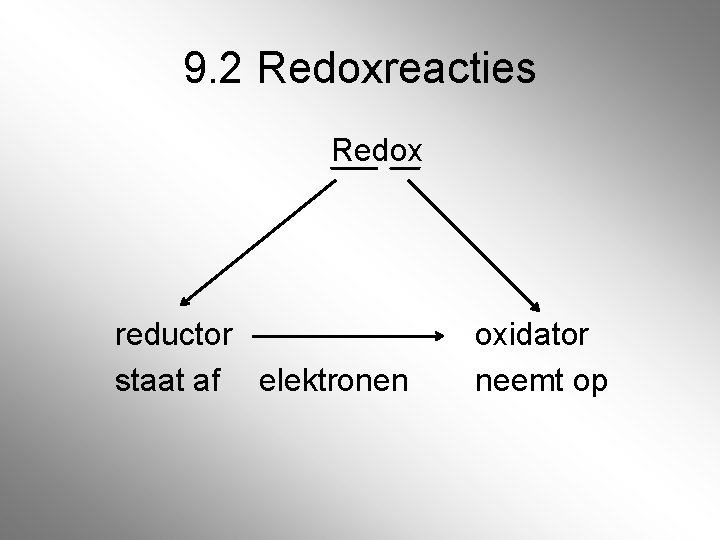
Hoofdstuk 9. 2 • Oxidatie wordt in het algemeen gebruikt als een deeltje met zuurstof reageert • Dit is erg beperkt • Koper blijkt aan de lucht te oxideren tot koper(II)oxide – Koper staat elektronen af en zuurstof neemt ze op • Bij koper en chloor is dat hetzelfde

De reductor • Atomen die elektronen afstaan zijn voornamelijk metalen • Een uitzondering is waterstof • Stoffen die elektronen afstaan noemen we reductoren

De reductor • Wanneer een reductor een elektron afstaat krijgt het een andere lading

voorbeelden • Na (s) Na+ + e • Zn (s) Zn 2+ + 2 e • Al (s) Al 3+ + 3 e-

De oxidator • Stoffen die bij reacties elektronen opnemen noemt men oxidatoren • Dit zijn de niet-metalen • De oxidator zal dan een andere lading krijgen

Voorbeeld oxidator • Chloor neemt 1 elektron op dus: • Chloor komt in de natuur alleen voor als Cl 2 • Dus: Cl 2 (s) + 2 e- 2 Cl-

Begrippen • Reductie is het opnemen van elektronen door een deeltje • Oxideren is het afstaan van elektronen door een deeltje • Een reductor is een stof die bij een reactie elektronen afstaat • Een oxidator is een stof die bij een reactie elektronen opneemt • Dus een oxidator reduceert • En een reductor oxideert

oxiden • Oxiden zijn verbindingen met zuurstof • Oxiden kun je in 2 groepen onderscheiden: – Oxiden van metalen – Oxiden van niet-metalen

oxiden van metalen • Het vormen van oxiden gaat niet altijd even makkelijk • Hiervoor kan het periodiek systeem gebruikt worden

• Groep 1 en 2 reageren het beste. – Bij verwarming heftige reactieverschijnselen • Bijv steekvlam, harde knal, fel licht – Onedele metalen • De overige metalen reageren minder fel • Sommige reageren niet of nauwelijks met zuurstof – Edele metalen – Au, Ag, Pt

Spontane reactie • De spontane reactie van metalen met zuurstof wordt oxidatie genoemd • Deze reacties gaan bij normale temperatuur gewoon door

Reactieschema • Metaal + zuurstof metaaloxide Bijv: • 2 Mg (s) + O 2 (g) 2 Mg. O (s) • 4 K (s) + O 2 (g) 2 K 2 O (s) Let op!!: • 2 Fe (s) + O 2 (g) 2 Fe. O (s) – Ijzer(II)oxide • 4 Fe (s) + 3 O 2 (g) 2 Fe 2 O 3 (s) – Ijzer(III)oxide

Huiswerk • Opdracht 1 t/m 6 van de open en meerkeuze vragen • Worden uitgedeeld!

Week 2 Scheikunde Redoxreacties

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk • Meerkeuze 1 t/m 6 1. C 2. A 3. A 4. D 5. A 6. A

Huiswerk 1. Na+, Ca 2+, Al 3+ 2. K (s) en Ba (s) 3. Opnemen: O 2 (g), S (s), Br 2 (l) Afstaan: Mg (s), Fe (s), Sn (s) 4. 5. Stikstof

6.

Corrosie • Wanneer oxidatie niet gewenst is • Metalen zijn aangetast • Metalen verliezen geheel of gedeeltelijk hun functie – Dof worden van aluminium – Zwart worden van zilveren sieraden – Groen uitslaan van koperen daken – Doorroesten van auto onderdelen

Roest Ijzer in water: • Fe (s) Fe 2+ (aq) + 2 e. Roestvorming: • Fe 2+ Fe 3+ + e • De elektronen die vrijkomen worden opgenomen door zuurstof uit water • Zink voorkomt roest bij ijzer

Roest • O 2 - en Fe 3+ ionen vormen de vaste stof Fe 2 O 3 (roest) • Bij roesten is altijd nodig: – Zuurstof – Water – metaal • Zout werkt als katalysator en zorgt voor sneller roesten

Corrosiebescherming • Om corrosie tegen te gaan worden verschillende manieren gebruikt: 1. Afsluitende deklaag aanbrengen • Op metaal van niet-metallische aard • Op metaal van metallische aard 2. Legeren 3. Kathodische bescherming

afsluitende deklaag op metalen van niet metallische aard • Vetten en oliën – Machine onderdelen en gereedschap • Bitumen – Aardolieproducten bij olietanks en leidingen • Kunststoffen – Beschermen van gereedschappen

• Email – Huishoudelijke voorwerpen • Fosfaten – Auto-industrie • Anodiseren – Oxide laagje bij aluminium en magnesium – huishoudelijke voorwerpen

afsluitende deklaag op metalen van metallische aard • Metallische aard: metalen die zelf een corrosiehuid aan kunnen maken • Thermische methode – Onderdompelen in vloeibaar zink, tin of lood • Galvaniseren – Verzinken van metalen – Bij metalen die niet zo warm mogen worden

Legeren • 2 metalen mengen • Belangrijkste eigenschappen worden benadrukt • Bijvoorbeeld: • Staal in combinatie met chroom of nikkel (of combinatie hiervan) – Roestvrij staal

Kathodische bescherming • Polijsten – Slijpen met bijv diamantpoeder of glaspoeder • Ontvetten • Beitsen – Voorwerpen onderdompelen in een zuur – Metaaloxiden worden verwijderd • Stralen – Krachtige straal zand op voorwerp – Oneffenheden en verontreinigingen weg

Oxiden van niet-metalen • Niet-metalen reageren ook met zuurstof maar niet spontaan • Verbranding • Groep 18 reageert niet met zuurstof • Niet-metaal + zuurstof niet-metaaloxide • Oxiden van niet-metalen zijn slecht voor het milieu

• • • Mono Di Tri Tetra Penta Hexa Hepta Octa Nona Deca telwoorden één twee drie vier vijf zes zeven acht negen tien

Herhaling: Begrippen • Reductie is het opnemen van elektronen door een deeltje • Oxideren is het afstaan van elektronen door een deeltje • Een reductor is een stof die bij een reactie elektronen afstaat • Een oxidator is een stof die bij een reactie elektronen opneemt • Dus een oxidator reduceert • En een reductor oxideert

9. 2 Redoxreacties Redox reductor staat af elektronen oxidator neemt op

Hoe herken je een redoxreactie • Ladingen veranderen – Pb 2+ + 2 e • reductor – Cl 2 + 2 e- 2 Cl- • Oxidator • Dit noemt men halfreacties! • Elementen ontstaan of verdwijnen

voorbeelden 2+ 1 - • Pb (s) + Cl 2 (g) Pb. Cl 2 (s) ladingsverschil 2+ 2 - • Ca 2+ (aq) + CO 32 - (aq) Ca. CO 3 (s) Geen ladingsverschil en geen elementen verandering • 2 H 2 (g) + O 2 (g) 2 H 2 O (l) Geen ladingsverschil maar elementen verdwijnen 1+ 2 - • 2 Ag 2 O (s) 4 Ag (s) + O 2 (g) Ladingsverschil en elementen ontstaan

Halfreacties Al (s) H+ (aq) + Cl- (aq) Al (s) Al 3+ (aq) + 3 e. Reductor (staat 3 e af) 2 H+ (aq) + 2 e- H 2 (g) oxidator

Halfreacties Al (s) Al 3+ (aq) + 3 e 2 H+ (aq) + 2 e- H 2 (g) x 2 x 3 Elektronen moeten gelijk worden!!! 2 Al (s) 2 Al 3+ (aq) + 6 e 6 H+ (aq) + 6 e- 3 H 2 (g) + 2 Al (s) + 6 H+ (aq) 2 Al 3+ (aq) + 3 H 2 (g)

Voorbeeld Cu 2+ (aq) + 2 NO 32 - (kopernitraat) Pb (s) Cu 2+ (aq) +2 e- Cu (s) Pb (s) Pb 2+ (aq) +2 e- + Cu 2+ (aq) + Pb (s) Cu (s) + Pb 2+ (aq) Elektronen zijn al gelijk!

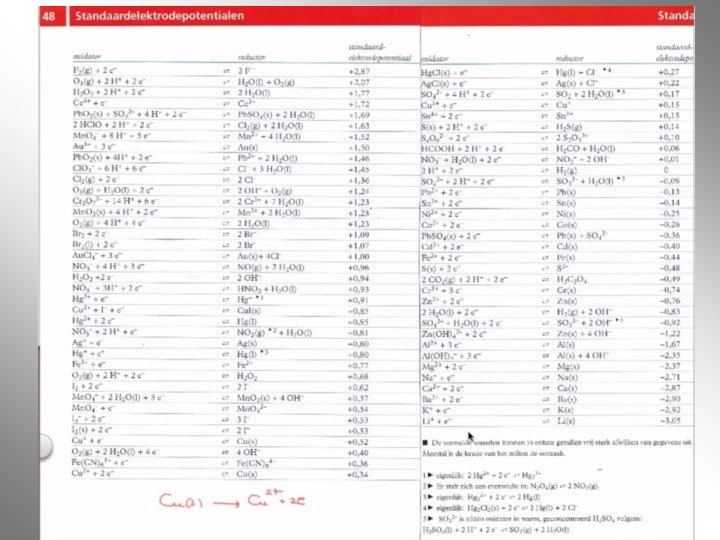
Tabel 48

Tabel 48 • • Oxidatoren Reductors Sterkte van oxidatoren en reductors Wanneer reageren de stoffen met elkaar – De oxidator moet boven de reductor staan


Huiswerk • Opdracht 2 t/m 7 blz 84 • Maak opdracht 8, 10 t/m 13, 15 a t/m d, 16 en 17

Hoofdstuk 9

Planning • • Huiswerk nakijken Herhaling Nieuwe theorie Huiswerk maken

Huiswerk nakijken 2. a. Een halfreactie is een verandering van 1 van de beginstoffen. Hierin staan altijd elektronen b. een totaalreactie is de optelsom van 2 halfreacties. Hierin staan geen elektronen 3. De elektronen verhuizen alleen maar er komen geen elektronen bij of weg.

4. a. 1. neemt op, 2 staat af, 3 staat af, 4 neemt op b. 1. Cu 2+ + 2 e- Cu 2. 2 Cl- Cl 2 + 2 e 3. Pb 2+ Pb 4+ + 2 e 4. S + 2 e- S 25. a. reductor is een deeltje dat elektronen afstaat b. Oxidator is een deeltje dat elektronen opneemt c. elke reactie waarbij ladingen veranderen en/of elementen betrokken zijn

6. Er is sprake van een redox reactie wanneer er ladingen veranderen en/of elementen verdwijnen of ontstaan. 7. 1, 2, 4 en 5 zijn redoxreacties. Dat zie je aan de elementen die erin staan. Bij 4 en 5 is ook een ladingsverschil 3 is geen redoxreactie. 8. a. de sterkste oxidator staat boven aan b. de sterkste reductor staat onderaan c. een oxidator en bijbehorende reductor is een redoxkoppel d. De Ox moet hoger staan de Red.

10. a. Reductor b. Oxidator c. Oxidator d. Reductor e. Oxidator f. Reductor g. kan Reductor of oxidator zijn 11. a. 2 Fe 2+ + Cl 2 2 Cl- + 2 Fe 3+ b. 2 Cr + 6 H+ 3 H 2 + 2 Cr 3+ c. Co + 2 Ag+ 2 Ag + Co 2+

12. a. b. 13. a. b en c. Ox Red Kan verlopen? 1 Co 2+ Pb Nee 2 Ag+ Co Ja 3 Pb 2+ Ag nee OX RED 1 Cl 2 Pb 2 I 2 K 3 Br 2 Ni 4 S Ag Pb 2+ + 2 e- Ni 2+ + 2 e- Cl 2 + 2 e- 2 Cl- Br 2 + 2 e- 2 Br- Pb + Cl 2 Pb. Cl 2 Ni + Br 2 Ni. Br 2 K K+ + e- Ag Ag+ + e- I 2 + 2 e- 2 I- S + 2 e- S 2 - 2 K + I 2 2 KI 2 Ag + S Ag 2 S

15. a. Cu 2+ = OX Zn = RED b. Cu 2+ staat boven Zn dus verloopt. c. Cu 2+ (aq)+ 2 e- Cu (s) Zn (s) Zn 2+ (aq) + 2 ed. Cu 2+ (aq)+ Zn Cu (s) + Zn 2+ (aq) 16. Inventariseer alle deeltjes in het reactievat Zoek voor elk deeltje of combinatie van deeltjes uit of het een oxidator of reductor is Tel de half vergelijkingen op van de sterkste oxidator en reductor.
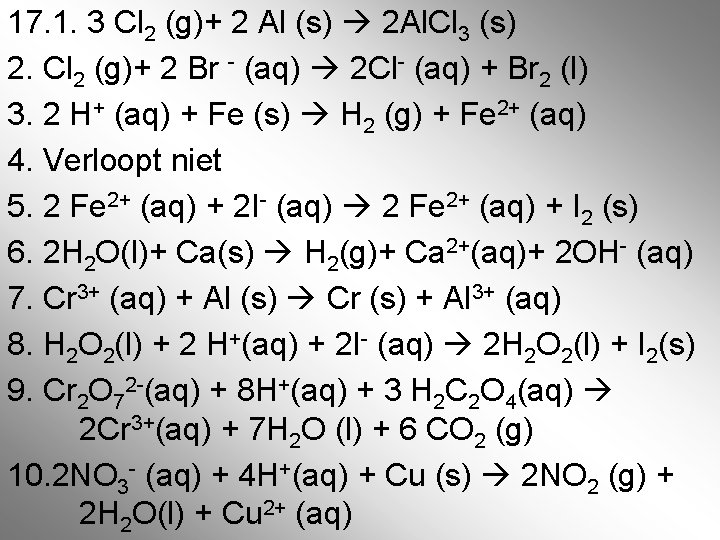
17. 1. 3 Cl 2 (g)+ 2 Al (s) 2 Al. Cl 3 (s) 2. Cl 2 (g)+ 2 Br - (aq) 2 Cl- (aq) + Br 2 (l) 3. 2 H+ (aq) + Fe (s) H 2 (g) + Fe 2+ (aq) 4. Verloopt niet 5. 2 Fe 2+ (aq) + 2 I- (aq) 2 Fe 2+ (aq) + I 2 (s) 6. 2 H 2 O(l)+ Ca(s) H 2(g)+ Ca 2+(aq)+ 2 OH- (aq) 7. Cr 3+ (aq) + Al (s) Cr (s) + Al 3+ (aq) 8. H 2 O 2(l) + 2 H+(aq) + 2 I- (aq) 2 H 2 O 2(l) + I 2(s) 9. Cr 2 O 72 -(aq) + 8 H+(aq) + 3 H 2 C 2 O 4(aq) 2 Cr 3+(aq) + 7 H 2 O (l) + 6 CO 2 (g) 10. 2 NO 3 - (aq) + 4 H+(aq) + Cu (s) 2 NO 2 (g) + 2 H 2 O(l) + Cu 2+ (aq)

Elektrische cellen • Bij de reactie van zink met een oplossing van koper(II)chloride wordt zink bedekt met een laagje koper • Cu 2+ (aq) + 2 e- Cu (s) • Zn (s) Zn 2+ (aq) + 2 e. Totaal: Cu 2+(aq) + Zn(s) Cu(s) + Zn 2+(aq) Hierbij wordt stroom opgewekt wanneer er een geleidende stof aanwezig is

Cu 2+(aq) + Zn(s) Cu(s) + Zn 2+(aq) Hierbij wordt stroom opgewekt wanneer er een geleidende stof aanwezig is • Dit noemt men een cel

• Een cel heeft een plus en min pool Cu 2+(aq) + Zn(s) Cu(s) + Zn 2+(aq) • Zink staat elektronen af dus is de – pool • Koper neemt elektronen op dus is de + pool

Batterijen • Wanneer een cel in een vast voorwerp zit noemen we dat een batterij • Een batterij bestaat uit: – Oxidator – Reductor – Stroomgeleidende tussenstof (elektrolyt)

Batterij • Er zijn verschillende soorten zoals: – Loodaccu • Accu van auto’s – Zinkbatterij • De batterij die we standaard kennen – Kwikcel • Kleine batterijen voor bijv. pacemakers en hoorapparaten • Heel slecht voor het milieu!!

3. 8 Elektrolyse • Reactie onder stroom • https: //www. youtube. com/watch? v=Vj 1 rkla _i. U 8 • https: //www. youtube. com/watch? v=1 e 8 K 6 oa. H-p 8

9. 3 energie uit batterijen • Energiebronnen: – Zon, aarde, water en wind • Energievormen: – Zonne-energie, wind-energie, licht enz • Energiedragers: – brandstoffen, biomassa en andere stoffen die met elkaar reageren waarbij energie vrijkomt

Rendement • Zo hoog mogelijk rendement • Veel energie gaat verloren in de vorm van warmte

Oplaadbare batterijen of niet? • De redoxreactie moet omkeerbaar zijn • Ligt aan de stoffen in de batterij • Niet oplaadbare batterijen: – Alkaline-mangaanoxide (digitale camera’s) • Oplaadbare batterijen: – Lithium-mangaanoxide (computers) – Nikkel-cadmium – Lithium-ion (mobiele telefoon)

Huiswerk • 20 t/m 22 a, 23, 25, 26, 29, 30, 32 a t/m d

Energie

Huiswerk nakijken 20 a. zon, aarde, water en wind b. brandstoffen, biomassa, chemische reactie c. zonne-energie, windenergie, licht 21. a. chemische energie in benzine kan omgezet worden in bewegingsenergie en of warmte b. Dat niet alle energie wordt omgezet in bewegingsenergie maar ook andere vormen van energie

21. c. warmte 22. a. 2 C 8 H 18 + 25 O 2 16 CO 2 + 18 H 2 O 23. a. elektrische stroom bestaat uit bewegende elektronen b. tijdens een redoxreactie worden elektronen overgedragen van de RED naar de OX. Als je deze elektronenstroom opvangt heb je beschikking tot elektrische stroom 25. oxidator, reductor, stroom geleidende tussen stof (elektrolyt)

26. a. ze stromen van de sterkste RED naar de sterkste OX b. in de halfcel met de sterkste red zit de negatieve elektrode 29. a. Een batterij is oplaadbaar wanneer de chemische reactie omkeerbaar is. b. De verhouding geleverde energie: massa batterij 30. a. Alkaline-mangaanoxide batterij en lithium-mangaanoxide batterij (niet) b. nikkel-cadmium, lithium-ion, loodaccu’s

30. c. grondstoffen sparen, onkosten sparen, milieu wordt ontzien 32. a. Zn is Red, Mn. O 2 is OX b. elektronen gaan van – naar + dus zink is de negatieve elektrode. c. In Mn. O 2 is de lading: +4 In Mn. O(OH) is de lading: +3 d. Zn (s) + 2 Mn. O 2 (s) + H 2 O(l) Zn. O(s) + 2 Mn. O(OH) (s) e. nee is een niet oplaadbare batterij. De oxidator en reductor zijn niet sterk genoeg

9. 4 Energie uit brandstoffen • Fossiele brandstoffen: – Steenkool – Aardolie • Moet eerst bewerkt worden voor het gebruik • Dmv destillatie – aardgas

Biobrandstoffen • Eerste generatie – Gemaakt uit plantaardig materiaal • Tweede generatie – Afgedankt frituurvet, plantenresten, houtsnippers • Derde generatie – Bacteriën, algen

processen • Vergisting – Zetmeel omzetten in glucose • Pyrolyse – Verhitten in afwezigheid van zuurstof – Hierdoor verdwijnt water en zuurstof en krijg je een olieachtige stof • Omestering – Biodiesel maken – Eerst esters verbreken en dan weer nieuwe vormen

huiswerk Maak opdracht: 40 t/m 43, 45 t/m 47, 52, 54

Energie

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 40. a. steenkool, aardolie, aardgas b. aardoliefracties worden opgevangen bij de destillatie van aardolie. Het zijn mengsels van vloeistoffen waarbij de kookpunten dicht bij elkaar liggen c. omdat een aardoliefractie een mengsel is, heeft het een kooktraject. d. Gas, Nafta, kerosine, lichte en zware gasolie

41. a. tijdens het condenseren komt er weer warmte vrij. b. je kunt de vrijgekomen warmte gebruiken om het te destilleren mengsel voor te verwarmen c. nee er wordt warmte afgestaan de omgeving: die gaat verloren voor het proces 42. a. Cn. H 2 N+2 b. c. d. Isomeren

43. a. C (s) + 2 Fe 2 O 3 (s) Fe (s) + 3 CO 2(g) b. Ladingsverschil c. Fe 3+ is OX en C is RED. 45. a. brandstoffen die gemaakt worden uit biomassa (plantaardig of dierlijk) b. eerste generatie: plantaardig materiaal dat geschikt is voor voedsel, tweede generatie: afvalstoffen c. neemt landbouwgrond in beslag 46. vergisting, pyrolyse, omestering, (HTU)

47. a. C 6 H 12 O 6 C 2 H 6 O + CO 2 b. ethanol wordt gemaakt uit suikerriet dus eerste generatie. Methaan wordt gemaakt uit mest dus tweede generatie 52. a. een brandstof is duurzaam als deze afkomstig is uit een hernieuwbare bron en het milieu zo min mogelijk belast b. klimaatneutraal betekend dat er geen verandering in het klimaat kan optreden als gevolg van het gebruik van deze brandstoffen. c. broeikaseffect en klimaatverandering

54. a. koolstofdioxide en water, bij zwavelverontreiniging ook zwaveldioxide b. alles van a en koolstofmonoxide, roet en onverbrande koolwaterstoffen. c. bij biobrandstof heb je dezelfde stoffen als bij fossiele brandstoffen alleen is er minder vervuiling waardoor er minder zwaveldioxide zal ontstaan

9. 5 duurzame energie uit bronnen • Duurzame energie is energie uit bronnen die nooit opraken – Zon – Zee – Wind – Aardwarmte – Biomassa – Water

Duurzame energie • Fossiele brandstoffen moeten vervangen worden door duurzame energiebronnen – Anders te weinig energie voor alle mensen – Fossiele brandstoffen raken op – Slecht voor het milieu – Duurzame energie raakt niet op

Energie van de zon • Grootste energieleverancier • In Nederland 2 technieken – Zonnecollector • Water verwarmen dmv de zon – Zonnepaneel • Zonne-energie meteen omzetten in elektrische energie – Zonnetoren • Kan beide

Energie uit de zee • • Getijdencentrales Watermolens Golfslagcentrales Osmose – Grens van zoet en zout water

Energie van wind en aarde Wind: • Windmolenparken op land of in zee Aarde: • Landen met vulkanische activiteit • Erg dure tecniek

Huiswerk • Maak opdracht: 60, 61, 63 t/m 65 c, 67, 69, 70

Huiswerk nakijken 60. a. Duurzame energie is energie uit bronnen die niet op raken. b. zon, wind, zee, aardwarmte, biomassa, water c. GEA betekend Global Energy Assessment 61. Fossiele brandstoffen hebben een negatief effect op het milieu en ze raken op

63. a. zonne-energie verwarmt water b. zonne-energie wordt direct omgezet in elektrische stroom c. zonne-energie wordt dmv spiegels opgevangen en de warmte wordt gebruikt om stroom te generen. De stroom zet turbines in werking waardoor bewegingsenergie ontstaat. Deze wordt omgezet in elektrische energie 64. a. in groep 14 b. atoommodel van Si

64. c. 4 omdat hij nog 4 elektronen op kan nemen d. er komen geladen deeltjes voor e. een fosfor atoom heeft 5 elektronen in zijn buitenste schil. 4 van de 5 elektronen vormen een binding met Si dus 1 elektron “over”. Deze zorgt voor de geleiding 65. a. spiegels ontvanger boven in de toren. Zonnewarmte opgevangen in een gesmolten nitraat Water stoomgenerator elektrische energie

65. b. Na. NO 3 c. bij stollen komt warmte vrij dus exotherm 67. getijden, golfslag, osmose 69. a. wind is bewegende lucht b. het blijft altijd waaien dus duurzaam c. bewegingsenergie wordt direct omgezet naar elektrische energie 70. a. windmolens zorgen voor geluidsoverlast en passen niet in het landschap b. kosten zijn te hoog. Niet rendabel.
 Theorie planning
Theorie planning Fijne dag vandaag
Fijne dag vandaag Arbo vandaag
Arbo vandaag Ik denk aan je vandaag
Ik denk aan je vandaag Wat gaan we doen vandaag
Wat gaan we doen vandaag Ik denk aan je vandaag
Ik denk aan je vandaag Jezus geneest vandaag
Jezus geneest vandaag Ajax vandaag
Ajax vandaag Vandaag speciale dag
Vandaag speciale dag Wiskunde 3 havo
Wiskunde 3 havo Hoofdstuk 3
Hoofdstuk 3 Belofte van pisa samenvatting
Belofte van pisa samenvatting Sparknotes noughts and crosses
Sparknotes noughts and crosses Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Exploitatiebegroting betekenis
Exploitatiebegroting betekenis Havo 4 wiskunde a hoofdstuk 4
Havo 4 wiskunde a hoofdstuk 4 Hoofdstuk in een opera
Hoofdstuk in een opera Voltage
Voltage Theorie mittlerer reichweite
Theorie mittlerer reichweite Kognitive triade
Kognitive triade Snaar theorie
Snaar theorie Attributietheorie van weiner
Attributietheorie van weiner Glans schijf van vijf
Glans schijf van vijf Théorie de rankine
Théorie de rankine Limites de la théorie des attentes de vroom
Limites de la théorie des attentes de vroom Approche administrative
Approche administrative Present simple theorie
Present simple theorie Sozialpsychologie themen
Sozialpsychologie themen La théorie du grand homme leadership
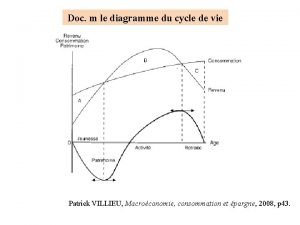
La théorie du grand homme leadership Diagramme cycle de vie
Diagramme cycle de vie Theorieën over criminaliteit
Theorieën over criminaliteit La théorie des attentes de vroom
La théorie des attentes de vroom Zelfzorgtheorie van orem
Zelfzorgtheorie van orem Théorie bicellulaire
Théorie bicellulaire Theorie van perrow
Theorie van perrow Capital asset pricing model
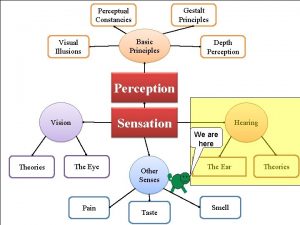
Capital asset pricing model Hering illusie
Hering illusie Act theorie anderson
Act theorie anderson Snaar theorie
Snaar theorie Les limites de l'école des relations humaines
Les limites de l'école des relations humaines La théorie x et y
La théorie x et y Neurona motora
Neurona motora Nancy roper théorie
Nancy roper théorie Theory of love
Theory of love Zur theorie der gesellschaftsspiele
Zur theorie der gesellschaftsspiele Gestalt psychology illusions
Gestalt psychology illusions Prospect theorie
Prospect theorie De dynamische driehoek
De dynamische driehoek Théorie de l'agence
Théorie de l'agence Polyvagal theorie
Polyvagal theorie Keynes theorie
Keynes theorie Mineralstoffe
Mineralstoffe équilibre de nash
équilibre de nash Ckredit
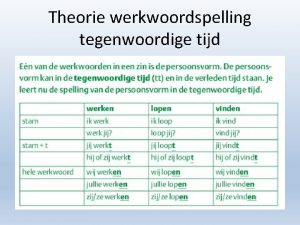
Ckredit Werkwoorden schema tegenwoordige tijd
Werkwoorden schema tegenwoordige tijd Théorie de skopos
Théorie de skopos Sdt theorie
Sdt theorie Segelflug theorie
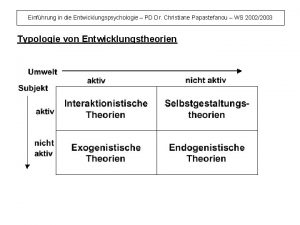
Segelflug theorie Exogenistische theorie
Exogenistische theorie Théorie néoclassique
Théorie néoclassique La théorie du polysystème
La théorie du polysystème Theorie begeleidingsmethoden
Theorie begeleidingsmethoden Dichte funktional theorie
Dichte funktional theorie ش4ا
ش4ا 6 postulats de la théorie particulaire
6 postulats de la théorie particulaire Théorie quantitative de la monnaie
Théorie quantitative de la monnaie Wachtrijtheorie
Wachtrijtheorie Théorie de l'action planifiée
Théorie de l'action planifiée Théorie des deux facteurs de herzberg
Théorie des deux facteurs de herzberg La théorie de l'apprentissage social
La théorie de l'apprentissage social Jeux jeuxnjeux
Jeux jeuxnjeux Lateiner theorie
Lateiner theorie Theorie des graphe
Theorie des graphe Rüsterholungszeit
Rüsterholungszeit John dewey theorie
John dewey theorie Taylor et la motivation
Taylor et la motivation 10 ziele nieke
10 ziele nieke Therapiesessel psychotherapie
Therapiesessel psychotherapie Theorie du big bang
Theorie du big bang Virginia henderson théorie
Virginia henderson théorie Markuspriorität
Markuspriorität Scenario planning workforce planning
Scenario planning workforce planning What is language planning
What is language planning N planning
N planning Aggregate capacity planning
Aggregate capacity planning Strategic planning vs tactical planning
Strategic planning vs tactical planning Perencanaan kapasitas dan agregat
Perencanaan kapasitas dan agregat