Genel Kimya Principles and Modern Applications Petrucci Harwood









![Arrhenius Tanımı Suya H+ [H 3 O+ (hidronyum)] katyonu veren maddeler ASİT Suya OH- Arrhenius Tanımı Suya H+ [H 3 O+ (hidronyum)] katyonu veren maddeler ASİT Suya OH-](https://slidetodoc.com/presentation_image_h/ba15f3877301c4bc480f9839b8aa04d9/image-12.jpg)




































![C- 50 m. L Na. OH (Ekv. Nok. ) [HCl] = (0, 1 C- 50 m. L Na. OH (Ekv. Nok. ) [HCl] = (0, 1](https://slidetodoc.com/presentation_image_h/ba15f3877301c4bc480f9839b8aa04d9/image-56.jpg)






- Slides: 68

Genel Kimya Principles and Modern Applications Petrucci • Harwood • Herring 8 th Edition Ünite 17: Asitler ve Bazlar ⇄ ⇌ ‾ + ÷ ↑↓ ↕ | ǁ |│║ │∫∑ √ ∛∜ ≤ ≥ ~ ∞ ≡ ≈ Δδπσυλα β γψμt τζΨ ΩθΧε φ ω ηō Ō½ ¼ ¾ ¼ ½ ¾ ΔGo , ΔSo , ΔHo 29. 11. 2020 01: 36 GK-II K. 17 1 / 81

İçindekiler 17 -1 17 -2 17 -3 17 -4 17 -5 17 -6 17 -7 17 -8 17 - ASİTLER ve BAZLAR 665 Asit ve Baz Tanımı-Arrhenius- Kuramı: Sunuş Asit ve Baz Tanımı Bronsted-Lowry Kuramı Suyun İyonlaşması ve p. H Eşeli Kuvvetli Asitler ve Bazlar Zayıf Asitler ve Bazlar Çok Protonlu Asitler Asit ve Baz Özelliği Gösteren İyonlar Molekül Yapısı ve Asit-Baz Davranışı Lewis Asit ve Bazları Özel Konu Asit Yağmuru 2

SULU ÇÖZELTİLERİ DOĞASI 29. 11. 2020 01: 36 3 / 81

Kuvvetli ve Zayıf Elektrolitler • Elektrik Sulu çözeltilerde iyonlar vasıtasıyla iletilir. . • KUVVETLİ ELEKTROLİTLER Çözeltilerinde büyük kısmı iyonlaşan ve çözeltileri elektriği iyi ileten maddelerdir HCl, Na. Cl, Mg. Cl 2 gibi • ZAYIF ELEKTROLİTLER Çözeltilerinde kısmen iyonlaşan ve çözeltileri elektriği zayıf ileten maddelerdir. , NH 3, HA, H 2 S gibi • Elektrolit olmayan(Nonelektolitler). Bunlar çözeltide iyonlaşmadığı için iletken değillerdir. CH 3 OH, Eter, üre, Aseton gibi 4

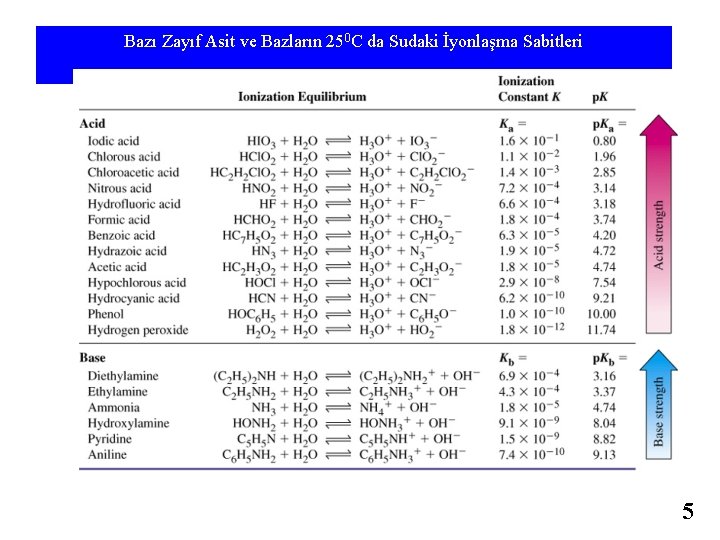
Bazı Zayıf Asit ve Bazların 250 C da Sudaki İyonlaşma Sabitleri 5

Kimyasal rx’larla ÖRNEK Elektrolit tipleri Kuvvetli Elektolit: % α=100(x/c) >10 , K=x 2/c>10 -2 ve p. K<2 ise Tam İyonlaştığı kabul edilir fakat tabiatta tamamen iyonlaşan madde yoktur. ÖRNEK: Kuvvetli bir elektrolit Mg. Cl 2 (aq) → Mg 2+ (aq) + 2 Cl- (aq) Başlangıç anı = to 0. 0050 M ------2+ Denge oluştuğunda=td [Mg. Cl 2] = 0 M [Mg ] = 0. 0050 M [Cl ] = 0. 0100 M ÖRNEK: Kuvvetli bir elektrolit Al 2(SO 4)3 (aq) → 2 Al 3+ (aq) + 3 SO 4= (aq) anı = to 0, 0165 M ------- 0, 033 M 0, 0495 M Denge oluştuğunda=td Başlangıç Zayıf Elektrolit: % α=100(x/c) <10 , K=x 2/c<10 -2 ve p. K>2 ise bu maddelerin ortamdaki iyon kons. K değerlerine göre hesaplanır. Bir Zayıf Asit olan Asetik Asitin iyonlaşması CH 3 CO 2 H (aq) ⇄ CH 3 CO 2 - - (aq) + H+ (aq) Basit Gösterimle HA ⇄ H++ A- K=[A ][ H+ ] / [HA]~10 -5 MHA=0, 1 M ise MH+=MA-=10 -3 M Elektrolit Olmayanlar (Non-elektrolitler): CH 3 OH(aq) gibi Kovalent molekül yapısında maddeler olup, çözeltilerinde iyonlaşmadıkları kabul edilirse de gerçekte çok az da olsa iyonlaşırlar. 6

Net Çökme ve Tüm Çökme reaksiyonları a) NET ÇÖKME REAKSİYONU Ag+ (aq) + Cl- (aq) → Ag. Cl (k) ↓ Tüm reaksiyon : Ag. NO 3(aq) + Na. Cl (aq) → Ag. Cl (k) + Na. NO 3(aq) b) Net ÇÖKME İYONİK rx : Sadece rx. a iştirak eden iyonların gösterildiği eşitliklerdir Ag+ (aq) + I- (aq) → Ag. I (aq) ↓ Tüm reaksiyon Ag. NO 3 (aq) +Na. I (aq) → Ag. I (k) ↓ + Na. NO 3 (aq) veya TÜM rx : Ag+(aq) + NO 3 -(aq) + Na+(aq) + I-(aq) → Ag. I(s) ↓ + Na+(aq) + NO 3 -(aq) Reaktif İYONLAR Çöken Ayrılan İyonlar 7

ÇÖZÜNÜRLÜK • KOLAY ÇÖZÜNEN BİLEŞİKLER: • Alkali metal (Li+, Na+, K+, Rb+, Cs+)ve Amonyum(NH 4+ ) bileşikleri. Halojenür, Nitrat, perklorat ve asetatlı bileşikler: X-, NO -, Cl. O - , CH CO 3 • • • 4 3 IA (Alkali Metal), IIA (Toprak Alkali Metal ) X-, NO 3 -ve S= Bileşikleri: IA grubu ve NH 4+ Karbonat ve Fosfatlar kolay çözünür. 2 ZOR ÇÖZÜNEN BİLEŞİKLER Pb 2+, Ag+, Hg 2+ Klorür, Bromür ve İyodürleri Sr 2+, Ba 2+, Ca 2+, Pb 2+, Hg 2+ Sülfatları IIA grubu OH- , CO 3= ve PO 43 - Hidroksitleri biraz çözünebilir fakat Karbonat ve Fosfatları zor çözünür. 8

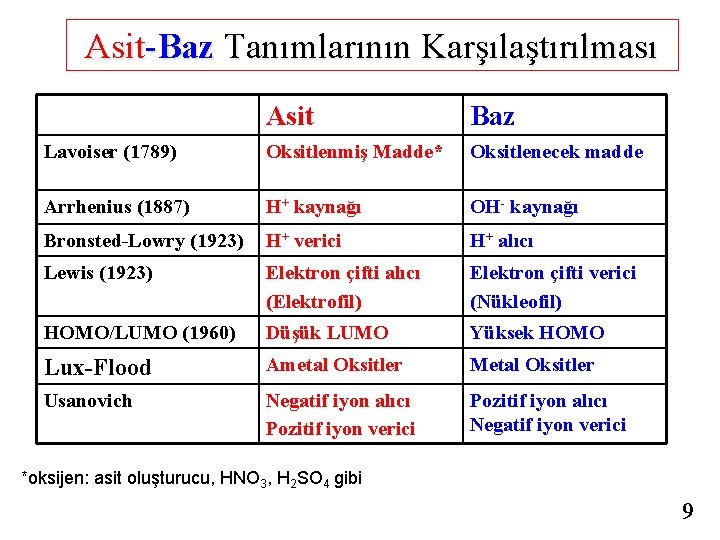
Asit-Baz Tanımlarının Karşılaştırılması Asit Baz Lavoiser (1789) Oksitlenmiş Madde* Oksitlenecek madde Arrhenius (1887) H+ kaynağı OH- kaynağı Bronsted-Lowry (1923) H+ verici H+ alıcı Lewis (1923) Elektron çifti alıcı (Elektrofil) Elektron çifti verici (Nükleofil) HOMO/LUMO (1960) Düşük LUMO Yüksek HOMO Lux-Flood Ametal Oksitler Metal Oksitler Usanovich Negatif iyon alıcı Pozitif iyon verici Pozitif iyon alıcı Negatif iyon verici *oksijen: asit oluşturucu, HNO 3, H 2 SO 4 gibi 9

Asit-Baz rx. ları • Latince ASİT =ekşi • Alkali (BAZ) sözcüğü Arabca al-qali (ashes of certain plants) Bitter taste ARRHENIUS 1884 Asit-Baz teorisi. • Asitler sulu çözeltide H+ , Bazlar OH- iyonu verirler. • Kuvvetli asit: HCl → H+ + Cl • HNO 3(aq) → H+ + NO 3 • Svante (aq) (aq) • Kuvvetli Baz Na. OH → Na+ + OHKOH → K+ + OH(aq) • • (aq) (aq) • Zayıf asit: CH 3 CO 2 H ⇄ CH 3 CO 2 - + H+ • Zayıf Baz NH 3 + H 2 O ⇄ NH 4+ + OH(aq) (aq) 10

Asit ve Bazların Tanımı Arrhenius Kuramı: 1. 1 - ARRHENİUS’a göre Asitler yapısında hidrojen bulunan ve sudaki çözeltisine hidrojen iyonu (H+) veren maddelerdir. En belirgin özellikleri ekşi tatda olmaları ve asit-baz indikatörü denilen bazı organik boya maddelerinin rengini değiştirmeleridir. Örneğin turnusolün mavi rengi asitle kırmızıya dönüşür. Örneğin HCl (g) + H 2 O H 3 O+ (aq)+ Cl- (aq) veya kısaca HCl (g)+ H 2 O H+ (aq) + Cl- (aq) şeklinde yazılabilir. Bazlar yapısında hidroksil bulunan ve sudaki çözeltisine hidroksil iyonu (OH-) veren maddelerdir. Elde kayganlık hissi uyandıran ve yine asit-baz indikatörlerinin rengini değiştiren maddelerdir. Örneğin turnusolün kırmızı rengi bazlarla maviye dönüşür. Örnek olarak sodyum hidroksit, Na. OH, verilebilir. Na. OH (k) Na+ (aq) + OH- (aq) Asit ve bazlar birbirlerini nötralleştirir su ve tuz oluşur. HCl (aq) + Na. OH (aq) Na+Cl- (aq) + H 2 O NÖTRALLEŞME rx Burada esas rx H+ (aq) + OH- (aq) H 2 O NÖTRALLEŞME rx denir. Arrhenius kuramı amonyağın baz oluşunu açıklayamaz. 11 / 81
![Arrhenius Tanımı Suya H H 3 O hidronyum katyonu veren maddeler ASİT Suya OH Arrhenius Tanımı Suya H+ [H 3 O+ (hidronyum)] katyonu veren maddeler ASİT Suya OH-](https://slidetodoc.com/presentation_image_h/ba15f3877301c4bc480f9839b8aa04d9/image-12.jpg)
Arrhenius Tanımı Suya H+ [H 3 O+ (hidronyum)] katyonu veren maddeler ASİT Suya OH- (hidroksit) anyonu veren maddeler BAZ HNO 3 + H 2 O NO 3– + H 3 O+ NÖTRALLEŞME H+Cl- + Na+ OH- H 2 O + Na. Cl NÖTRALLEŞME zayıf asit + (zayıf) baz ⇄ tuz + su HİDROLİZ KUVVETLİ ASİTLER HCl, HNO 3, H 2 SO 4, HCl. O 4, HI, HBr KUVVETLİ BAZLAR KOH, Na. OH, Li. OH, Ca(OH)2, Ba(OH)2 ZAYIF ASİTLER CH 3 COOH, HF, H 2 S, H 2 CO 3, HCN ZAYIF BAZLAR NH 4 OH, Organik Aminler, 12

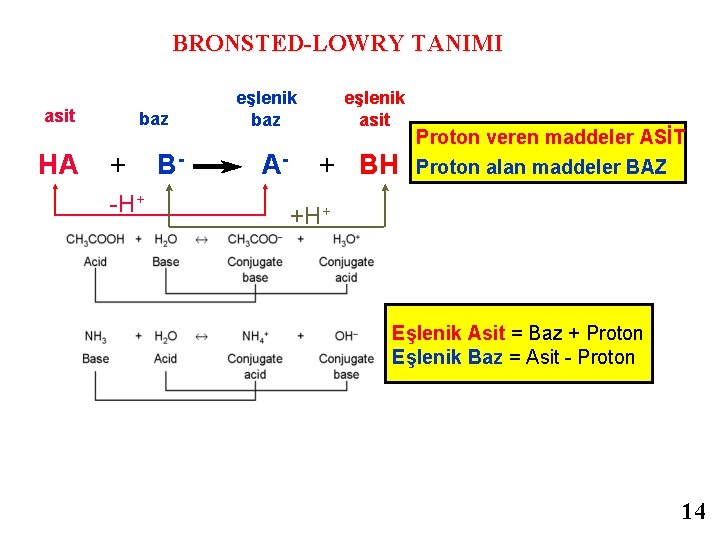
Asit ve Bazların Brønsted-Lowry Kuramı • Asit, proton veren maddedir. • Baz, proton alan maddedir. NH 3 + H 2 O ⇄ NH 4+ + OHbaz asit Konj. baz 1. 2 - BRONSTED-LOWRY’ye göre asitler proton veren, bazlar ise proton alan maddelerdir. HCl + H 2 O → H 3 O+ + Cl- Burada HCl proton verdiğine göre asit, H 2 O ise proton aldığına göre bazdır. HCl ve H 2 O arasındaki tepkime sonucunda konjüge asit ve bazlar oluşur. Ancak H+ iyonunun suda serbest halde bulunması olası değildir. Su molekülleriyle sarılması beklenir. Yaklaşık dokuz su molekülüyle sarılan H+ iyonu, bunlardan birisi ile de sıkıca bağlanır. Bundan dolayısıyla suda, H+ yerine H 3 O+ hidronyum iyonu da denilmektedir. Arrhenius' a göre baz olması beklenmeyen NH 3 (aq) (amonyak çözeltisi) bu tanıma göre bazdır, bu da aşağıdaki tepkime ile verilebilir. NH 3 (aq) + H 2 O ⇄ NH 4+ (aq) + OH- (aq) baz (1) asit(2) konjüge asit(1) konjüge baz (2) (eşlenik asit) (eşlenik baz) Yukarıdaki tepkimeye bakacak olursak, NH 3 proton aldığı için baz, H 2 O ise proton verdiği için asittir. Aynı zamanda NH 4+ , NH 3 ün konjüge asidi, OH- ise H 2 O nun konjüge bazıdır. 13

BRONSTED-LOWRY TANIMI asit baz eşlenik asit HA + B- A- + BH -H+ Proton veren maddeler ASİT Proton alan maddeler BAZ +H+ Eşlenik Asit = Baz + Proton Eşlenik Baz = Asit - Proton 14

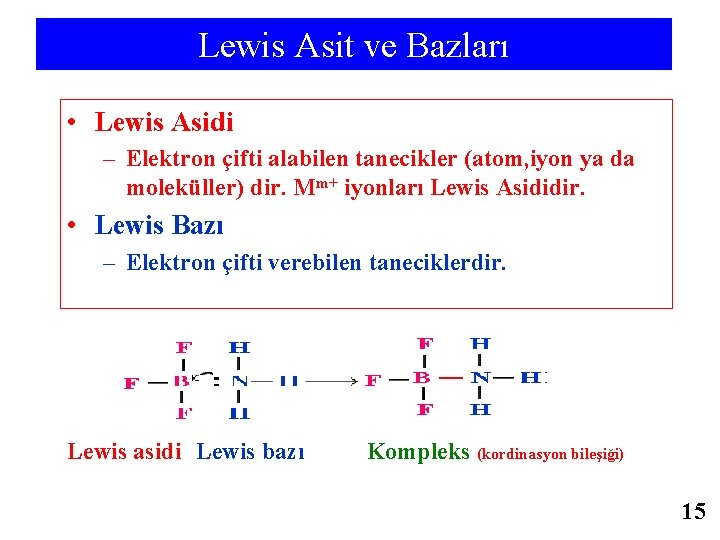
Lewis Asit ve Bazları • Lewis Asidi – Elektron çifti alabilen tanecikler (atom, iyon ya da moleküller) dir. Mm+ iyonları Lewis Asididir. • Lewis Bazı – Elektron çifti verebilen taneciklerdir. Lewis asidi Lewis bazı Kompleks (kordinasyon bileşiği) 15

LEWİS TANIMI ASİT electron-çifti alıcı (acceptor) nükleofil BAZ elektron-çifti verici (donor) elektrofil ASİT Kompleks BAZ 1. 4 - LEWİS' e göre ise ASİT elektron çifti alabilen, BAZ ise elektron çifti verebilen maddedir. Baz grubuna genellikle elektron verebilen oksijen veya azot içeren maddeler girer. Diğer taraftan hidrojen içermeyen maddeler asit olabilir. Örneğin bor triflorür, BF 3, bir asittir, çünkü é eksikliği vardır ve bunu tamamlamak ister. Öte yandan NH 3 veya diğer azotlu maddelerde ortaklanmamış elektron çiftleri bulunur, dolayısıyla bazdır. 3+ + 6 CN- ⇄ [Fe(CN) ]3 Lewis Asitleri Bütün katyonlar Lewis Asitidir Fe Lewis Asitleri 6 Oktet boştuğu olan bileşikler Al 3+ + 6 F- ⇄ [Al(F) ]36 Hipervalent oluşturabilen bileşikler Sn. Cl 4 + 2 Cl- ⇄ [Sn(Cl)6]2 Çok katlı π-bağlara sahip bileşikler CO + OH- ⇄ HCO 2 3 -, F-, S-2…) H+ + OH- ⇄ H O Lewis Bazları Bütün anyonlar: (OH Lewis Bazları 2 No é çifti içeren nötral bileşikler (H 2 O, NH 3 gibi. . ) Cu 2+ + 4 H 2 O ⇄ [Cu(H 2 O)4]2+ Çok katlı π-bağlara sahip bileşikler Ag+ + C 2 H 4 ⇄ [Ag(C 2 H 4)]+ MOT göre: ASİT: Düşük enerjili LUMO, BAZ : Yüksek enerjili HOMO olan komplexlerdir. 16

Lux-Flood Asit Baz Tanımı 1. 5 - Lux-Flood Tanımı göre ametal oksitler ASİT olup oksit alıcıdır , metal oksitler BAZ olup oksit vericidir. Örneğin; Ba. O (baz) + Si. O 2 (asit) → Ba(Si. O 3) Na 2 O (baz) +CO 2 (asit) → Na 2 CO 3 gibi… Oksit anyonu alan bileşikler ASİT Ca. O + Si. O 2 Ca. Si. O 3 Oksit anyonu veren bileşikler BAZ Pb. O + SO 3 Pb. SO 4 Ti. O 2 + Na 2 S 2 O 7 Na 2 SO 4 + Ti. OSO 4 Usanowich Asit-Baz Tanımı 1. 6 - USANOVİCH’ e göre ASİTLER rx’da katyon verir, anyon veya e- alır ve bazlarla rx girer, BAZLAR ise rx’da anyon veya e- verir, katyon alır ve asitlerle rx’a girerler. Bu tanım bundan evvel ki aşağı yukarı tüm tanımları kapsamaktadır Katyon veren bileşikler ASİT Anyon alan bileşikler BAZ Büyün kimyasal tepkimeler asit-baz tepkimesi olarak kabul edilebilir. 17

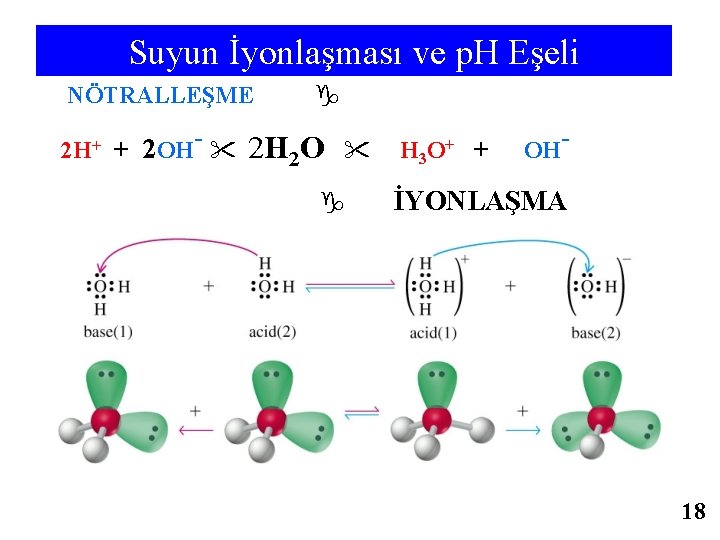
Suyun İyonlaşması ve p. H Eşeli NÖTRALLEŞME 2 H+ + 2 OH- 2 H 2 O H 3 O+ + OH- İYONLAŞMA 18

Suda Asit ve Baz Dengeleri Bir asit veya baz suda çözüldüğünde iyonlaşır (dissosiye olur). İyonlaşmanın derecesi asit veya bazın kuvvetiyle ilişkilidir. % 10’dan daha fazla iyonlaşan Kuvvetli asit/bazın tamamen iyonlaştığı kabul edilir. En Çok kullanılan Kuvvetli Asitler H 2 SO 4 (zac yağı), HNO 3 (Kezzap), HCl (Tuz Ruhu), HBr, HI, HCl. O 4 dir. Kuvvetli Bazlar Alkali ve Toprak Alkali Metallerinin Hidroksitleri: Na. OH(Sud Kostik), KOH (Potas Kostik), Ca(OH)2 (Kireç suyu, Sönmüş Kireç=Badana). Zayıf asit ve bazlar ise suda kısmen iyonlaşırlar. HA Zayıf Asiti HA (aq) ⇄ H+ + A- şeklinde iyonlaşır. veya Su ile HA (aq) + H 2 O ⇄ H 3 O+ + A- şeklinde iyonlaşır. Denge sabiti=Ka= [Ürünler]/ [Reaktifler] = [H+] [A-] / [A] şeklindedir. Ka. [H 2 O] = Ka = [H 3 O+] [A-] / [HA] şeklinde de yazılabilir. BOH Zayıf baz için BOH ⇄ B+ + OH Denge sabiti =Kb = [B+] [OH-]/ [BOH] veya su ile Kb = Kdenge. [H 2 O] = [BH+] [OH-] / [B] şeklinde de yazılabilir. 19

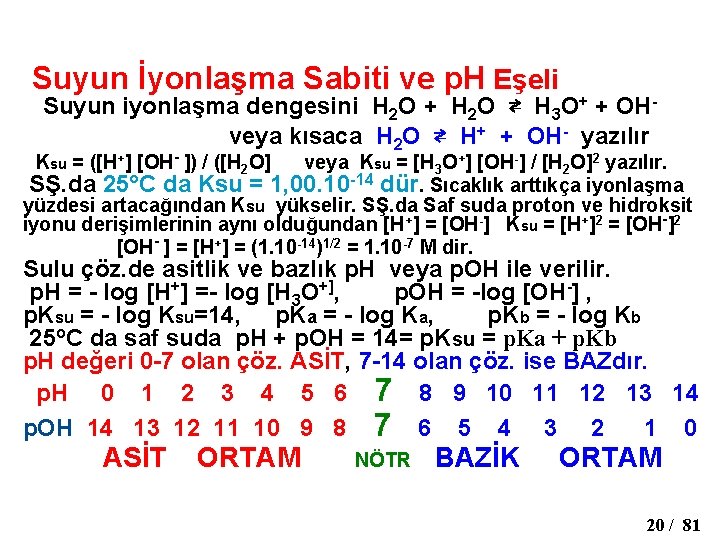
Suyun İyonlaşma Sabiti ve p. H Eşeli Suyun iyonlaşma dengesini H 2 O + H 2 O ⇄ H 3 O+ + OH- veya kısaca H 2 O ⇄ H+ + OH- yazılır Ksu = ([H+] [OH- ]) / ([H 2 O] veya Ksu = [H 3 O+] [OH-] / [H 2 O]2 yazılır. SŞ. da 25°C da Ksu = 1, 00. 10 -14 dür. Sıcaklık arttıkça iyonlaşma yüzdesi artacağından Ksu yükselir. SŞ. da Saf suda proton ve hidroksit iyonu derişimlerinin aynı olduğundan [H+] = [OH-] Ksu = [H+]2 = [OH-]2 [OH- ] = [H+] = (1. 10 -14)1/2 = 1. 10 -7 M dir. Sulu çöz. de asitlik ve bazlık p. H veya p. OH ile verilir. p. H = - log [H+] =- log [H 3 O+], p. OH = -log [OH-] , p. Ksu = - log Ksu=14, p. Ka = - log Ka, p. Kb = - log Kb 25 o. C da saf suda p. H + p. OH = 14= p. Ksu = p. Ka + p. Kb p. H değeri 0 -7 olan çöz. ASİT, 7 -14 olan çöz. ise BAZdır. p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 p. OH 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 ASİT ORTAM NÖTR BAZİK ORTAM 20 / 81

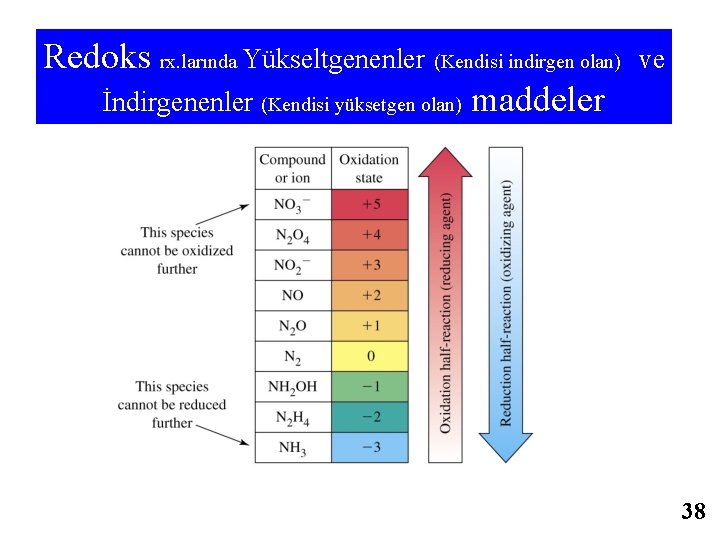
Table 17. 3 Bazı Zayıf Asit ve Bazların 250 C da Sudaki İyonlaşma Sabitleri 21

Asit-Baz Reaksiyonları • Asitler iyonlaşabilen H+ içerirler CH 3 CO 2 H veya HC 2 H 3 O 2 şeklinde yazılır –BAZLAR bir Mm+ yanında iyonlaşabilen OH- sahiptir. . KOH Mg(OH)2 (k) + 2 H+ Cl-(aq) → Mg 2+ Cl-2 (aq) + 2 H 2 O (s) Mg(OH)2(k) + 2 CH 3 CO 2 H (aq) ⇄ Mg 2+(CH 3 CO 2 -)2 (aq) + 2 H 2 O (s) H 2 CO 3 (aq) ⇄ H 2 O (s) + CO 2 (g) şeklinde yazılabilir • Kireç taşı, Mermer, Tebeşir Ca. CO 3(k) + 2 H+ Cl-(aq) ⇄ Ca 2+ Cl-2(aq) + H 2 CO 3(aq) Kireç Ca. O(k) + 2 H+ Cl-(aq) → Ca 2+ Cl-2(aq) + H 2 O şeklinde yazılabilir. Na 2 CO 3 (aq) iki kademede iyonlaşabilen bazik bir tuzdur Na 2 CO 3 (k) + H 2 O (s) ⇄Na+ HCO 3 - (aq) + Na+OH- (aq) Na+ HCO 3 - (aq) + H 2 O (s) ⇄ H 2 CO 3 (aq) + Na+OH- (aq) 22

Asit-Baz Hesaplamaları Asit-Baz karışımlarına ait hesaplamalarda özellikle şunlara dikkat edilmelidir: • 1 - Çözeltide hangi tür iyonlar önemlidir ve derişimleri nedir? Örneği HCl+HA karışımında H+, Cl -, HA ve A- bulunur. Burada en önemli olan HCl den gelen H+ miktarı olup ortamı o belirler. HA iyonlaşması ortak iyon etkisiyle azaldığı için HA’dan gelen H+ rahatça ihmal edilebilir düzeydedir. • 2 -Çözeltide bulunan türler arasında herhangi bir tepkime söz konusu ise buna dikkat edilmesi gerekir ve sonuç tepkime neticesinde ortamın durumuna ve etkin olacak türe göre hesaplanır. • 3 - rx neticesinde ortam nedir? Kuv. Asit mi? Kuv. Baz mı ? , Zayıf Asit mi? , Zayıf Baz mı ? , Asidik Tuz mu? , Bazik Tuz mu ? Nötral mi ? Amfoter mi ? Tampon mu? Mutlaka Doğru belirlenmeli ve ona göre hesaplama yolu seçilmelidir. Asidin etkin olduğu karışımlarda [H+] , azın etkin olduğu karışımlar da ise [OH -] hesaplandığını Asit Ortamda p. H<7 , • Baz ortamda p. H>7 olduğunu unutmamak gerekir. 29. 11. 2020 01: 36 23

Kuvvetli Asitler ve Kuvvetli Bazların p. H (%α≥ 10 olan kuvvetli asit veya kuvvetli bazın tamamen iyonlaştığı kabul edilir ve Asit veya bazın M konsantrasyonu [H 3 O+] (hidronyum)= [H+] iyonu veya [OH- ] (hidroksit) iyonu derişimine eşit kabul edilir p. H = -log Ca, p. OH = -log Cb alınır. Örnek) 0, 05 M HCl (aq) p. H=? nedir? HCl+H 2 O H 3 O+ + Cl- Çözüm) [H 3 O+]= [HCl] = 0, 05 M p. H = -log 0, 05 = 1, 30 Aynı durum kuvvetli bazlar için de geçerlidir. p. OH = -log C bdir Örnek) 0, 05 M Na. OH(aq) p. H=? nedir? Na. OH(aq) Na+ + OHÇözüm) [OH- ] = [Na. OH] = 0, 05 M p. OH=-log 0, 05=1, 30 p. H=12, 7 Derişimin 10 -6 M dan küçük olması durumunda suyun iyonlaşma etkisini göz önüne alacağımızdan çözeltideki OH- derişimi için aşağıdaki eşitliliği yazmamız gerekir. [OH-] = Cb + [OH-]su = [H 3 O+]su = C olduğundan Ksu = (Cb+C). C = 1. 10 -14 C 2 + Cb. C – 1. 10 -14 = 0 dır. Bu eşitliğin çözümü ile C yani sudan gelen hidroksit iyonu derişimi bulunur, Cb ye eklenerek çözeltideki hidroksit derişimine geçilir ve p. OH hesaplanır. 24

Çok seyreltik Kuvvetli Asitler ve Kuvvetli Bazların p. H Derişimin 10 -6 M dan küçük olması durumunda suyun iyonlaşma etkisini göz önüne alacağımızdan çözeltideki [H+] veya [OH-] derişimi için aşağıdaki eşitliliği yazmamız gerekir. [H+] = Ca + [H+] su [H+]su = [OH-]su = Csu olduğundan Ksu = (Ca+Csu). Csu = 1. 10 -14 dan Csu 2 + Cb. Csu – 1. 10 -14 = 0 dır. Bu eşitliğin çözümü ile Csu yani sudan gelen hidroksit iyonu derişimi bulunur, Ca ye eklenerek çözeltideki [H+]t derişimine geçilir ve p. H hesaplanır veya basit olarak aşağıdaki gibi yaklaşık hesap yapılabilir. ÖRNEK : [H+] =10 -8 olan kuv. Asitte [H+]t= 10 -7+ 10 -8=1, 1. 10 -7 dan p. H=6, 9 Asidik çözeltide daima p. H<7 dir. Veya [OH ] =10 -8 olan kuv. Bazda [OH ]t = 10 -7+ 10 -8=1, 1. 10 -7 dan p. OH=6, 9 olur ve p. H=7, 1 bulunur. Bazik çözeltide daima p. H>7 dir. 25

Kuvvetli Asit veya Baz Karışımları Örnek: 100 ml 0, 050 M Na. OH ile 100 ml 0, 020 M Ca(OH)2 çözeltileri karıştırılıyor. Elde edilen çözeltinin p. OH ve p. H değerleri nedir? Çözüm: Na. OH (aq) → Na+ + OH- Ca(OH)2 (aq) → Ca 2+ + 2 OH- 0, 05 0. 02 0, 02 2 x(0, 02) İki ayrı baz çözeltisinin karıştırılması ile oluşan yeni çözeltide hidroksit iyonu derişimi şöyle bulunur. Çözeltideki toplam OH - iyonu, Na. OH ve Ca(OH)2 tarafından verilir. Her iki çözeltiden 100’er m. L alındığından çözeltinin son hacmi 200 m. L olur. M = n/V formülünde hacim değiştiği için molarite de değişecek. Öncelikle M x V formülünden yeni mol sayısı (n) bulunur. Daha sonra bu mol sayısı (n) toplam hacime (V) bölünerek yeni derişim bulunur. [OH-] = (100 x 0, 05+ 100 x 0, 04) / 200 = 4, 50. 10 -2 M p. OH = -log 4, 50. 10 -2 = 2 -log 4, 50 = 2 -0, 65 = 1, 35 p. H = 14 -p. OH = 14 -1, 35 = 12, 65 26

Kuvvetli Asit, Baz veya Tuz Karışımları S. 1) %15 H 2 SO 4(aq) (d=1, 103) ve %45 H 2 SO 4(aq) (d=1, 352) ile su eşit hacımlarda karıştırılırsa meydana gelen H 2 SO 4(aq) d=? , %c=? , %v=? , M=? , N=? , m=? , %n=? ➨CEVAP) d=1, 151 - % 22, 4 -%c=25, 78 - %v=10, 69 - M=2, 65 - N=5, 30 - m=2, 95 - %n=5, 04 S. 2) %40 H 2 SO 4(aq) (d=1, 3) su ile kütlece ve hacımca 3: 1 oranında karıştırılırsa meydana gelen H 2 SO 4(aq) d=? , %c=? , %v=? , M=? , N=? , m=? , %n=? ➨CEVAP) Kütlece 3: 1 karışımın d=1, 21 - % 30 ➪ hacımca 3: 1 karışımın d=1, 225 %31, 84 27

S. 3)- A) % 20 HCl (aq) (d=1, 1 g/m. L) B) % 40 KOH (aq) (d= 1, 42 g/ml) A ve B den eşit ağırlıkta karıştırıldığında oluşan tepkimeyi yazınız. Tepkimeden evvel ve sonra karışımdaki madde miktarlarını Molarite olarak belirtiniz. Rx’dan sonraki karışım çözeltinin kütlece yüzdesini tepkimede artan maddeye göre bulunuz. Çözeltinin p. H=? Aw’ler H=1 , O=16 , Cl = 35, 5 , K=39. . g/mol ➨CEVAP) HCl (100*0, 2/36, 5=0, 548 mol) + KOH (100*0, 4/56=0, 714 mol) ➔ KCl + H 2 O rx’dan sonra ortamdaki artan maddeler [OH-]= 0, 166 mol / (100/1, 1 + 100/ 1, 42=161, 333. 10 -3 L ) =1, 029= [KOH] p. OH=0, 01 p. H=13, 99 [KCl] = [Cl-]=0, 548/0, 161333=3, 397 [K +] =3, 397+1, 029=4, 426 28

S. 4)Ca(OH) (k) + 2 HCI(aq) Ca. Cl 2(aq) + H 2 O(s) tepkimesi veriliyor, 421 m. L 2 0, 467 M HCI(aq) çözeltisi 10 g Ca(OH)2 ile rx verdiğinde 8, 42 g Ca. Cl 2 elde edilmiştir ( HCl=36, 5 g/mol, Ca(OH)2=74 g/mol, Ca. Cl 2=111 g/mol). a) Sınırlayıcı bileşeni, b)Kuramsal, c)Gerçek, d) Yüzde verimi bulunuz, e) rx sonra hangi maddeden ne kadar artmıştır? ➨CEVAP) Ca(OH)2(k) (74 g/n) + 2 HCI(aq) (2*36, 5) Ca. Cl 2(aq) (111 g/n) +H 2 O(s) 10 g/74 g/n=0, 135 n 0, 421 L* 0, 467 M=0, 197 n 8, 42 g /111 g/n=0, 076 n a) Sınırlayıcı rf (reaktif=bileşen) HCIaq b) Kuramsal (teo. )Verim (0, 197/2)n*111 g/n=10, 9335 g c)Gerçek Verim 8, 42 g /111 g/n=0, 076 n d)Yüzde Verimi 8, 42 g/10, 9335 g = 0, 076/(0, 197/2) =0, 77 ➪ %77 e) rx’dan sonra Ortamda artan madde Ca(OH)2(k) 0, 135 -(0, 197/2)=0, 0365 n ➪ *74=2, 701 g 29

S. 5) % 92. 5 Na. OH ve % 7. 5 Ca. O içeren katı karışımdan 0. 239 g alınıp suda çözülerek HCl(aq) çözeltisi ile titre edildiğinde 45. 6 m. L HCl(aq) sarfediliyor. HCl(aq) molaritesi nedir? ➨CEVAP) nt = [OH-] Na. OH (=0, 235*0, 925/40 = 0, 00543 mol) + +[OH-] Ca. O (=0, 235*0, 075*2 / 56 = 0, 00048 mol) = 5, 91. 10 -3 mol [OH-] = 5, 91. 10 -3 mol [HCl] 1 mol HCl / 1 mol OH- * 1/ 0, 0456 L = 0, 130 M HCl ****************************************************** S. 6)%98, 5 K 2 Cr 2 O 7 (294 g/n) içeren 62, 5 g numune %30 HCl(aq)(d=1, 15 g/cc)’in 325 m. L ile rx’dan kaç g Cl 2(g) oluştuğunu rx yazıp denleştirerek bulunuz. (Aw H=1, O=16, Cl=35, 5, K=39, Cr=52…g/n) ➨CEVAP: K 2 Cr 2 O 7 + 14 HCl (aq) ➔ 2 KCl(aq) + 2 Cr. Cl 3(aq) + 3 Cl 2(g) + 7 H 2 O (62, 5*0, 98) / 294=0, 21 n (325*1, 15*0, 3)/36, 5=3, 082 n ➪ 0, 21 n K 2 Cr 2 O 7 x 14=2, 94 n HCl gerekir. HCl fazladır ve sınırlayıcı bileşen K 2 Cr 2 O 7 olup K 2 Cr 2 O 7’nin mol miktarına göre çıkan Cl 2(g) miktarı=0, 21 x(3/1)x 71 = 44, 73 g. dır. 30 / 81

OLEUM (H 2 S 2 O 7+ H 2 SO 4 Karışımı) PROBLEMLERİ 7) % 95 H 2 SO 4(aq) ile %30 Oleum ( 100 g=30 g H 2 S 2 O 7+70 g H 2 SO 4) ne oranda karıştırılırsa %20 Oleum olur? ➨CEVAP: Burada SINIRLAYICI BİLEŞEN Su dur 100 g %95 H 2 SO 4(aq) (100 g=95 g H 2 SO 4+5 g H 2 O) üzerine A g % 30 Oleum H 2 S 2 O 7(178 g/n) + H 2 O (18 g/n) ➔ 2 H 2 SO 4 (196 g) olduğunda burada ~ 50 g H 2 S 2 O 7 ➪ 5 g H 2 O harcar ➪ ~ 54, 44 g H 2 SO 4 oluşturur. Burada neticede %20 oleum oluşması için 0, 20 Oleum = 0, 30 x. A - (5 x 178: 18) / 100+ A dan A= 694, 44 g ➪ A = 694, 44 g %30 Oleum +100 g % 95 H 2 SO 4(aq) ≈ 7/1 oranında karıştırısa sonuçda Karışım % 20 Oleum olur. 31

OLEUM (H 2 S 2 O 7+ H 2 SO 4 Karışımı) PROBLEMLERİ 8) %20 oleum ile % 70 H 2 SO 4 çözeltisi ¼ oranında karıştırılırsa oluşan çözelti % kaçlıktır? ÇÖZÜM: 25 g %20 oleum alırsak bunun 25 x 0, 20 = 5 g’ı H 2 S 2 O 7 , 25 – 5 = 20 g ‘ ı ise H 2 SO 4 içerir. 100 g % 70 H 2 SO 4 çözeltisinde ise 70 g H 2 SO 4 ile 30 g H 2 O bulunur. Burada H 2 S 2 O 7 Oleum SINIRLAYICI REAKTİFTİR. H 2 S 2 O 7(178 g/n) + H 2 O (18 g/n) ➔ 2 H 2 SO 4 (196 g) olduğunda burada 5 g H 2 S 2 O 7 ➪ ~ 0, 5 g H 2 O harcar ➪ ~ 5, 5 g H 2 SO 4 oluşturur. O halde oluşan yeni çözeltide bulunan maddeler şu şekildedir: 70 + 20 + 5, 5 =95, 5 g H 2 SO 4 Kalan su miktarı 30 – 0, 5 = 29, 5 g H 2 O Çözeltinin son toplam kütlesi = 95, 5 H 2 SO 4 + 29, 5 su = 125 g % H 2 SO 4 = 95, 5 / 125 x 100 = %76, 4 H 2 SO 4 aq oluşur. 32

OLEUM (H 2 S 2 O 7+ H 2 SO 4 Karışımı) PROBLEMLERİ 9) 80 g % 98 H 2 SO 4(aq) ile 150 g %20 Oleum ( 100 g=20 g H 2 S 2 O 7+80 g H 2 SO 4) karıştırılırsa ne oluşur ? + ➨CEVAP: 80 g %98 H 2 SO 4(aq) = (80 x 0, 98=) 78, 4 g H 2 SO 4 1, 6 g H 2 O içerir 178 g/n 18 g/n 2 x 98=196 150 g %20 Oleum = (150 x 0, 20=)30 g H 2 S 2 O 7+120 g H 2 SO 4 içerir H 2 S 2 O 7(178 g/n) + H 2 O (18 g/n) ➔ 2 H 2 SO 4 (196 g) olduğundan burada 30 g H 2 S 2 O 7 ➪ ~3 g H 2 O harcar ➪ ~ 32, 2 g H 2 SO 4 oluşturur. Burada SU SINIRLAYICI BİLEŞEN’dir 1, 6 x 178/18=15, 82 g H 2 S 2 O 7 harcar Artan H 2 S 2 O 7 miktarı = 30 - 15, 82 = 14, 18 g/230 g ➪ NETİCE % 6, 16 OLEUM çözeltisi oluşur 33

OLEUM (H 2 S 2 O 7+ H 2 SO 4 Karışımı) PROBLEMLERİ 10) % 10 Oleum ile % 50 H 2 SO 4(aq) den % 95 H 2 SO 4(aq) eldesi için ne oranda karıştırılmalıdır ? ➨CEVAP: Burada. OLEUM KISITLAYICI BİLEŞEN’dir. Onun için 100 g %10 Oleum alınır ve buna A g % 50 H 2 SO 4(aq) katılır. H 2 S 2 O 7(178 g/n) + H 2 O (18 g/n) ➔ 2 H 2 SO 4 (196 g) olduğundan burada 10 g H 2 S 2 O 7 ➪ 1, 011 g H 2 O harcar ➪ 11, 011 g H 2 SO 4 oluşturur. Ohalde H 2 O’a göre=0, 5 A - 1, 011/100+A=0, 05 ➪ A=13, 36 g % 50 H 2 SO 4(aq)100 g%10 Oleum katılır % 95 H 2 SO 4(aq) olur H 2 SO 4’a göre=0, 5 A + 90 + 11, 011/100+A=0, 95 ➪ A=13, 36 g % 50 H 2 SO 4(aq)100 g%10 Oleum katılır % 95 H 2 SO 4(aq) olur. 34

ASİT/BAZ ORTAMDA OLAN TEPKİMELER 11 - Bir çözeltinin redoks titrasyonu ile ayarlanması: 0, 1568 g Fe tel numunesi H 2 SO 4 (aq) çözerek Fe 2+ haline dönüştürüldüğünde ayarlanmak için hazırlanan KMn. O 4(aq) çöz den 26, 62 m. L kullanılmıştır. KMn. O 4(aq)ın M=? 5 Fe 2+(aq) + Mn. O 4 -(aq) + 8 H+(aq) → 4 H 2 O(l) + 5 Fe 3+(aq) + Mn 2+(aq) 35

14) A) % 20 HNO 3 (aq) (d=1, 1 g/m. L), B) % 40 Na. OH (aq) (d= 1, 42 g/ml) A ve B den eşit hacımda karıştırıldığında oluşan tepkimeyi yazınız. Tepkimeden önce ve sonra karışımdaki madde miktarlarını Molarite ve kütlece % olarak belirtiniz. Rx % 80 verimle gerçekleştiğinde oluşan ürün miktarını g. , % ve M olarak bulunuz. Kütle numaraları H=1 , O=16 , Cl = 35, 5 , K=39. . g/mol CEVAP : Na. OH + HNO 3 Na. NO 3 + H 2 O Karışmadan önce (1420 g/Lx 0, 4) : 40 =14, 2 M (1100 x 0, 2): 63=3, 49 M ---Karıştıktan sonra (14, 2 -3, 49) : 2 = 5, 355 M -------1, 745 M x 85 g/M= 148, 325 g/L “ “ %= (10, 71 x 40) : (1420+1100)= % 17 -------% = (148, 325 : 1260)x 100=11, 77 Rx % 80 verimle olursa % 11, 77 x 0, 8= % 9, 416 Na. NO 3 oluşur bu 148, 325 x 0, 8= 118, 66 g/L= 1, 396 M demektir. ******************************************** 15) A) % 20 HCl (aq) (d=1, 1 g/m. L) B) % 40 KOH (aq) (d= 1, 42 g/ml) A ve B den eşit ağırlıkta karıştırıldığında oluşan tepkimeyi yazınız. Tepkimeden evvel ve sonra karışımdaki madde miktarlarını Molarite olarak belirtiniz. Rx’dan sonraki karışım çözeltinin kütlece yüzdesini tepkimede artan maddeye göre bulunuz. Çözeltinin p. H=? Kütle numaraları H=1 , O=16 , Cl = 35, 5 , K=39. . g/mol ➨CEVAP: HCl (100*0, 2/36, 5=0, 548 mol) + KOH (100*0, 4/56=0, 714 mol) ➔ KCl + H 2 O rx’dan sonra ortamdaki artan maddeler [OH-]= 0, 166 mol / (100/1, 1 + 100/ 1, 42=161, 333. 10 -3 L ) =1, 029= [KOH] p. OH=0, 01 p. H=13, 99 [KCl] = [Cl-]=0, 548/0, 161333=3, 397 [K+] =3, 397+1, 029 = =4, 426 M Oluşan çözeltinin Yoğunluğu d= (110+142) / 200 = 1, 26 %KOH = (1, 029*56*0, 1) /1, 26= 4, 73 36

37

Redoks rx. larında Yükseltgenenler (Kendisi indirgen olan) İndirgenenler (Kendisi yüksetgen olan) maddeler ve 38

Bazı Gaz oluşturan tepkimeler Gas Forming Reactions 39

ÖRNEK Yükseltgen ve İndirgenin Belirlenmesi : Hydrogen peroxide, H 2 O 2, hem yükseltgen hemde indirgen bir maddedir. H 2 O 2(aq) + 2 Fe 2+(aq) + 2 H+ → 2 H 2 O(l) + 2 Fe 3+(aq) Iron is oxidized and peroxide is reduced 5 H 2 O 2(aq) + 2 Mn. O 4 -(aq) + 6 H+ → 8 H 2 O(l) + 2 Mn 2+(aq) + 5 O 2(g) Manganese is reduced and peroxide is oxidized. 29. 11. 2020 01: 36 40 / 81

Asit /Baz ortamda yarı rx. ları tamamlama? Anot rx : Fe 2+ → Fe 3+ + e‾ Eºsolyük = -0. 77 V Katot rx : Mn. O 4‾+8 H+ + 5é → Mn 2+ +4 H 2 O Eºsağind =1, 51 v TOPLAM PİL rx 5 Fe 2+aq+ Mn. O 4‾aq+ 8 H+→ 5 Fe 3+ + Mn 2+aq+4 H 2 O Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 0, 77) = 0, 74 V PİL ŞEMASI -ANOT Fe | Fe 2+aq║ Mn. O 4‾aq|H+| C (k) KATOT+ ÖRNEK 21 -2 A/507 A) Eºyük. Fe 2+→Fe 3+ = - 0, 77 v B) Eºind Cl 2→Cl ‾ = 1, 36 v rx yaz, Epil=? ÇÖZÜM : 2 Fe 2+ (aq) +Cl 2 (g) → 2 Fe 3+(aq) + 2 Cl‾(aq) Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 36 + (-0, 77) = 0, 59 v. 41

Çözelti rx. larında Stokiyometri: Titrasyon • Titrasyon : Ayarlı çözelti ile tayin edilecek maddeyi belirtec (indikatör) yardımıyla reaksiyona sokma işlemidir. • Ekivalens Noktası: İndikatörün Dönüm Noktası (rx bitimi) • İndikator : rx sonunda belirgin şekilde renk değiştiren madde 42

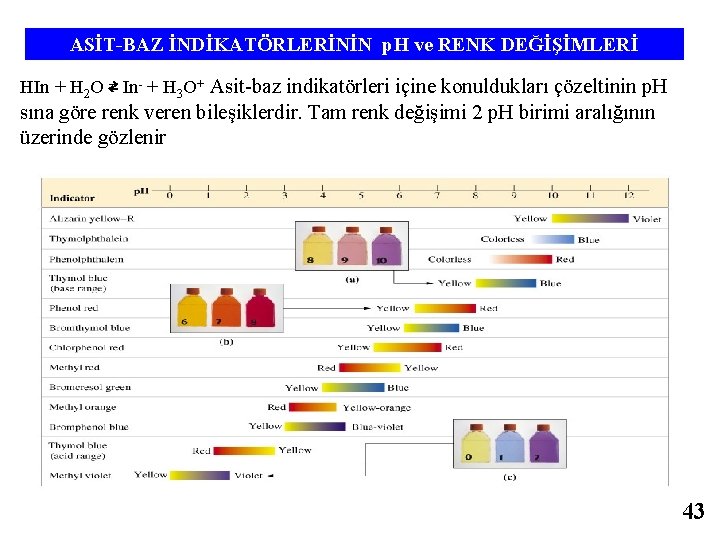
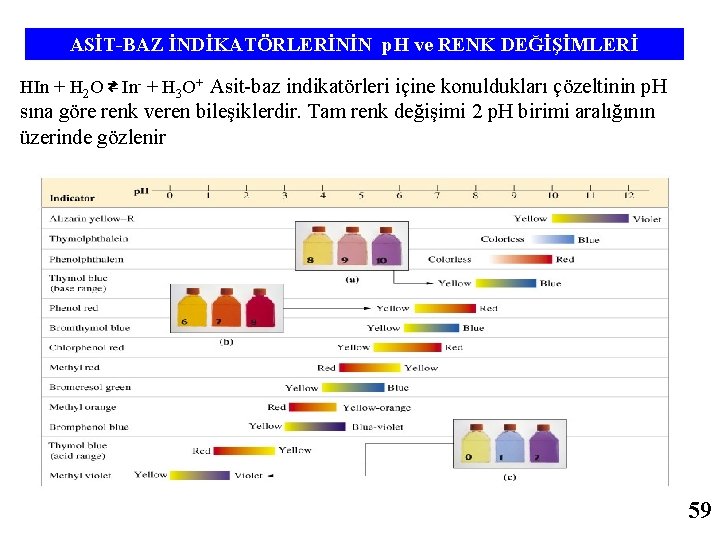
ASİT-BAZ İNDİKATÖRLERİNİN p. H ve RENK DEĞİŞİMLERİ HIn + H 2 O ⇄ In- + H 3 O+ Asit-baz indikatörleri içine konuldukları çözeltinin p. H sına göre renk veren bileşiklerdir. Tam renk değişimi 2 p. H birimi aralığının üzerinde gözlenir 43

ASİT/BAZ ORTAMDA DENKLEŞTİRME 17): SO 32 -(aq) + Mn. O 4 -(aq)→ SO 42 -(aq) + Mn 2+(aq) rx’unu asit/Baz ortamda denkleştiriniz. A) SO 32 -(aq)+H 2 O(s) →SO 42 -(aq) +2 H+(aq) +2 e- *5 Eo= - 0, 17 v B) B) Mn. O 4 -(aq) + 8 H+(aq)+5 e- → Mn 2+(aq) + 4 H 2 O(s) *2 Eo= + 1, 51 v Top. 5 SO 32 - (aq)+2 Mn. O 4 - (aq) +5 H 2 O(s)+16 H+ (aq)→ 5 SO 42 - (aq) +2 Mn 2+ (aq) +8 H 2 O (s) +10 H+ (aq) Asit. Ort. 5 SO 32 -(aq) + 2 Mn. O 4 -(aq) + 6 H+(aq) → 5 SO 42 - (aq) + 2 Mn 2+(aq) + 3 H 2 O(s) • YÜK DENGESİ için Önce Aé=Vé yapılır. A)’da Vé=2é, B)’de Aé=5é, olduğuna göre A* 5 ile B*2 yapılır. Sonuçda Sol tarafta -12 yük, Sağ tarafta (-10+4= - 6) yük olduğundan Asit Ort. için sola (+6 H+ ), H eşitliği için Asit ort. da sağa (+ 3 H 2 O)ilave edilir. • Baz Ort. isteniyorsa sağa (+6 OH - ), H eşitliğini sağlamak içinde sola (+ 3 H 2 O) ilave edilmelidir. Baz Ort. 5 SO 32 -(aq) + 2 Mn. O 4 -(aq) + 3 H 2 O(s) → 5 SO 42 - (aq) + 2 Mn 2+(aq) + 6 OH -(aq) • Eopil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 0, 17) = 1, 34 V>0 44

ASİT / BAZ ORTAMDA DENKLEŞTİRME 18) Toz halinde 6 g Al metalinden derişik kalevi çözeltisi içinde havadaki O 2 yardımıyla %90 verimle kaç g Lityum. Aluminat Li[Al(OH)4] oluşur reaksiyonunu yazıp eşitleyiniz. H=1, Li=3, Al=27, O=16…g/mol • CEVAP: • 2 Al +3/2 O 2 + 2 Li. OH + 3 H 2 O → 2 Li[Al(OH)4] • 2*27 2*[3+(27+4*17)]=196 • 6*0, 9=5, 4 g dan 19, 6*2=39, 2 g Li[Al(OH) ] oluşur. 4 • Benzer soru Zn+1/2 O 2 + 2 KOH + H 2 O → K 2[Zn(OH)4] reaksiyonu için sorulabilir. 45

ASİT/BAZ ORTAMDA DENKLEŞTİRME 19) Cl -( aq) → Cl. O 3 - (aq) , Mn. O 4 - (aq) → Mn 2+ (aq) yarım rx’ları Asit/Baz ort. birleştiriniz. A) Yük. : {Cl-(aq) + H 2 O(s) → Cl. O 3 - (aq)+ 6 H+(aq) +6 e- } * 5 E°Cl- / Cl. O 3 - = 1, 07 V B) İnd. : {Mn. O 4 - (aq) +8 H+(aq) +5é→ Mn+2(aq)+4 H 2 O(s) } * 6 EºMn. O 4 - →Mn 2+= 1, 51 V • Toplam rx 5 Cl- (aq) + 6 Mn. O 4 - (aq) + 48 H+ (aq) +5 H 2 O (s) → 5 Cl. O 3 - (aq) + 6 Mn+2 (aq) + 24 H 2 O (s) + 30 H+ (aq) • Asit Ort. Tp. Net: 5 Cl-(aq)+6 Mn. O 4 -(aq) +18 H+ (aq) → 5 Cl. O 3 -(aq) + 6 Mn+2 (aq) + 9 H 2 O(s) Eopil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 1, 07) = 0, 34 V>0 • Yük dengesi için Önce Aé=Vé yapılır. Vé=6é, Aé=5 olduğuna göre A*5 ve B*6 yapılır. Sağ tarafta + 7 yük, Sol tarafta (– 11) yük olduğundan • Asit Ort. için sola (+18 H+ ), H eşitliğini sağlamak için de sağa (+ 9 H 2 O) yazılır. Baz Ort. için sağa (+18 OH - ) , ve H eşitliği için de sola (+ 9 H 2 O) ilave edilmelidir. Baz Ort. Tp. Net: 5 Cl-(aq) + 6 Mn. O 4 - (aq)+ 9 H 2 O(s) → 5 Cl. O 3 -(aq) +6 Mn+2(aq) + 18 OH- (aq) 29. 11. 2020 01: 36 46

ASİT/BAZ ORTAMDA DENKLEŞTİRME 20) Fe 2+ → Fe 3+ + e‾ (Asit ortam) Eºsolyük = - 0, 77 V Mn. O 4‾+8 H+ + 5é → Mn 2+ +4 H 2 O (Asit ortam) Eoind= + 1, 51 V Asit Ort. da 5 Fe 2+aq+ Mn. O 4‾aq+ 8 H+→ 5 Fe 3+ + Mn 2+aq+4 H 2 O Baz Ort. da 5 Fe 2+aq+ Mn. O 4‾aq+ 4 H 2 O→ 5 Fe 3+ + Mn 2+aq+8 OH- • Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 0, 77) = 0, 74 V 21) Mo→Mo. O 4= ve Sb 2 O 5→ Sb. H 3 yarı rx. asit/baz ort. denkleştiriniz. ? • CEVAP)8/ Mo + 4 H 2 O → Mo. O 4= + 8 H+ + 6é - Eºyük = 0, 08 v • - 3/ Sb 2 O 5+ 16 H+ + 16 é → 2 Sb 3+H 3+ 5. H 2 O E ind =1, 77 v Asit Top. rx. 8 Mo+3 Sb 2 O 5 +17 H 2 O → 8 Mo. O 4= + 6 Sb. H 3 + 16 H+ olur. Yük dengesi ile denkleştirmek için önce Aé=Vé yapılır, Sağda -16 yük olduğundan Asit ort. için sağa (+16 H+), H dengesi için de sola +17 H 2 O ilave edilir. Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = 1, 77 + 0, 08 = 1. 85 v >0 Baz ort. için sola (+16 OH - ) ve H dengesi için de sola +H 2 O ilave edilmelidir. Baz Top. rx. 8 Mo+3 Sb 2 O 5 + H 2 O + 16 OH - → 8 Mo. O 4= + 6 Sb. H 3 olur. 47

ASİT/BAZ ORTAMDA DENKLEŞTİRME 22) : Mn. O 4 -(aq) → Mn. O 2(k) ve CN-(aq) → OCN-(aq) yarı rx larından Baz/Asit ortamda tam ve denk rx oluşturunuz. A) (Mn 7+O 4)-(aq)+2 H 2 O + 3é → Mn 4+O 2(k) + 4 OH - (aq) *2 Eºind = - 1, 695 v (C 2+N 3 - )- (aq) + 2 OH -(aq) → (O=C 4+N 3 - )- (aq) + H 2 O + 2 e- *3 Eºyük = - 1, 98 v B) 2(Mn. O 4)-(aq) + 4 H 2 O + 6 e- → 2 Mn. O 2(k) + 8 OH - (aq) 3 CN- (aq) + 6 OH - (aq) → 3 OCN- (aq) +3 H 2 O + 6 e-_______ C) 2 Mn. O 4 -(aq) + 3 CN- (aq) + 6 OH - (aq)+ 4 H 2 O + 6 e- → 2 Mn. O 2(k) + 8 OH – +3 OCN- (aq) +3 H 2 O + 6 e. Baz Ort. 2 Mn. O -(aq) + 3 CN-(aq) + H O → 2 Mn. O (k) +3 OCN -(aq) + 2 OH - (aq) 4 ind -Eº ind =Eº 2 ind + Eº 2 yük = -1, 695 + 1, 98 = 0, 285 V > 0 Epil=Eºsağ sol Yük dengesi ile denkleştirmek için. Önce Aé=Vé yapılır. Aé=3, Vé=2é olduğu için A*2, B*3 yapılır, Sonuçda Sol tarafta ise -5 yük, Sağ tarafta -3 yük olduğundan dengenin sağlanması için BAZ Ort. da sağa (+2 OH - ) ve H eşitliği için sola + H 2 O yaz. Asit Ort. İçin sola + 2 H+ , sağa + H 2 O yazılır. Asit Ort. 2 Mn. O 4 -(aq) + 3 CN-(aq) + 2 H+ (aq) → 2 Mn. O 2(k) +3 OCN -(aq) + H 2 O 48

ASİT/BAZ ORTAMDA DENKLEŞTİRME 23) a) Cr. O 4 = (aq) + S 2 O 4 = (aq) Cr(OH)3 (s) + SO 3 = (aq) rx bazik ortamda denkleştiriniz. b) 100 L atık su için [Cr. O 4 =] = 0, 0148 M içeren çözeltiye harcanacak Na 2 S 2 O 4 (174 g/n) kütlesi ne kadar olur? • CEVAP a) Cr+6 O 4=(aq) + 4 H 20 + 3é Cr+3(OH)3 + 5 0 H- (-2 -3é=X=- 5 OH-)olur Eºind = - 0, 13 v b) S 2+3 O 4=(aq)+4 0 H- 2 S 4+O 3 = (aq)+2 H 20 + 2é (-2 -X=-(2*2)-2 X=4 OH-olur Eºyük = - 2, 03 v 2 Cr. O 4=(aq) + 8 H 20 + 3 S 2 O 4=(aq)+12 0 H- 2 Cr(OH)3 + 10 0 H- + 6 SO 3=(aq) +6 H 2 O - Baz Ort. için 2 Cr. O 4=(aq) + 3 S 2 O 4=(aq) + 2 H 20 + 2 0 H 2 Cr(OH)3 + 6 SO 3=(aq) Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = -0, 13 + 2, 03 = 1, 9 V > 0 b) Na 2 S 2 O 4=174 g/n 1 L için 0, 0148 x 174 x 3/2=12, 528 g gerekli 100 L için 1252, 8 g gerekir. Yük dengesi ile denkleştirmek için. Önce Aé=Vé yapılır. Aé=3 Vé=2é olduğuna göre 2 ve 3 ile çarpılır. Sonuç da Sağ da tp (– 12) yük, solda ise ( - 10) yük olduğundan, Baz ort. için sola (+2 OH - ) yazılır denge için yine sola + 2 H 0 yazılmalıdır. 2 Asit ort. için sağa (+2 H+) yazılır ve denge için de sola + 4 H 20 yazılmalıdır. Asit Ort. için 2 Cr. O 4=(aq) + 3 S 2 O 4=(aq) + 4 H 20 2 Cr(OH)3 + 6 SO 3=(aq) + 2 H+ 49

ASİT/BAZ ORTAMDA DENKLEŞTİRME 24) Cr. I 3 (aq) + H 2 O 2 (aq) Cr. O 4 = (aq) + IO 4 - (aq) rx bazik ortamda denkleştiriniz. CEVAP a) Cr+3 I-3(aq) +32 OH- [Cr+6 O 4]=(aq+ 3 I 7+O 4 - +16 H 2 O +[3é +(3*8=)24é] *2 - Eºyük = 0, 13+1, 74=1, 87 v b) H 2 O-2 (aq) 2 O=H-(aq) + 2é olur *27 Aé=Vé için 2 a+27 b yapılıp toplanırsa Eºind = 0, 93 v Toplam rx 2 Cr. I +64 OH-+ 27 H O 2 Cr. O = + 6 IO - +32 H O+ 54 OH 3(aq) 2 2 (aq) 4 (aq) 4 2 (aq) - Baz Ort. 2 Cr. I 3(aq)+ 27 H 2 O 2 (aq) + 10 OH 2 Cr. O 4=(aq)+ 6 IO 4 - + 32 H 2 O olur. Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = 0, 93 + 1, 87 = 2, 8 V > 0 Yük dengesi ile denkleştirmek için Önce Aé=Vé yapılır. Vé=27é Aé=2 olduğuna göre uygun maddeler 2 ile ve 27 ile çarpılır. Sağ tarafta toplam -10 yük, sol tarafta herhangi bir( - ) yük olmadığı için dengenin sağlanması için BAZ Ort. da sola ( +10 OH- ) yazılır, H dengesi için de sağa + 32 H 2 O ilave edilir. Asit Ort. için sağa ( +10 H+ ) yazılır, H dengesi için de sağa + 22 H 2 O ilave edilir. - + Asit Ort. 2 Cr. I 3(aq)+ 27 H 2 O 2 (aq) 2 Cr. O 4=(aq)+ 6 IO 4 + 10 H + 22 H 2 O olur 50 / 81

ASİT/BAZ ORTAMDA DENKLEŞTİRME 25)Kandaki alkol (C H OH) miktarı, kan plazmasının Asit ortamda Cr 2 O 72 -aq) 2 5 ile titrasyonuyla bulunur. 28 g plazma için 26 m. L 0, 03 M. Cr 2 O 72 - (aq) çözeltisi sarf edildiğine göre, kandaki alkolün % nedir? Titrasyon rx Cr 2 O 72 -(aq)+ C 2 H 5 OH(aq) → Cr 3+(aq)+ CO 2(g) ➨CEVAP: Yük Dengesi ile 2 Cr 6+2 O 72 -(aq)+ C 2 -2 H 5 OH(aq) +16 H+ (± 12é) → 4 Cr 3+(aq)+ 2 C 4+O 2(g)+ 11 H 2 O Solda -4 yük, Sağda +12 yük var ASİT Ort. da Yük Dengesi için sola +16 H+, sağa +11 H 2 O BAZ Ort. İçin de sağa +16 OH- sola + 5 H 2 O yazılırsa, Yük ve madde dengesi oluşur. Et. Al=0, 03*26*10 -3*(1/2)*46*(100/28) =0, 069 %Et. Al m YARI REAKSİYON YÖNTEMİ Asit Ortamda İLE DENKLEŞTİRME : 2/ Cr 6+2 O 72 -(aq)+ 14 H+ +6é → 2 Cr 3+(aq)+ 7 H 2 O Eºind = 1, 33 v C 2 -2 H 5 OH(aq+ 3 H 2 O → 2 C 4+O 2(g) +12 H+ +12é - Eºyük = 0, 24 v 2 Cr 6+2 O 72 -(aq)+ C 2 -2 H 5 OH(aq) + 16 H+ (± 12é) → 4 Cr 3+(aq)+ 2 C 4+O 2(g)+ 11 H 2 O YARI REAKSİYON YÖNTEMİ Baz Ortamda İLE DENKLEŞTİRME : 2 Cr 6+2 O 72 -(aq)+ C 2 -2 H 5 OH(aq) )+ 5 H 2 O (± 12é) → 4 Cr 3+(aq)+ 2 C 4+O 2(g+ 16 OH- Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = 1, 33 + 0, 24 = 1, 57 V > 0 51

ASİT/BAZ ORTAMDA DENKLEŞTİRME 26) Sınav için rx. lar ham haliyle verilir. Kırmızı yazılar sizin yapmanız gereken kısımdır. Açıkca görüldüğü gibi A rx yük. , B ve C rx. ları ind. dir. Önce yarı rx. lar denk hale getirilir ve sonra olabilecek denk ve tam rx yazılır. A) 2 I-→ I 2+2é için Eº = 0, 84 v (Yük) B) 2é +2 H+ + SO 4=→ SO 3= + H 2 O için Eo = - 0, 46 (İnd) C) 8é +8 H++ SO 4=→ S= + 4 H 2 O için Eo = - 0, 14 v (İnd) A, B, C yarı rx’ları Asit ortamda olabilecek denk ve tam rx haline getirmek için Aé=Vé denkliği sağlanmalıdır. Bunun içinde A rx 5 ile çarpılır ve toplanırsa denk ve tam rx. elde edilir. Son haliyle 5 A+B+C toplamı rx • 10 I- + 2 SO = + 10 H + → SO = + S = + 5 I + 5 H 0 4 • 3 2 2 Eopil= 0, 84 + ( - 0, 46 – 0, 14) = 0, 24 v >0 olup rx. olabilir. 52

Çözelti Denge Hesaplarına Genel Bir Yaklaşım • Çözeltide bulunan tüm türleri belirleyiniz (Su molekülleri hariç). • Bu türleri içeren eşitlikleri yazınız. • Denge sabiti ifadeleri • Kütle denkliği eşitlikleri • Yük denkliği koşulu • Eşitlikleri bilinmeyenler için çözünüz. 53

Asit-Baz Hesaplamaları Asit-Baz karışımlarına ait hesaplamalarda özellikle şunlara dikkat edilmelidir: • 1 - Çözeltide hangi tür iyonlar önemlidir ve derişimleri nedir? Örneği HCl+HA karışımında H+, Cl -, HA ve A- bulunur. Burada en önemli olan HCl den gelen H+ miktarı olup ortamı o belirler. HA iyonlaşması ortak iyon etkisiyle azaldığı için HA’dan gelen H+ rahatça ihmal edilebilir düzeydedir. • 2 -Çözeltide bulunan türler arasında herhangi bir tepkime söz konusu ise buna dikkat edilmesi gerekir ve sonuç tepkime neticesinde ortamın durumuna ve etkin olacak türe göre hesaplanır. • 3 - rx neticesinde ortam nedir? Kuv. Asit mi? Kuv. Baz mı ? , Zayıf Asit mi? , Zayıf Baz mı ? , Asidik Tuz mu? , Bazik Tuz mu ? Nötral mi ? Amfoter mi ? Tampon mu? Mutlaka Doğru belirlenmeli ve ona göre hesaplama yolu seçilmelidir. Asidin etkin olduğu karışımlarda [H+] , azın etkin olduğu karışımlar da ise [OH -] hesaplandığını Asit Ortamda p. H<7 , • Baz ortamda p. H>7 olduğunu unutmamak gerekir. 54

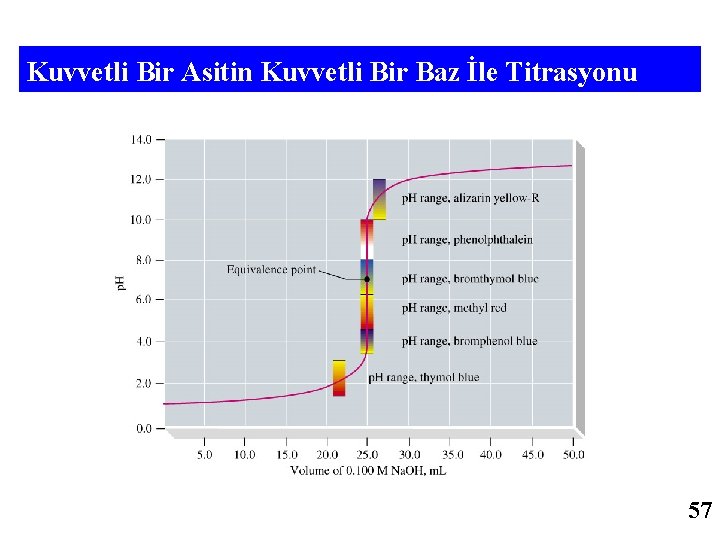
ASİT VEYA BAZLARIN TİTRASYON EĞRİLERİ 27. Kuvvetli Bir Asidin Kuvvetli Bir Bazla Titrasyonu Asit baz titrasyonlarında hesaplanması gereken dört temel nokta vardır. A- Başlangıç p. H sı , B- EKİVALENS (Eşdeğerlik) noktasından önceki hesaplar, C- Ekv. Nok. Hesapları, D- Ekv. Nok. dan sonraki hesaplar Örnek : A- 100 m. L 0, 025 M HCl asidin 0, 050 M Na. OH ile titrasyonu sonucunda oluşacak titrasyon eğrisinin çizilmesi Başlangıçta asit üzerine hiç baz eklenmediğinde ortamın p. H’ı direk asidin p. H’ına eşittir. p. H = -log[H 3 O+] = -log 0, 025 = 1, 60 B- 25 m. L Na. OH eklendiği zaman (Eşdeğerlik noktasından önce) Asit üzerine baz eklendiğinde, eklenen baz asidin bir kısmını nötralleştirecektir. Böylelikle ortamdaki asit derişimi azalacaktır. Kalan asidin derişimide direk ortamın p. H’sına eşit olacaktır. Diğer dikkat edilmesi gereken konu ise çözeltinin son hacminin değiştiğidir. Bunun için asidin mol sayısı bulunarak (M x V) toplam hacme (L) bölünerek son derişim bulunur. [HCl] = (0, 1 x 0, 025 – 0, 025 x 0, 050) / 0, 1+0, 025 = 0, 01 p. H = -log 0, 01= 2 55
![C 50 m L Na OH Ekv Nok HCl 0 1 C- 50 m. L Na. OH (Ekv. Nok. ) [HCl] = (0, 1](https://slidetodoc.com/presentation_image_h/ba15f3877301c4bc480f9839b8aa04d9/image-56.jpg)
C- 50 m. L Na. OH (Ekv. Nok. ) [HCl] = (0, 1 x 0, 025– 0, 050 x 0, 050)/ 0, 1+0, 050 [HCl] = 0 Buda asit baz konsantrasyonlarının o anda eşit olduğunu gösterir. Ortam nötrdür. Ksu=[H 3 O+]x[OH-] [H 3 O+] =√ Ks [H 3 O+] = √ 1 x 10 -14 = 1 x 10 -7 p. H = 7 olur. D - 75 m. L Na. OH (Eşd. Nok. dan sonra) Eklenen baz, asitten fazla olduğu için bütün asit nötrleşir ve ortamda sadece baz kalır. [Na. OH] = (0, 075 x 0, 050– 0, 10 x 0, 025)/ 0, 1+0, 075 = 0, 0071 p. OH= 2, 15 p. H = 11. 85 Aynı mantık ve kurallar kuvvetli bir bazın kuvvetli bir asitle titrasyonunda da geçerlidir. Sadece başlangıçta ortam bazik olacak ve asit eklendikçe ortamdaki bazın derişimi eklenen asit kadar azalacaktır. 29. 11. 2020 01: 37 56

Kuvvetli Bir Asitin Kuvvetli Bir Baz İle Titrasyonu 57

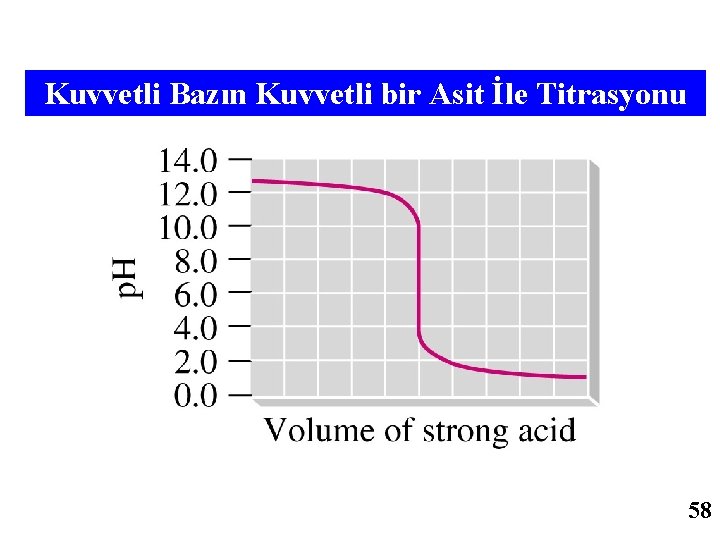
Kuvvetli Bazın Kuvvetli bir Asit İle Titrasyonu 58

ASİT-BAZ İNDİKATÖRLERİNİN p. H ve RENK DEĞİŞİMLERİ HIn + H 2 O ⇄ In- + H 3 O+ Asit-baz indikatörleri içine konuldukları çözeltinin p. H sına göre renk veren bileşiklerdir. Tam renk değişimi 2 p. H birimi aralığının üzerinde gözlenir 59

Kimyasal Yapı ve Asit-Baz İlişkisi Asitler ve bazlar birbirleriyle kolay rx verebilmeleri dolayısıyla tüm rx verebilen maddeler birbirlerine karşı asit ve baz karekterleriyle belirlenebilir dolayısıyla Asitliğin bazlarla rx sonucu pozitif karekteri azalır, bazlıkta ise negatif karekterde azalma olur. Böylece MO (Metal. Oksit)lerin asitliği ve bazlığı, Aminlerin bazlığı, Oksiasitlerin asitliği, M’nin elektronegatifliği ile asitliğinin artması, Yükseltgenme Basamağı ve Formal Yük ile asitliğin artması, poliasitlerde asitliğin gittikçe azalması, M’nin r’nın değişiminin asitliği bazen artırıp bazen azaltması gibi özellikler yapıyla asitbaz ilişkisini gösterir 60

ASİTLİK GÜCÜ Ka değeri ve Asitlik gücü p. Ka< -10 Süper Asit - p. Ka< -8 Çok Kuvvetli Asit - p. Ka<2 Kuvvetli Asit- p. Ka>2 Zayıf. Asit - p. Ka>7 Çok Zayıf Asit. Süperasitler, H 2 SO 4 den daha kuvvetlidir. Kuvvetli asitlerin (HF) protonlanması ile elde edilir. 2 HF + 2 Sb. F 5 H 2 F+ + Sb 2 F 11 - (Floroantimonik asit) Ho=Hammet Asitliğine göre Oksijen sayısı arttıkça, asitlik gücü artar. HCl. O 4 > HCl. O 3 > HCl. O 2 > HCl. O Ametalin elektronegatifliği arttıkça asitlik artar. H 2 SO 4 > H 2 Se. O 4 > H 2 Te. O 4 61

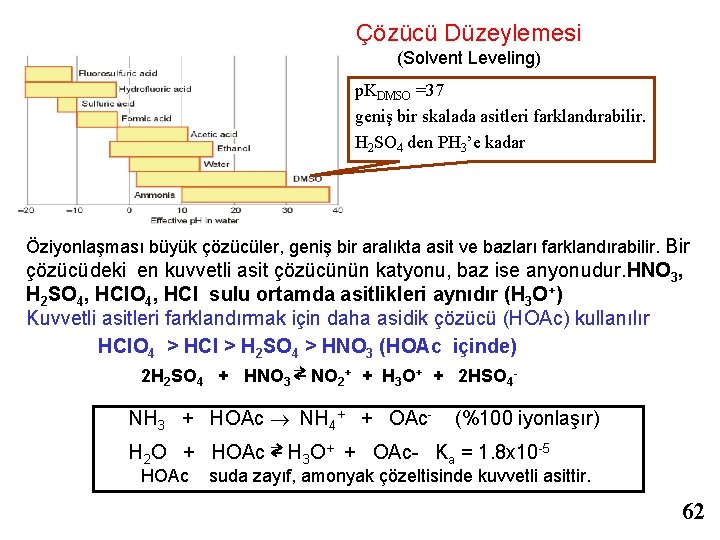
Çözücü Düzeylemesi (Solvent Leveling) p. KDMSO =37 geniş bir skalada asitleri farklandırabilir. H 2 SO 4 den PH 3’e kadar Öziyonlaşması büyük çözücüler, geniş bir aralıkta asit ve bazları farklandırabilir. Bir çözücüdeki en kuvvetli asit çözücünün katyonu, baz ise anyonudur. HNO 3, H 2 SO 4, HCl sulu ortamda asitlikleri aynıdır (H 3 O+) Kuvvetli asitleri farklandırmak için daha asidik çözücü (HOAc) kullanılır HCl. O 4 > HCl > H 2 SO 4 > HNO 3 (HOAc içinde) 2 H 2 SO 4 + HNO 3 ⇄ NO 2+ + H 3 O+ + 2 HSO 4 - NH 3 + HOAc NH 4+ + OAc- (%100 iyonlaşır) H 2 O + HOAc ⇄ H 3 O+ + OAc- Ka = 1. 8 x 10 -5 HOAc suda zayıf, amonyak çözeltisinde kuvvetli asittir. 62

SUSUZ OKSİTLER 1. Asidik Oksitler- Ametal Oksitler CO 2 + H 2 O H 2 CO N 2 O 5 + H 2 O 2 HNO 3 SO 3 + H 2 O H 2 SO 4 Yağmur suyu asidikti 2. Bazik Oksitler-Metal Oksitler Na 2 O + H 2 O 2 Na. OH Mg. O + 2 H 3 O+ Mg 2+ + 3 H 2 O (Mg. O asidik ortamda çözünür) 3. Amfoter oksitler Al 2 O 3(k) + 3 H 2 O + H 3 O+(aq) 2[Al(OH 2)6]3+(aq) Al 2 O 3(k) + 3 H 2 O + 2 OH-(aq) 2[Al(OH)4]-(aq) Katyonların çapı küçüldükçe ve yükü büyüdükçe asitlik gücü artar. Alkali metaller asit değildir. Toprak alkali metaller zayıf asittir. 2+ geçiş elementleri zayıf asittir. 3+ geçiş elementleri kuvvetli asittir. 4+ ve daha yüksek metaller çok kuvvetli asittir. (Mx. Oy) BX 3 Lewis Asitliği Gözlenen sıralama BF 3 < BCl 3 < BBr 3 Beklenen sıralama (Elektronegatiflik ve sterik etkiye göre ) BF 3 > BCl 3 > BBr 3 Organik Aminlerin BAZLIĞI yapı simetrikleştikçe azalır. Antisimetrik yapılarda Bazlık daha Kuvvetlidir. 63

Oksiasitlerin Kuvvetleri • Oksitlerin bağıl kuvvetlerini belirleyebilmek için, O-H bağı elektronlarının merkez atomuna doğru çekilmesini inceleyelim: – Merkez atomun elektronegatifliği(EN) – Asit molekülündeki O atomlarının sayısı. H-O-Cl H-O-Br ENCl = 3. 0 ENBr= 2. 8 Ka = 2. 9 10 -8 Ka = 2. 1 10 -9 64


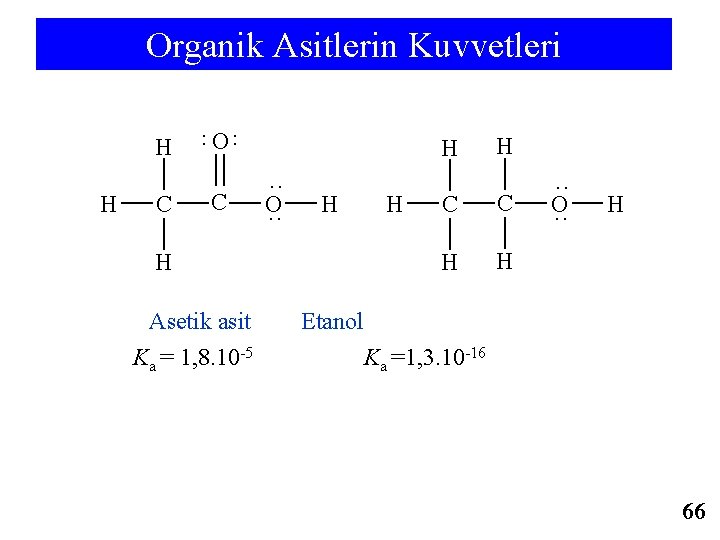
Organik Asitlerin Kuvvetleri H C O ·· ·· H C H ·· O ·· H H Asetik asit Ka = 1, 8. 10 -5 H H C C H H ·· O ·· H Etanol Ka =1, 3. 10 -16 66

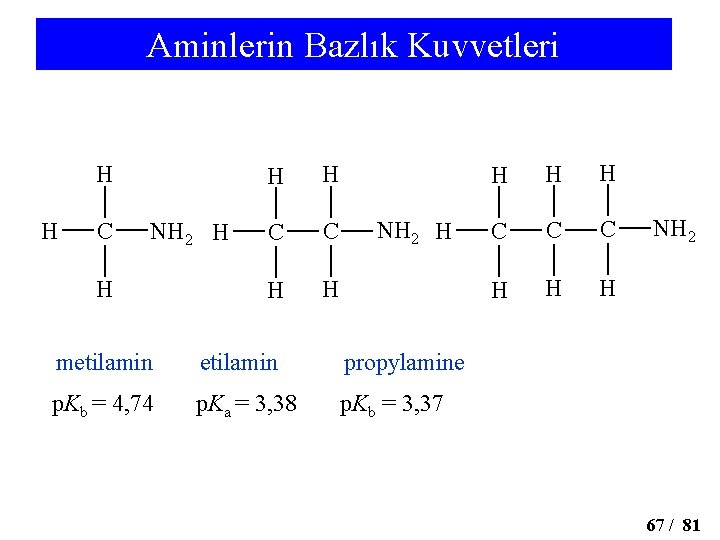
Aminlerin Bazlık Kuvvetleri H H C NH 2 H H C C H H NH 2 H metilamin propylamine p. Kb = 4, 74 p. Ka = 3, 38 p. Kb = 3, 37 H H H C C C H H H NH 2 67 / 81

KONU: 17’de ÇÖZÜLMESİ TAVSİYE EDİLEN SORULAR Öncelikle konu içinde verilmiş olan 1 adedi çözülmüş 2 adedi çözülecek örnek sorular üzerinde titizlikle durulması tavsiye edilir. Sınav soruları genellikle onlardan seçilecektir. Konunun daha iyi anlaşılması açısından konunun sonunda yer alan aşağıdaki sorulara da bakılırsa iyi olur. 9 -12 -14 -17 -19 -31 -35 -39 -4145 -49 -51 -57 -61 -65 -69 -7173 -75 - 83 -105 -106 29. 11. 2020 01: 37 GK-II K. 17 68 / 81
 Kısmi basınç
Kısmi basınç Kuantum sayıları çıkmış sorular
Kuantum sayıları çıkmış sorular Alan petrucci
Alan petrucci Petrucci
Petrucci Petrucci
Petrucci Organik kimya adlandırma öncelik sırası
Organik kimya adlandırma öncelik sırası Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Doug harwood
Doug harwood Insan ilişkileri yaklaşımı nedir
Insan ilişkileri yaklaşımı nedir Crusher hire harwood
Crusher hire harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Gwen harwood selected poems
Gwen harwood selected poems Joe harwood
Joe harwood Leigh harwood
Leigh harwood 1 metil siklobüten
1 metil siklobüten Organik kimya homolog sıra
Organik kimya homolog sıra Uç alkin
Uç alkin Sabun ve deterjan kimya
Sabun ve deterjan kimya Alkanların yer değiştirme tepkimeleri
Alkanların yer değiştirme tepkimeleri Ideal gaz denklemi
Ideal gaz denklemi Cis trans izomeri nedir
Cis trans izomeri nedir Molekülerite tepkime derecesi
Molekülerite tepkime derecesi Meltem kimya akhisar
Meltem kimya akhisar Kimya artan madde problemleri
Kimya artan madde problemleri Heterojen nedir
Heterojen nedir Yaygın bileşikler ve formülleri
Yaygın bileşikler ve formülleri Ersağ kazanç tablosu
Ersağ kazanç tablosu Can kimya
Can kimya Dibor tetra bromür formülü
Dibor tetra bromür formülü Pteridin halkası
Pteridin halkası Adi karışım nedir
Adi karışım nedir Organik kimya solomon ders notları
Organik kimya solomon ders notları 2al(k) + 6hcl(suda) →2alcl3(suda) + 3h2(g)
2al(k) + 6hcl(suda) →2alcl3(suda) + 3h2(g) üniform korozyon
üniform korozyon Entropi kimya
Entropi kimya Kir nedir nasıl temizlenir
Kir nedir nasıl temizlenir Kimya nedir
Kimya nedir Analitik kimya nedir
Analitik kimya nedir Normal koşullarda sıcaklık
Normal koşullarda sıcaklık Kimyasal uyarı işaretleri
Kimyasal uyarı işaretleri Bileşik nedir kimya
Bileşik nedir kimya Derişim pilleri
Derişim pilleri Anlamlı rakamlar kimya
Anlamlı rakamlar kimya Froma kimya
Froma kimya Froma kimya
Froma kimya Ber kimya
Ber kimya Terahertz spectroscopy principles and applications
Terahertz spectroscopy principles and applications Sport management principles and applications
Sport management principles and applications Principles and applications of electrical engineering
Principles and applications of electrical engineering Allan
Allan Learning principles and applications
Learning principles and applications Principles of network applications in computer networks
Principles of network applications in computer networks Principles of network applications
Principles of network applications Yetenek testleri
Yetenek testleri Tapu kadastro genel m?d?rl?g?
Tapu kadastro genel m?d?rl?g? Varyans analiz tablosu
Varyans analiz tablosu Genel muhasebe borç alacak kavramı
Genel muhasebe borç alacak kavramı Finansal durum tablosu
Finansal durum tablosu Genel kuvvet nedir
Genel kuvvet nedir Karboksil grubu
Karboksil grubu Sikloalkan genel formül
Sikloalkan genel formül 327 sıra sayılı milli emlak genel tebliği
327 sıra sayılı milli emlak genel tebliği Genel muhasebe borç alacak kavramı
Genel muhasebe borç alacak kavramı Belirtke tablosu örneği
Belirtke tablosu örneği Doğru yanlış testlerinin avantaj ve dezavantajları
Doğru yanlış testlerinin avantaj ve dezavantajları Birleşik cevap gerektiren maddeler
Birleşik cevap gerektiren maddeler Mekansal planlama genel müdürlüğü
Mekansal planlama genel müdürlüğü Banka muhasebesi ve genel muhasebe arasındaki farklar
Banka muhasebesi ve genel muhasebe arasındaki farklar Aldehit
Aldehit