Genel Kimya lkeler ve Modern Uygulamalar Petrucci Harwood




























- Slides: 30

Genel Kimya İlkeler ve Modern Uygulamalar Petrucci • Harwood • Herring Bölüm 4: Kimyasal Reaksiyonlar Slide 1 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Konular 4 -1 4 -2 Kimyasal Reaksiyonlar ve Kimyasal Denklemler ve Stokiyometri 4 -3 Çözeltilerdeki Kimyasal Reaksiyonlar 4 -4 4 -5 Sınırlayıcı Bileşenin Belirlenmesi Reaksiyon Stokiyometrisinde diğer konular Slide 2 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

4 -1 Kimyasal Reaksiyonlar (Tepkimeler) ve Kimyasal Denklemler Bir kimyasal tepkimede tepkenlerin ürünlere dönüşümü esnasında: –Renk değişimi –Çökelek oluşumu –Gaz çıkışı –Isı salınması yada soğurulması Gibi kimyasal değişimlerin gözlenmesine ihtiyaç vardır Slide 3 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Kimyasal Denklemler Tepkenler Ürünler Tepkimeye giren Maddelerin halleri (k) katı (s) sıvı (g) gaz (aq) sulu çözeltide 2 H 2 (g) + O 2 (g) Slide 4 of 29 General Chemistry: Chapter 4 2 H 2 O (g) Prentice-Hall © 2002

Kimyasal Tepkimeler Azot monoksit + oksijen → Azot dioksit Basamak 1: Kimyasal semboller kullanılarak tepkimenin yazılması. Basamak 2: Kimyasal denklemin denkleştirilmesi. 2 NO(g) + 1 O 2(g) → Slide 5 of 29 2 NO 2(g) General Chemistry: Chapter 4 Prentice-Hall © 2002

Denklem Denkleştirmeler • Asla denklem dışı formüller veya atomlar ilave edilmemelidir. NO + O 2 → NO 2 + O • Denklemi denkleştirmek için formüller değiştirilmemelidir. NO + O 2 → NO 3 Denkleştirilmiş eşitlikte, her iki taraftaki atom sayıları birbirine eşittir. Slide 6 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Denlem Denkleştirme • Denlemin her iki tarafında birer bileşikte aynı element mevcutsa önce onu denkleştirin. • Serbest elementleri en son denkleştirin. • Değişmeden kalan çoklu atom gruplarını değiştirmeden denkleştirin. • Katsayılar tam sayı ya da kesirli sayılarla denkleştirilebilir, kesirli sayılardan kurtarabilmek için belirli bir çarpan kullanılabilir. Slide 7 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Örnek Bir eşitliğin yazılıp denkleştirilmesi; karbon-hidrojenoksijen içeren bir bileşiğin yanması. Sıvı trietilenglikol, C 6 H 14 O 4, vinil ve poliüretan plastikleri için çözücü olarak kullanılır. Bu bileşiğin tam yanmasına ait denklemi yazıp denkleştiriniz. Trietilenglikol Slide 8 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Örnek Kimyasal Denklem: C 6 H 14 O 4 + 15 O 2 → 6 CO 2 + 7 H 2 O 2 C 6 H 14 O 4 + 1. C Eşitliği. O 2 → 6 CO 2 + 2. H Eşitliği 3. O Eşitliği 4. 2 ile çarpın C 6 H 14 O 4 + H 2 O O 2 → 6 CO 2 + 7 H 2 O 15/2 O 2 → 6 CO 2 + 7 H 2 O 2 C 6 H 14 O 4 + 15 O 2 → 12 CO 2 + 14 H 2 O Bütün elementleri kontrol ediniz. Slide 9 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Kimyasal Denlemler ve Stokiyometri • Stokiyometri formüller ve kimyasal denklemlerle ilgili tüm sayısal ilişkileri içerir. • Mol oranları stokiyometrik çevrimi faktörleri olarak kullanılabilir Slide 10 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Örnek Tepken ve ürünlerin mol sayıları arasındaki ilişki. 2. 72 mol H 2 nin fazla miktardaki O 2 ile yakılması sonucunda kaç mol H 2 O oluşur? Kimyasal Denklemi yazın Denklemi denkleştirin: 2 H 2 + O 2 → 2 H 2 O Denklemdeki mole oranlarını veya sitokiyometrik faktörü kullanın: n. H 2 O = 2. 72 mol H 2 × 2 mol H 2 O = 2. 72 mol H 2 O 2 mol H 2 Slide 11 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Örnek Sitokiyometrik hesaplamalarda hacim, yoğunluk ve yüzde bileşim gibi ilave dönüşüm faktörlerinin kullanılması. Uçak yapımında kullanılan bir alaşım kütlece 93. 7% Al ve 6. 3% Cu içeriyor. Bu alaşımın yoğunluğu 2. 85 g/cm 3 tür. 0. 691 cm 3 alaşım parçası aşırı miktarda HCl(aq) ile tepkimeye giriyor: Eğer Cu nun tepkimeye girmediği aluminyumun tamamının HCl ile tepkimeye girdiği varsayılırsa elde edilen H 2(g) nin kütlesini hesaplayınız ? Slide 12 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

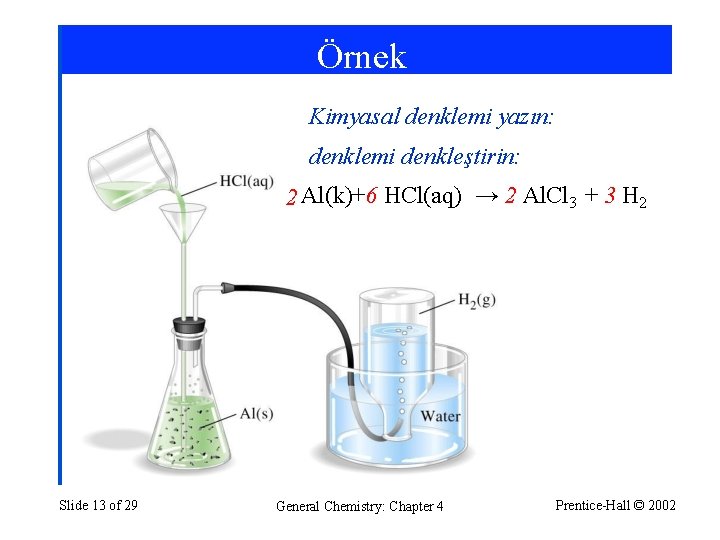
Örnek Kimyasal denklemi yazın: denklemi denkleştirin: 2 Al(k)+6 HCl(aq) → 2 Al. Cl 3 + 3 H 2 Slide 13 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Örnek 2 Al + 6 HCl → 2 Al. Cl 3 + 3 H 2 Yöntem: cm 3 alloy → g Al → mole Al → mol H 2 → g H 2 5 tane çevrim faktörüne ihtiyaç var! Denklemi yazın ve hesaplayın 97. 3 g Al m. H 2 = 0. 691 cm 3 alaşım × 2. 85 g alaşım × × 3 100 g alaşım 1 cm 1 mol Al × 3 mol H 2 × 2. 016 g H 2 26. 98 g Al 2 mol Al 1 mol H 2 Slide 14 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Çözeltide Kimyasal Tepkimeler • Çözelti içinde tepkenlerin karıştırılarak atomlar, iyonlar ve moleküller arasında tepkime için gerekli yakın temas sağlanır • Çözücü – Çoğunlukla sulu çözeltiler kullanılırı bunlar (aq) ile gösterilirler. Bu çözeltilerde çözücü su dur. • Çözünen – Çözücüde çözünen maddeye denir. Slide 15 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Molarite (M) = M= Çözünen maddenin mol sayısı Çözeltinin Toplam hacmi (L) n V Eğer 0. 444 mol CO(NH 2)2 üre sulu çözeltinin 1, 000 sinde çözünmüşse, çözeltinin molarite olarak derişimi curea = 0. 444 mol urea = 0. 444 M CO(NH 2)2 1. 000 L Slide 16 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Çözeltinin Hazırlanması Katı örneği tartın. Bir kısmı çözücü ile doldurulmuş işaretli balon şişe içerisinde çözünür. İşaretli yere kadar balon doldurulur. Slide 17 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Örnek Bilinen molarite deki çözeltide çözünenin kütlesinin hesaplanması. . 0. 2500 L (250 m. L), 0. 250 M K 2 Cr. O 4 çözeltisi hazırlamak için kaç gram K 2 Cr. O 4 gereklidir. Plan stratejisi: Hacim → mol → kütle İki tane çevirme faktörüne ihtiyaç var! Denklemi yazıp hessaplayın: 194. 02 g m. K 2 Cr. O 4 = 0. 2500 L × 0. 250 mol× 1. 00 L 1. 00 mol = 12. 1 g Slide 18 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

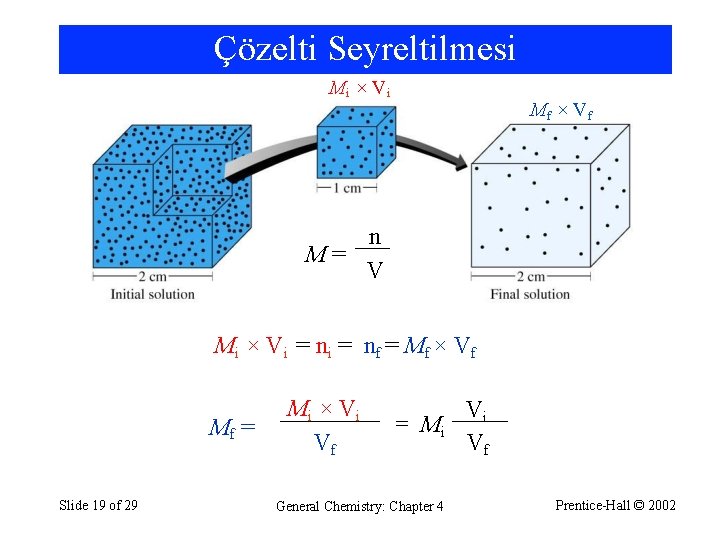
Çözelti Seyreltilmesi Mi × V i Mf × V f n M= V Mi × Vi = nf = Mf × Vf Mf = Slide 19 of 29 Mi × V i Vf = Mi General Chemistry: Chapter 4 Vi Vf Prentice-Hall © 2002

Örnek Seyreltme yaparak çözelti hazırlanması Analitik kimyanın bir deneyinde 0. 0100 M K 2 Cr. O 4 çözeltisi gereklidir. 0. 250 L of 0. 0100 M lık K 2 Cr. O 4 çözeltisini hazırlamak için 0. 250 M K 2 Cr. O 4 çözeltisinden ne kadar kullanmak gerekir ? Vi Mf Mf = Mi Vi = Vf Vf Mi 1. 000 L = 0. 0100 L VK 2 Cr. O 4 = 0. 2500 L × 0. 0100 mol × 0. 250 mol 1. 00 L Slide 20 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

4 -4 Sınırlayıcı Bileşenin Belirlenmesi • Tepkime sırasında tamamen tükenen bileşiğe sınırlayıcı bileşen denir. Oluşan ürünlerin miktarlarını belirler. Slide 21 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Sınırlayıcı Bileşen Problemleri a. A + b. B + c. C d. D + e. E + f F Çözüm Basamakları: • Problemin Sınılayıcı Bileşen problemi olduğunun anlaşılması- problemde birden fazla tepken için kütle, molarite, hacim vb. olarak madde miktarının verilmesi durumu. • Her tepkenin mol miktarlarını hesaplayın! • Elde edilen mol miktarlarını eşitlikteki katsayılara bölün (a, b, c vs. )! • Hangi tepken için elde edilen sayı daha küçükse o tepken sınırlayıcı bileşiktir! • Sınırlayıcı bileşiğin mol miktarını kullanarak ürünlerin ve fazla miktardaki diğer tepkenlerin mol miktarlarını hesaplayın. Bu mol miktarlarından istenilen birimlere (kütle, hacim, mol, atom sayısı vs. ) ulaşın. Slide 22 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Sınırlayıcı Bileşen Problemi Problem: Roketçiliğin ilk zamanlarında yakıt olarak iki sıvı madde olan hidrazin (N 2 H 4) ve diazot tetroksit (N 2 O 4) den oluşan bir karışım kullanılmaktaydı. Bu maddeler birbiriyle temas ettiğinde yanarak azot gazı ve su buharı oluştururlar. Tam olarak 1. 00 x 102 g N 2 H 4 ve 2. 00 x 102 g N 2 O 4 karıştırıldığında kaç gram azot gazı açığa çıkar? Plan: İki tepken bileşiğin de miktarları verildiğinden sınırlayıcı bileşiğin bulunmasını gerektiren bir problem ile karşıyayız Herbir tepkenin mol miktarlarını hesaplayın. Eşitliği yazıp denkleştirdikten sonra elde edilen bu mol miktarlarını eşitlikteki katsayılara bölün ve sınırlayıcı bileşeği bulun. Sınırlayıcı bileşiğin mol sayısı ve kimyasal eşitlikteki oranları kullanarak azotun mol sayısını ve bundan da kütlesini hesaplayın. 2 N 2 H 4 (s) + N 2 O 4 (s) Slide 23 of 29 3 N 2 (g) + 4 H 2 O (g) + Energy General Chemistry: Chapter 4 Prentice-Hall © 2002

Sınırlayıcı Bileşen Problemi mol kütlesi N 2 H 4 = ( 2 x 14. 01 + 4 x 1. 008 ) = 32. 05 g/mol kütlesi H 2 O 4 = ( 2 x 14. 01 + 4 x 16. 00 ) = 92. 02 g/mol 1. 00 x 102 g Mol # N 2 H 4 = = 3. 12 mol N 2 H 4 32. 05 g/mol 2. 00 x 102 g Mol# N 2 O 4 = 92. 02 g/mol = 2. 17 mol N 2 O 4 Katsayılarla bölün Oluşan Azot= 3. 12 mol / 2 = 1. 56 mol N 2 H 4 2. 17 mol / 1 = 2. 17 mol N 2 O 4 3 mol N 2 3. 12 mol N 2 H 4 x 2 mol N H 2 4 Sınırlayıcı ! = 4. 68 mol N 2 Azotun Kütlesi = 4. 68 mol N 2 x 28. 02 g N 2 / mol = 131 g N 2 Slide 24 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Asit - Metal Sınırlayıcı Bileşik-I • 2 Al(k) + 6 HCl(g) 2 Al. Cl 3(k) + 3 H 2(g) • 30. 0 g Al ve 20. 0 g HCl reaksiyona girdiğinde kaç mol Aluminyum Klorür oluşur? • 30. 0 g Al / 26. 98 g Al/mol Al = 1. 11 mol Al • 1. 11 mol Al / 2 = 0. 555 • 20. 0 g HCl / 36. 5 g. HCl/mol HCl = 0. 548 mol HCl • 0. 548 mol HCl / 6 = 0. 0913 • Öyleyse HCl sınırlayıcı bileşiktir ! Slide 25 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002

Asit - Metal Sınırlayıcı Bileşik-II • 6 mol HCl den 2 mol Al. Cl 3 oluşursa • 0. 548 mol HCl den: • (0. 548 mol HCl / 6 mol HCl )x 2 mol of Al. Cl 3 = 0. 183 • mol Al. Cl 3 Slide 26 of 29 General Chemistry: Chapter 4 Prentice-Hall © 2002


4 -5 Tepkime Stokiyometrisinde Diğer Konular Kuramsal (Teorik) verim= bir kimyasal tepkimede oluşan ürünlerin hesaplanarak bulunan miktarına denir. Gerçek verim= Gerçekte oluşan ürün miktarı. % Verim = Slide 28 of 29 Gerçek Verim × Kuramsal 100% Verim General Chemistry: Chapter 4 Prentice-Hall © 2002

% Verim / Sınırlayıcı Bileşen Problemi - I Problem: Haber Prosesi denilen bir proses kullanılarak azot ve hidrojen gazlarından amonyak elde edilir. 85, 90 g of azot 21, 66 g Hidrojen ile tepkimeye girdiğinde 98, 67 g amonyak oluşuyorsa tepkimenin % verimi nedir? N 2 (g) + 3 H 2 (g) 2 NH 3 (g) Plan: Her iki tepkenin de miktarları verildiğinden bu bir sınırlayıcı Bileşik problemidir. Önce sınırlayıcı bileşik bulunduktan sonra kuramsal verim ve daha sonra da % verim hesaplanır. . Cevap: Azot ve Hidrojenin mol miktarları: Katsayı ile bölün: 85. 90 g N 2 mol N 2 = = 3. 066 mol N 2 3. 066 g N 2 28. 02 g/mol N 2 = 3. 066 1 21. 66 g H 2 mol H 2 = =10. 74 mol H 2 2. 016 g/mol Slide 31 of 29 10. 74 g H 2 3. 582 3 Prentice-Hall=© 2002

% Verim / Sınırlayıcı Bileşen Problemi - I N 2 (g) + 3 H 2 (g) 2 NH 3 (g) Sınırlayıcı bileşik olarak 3. 066 mol azotumuz var. Böylelikle Amonyak ın kuramsal verimi: 3. 066 mol N 2 x 2 mol NH 3 2 1 mol N 6. 132 mol NH 3 x % Verim = Slide 32 of 29 = 6. 132 mol NH 3 (Kuramsal Verim) 17. 03 g NH 3 = 104. 427 g NH 3 1 mol NH 3 (Kuramsal Gerçek verim Verim) Kuramsal verim x 100% 98. 67 g NH 3 104. 427 g x 100% = 94. 49 %
 Sodyum metalinin su ile tepkimesi
Sodyum metalinin su ile tepkimesi Lkeler
Lkeler Menü planlama ilkeleri
Menü planlama ilkeleri Lkeler
Lkeler Kuantum sayıları çıkmış sorular
Kuantum sayıları çıkmış sorular Petrucci
Petrucci Petrucci
Petrucci General chemistry petrucci
General chemistry petrucci Alan petrucci
Alan petrucci Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Doug harwood
Doug harwood Joe harwood
Joe harwood Gwen harwood: selected poems
Gwen harwood: selected poems Yankee city araştırması
Yankee city araştırması Leigh harwood
Leigh harwood Crusher hire harwood
Crusher hire harwood Internetin temel kavramları
Internetin temel kavramları Okul içi gözlem ve uygulamalar
Okul içi gözlem ve uygulamalar İşlem adımlarıyla ebelikte klinik uygulamalar
İşlem adımlarıyla ebelikte klinik uygulamalar Sekresyon atılımını kolaylaştıran uygulamalar
Sekresyon atılımını kolaylaştıran uygulamalar Sıcak-soğuk uygulamalar ppt
Sıcak-soğuk uygulamalar ppt Bürete
Bürete Entropi kimya
Entropi kimya Can kimya
Can kimya Sabun ve deterjan kimya
Sabun ve deterjan kimya Nernst eşitliği
Nernst eşitliği Organik kimya solomon ders notları
Organik kimya solomon ders notları Hız sabitini değiştiren faktörler
Hız sabitini değiştiren faktörler Katı çeşitleri
Katı çeşitleri Bromlu suyun rengini gideren organik bileşikler
Bromlu suyun rengini gideren organik bileşikler