Genel Kimya lkeler ve Modern Uygulamalar Petrucci Harwood
































![Standart Tepkime Entalpisi (Devamı) H° = H°ol[Na 2 CO 3(k)] + H°ol[H 2 O(s)] Standart Tepkime Entalpisi (Devamı) H° = H°ol[Na 2 CO 3(k)] + H°ol[H 2 O(s)]](https://slidetodoc.com/presentation_image_h2/23617f556849df37632296aab9c55725/image-33.jpg)


![Örnek H°ol[Ba. SO 4(k)] = -1473 k. J mol olduğuna göre, Baryum sülfatın çökmesinde Örnek H°ol[Ba. SO 4(k)] = -1473 k. J mol olduğuna göre, Baryum sülfatın çökmesinde](https://slidetodoc.com/presentation_image_h2/23617f556849df37632296aab9c55725/image-36.jpg)
- Slides: 36

Genel Kimya İlkeler ve Modern Uygulamalar Petrucci • Harwood • Herring 8. Baskı Bölüm 7: Termokimya Prentice-Hall © 2002

Konular 7 -1 7 -2 7 -3 7 -4 7 -5 7 -6 7 -7 7 -8 Termokimyada Bazı Terimler Isı Tepkime Isısı ve Kolorimetre İş Termodinamiğin Birinci Yasası Tepkime Isısı ∆U ve ∆H ∆H ın Dolaylı bulunması Hess Yasası Standart Oluşum Entalpisi ∆H° Prentice-Hall © 2002

7 -1 Termokimyada Bazı Terimler Evreni incelemek üzere seçilen bölümüne Sistem adı verilir Prentice-Hall © 2002

Kinetik ve Potansiyel Enerji Kinetik Enerji = iş = kuvvet x yol = Prentice-Hall © 2002

ISI Sıcaklık farkından ileri gelen enerji alış verişidir Isının miktarı; ● Sıcaklığın ne kadar değiştiğine ● Maddenin miktarına ● Maddenin niteliğine (atom ya da molekül türüne) bağlıdır Bir gram suyun sıcaklığını bir derece santigrat °C (Celsius) yükseltmek için gerekli ısı miktarına Kalori (kal) denir. SI birim sisteminde enerji birimi Joule dir. 1 kal = 4, 184 J Prentice-Hall © 2002

ISI Bir sistemin sıcaklığını bir derece değiştirmek için gerekli ısı miktarına o sistemin ısı kapasitesi denir. Sistem bir mol madde ise mol ısı kapasitesi, sistem bir gram madde ise özgül ısı kapasitesi adı alır. Isı miktarı = maddenin kütlesi x özgül ısısı x sıcaklık değişimi Isı kapasitesi = C q = m x özgül ısı x ∆T Prentice-Hall © 2002

Özgül Isıların Deneysel Belirlenmesi qkurşun = qsistem; qsu = qçevre qsu = 50, 0 g su x 4. 184 J / g su °C x (28, 8 -22, 0) °C qkurşun = - qsu = -1. 4 x 103 J qkurşun = 150, 0 g kurşun x kurşunun Özgül ısısı x (28, 8 -100, 0) °C = -1. 4 x 103 J Kurşunun Özgül ısısı = -1. 4 x 103 J / 150, 0 g kurşun x -71, 2 °C = 0, 131 J. g-1°C-1 Prentice-Hall © 2002

Tepkime Isısı ve Kalorimetre Tepkime ısısı, qtep sabit sıcaklıkta yürüyen bir kimyasal tepkimede sistem ile çevresi arasında alınıp verilen ısı miktarıdır. Yalıtılmış bir sistemde sıcaklığın azalmasına neden olan ya da yalıtılmamış sistemde çevreden ısı alan bir tepkimeye endotermik tepkime denir Endotermik bir tepkimede q > 0 Ekzotermik bir tepkimede q < 0 Yalıtılmış bir sistemde sıcaklık artışına neden olan ya da yalıtılmamış sistemde çevreye ısı veren bir tepkimeye ekzotermik tepkime denir Prentice-Hall © 2002

Kalorimetre Bombası Yanma tepkimelerinden açığa çıkan ısıyı ölçmede kullanılan sisteme kalorimetre bombası denir. Sistem çevresinden yalıtılmıştır. Kimyasal enerjiyi ısı enerjisine dönüştürür ve sistemin sıcaklığı artar. Tepkime ısısı, sistemin başlangıç sıcaklığına ve basıncına dönebilmesi için çevresine vermesi gereken ısı miktarıdır. qtep = - qkal (burada qkal = qbomba+ qsu …) Kalorimetreye her defasında aynı şartları sağlarsak kalorimetrenin ısı kapasitesi bulunur. qkal = kalorimetrenin ısı kapasitesi x ∆T Prentice-Hall © 2002

Örnek Tepkime ısısının kalorimetre bombasıyla belirlenmesi. 1, 010 g sakkarozun C 12 H 22 O 11 yakılmasıyla kalorimetrenin sıcaklığını 24, 92 °C’dan 28, 33 °C’a yükseltmektedir. Kalorimetrenin ısı kapasitesi 4, 90 k. J/°C olduğuna göre (a) sakkarozun yanma ısısı k. J/mol C 12 H 22 O 11 cinsinden ne kadardır. (b) Bir çay kaşığı şekerin (4, 8 g) 19 kal içerdiğini doğrulayınız qkal = 4, 90 k. J/°C x (28, 33 -24, 92) °C = 16, 7 k. J qtep = - qkal = -16, 7 k. J qtep = -16, 7 k. J/ 1, 010 g sakkaroz = -16, 7 k. J /g sakkaroz qtep = -16, 7 k. J/g sakkaroz x 342, 3 sakkaroz / 1 mol sakkaroz qtep = -5, 65 x 103 k. J/mol sakkaroz 4, 8 g sakkaroz /cay kaşığı x 16, 5 kj/ g sakkaroz x 1 cal /4, 184 J = -19 kkal/ çay kaşığı Prentice-Hall © 2002

“Kahve Fincanı” Kalorimetresi Genellikle sulu çözeltiler halinde olan tepkenler poliüretan (iyi bir yalıtkan) köpükten yapılmış bir kap içerisinde karıştırılır ve sıcaklık değişimi ölçülür. HCl(aq) + Na. OH (aq) H 2 O (s) + Na. Cl(aq) Her ikisi de 21, 1 °C olan 100, 0 m. L 1, 00 M HCl ve 100, 0 m. L 1, 00 M Na. OH çözeltileri poliüretan kolarimetre kabına konuluyor. Tepkime sonunda sıcaklık 27, 8 °C’e yükseliyor. Oluşan 1 mol H 2 O başına tepkime ısısı nedir. qkal = 200, 0 m. L x 1, 00 g/ m. L x 4, 18 J / g °C x (27, 8 -21, 1) °C = 5, 6 x 103 J qnötr = - qkal = -5, 6 x 103 J = -5, 6 k. J ? mol H+ = 0, 1000 L x 1 mol HCl / 1 L x 1 mol H+/ 1 mol HCl = 0, 100 mol H+ = 0, 100 mol H 2 O qnötr = -5, 6 k. J/0, 100 mol H 2 O qtep = -56 k. J/mol H 2 O Prentice-Hall © 2002

İŞ Gazların genleşmesi veya sıkışmasıyla ile ilgili işe basınç-hacim işi denir. P-V işi İş (w) = Kuvvet (F) x Uzaklık (h) = Px. Axh w = Pdış x ∆V 8, 3145 m 3 Pa mol-1 K-1 = 8, 3145 m 3 Nm-2 mol-1 K-1 = 8, 3145 kg m 2 s-2 mol-1 K-1 8, 3145 Jmol-1 K-1 = 0, 082057 L atm mol-1 K-1 8, 3145 J / 0, 082057 L atm = 101, 33 J L-1 atm-1 Prentice-Hall © 2002

Örnek 298 K de 0, 100 mol He olduğunu düşünelim. Sabit sıcaklıkta bu gaz genleştirildiğinde J olarak ne kadar iş yapar? w = -Pdış x ∆V = -1, 30 atm x (1, 88 – 1, 02) L x 8, 314 J / 0, 0821 L atm = -1, 1 x 102 J sistem çevreye iş yapıyor Prentice-Hall © 2002

Termodinamiğin Birinci Yasası Isı (q), iş (w) ve iç enerji değişimi (∆U) arasındaki ilişki, enerjinin korunumu yasasına uyar ve termodinamiğin birinci yasası olarak bilinir. İç enerji (U), bir sistemin (kinetik ve potansiyel) enerjilerinin bir toplamı olup, moleküllerin öteleme kinetik enerjilerini, moleküllerin dönme ve titreşim enerjilerini, bağlarda depo edilmiş kimyasal enerjiyi, moleküller arası etkileşim enerjilerini ve atomlardaki elektronlara bağlı enerjiyi içine alır. Bir sistem enerjiyi sadece iç enerji olarak içerir, ısı veya iş olarak içermez. Isı ve iş, sistemin çevresi ile enerji değişimlerindeki bir araçtır. ∆U = q + w Çevresi ile ısı ve iş değişimni yapamayan izole bir sistemde ∆Uizole sistem = 0, enerji sabittir. Prentice-Hall © 2002

İşaretler Sisteme giren enerji pozitif işaretlidir. Buna göre Sistem ısı alırsa q > 0, iş sisteme yapılırsa w > 0 dır. Sistemden çıkan enerji negatif işaretlidir. Sistem ısı verirse q < 0, sistem çevreye iş yaparsa w < 0 dır. Sisteme giren ya da sistemden çıkan enerji sistemin iç enerjisini değiştirir. Sistemden çıkandan daha fazla enerji sisteme girerse ∆U pozitif tersi negatif olur. Örnek Bir gaz genleşirken 25 J luk bir ısı almakta ve dışarıya 243 J luk iş yapmaktadır. Gazdaki ∆U nedir ? ∆U = q + w = (+25 J) + (-243 J) = 218 J Prentice-Hall © 2002

Hal fonksiyonları Bir sistemi, sıcaklık basınç ve içerdiği madde miktarı ile tanımlarız. Bunlar sistemin halini belirtir. Sistemin belli bir hali için belli bir değeri olan özelliğe hal fonksiyonu denir. Örneğin 20 °C ve standart 1 atm basınçtaki bir su örneğinin hali belirlidir. Bu suyun yoğunluğu 0, 99820 g / m. L dir. Bir sistemin iç enerjisi bir hal fonksiyonudur. İç enerji değerini bulmak için basit bir ölçme veya hesaplama yöntemi yoktur. İç enerjinin gerçek değerini bilmemize gerek yoktur. U nun her bir hal için tek bir değeri olduğundan, ∆U nun da tek bşir değeri vardır, U 2 -U 1 e eşittir. Sistem 2 halinden 1 haline döndüğünde -∆U = U 1 -U 2 dir. ∆U + (- ∆U ) = (U 2 -U 1) + (U 1 -U 2) = 0 Prentice-Hall © 2002

Yola Bağlı fonksiyonlar İç enerji değişiminin (∆U) aksine, ısı (q) ve iş (w) hal fonksiyonları değildirler. Bu fonksiyonların değeri sistemdeki değişiklik için izlenen yola bağlıdır. 298 K de 2, 40 atm basınçta 0, 100 mol He u ele alalım. (hal 1) ve 1, 30 atm basınca genleştirelim (hal 2). Hal 1 den hal 2 ye geçişin tek basamakta gerçekleştiğini düşünelim. İkinci durumda aynı genleşmenin şekildeki gibi bir ara basamak üzerinden genleştiğini kabul edelim. w = -Pdış x ∆V = -1, 30 atm x (1, 88 – 1, 02) L x 8, 314 J / 0, 0821 L atm = -1, 1 x 102 J sistem çevreye iş yapıyor İkinci durum; w = -Pdış x ∆V =-1, 80 atm x (1, 36 – 1, 02) L-1, 30 atm(1, 88 L-1, 36 L) =(0, 61 Latm-0, 68 Latm)x 101, 3 J / 1 L atm = -1, 3 x 102 J sistem çevreye iş yapıyor. ∆U değeri ister tek isterse çok basamaklı olsun değeri sabittir, w ise yola bağlıdır. Prentice-Hall © 2002

Tepkime Isıları : U ve H Bir kimyasal tepkimede tepkenlerin sistemin ilk halini, ürünlerin sistemin son halini gösterdiğini düşünelim. tepkenler ürünler U 1 U 2 U = Us - Ui Bir kalorimetre bombasındaki tepkimede, tepkime sabit hacimde gerçekleştiğinden w = -Pdış. V = 0 dır. Bu durumda tepkime ısısı qtep = qv olur. Termodinamiğin birinci yasasına göre U = qv elde edilir. Genellikle kimyasal tepkimeleri kalorimetre bombasında gerçekleştiremeyiz. Sabit basınçtaki bir tepkimede U = q + w yazabiliriz. Ayrıca U = qv dir. w = 0 olmadıkça qv ile qp birbirinden farklı olacaktır. Bir tepkimenin qv ve qp si U değeri değişmediği halde farklı olabilir. Bu durum U nun bir hal fonksiyonu olduğunu, ama q ve w nin olmadıklarını gösterir. Prentice-Hall © 2002

Tepkime Isıları : U ve H qv = qp + w U = qv ve w = -P V yazalım ve düzenleyelim U = qp - P V qp= U + P V U, P ve V değişkenleri birer hal fonksiyonudur. Öyleyse, U + P V ifadesi de bir hal fonksiyonu olmalıdır. Bu hal fonksiyonu entalpi, H olarak isimlendirilir ve basınç-hacim işi ile iç enerjinin toplamına eşittir: H = U + PV bir işlemdeki entalpi değişimi, H dır. H = Hs –Hi = (Us + Ps. Vs) – (Ui + Pi. Vi) H = (Us – Ui) + (Ps. Vs – Pi. Vi) H = U + PV Eğer işlem sabit sıcaklık ve basıçta gerçekleşirse (Pi = Ps) ve iş, hacim basınç işi ile sınırlı ise, entalpi : H = U + P V olur ve bu koşullarda işlemdeki ısı akımı H = qp olur. Prentice-Hall © 2002

Kimyasal tepkimede Entalpi ( H) ve iç enerji U değişimleri Sabit basıçtaki tepkime ısısı, H ve sabit hacimdeki tepkime ısısı, U arasındaki eşitlik U = H - P V dir. P V, sabit dış basınçtaki sistemin hacmindeki değişmeden kaynaklanan enerjiyi ifade eder. 2 CO(g) + O 2 (g) 2 CO 2(g) Bu tepkimenin ısısını sabit basınç altında, 289 K sabit sıcaklıkta ölçersek -566, 0 k. J enerji elde ederiz. 566, 0 k. J enerji sistemden çıkar. H = -566, 0 k. J. Basınç haci işini bulabilmek için P V = P(Vs-Vi). İdeal gaz denkleminden P V = RT(ns-ni). P V = 0, 0083145 k. J. mol-1. K-1 x 298 K x -1 mol = -2, 5 k. J U = H - P V U = - 566, 0 k. J – (-2, 5 k. J) U = - 563, 5 k. J Prentice-Hall © 2002

Kimyasal tepkimede Entalpi ( H) ve iç enerji U değişimleri C 12 H 22 O 11(k) + 12 O 2 (g) 12 CO 2(g) + 11 H 2 O(s) H = -5, 65 x 10 -3 k. J Sabit sıcaklıkta, sakkorozun yanma tepkimesinde, ister sabit hacimde (qv) isterse de yanma sabit basınçta (qp) olsun aynı değerdedir. 12 mol CO 2 gazı 12 mol O 2 gazı ile aynı hacmi işgal eder, qp = qv dir. Pek çok tepkimede ölçülen tepkime ısısı H dır. Bazı tepkimelerde özellikle yanma tepkimelerinde, U’u (qv) ölçeriz. Yukarıdaki tepkimede H = U dur. H = U eşitliği her zaman doğru değildir. Ancak birine çok yakın değerlerdedir. Prentice-Hall © 2002

Örnek 1, 00 kg sakkarozun, C 12 H 22 O 11, tam yanmasından açığa çıkacak enerji ne kadardır ? ? mol = 1 kg C 12 H 22 O 11 x 1000 g C 12 H 22 O 11 1 kg C 12 H 22 O 11 ? k. J = 2, 92 mol C 12 H 22 O 11 x x 1 mol C 12 H 22 O 11 342, 3 g C 12 H 22 O 11 -5, 65 x 103 k. J C 12 H 22 O 11 1 mol C 12 H 22 O 11 = 2, 92 mol C 12 H 22 O 11 = - 1, 65 x 104 k. J C 12 H 22 O 11 İşaretin negatif olması ısının açığa çıktığını belirtir Prentice-Hall © 2002

Hal değişimlerinde Entalpi değişimi Hava ile temasta bulunan bir sıvıda yüzeyde bulunan moleküller, komşu moleküllerin çekim kuvvetlerini yenerek gaz veya buhar faza geçerler. Buna sıvının buharlaşması deriz. Sıvının sıcaklığının sabit kalabilmesi için, çevreden ısı alarak moleküllerin götürdüğü enerjiyi yerine koyar. Belirli miktar sıvının buharlaşabilmesi için gereken ısıya buharlaşma entalpisi (ısısı) denir. Genellikle belirli miktar moldür. H 2 O(s) H 2 O(g) H = 44, 0 k. J, 298 K Bir katının erimesi için gereken enerjiye de Erime entalpisi (ısısı) denir. H 2 O(k) H 2 O(s) H = 6, 01 k. J, 273, 15 K Prentice-Hall © 2002

Örnek 50, 00 g suyun 10°C da sıvı halden 25, 0 °C da buhar haline gelmesi işlemindeki entalpi değişimini hesaplayınız. Suyun 10°C’den 25, 0 °C’e ısıtılması: ? k. J = 50, 0 g H 2 O x 4, 184 J g H 2 O °C x (25, 0 – 10, 0) °C x 1 k J 1000 J = 3, 14 k. J 25°C suyun buharlaşması: 50, 0 g H 2 O x 1 mol H 2 O 18, 02 g H 2 O x 44, 0 k. J 1 mol H 2 O = 122 k. J Toplam entalpi değişimi: H = 3, 14 k. J + 122 k. J = 125 k. J Prentice-Hall © 2002

Standart haller ve standart entalpi değişimleri Tepkimenin ilk hali (tepkenler) ve son hali (ürünler) kesin olarak belirli ise bir tepkimenin ölçülen entalpi değişimi belirli bir değerdedir. Tepkenler be ürünler için bir standart hal belirlersek buna tepkime standart entalpi değişimi deriz ve H° sembolü ile gösteririz. Katı ve sıvıların standart hali saf element ve bileşiklerde 1 bar basınç ve çalışılan sıcaklıktır. Gazların standart hali ise 1 bar basınç ve ilgili sıcaklıktaki ideal gaz gibi davrandığı haldir. Entalpi diyagramları H < 0, ürünlerin entalpisi tepkenlerin entalpisinden küçük, ısı verendir. Ekzotermik tepkimedir N 2(g) + O 2(g) H 2 O(g) H = + 180, 50 k. J H > 0, ürünlerin entalpisi tepkenlerin entalpisinden büyük, ısı alandır. Endotermik tepkimedir. Prentice-Hall © 2002

H ın dolaylı yoldan belirlenmesi: Hess Yasası 1. H bir kapasite özelliğidir. N 2 (g) + O 2 (g) 2 NO(g) H = 180, 50 k. J Bir mol NO(g) başına H belirtmek için bütün katsayılar ve H değeri ikiye bölünür ½ N 2 (g) + ½ O 2 (g) NO(g) H = ½ x 180, 50 k. J = 90, 25 k. J 2. Tepkime tersine döndüğünde H ın işareti değişir. NO(g) ½ N 2 (g) + ½ O 2 (g) H = - 90, 25 k. J 3. Hess’in tepkime ısılarının toplanabilirliği yasası. ½ N 2 (g) + O 2 (g) NO 2(g) H = ? Bu tepkimenin oluşmasındaki entalpi değişimini bulabilmek için; Prentice-Hall © 2002

Hess Yasası (Devamı) ½ N 2 (g) + ½ O 2 (g) NO(g) H = 90, 25 k. J NO(g) + ½ NO 2 (g) H = - 57, 07 k. J NO 2(g) H = + 33, 18 k. J ½ O 2 (g) ½ N 2 (g) + O 2 (g) Bir işlem basamaklar ya da kademeler şeklinde yürüyorsa toplam (net) işlemin entalpi değişimi ( H), tek basamakların ya da kademelerin entalpi değişimleri toplamına eşittir. Prentice-Hall © 2002

Örnek 3 C(grafit) + 4 H 2 (g) C 3 H 8(g) tepkimesinin H° değerini, aşağıda verilen yanma ısıları yardımıyla bulunuz. C 3 H 8 (g) + 5 O 2 (g) 3 CO 2(g) + 4 H 2 O(s) H = -2219, 9 k. J C(grafit) + CO 2 (g) H 2 (g) + ½ O 2 (g) H = - 285, 8 k. J HO 2(s) -(a): 3 CO 2(g) + 4 H 2 O(s) 3 x (b): 3 C(grafit) + 3 O 2 (g) 4 x (c): 4 H 2 (g) + 2 O 2 (g) 3 C(grafit) H = - 393, 5 k. J + 4 H 2 (g) C 3 H 8 (g) + 5 O 2 (g) 3 CO 2 (g) 4 HO 2(s) C 3 H 8(g) H = 2219, 9 k. J H = - 1181 k. J H = - 1143 k. J H = - 104 k. J Prentice-Hall © 2002

Standart Oluşum Entalpisi İç enerjinin (U) mutlak değeri ölçülemediği gibi entapinin (H) de mutlak değeri ölçülemez. Entalpi iç enerjiye bağımlı bir özelliktir. Entalpinin mutlak değerine de ihtiyacımız yoktur. Entalpi bir hal fonksiyonudur ve entalpi değişimi ( H) belirli bir değere sahiptir. Diğer bütün özelliklerde olduğu gibi entalpide de bir sıfır noktası vardır. Elementlerin entapileri keyfi olarak sıfır kabul eder ve sıfır noktasına göre bileşiklerin oluşum entalpilerini belirtiriz. Bir maddenin standart oluşum entalpisi ( H°ol) standart halde bir mol maddenin, standart haldeki elementlerinin referans şekillerinden oluşması sırasındaki entalpi değişimidir. Saf elementlerin referans hallerinde standart oluşum entalpileri 0 dır. Na(k) C (grafit) H 2(g) N 2(g) O 2(g) C(elmas) C(grafit) Br 2(g) H°ol = 1, 9 k. J Prentice-Hall © 2002

Standart Oluşum Entalpisi (Devamı) Br 2 (s) P(beyaz) P(kırmızı) Br 2(g) H°ol = 30, 91 k. J H°ol = -17, 6 k. J Prentice-Hall © 2002

Standart Oluşum Entalpisi (Devamı) Bazı yaygın maddelerin oluşum entalpileri listede verilmektedir. Daha geniş liste literatürde ve Handbook’larda verilmektedir. Elementlerin oluşum entalpileri, H°ol = 0, düzlem içinde verilmektedir. Oluşum entalpileri pozitif olan bileşikler düzlemin üstünde, negatif olan bileşikler düzlemin altında verilmektedir. Prentice-Hall © 2002

Standart Tepkime Entalpisi Hess yasasını, sodyum bikorbonatın bozunma tepkimesinin standart tepkime entalpisini hesaplamada kullanalım. Bu tepkime fırında pişirme işlemlerinde soda kullanıldığında meydana gelir. 2 Na. HCO 3(k) (a) 2 Na. HCO 3(k) H = ? Na 2 CO 3(k) + H 2 O(s) + CO 2(g) 2 Na(k) + 2 H 2(s) + 2 C(grafit) + 3 O 2(g) H° = -2 x H°ol[Na. HCO 3(k)] (b) 2 Na(k) + C(grafit) + 3/2 O 2(g) 2 Na 2 CO 3(k) H° = H°ol[Na 2 CO 3(k)] (c) H 2(g) + ½ O 2(g) H 2 O(s) H° = H°ol[H 2 O(s)] (d) C(grafit) + O 2(g) CO 2(g) H° = H°ol[CO 2(g)] Prentice-Hall © 2002
![Standart Tepkime Entalpisi Devamı H HolNa 2 CO 3k HolH 2 Os Standart Tepkime Entalpisi (Devamı) H° = H°ol[Na 2 CO 3(k)] + H°ol[H 2 O(s)]](https://slidetodoc.com/presentation_image_h2/23617f556849df37632296aab9c55725/image-33.jpg)
Standart Tepkime Entalpisi (Devamı) H° = H°ol[Na 2 CO 3(k)] + H°ol[H 2 O(s)] + H°ol[CO 2(g)] -2 x H°ol[Na. HCO 3(k)] H° = H°bozunma + H°oluşum H°bozunma = -2 x H°ol[Na. HCO 3(k)] H°oluşum = H°ol[Na 2 CO 3(k)] + H°ol[H 2 O(s)] + H°ol[CO 2(g)] H° = ü H°ol(ürünler) - t H°ol(tepkenler) Prentice-Hall © 2002

Örnek Doğal gazın bir bileşeni olan etanın C 2 H 6(g) standart yanma entalpisini hesaplayınız. C 2 H 6 (g) + 7/2 O 2 (g) 2 CO 2(g) + 3 H 2 O(s) H = ? H° = {2 mol CO 2 x H°ol[CO 2(g)] + 3 mol H 2 O x H°ol[H 2 O(s)]} - {1 mol C 2 H 6 x H°ol[C 2 H 6(g)] + 7/2 mol O 2 x H°ol[O 2(g)]} H° = 2 mol CO 2 x (393, 5 k. J/mol CO 2) + 3 mol H 2 O x (-285, 8 k. J/mol H 2 O) - 1 mol C 2 H 6 x -84, 7 k. J/mol C 2 H 6) - 7/2 mol O 2 x 0 k. J/mol O 2) H° = 787, 0 k. J – 857, 4 k. J + 84, 7 k. J = 1559, 7 k. J Prentice-Hall © 2002

Çözeltilerde İyonik Tepkimeler H+(aq) + OH- (aq) H 2 O(s) H° = - 55, 8 k. J H° = ( 1 mol H 2 O x H°ol[H 2 O(s)] )- ( 1 mol H+ x H°ol[H+(aq)] ) – ( 1 mol OH- x H°ol[OH-(aq)] ) = -55, 8 k. J [OH-(aq)] = 55, 8 k. J + ( 1 mol H 2 O x H°ol[H 2 O(s)] )- ( 1 mol H+ x H°ol[H+(aq)] ) H°ol[OH-(aq)] = 1 mol OH 55, 8 k. J – 285, 8 k. J – 0 k. J 1 mol OH- = -230, 0 k. J/mol OHPrentice-Hall © 2002
![Örnek HolBa SO 4k 1473 k J mol olduğuna göre Baryum sülfatın çökmesinde Örnek H°ol[Ba. SO 4(k)] = -1473 k. J mol olduğuna göre, Baryum sülfatın çökmesinde](https://slidetodoc.com/presentation_image_h2/23617f556849df37632296aab9c55725/image-36.jpg)
Örnek H°ol[Ba. SO 4(k)] = -1473 k. J mol olduğuna göre, Baryum sülfatın çökmesinde entalpi değişimi nedir ? Ba 2+(aq) + SO 42 -(aq) H°ol, k. J/mol - 537, 6 - 909, 3 Ba 2 SO 4(k) H° = ? -1473 H° = 1 mol Ba 2 SO 4 x H°ol[Ba 2 SO 4(k)] - 1 mol Ba 2+ x H°ol[Ba 2+(aq)] – 1 mol SO 42 - x H°ol[SO 42 -(aq)] H° = 1 mol Ba 2 SO 4 x (-1473 k. J/mol Ba 2 SO 4) - 1 mol Ba 2+ x (-537, 6 k. J/mol Ba 2+) – 1 mol SO 42 - x (-909, 3 k. J/SO 42 -) H° = -1473 k. J + 537, 6 k. J + 909, 3 k. J = -26 k. J Prentice-Hall © 2002
 Genel kimya gazlar
Genel kimya gazlar Arif emecen
Arif emecen Lkeler
Lkeler Lkeler
Lkeler Kuantum sayıları çıkmış sorular
Kuantum sayıları çıkmış sorular Klorpentan
Klorpentan Alan petrucci
Alan petrucci Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Petrucci
Petrucci Petrucci
Petrucci Crusher hire harwood
Crusher hire harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Doug harwood
Doug harwood Joe harwood
Joe harwood Gwen harwood: selected poems
Gwen harwood: selected poems Yankee city araştırması nedir
Yankee city araştırması nedir Leigh harwood
Leigh harwood İşlem adımlarıyla ebelikte klinik uygulamalar
İşlem adımlarıyla ebelikte klinik uygulamalar Sekresyon atılımını kolaylaştıran uygulamalar
Sekresyon atılımını kolaylaştıran uygulamalar Sıcak-soğuk uygulamalar ppt
Sıcak-soğuk uygulamalar ppt Internet ve temel uygulamalar
Internet ve temel uygulamalar Okul içi gözlem ve uygulamalar
Okul içi gözlem ve uygulamalar Analitik kimya
Analitik kimya Yanıcı madde sembolü
Yanıcı madde sembolü Aromatik kimya
Aromatik kimya Pv nrt r sabiti
Pv nrt r sabiti Meltem kimya akhisar
Meltem kimya akhisar Froma kimya
Froma kimya üniform korozyon
üniform korozyon Ersağ kazanç tablosu
Ersağ kazanç tablosu Alkan alken alkin asitlik sıralaması
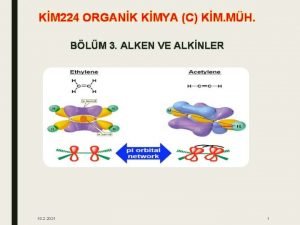
Alkan alken alkin asitlik sıralaması Bileşik nedir
Bileşik nedir Adi karışım nedir
Adi karışım nedir Cis trans izomeri nedir
Cis trans izomeri nedir Karışım problemleri formül
Karışım problemleri formül Froma kimya
Froma kimya Entropi ne demek
Entropi ne demek