GAZLAR ERK l l l Gaz nedir deal



















- Slides: 24

GAZLAR

İÇERİK l l l Gaz nedir? İdeal gaz kanunları 1. 2. 3. 4. l Boyle Yasası Charles Yasası Gay Lussac Yasası Avagadro Yasası Gazların ideal olmayan davranışları

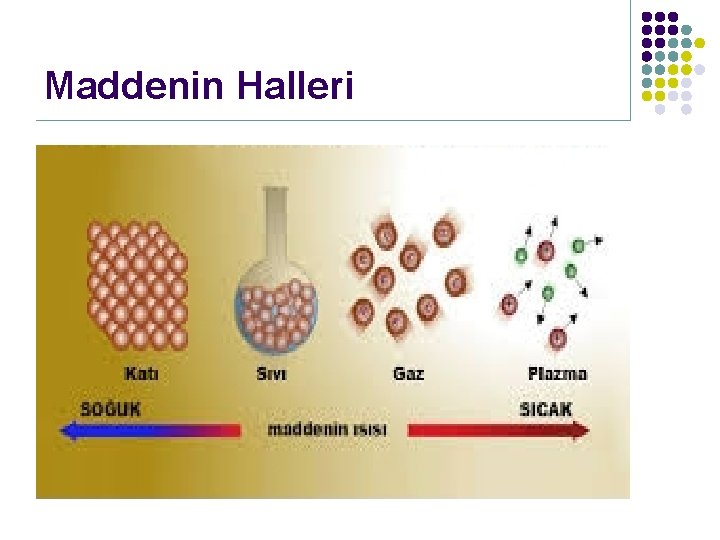
Maddenin Halleri

Gaz nedir?

İdeal gaz nedir? İdeal Gaz; Moleküllerinin kendi hacimleri (öz hacim) toplam hacim yanında ihmal edilebilecek kadar küçük olan moleküller arasında hiçbir itme ve çekme kuvveti bulunmayan ve gaz moleküllerinin birbiriyle çarpışmasında hiçbir kinetik enerji kaybı olmayan bir hayali gaz örneğine ideal gaz denir. 1. Düşük basınçta 2. Yüksek sıcaklıktaki gazlarlar idealliğe yaklaşırlar.

İDEAL GAZ DENKLEMİ


Gaz Sabiti PV = n. RT = 8. 3145 m 3 Pa mol-1 K-1 = 8. 3145 J mol-1 K-1

İdeal Gazın Varsayımları 1. Molekül veya atomlardan oluşur. Aralarındaki mesafe çok büyüktür, aralarında itici veya çekici etkileşme yoktur. 2. Parçacıklar değişik hızlarda ve yönlerde rasgele hareket ederler. Birbirleriyle veya kabın duvarlarıyla çarpışmadıkları sürece doğrusal bir yol boyunca hareket ederler. Bir gaz molekülünün oda sıcaklığındaki ortalama hızı 300 m/s dir. 3. Birbirleriyle veya kabın duvarlarıyla tamamen esnek çarpışma yaparlar. Enerji kaybı olmadan, kinetik enerjilerini birbirlerine aktarılar.

İDEAL GAZ KANUNLARI Boyle yasası, Boyle-Mariotte yasası veya uçucu gazların sıvılaştırılması olarak da bilinir. Boyle yasasına göre, sıcaklıklar sabit tutulduğu sürece, belirli ölçüde alınan bir ideal gazın hacmiyle basıncının çarpımı sabittir. Matematiksel bir anlatımla: PV = k l l l P paskal olarak basınç, V kübik metre olarak hacim, k gaz sabiti (8. 3145 J/(mol K).

Boyle Yasası l

CHARLES – GAY LUSSAC YASASI Charles yasası, gaz yasalarından biridir. Bu yasaya göre, sabit basınçta, herhangi bir miktardaki ideal gazın hacminin azalıp çoğalması, aynı oranda sıcaklığının da azalıp çoğalmasını etkiler.

Charles Yasası l Yasanın formülü: V / T= k l l l V kübik metre olarak hacim, k gaz sabiti (8. 3145 J/(mol K)) T de Kelvin olarak sıcaklıktır.

Gay Lussac Yasası Gay-Lussac yasası; belirli bir miktarda ki ideal gazın basıncının, Kelvin birimiyle belirtilmiş sıcaklığına doğru orantılı olduğunu belirtir.

Gay Lussac Yasası P / T=k l l P paskal olarak basınç, k gaz sabiti (8. 3145 J/(mol K)), T de Kelvin olarak sıcaklıktır. Sıcaklık, bir maddenin ortalama kinetik enerjisi olduğu için sıcaklığının arttığında kinetik enerjisinin de arttığı söylenilebilir. Bu durumda, gaz parçacıkları, gazın tutulduğu kabın duvarlarıyla daha çok çarpışacağından, daha çok basınç uygularlar.

Avogadro Yasası Avogadro yasası, avogadro hipotezi olarak da bilinir. Bu yasa, eşit hacimdeki gazların; eşit sıcaklık ve eşit basınçta aynı sayıda parçacık ya da molekülsayısına sahip olduğunu öne sürer.

Avagadro Yasası Bu yasanın bir kısmı, matematiksel olarak şöyle gösterilebilir: V / n= k l l V kübik metre olarak hacim, n gazın mol sayısı, k da bir sabittir. Ancak yukardaki denklem, sadece homojen maddeler için geçerlidir. Buna homojen sıvılar ve katılar da dahildir. Bu ilişki bulunması kolay bir ilişkidir ki, nitekim Avogadro'dan önce de varsayılmıştır.

Avagadro Yasası Avogadro yasasının en önemli sonucu, yasanın ideal gaz sabitinin tüm gazlar için aynı olduğunu bulmasıdır.

Avogadro yasası, toplam gaz yasasını oluşturan Boyle yasası, Charles yasası ve Gay-Lussac yasasıyla birlikte ideal gaz yasasını oluşturur.

Gazların İdeal Olmayan Davranışları Buraya kadar gazların PVT davranışları ile ilgili olarak Boyle, Charles - Gay Lussac yasalarına uyduğunu ve bu ilişkinin PV= n. RT eşitliği ile genellenebileceğini ifade ettik.

Gazların İdeal Olmayan Davranışları Yüksek basınçlarda veya sıradan basınçlarda çok daha hassas ölçümler yapıldığında gazların bu yasalara uygun davranış göstermedikleri ortaya çıkartılmıştır. Bir gaz İdeal gaz kanunlarından saptığında, gazın davranışı için gerçek gaz veya ideal olmayan gaz terimleri kullanılır.

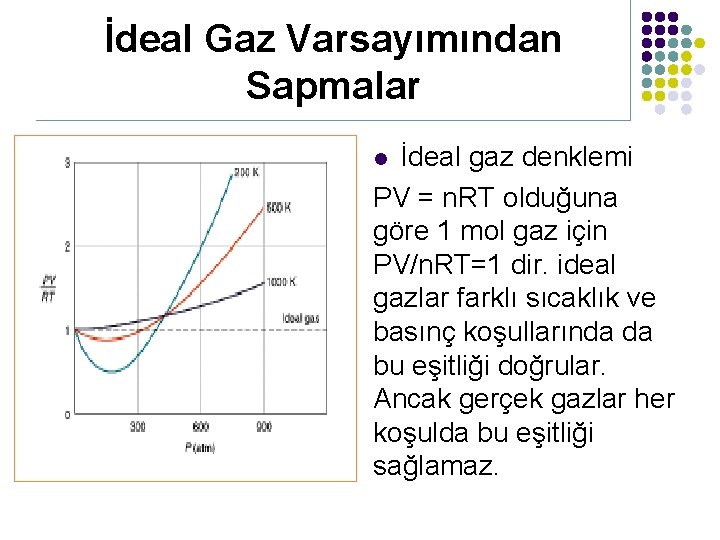
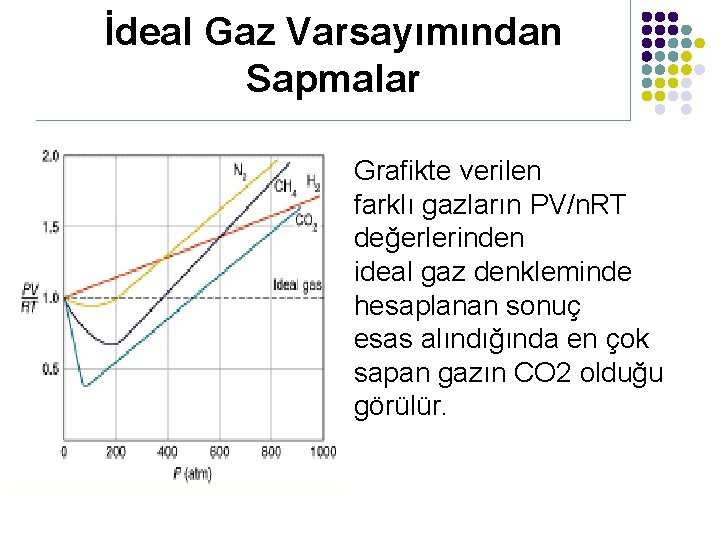
İdeal Gaz Varsayımından Sapmalar İdeal gaz denklemi PV = n. RT olduğuna göre 1 mol gaz için PV/n. RT=1 dir. ideal gazlar farklı sıcaklık ve basınç koşullarında da bu eşitliği doğrular. Ancak gerçek gazlar her koşulda bu eşitliği sağlamaz. l

İdeal Gaz Varsayımından Sapmalar Grafikte verilen farklı gazların PV/n. RT değerlerinden ideal gaz denkleminde hesaplanan sonuç esas alındığında en çok sapan gazın CO 2 olduğu görülür.

DİNLEDİĞİNİZ İÇİN TEŞEKKÜR EDERİM Dönsel ÖZEL 100608022
 Deal or no deal machine
Deal or no deal machine Rudolf vizental
Rudolf vizental Yanıcı gazlar
Yanıcı gazlar Parlayıcı gazlardan havadan hafif
Parlayıcı gazlardan havadan hafif Basit boğucu gazlar
Basit boğucu gazlar Yanıcı gazlar
Yanıcı gazlar Kayganlık özelliği az olan madde
Kayganlık özelliği az olan madde Asit yağmuru oluşturan gazlar
Asit yağmuru oluşturan gazlar Normal koşullar
Normal koşullar Bulunduğu kabı tamamen dolduran maddeler
Bulunduğu kabı tamamen dolduran maddeler Hiatus aorticus seviyesi
Hiatus aorticus seviyesi Güdü nedir
Güdü nedir Nevin erk
Nevin erk Nejat erk
Nejat erk Katrin erk
Katrin erk Erk pwsz tarnów
Erk pwsz tarnów Dreieichschule langen lehrer
Dreieichschule langen lehrer Tomat erk
Tomat erk Daniment
Daniment Wampimuk
Wampimuk Erk proses
Erk proses R sabiti
R sabiti Soluduğumuz gaz halindeki madde nedir
Soluduğumuz gaz halindeki madde nedir Gaz absorpsiyonu kolon tipleri
Gaz absorpsiyonu kolon tipleri Elektr yoy yordamida payvandlash
Elektr yoy yordamida payvandlash