Genel Kimya Prensipleri ve Modern Uygulamalar Petrucci Harwood































- Slides: 40

Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci • Harwood • Herring Bölüm 3: Kimyasal Bileşikler

İçindekiler 3 -1 Molekül Bileşikler ve İyonik Bileşikler 3 -2 Molekül Kütlesi 3 -3 Kimyasal Bileşiklerin Bileşimi 3 -4 Yükseltgenme Basamakları 3 -5 Organik ve Anorganik Bileşikler 3 -6 Anorganik Bileşiklerin Adları ve Formülleri 3 -7 Organik Bileşiklerin Adları ve Formülleri 2

3 -1 Molekül Bileşikler Molekül yapısında bileşik bağımsız moleküller içeren bileşiktir ve molekülde az sayıda ametal atomları kovalent bağlarla bir arada tutulurlar. Molekül yapısında bileşiği göstermek için, kimyasal formül kullanırız. Kimyasal formül simgelerle gösterilir ve formül • bileşikte bulunan elementleri ve • her bir elementin bağıl atom sayısını belirtir. Kaba Formülü: Bir bileşik için en basit formüldür; bileşikteki atomları ve bunların bağıl sayılarını gösterir. Molekül Formülü: Bileşiğin gerçek formülüdür. Bazı durumlarda kaba ve molekül formülleri aynıdır. Diğer durumlarda, molekül formülü kaba formülün katlarıdır. 3

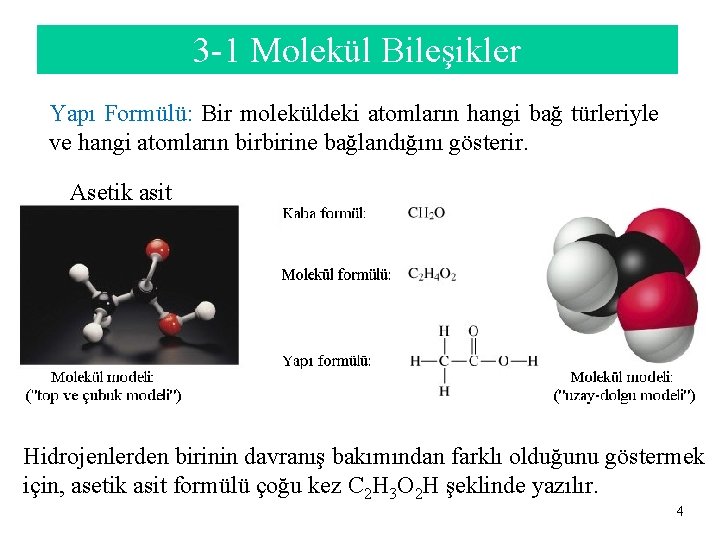
3 -1 Molekül Bileşikler Yapı Formülü: Bir moleküldeki atomların hangi bağ türleriyle ve hangi atomların birbirine bağlandığını gösterir. Asetik asit Hidrojenlerden birinin davranış bakımından farklı olduğunu göstermek için, asetik asit formülü çoğu kez C 2 H 3 O 2 H şeklinde yazılır. 4

Standart Renk Şeması Molekül modellerinde kullanılan renkler; Atom büyüklükleri elementlerin periodilk çizelgedeki yerlerine bağlı olup, şekilde farklı renklerdeki topların büyüklükleri ile gösterilmiştir.

İyonik Bileşikler Bir metal ve ametalin kimyasal olarak birleşmesi bir iyonik bileşik verir. İyonik Bileşik: Pozitif ve negatif iyonlarının elektrostatik çekim kuvveti ile bir araya gelmesinden oluşur. Ör. Na. Cl : Na+ ve Cl- sodyum klörür oluşturur. Metal atomları ametal atomları ile birleştiği zaman, bir ya da daha fazla elektron kaybetme, ametal atomları da bir ya da daha fazla elektron alma eğilimindedirler. Bunun sonucu, metal atomu pozitif iyon (katyon) ve ametal atomu negatif iyon (anyon) haline gelir. 6

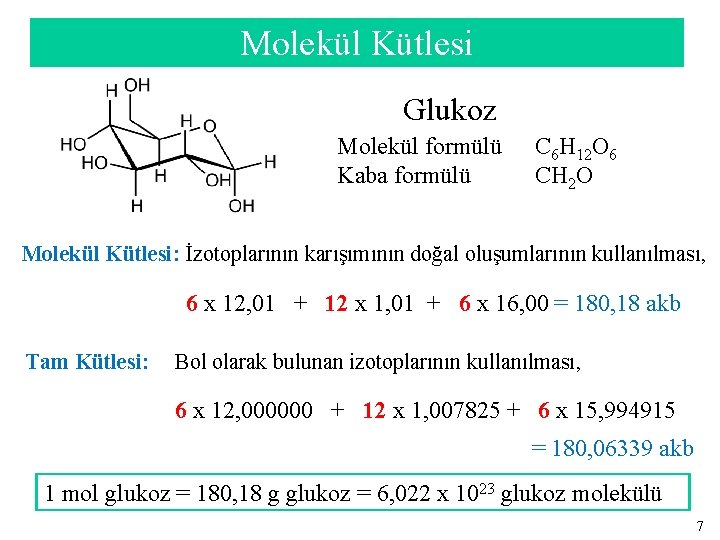
Molekül Kütlesi Glukoz Molekül formülü Kaba formülü C 6 H 12 O 6 CH 2 O Molekül Kütlesi: İzotoplarının karışımının doğal oluşumlarının kullanılması, 6 x 12, 01 + 12 x 1, 01 + 6 x 16, 00 = 180, 18 akb Tam Kütlesi: Bol olarak bulunan izotoplarının kullanılması, 6 x 12, 000000 + 12 x 1, 007825 + 6 x 15, 994915 = 180, 06339 akb 1 mol glukoz = 180, 18 g glukoz = 6, 022 x 1023 glukoz molekülü 7

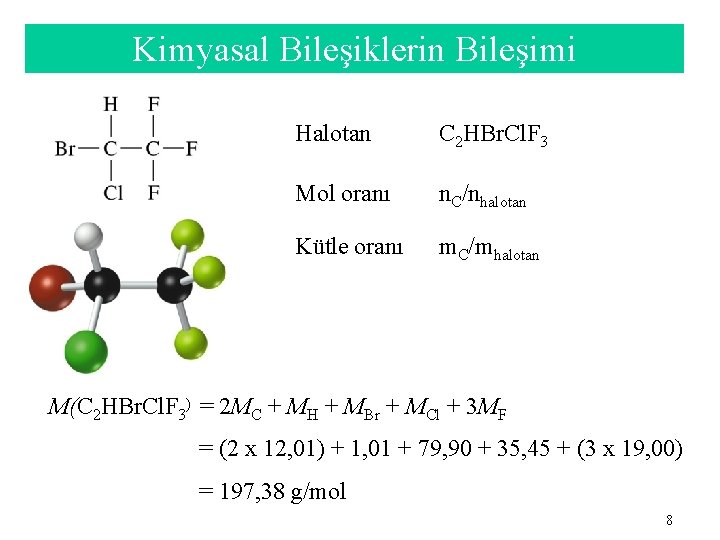
Kimyasal Bileşiklerin Bileşimi Halotan C 2 HBr. Cl. F 3 Mol oranı n. C/nhalotan Kütle oranı m. C/mhalotan M(C 2 HBr. Cl. F 3) = 2 MC + MH + MBr + MCl + 3 MF = (2 x 12, 01) + 1, 01 + 79, 90 + 35, 45 + (3 x 19, 00) = 197, 38 g/mol 8

Örnek 3. 4 Bileşiğin Yüzde Kütle Bileşiminin Hesaplanması Molekül kütleyi hesaplayınız M(C 2 HBr. Cl. F 3) = 197, 38 g/mol Sonra, bir mol bileşikteki kütle oranlarını ve yüzdelerini hesaplayınız: %C = [ (2 x 12, 01) g / 197, 38 g ] x %100 = %12, 7 9

Örnek 3. 4 10

Bir Bileşiğin Deneysel Olarak Bulunan Yüzde Bileşiminden Formülünün Bulunması 1. Elinizdeki örneğin tam 100 g olduğunu varsayın. 2. 100 g örnekteki kütleleri mollere çeviriniz. 3. Bulunan mol değerlerine uyan formülü yazın. 4. Bulduğunuz sayıları en küçüğüne bölerek indisleri tam sayı haline getirin. 5. Bu noktada indisler tam sayılardan çok az farklı ise bu rakamları tam sayıya yuvarlayın. Bir veya daha fazla indis tam sayılı değilse, bütün indisleri tam sayı yapacak küçük bir tam sayı ile çarpın. 11

Örnek 3 -5 Bir Bileşiğin Kaba ve Molekül Formüllerinin Yüzde Bileşimlerinden Bulunması Dibütil süksinat ev karıncaları ve hamam böceklerine karşı kullanılan bir böcek kovucudur. Bileşimi %62, 58 C, %9, 63 H ve %27, 79 O’dir. Deneysel olarak bulunan molekül kütlesi 230 akb’dir. Dibütil süksinatın kaba ve molekül formüllerini bulunuz. 1. Basamak: 100, 0 g örnekteki elementlerin kütlelerini belirleyiniz. 62, 58 g C; 9, 63 g H; 27, 79 g O 12

Örnek 3 -5 2. Basamak: Bütün bu kütleleri mole çeviriniz. 3. Basamak: Bulduğunuz mol sayılarına göre geçici bir formül yazınız. C 5, 21 H 9, 55 O 1, 74 4. Basamak: Geçici formüldeki her bir sayıyı en küçüğüne bölünüz. C 2, 99 H 5, 49 O 13

Örnek 3 -5 5. Basamak: Bütün sayıları tam sayı yapmak için, indisleri uygun bir tamsayı ile çarpınız. Burada 2 ile çarpmamız gerekir: C 5, 98 H 10, 98 O 2 Kaba Formülü C 6 H 11 O 2’dir. 6. Basamak: Molekül formülünün belirlenmesi. Kaba formülün kütlesi 115 akb. Molekül formülün kütlesi 230 akb. Kütle açısından farkın oranı (A) : 2 Molekül formülü C 12 H 22 O 4’dir. 14

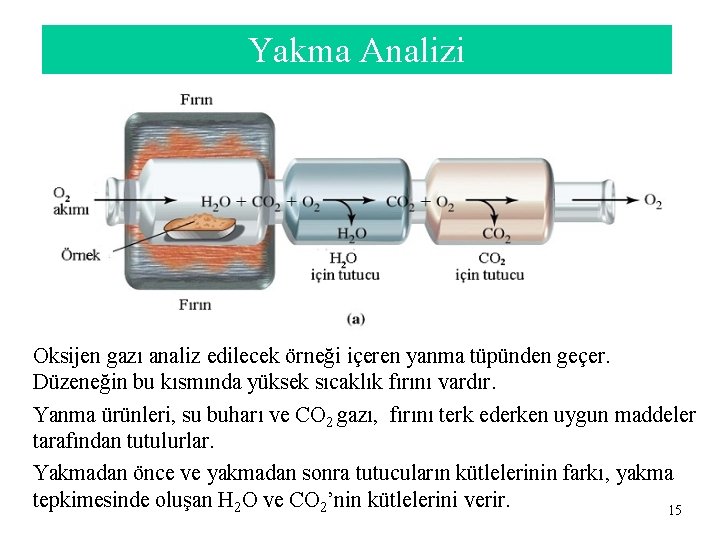
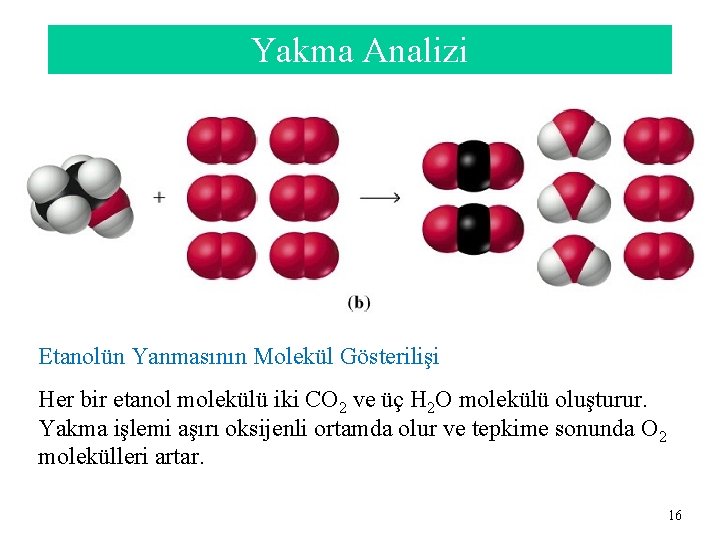
Yakma Analizi Oksijen gazı analiz edilecek örneği içeren yanma tüpünden geçer. Düzeneğin bu kısmında yüksek sıcaklık fırını vardır. Yanma ürünleri, su buharı ve CO 2 gazı, fırını terk ederken uygun maddeler tarafından tutulurlar. Yakmadan önce ve yakmadan sonra tutucuların kütlelerinin farkı, yakma tepkimesinde oluşan H 2 O ve CO 2’nin kütlelerini verir. 15

Yakma Analizi Etanolün Yanmasının Molekül Gösterilişi Her bir etanol molekülü iki CO 2 ve üç H 2 O molekülü oluşturur. Yakma işlemi aşırı oksijenli ortamda olur ve tepkime sonunda O 2 molekülleri artar. 16

Soru 1: 0, 741 g CO 2 x 1 mol CO 2 1 mol C x = 0, 01684 mol C / 0, 01677 = 1, 004 44, 01 g CO 2 1 mol CO 2 0, 645 g H 2 O x 1 mol H 2 O 2 mol H x = 0, 06747 mol H / 0, 01677 = 4, 023 18, 014 g H 2 O 1 mol H 2 O 0, 235 g N 2 x 1 mol N 2 2 mol N x 18, 014 g N 2 1 mol N 2 = 0, 01677 mol N / 0, 01677 = 1, 000 Dimetilhidrazin : CH 4 N 17

Soru 2: Cvp: Kaba formül - C 6 H 10 O 3 Molekül formül – C 12 H 20 O 6 18

3 -4 Yükseltgenme Basamakları Metaller elektron vermeye yatkındır. Ametaller elektron almaya yatkındır. Na+ + e- Cl + e- Cl- İndirgeyiciler Yükseltgenme Basamağı (Y. B): Bir atomun bileşiklerinde verdiği ya da aldığı elektron sayısını gösterir. Ör. Na+ Y. B: +1 Cl- Y. B: -1 19

Yükseltgenme Basamaklarını Belirlemek İçin Gereken Kurallar 1. Serbest element atomunun yükseltgenme basamağı (Y. B. ) 0’dır. 2. Tüm atomların yükseltgenme basamaklarının toplamı; i. Serbest atomlar, moleküller ve formül birimleri gibi nötür türlerde 0’dır. ii. Bir iyonda iyonun yüküne eşittir. 3. Grup 1 metallerinin bileşiklerinde Y. B. +1 ve Grup 2 metallerinin ise +2’dir. 4. Bileşiklerinde florun Y. B. daima -1’dir. 20

Yükseltgenme Basamaklarını Belirlemek İçin Gereken Kurallar 5. Bileşiklerinde hidrojenin Y. B. genellikle +1’dir. 6. Bileşiklerinde oksijenin Y. B. genellikle – 2’dir. 7. Metallerle yaptığı ikili bileşiklerde: i. Halojenlerin Y. B. – 1, ii. Grup 16 elementlerinin Y. B. – 2 ve iii. Grup 15 elementlerinin Y. B. – 3’tür. 21

Örnek 3 -7 Yükseltgenme Basamaklarının Belirlenmesi Aşağıda altı çizilmiş elementlerin Y. B. ’larını bulunuz? a) P 4; b) Al 2 O 3; c) Mn. O 4 - ; d) Na. H a) P 4 serbest elementtir. P’nin Y. B. = 0 b) Al 2 O 3: O – 2’dir. O 3 – 6’dır. (+6)/2=(+3), Al’nin Y. B. = +3. c) Mn. O 4 -: net Y. B. = -1, O 4 – 8’dir. Mn’nin Y. B. = +7. d) Na. H: net Y. B. = 0, Na’un Y. B. = +1’dir ve H’nin Y. B. = -1. 22

İyonik Bileşikler Katyon ve anyondaki yükler sayısal olarak farklıysa, formülü elektriksel olarak nötr hale getirmek için aşağıdaki kuralı uygularız: Katyonun alt indisi, anyondaki yüke sayısal olarak eşittir ve anyonun alt indisi, katyondaki yüke sayısal olarak eşittir. 2 x +3 = +6 Al 3+ 3 x -2 = -6 Al 2 O 3 1 x +2 = +2 O 2 - Ca 2+ 2 x +1 = +2 Na+ 2 x -1 = -2 Ca. Br 2 Br- 1 x -2 = -2 Na 2 CO 32 - 23

Alıştırma sorusu: Aşağıdaki iyon içeren iyonik bileşiklerin formüllerini yazınız: a) Kalsiyum ve oksijen Cvp: Ca. O b) Lityum ve kükürt Cvp : Li 2 S c) Alüminyum ve oksijen d) Baryum ve iyot Cvp : Al 2 O 3 Cvp : Ba. I 2 24

Kimyasal Adlandırma İyonik Bileşikler Ø metal + ametal • İstisna: NH 4+ (amonyum iyonu) Ø Anyon (ametal), “ür” ya da “it” eki alır Ba. Cl 2 Baryum klorür K 2 O Potasyum oksit Mg(OH)2 Magnezyum hidroksit KNO 3 Potasyum nitrat 25

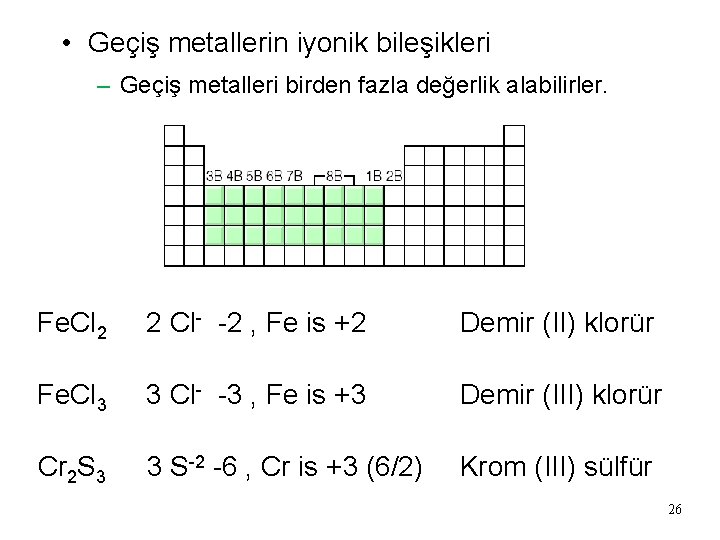
• Geçiş metallerin iyonik bileşikleri – Geçiş metalleri birden fazla değerlik alabilirler. Fe. Cl 2 2 Cl- -2 , Fe is +2 Demir (II) klorür Fe. Cl 3 3 Cl- -3 , Fe is +3 Demir (III) klorür Cr 2 S 3 3 S-2 -6 , Cr is +3 (6/2) Krom (III) sülfür 26

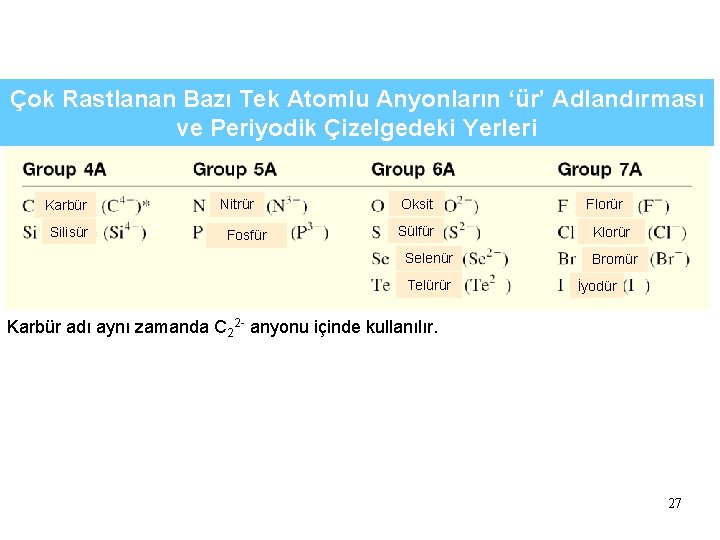
Çok Rastlanan Bazı Tek Atomlu Anyonların ‘ür’ Adlandırması ve Periyodik Çizelgedeki Yerleri Karbür Silisür Nitrür Fosfür Oksit Sülfür Selenür Telürür Florür Klorür Bromür İyodür Karbür adı aynı zamanda C 22 - anyonu içinde kullanılır. 27

Bazı yaygın tek atomlu katyonların adlandırılması Lityum Li+ Krom (II) Cr+2 Sodyum Na+ Krom (III) Cr+3 Potasyum K+ Demir (II) Fe+2 Magnezyum Mg+2 Demir (III) Fe+3 Kalsiyum Ca+2 Kobalt (II) Co+2 Stronsiyum Sr+2 Kobalt (III) Co+3 Baryum Ba+2 Bakır (I) Cu+ Aluminyum Al+3 Bakır (II) Cu+2 Çinko Zn+2 Civa (I) Hg 2+2 Gümüş Ag+ Civa (II) Hg+2 Rubidyum Rb+ Kalay (II) Kalay (IV) Sn+2 Sn+4 Sezyum Cs+ Kurşun (II) Kurşun (IV) Pb+2 Pb+4 28

Moleküler Bileşikler − Ametaller veya ametaller + yarımetaller Önekler: − Yaygın olanlar − H 2 O, NH 3, CH 4 − Genellikle ametallerin ikili bileşikleridir. − Bileşikteki ilk element bir tane ise ön ek kullanılmaz. Birden fazla ise; önce elementin sayısı ve elementin adı sonra ikinci elementin sayısı ve elementin adı sonuna ‘ür’ eki alarak yazılır. 29

29

Bazı Yaygın Çok Atomlu İyonların Adlandırılması ADI FORMÜLÜ Amonyum NH 4+ Nitrit NO 2 - Asetat CH 3 COO- Nitrat NO 3 - Karbonat CO 3 -2 Okzalat C 2 O 4 -2 Hipoklorit Cl. O- Permanganat Mn. O 4 -2 Klorit Cl. O 2 - Fosfat PO 4 -3 Klorat Cl. O 3 - Hidrojen fosfat HPO 4 -2 Perklorat Cl. O 4 - Dihidrojen fosfat H 2 PO 4 - Kromat Cr. O 4 -2 Sülfit SO 3 -2 Dikromat Cr 2 O 7 -2 Bisülfit HSO 3 - Siyanür CN- Sülfat SO 4 -2 Hidroksit OH- Bisülfat HSO 431

Asit suda çözündüğünde hidrojen iyonları (H+) veren bir madde olarak tanımlanabilir. Örnek: HCl gaz ve HCl suda • Saf madde, hidrojen klorür • Suda çözünmüş (H 3 O+ (hidronyum) ve Cl−), hidroklorik asit • Aynı formüle iki farklı isim atanabilir; Böylece: HCl (g) HCl (aq) hidrojen klörür hidroklorik asit 32

Asit formülleri bir veya daha fazla hidrojen atomunun yanı sıra bir anyonik grup içerir. İsimleri “-ür” ile biten anyonlar, “hidro-” öneki ve “-ik” ile biten asitlere sahiptir. Bazı Basit Yapılı Asitler Anyon Florür Klorür Bromür İyodür Siyanür Karşılık Gelen Asit Hidroflorik asit Hidroklorik asit Hidrobromik asit Hidroiyodik asit Hidrosiyanik asit 33

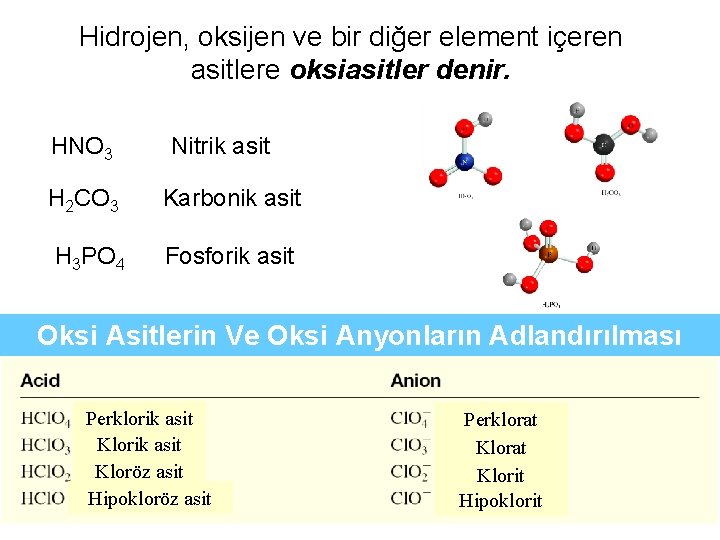
Hidrojen, oksijen ve bir diğer element içeren asitlere oksiasitler denir. HNO 3 Nitrik asit H 2 CO 3 Karbonik asit H 3 PO 4 Fosforik asit Oksi Asitlerin Ve Oksi Anyonların Adlandırılması Perklorik asit Kloröz asit Hipokloröz asit Perklorat Klorit Hipoklorit 34

Baz, suda çözündüğünde hidroksit iyonları (OH-) veren bir madde olarak tanımlanabilir. Na. OH Sodyum hidroksit KOH Potasyum hidroksit Ba(OH)2 Baryum hidroksit Bir madde su içinde çözündüğünde hidroksit iyonları verdiği sürece, yapısında baz olarak kabul edilmesi için hidroksit iyonları içermesine gerek yoktur. Amonyak (NH 3), NH 4+ ve OH- iyonlarını vermek üzere kısmen suyla reaksiyona girer. Böylece, uygun şekilde bir baz olarak sınıflandırılır. 35

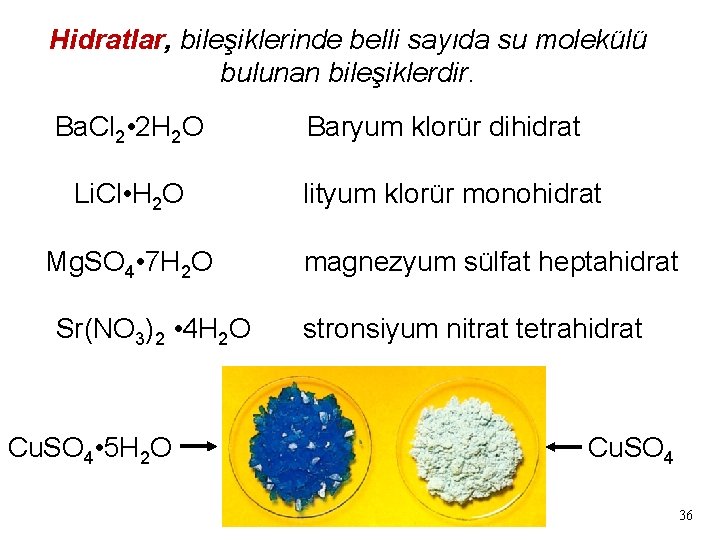
Hidratlar, bileşiklerinde belli sayıda su molekülü bulunan bileşiklerdir. Ba. Cl 2 • 2 H 2 O Li. Cl • H 2 O Mg. SO 4 • 7 H 2 O Sr(NO 3)2 • 4 H 2 O Cu. SO 4 • 5 H 2 O Baryum klorür dihidrat lityum klorür monohidrat magnezyum sülfat heptahidrat stronsiyum nitrat tetrahidrat Cu. SO 4 36

Soru 1: 40

Soru 2: (a) ICl : İyot klorür (b) Cl. F 3 : Klor triflorür (c) SF 4 : Kükürt tetraflorür (d) Br. F 5 : Brom pentaflorür (e) N 2 O 4 : Diazot tetraoksit 41

Soru 3. Aşağıdaki moleküler bileşiklerin formülü nedir? a) Dihidrojen oksit H 2 O b) Karbon tetraklorür CCl 4 c) Kükürt heksaklorür SCl 6 d) Diazot tetrahidrid N 2 H 4 39

Soru 4. Aşağıdaki bileşiklerin sistematik adı nedir? a) Al. Cl 3 - Iyonik bileşik Aluminyum klorür b) CO 2 - Moleküler bileşik Karbon dioksit c) C 2 H 6 - Moleküler bileşik Genel isim: etan, sistematik ad: dikarbon heksahidrit d) Cr. SO 4 - Iyonik bileşik; geçiş metali - Katyon Krom (II) sulfat e) (NH 4)3 PO 4 - Iyonik bileşik; çok atomlu iyon - Anyon Amonyum fosfat 40
 Sodyum metalinin su ile tepkimesi
Sodyum metalinin su ile tepkimesi Slidetodoc.com
Slidetodoc.com Modern atom teorisi alt başlıkları
Modern atom teorisi alt başlıkları Petrucci
Petrucci Klorpentan
Klorpentan Alan petrucci
Alan petrucci Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Petrucci
Petrucci Gwen harwood: selected poems
Gwen harwood: selected poems Tavistock enstitüsü araştırması
Tavistock enstitüsü araştırması Joe harwood
Joe harwood Crusher hire harwood
Crusher hire harwood Leigh harwood
Leigh harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Doug harwood
Doug harwood Okul içi gözlem ve uygulamalar
Okul içi gözlem ve uygulamalar İşlem adımlarıyla ebelikte klinik uygulamalar
İşlem adımlarıyla ebelikte klinik uygulamalar Sare değirmenci
Sare değirmenci Sıcak-soğuk uygulamalar ppt
Sıcak-soğuk uygulamalar ppt Internet ve temel uygulamalar
Internet ve temel uygulamalar Temel tasarım matris etkinliği
Temel tasarım matris etkinliği Amalgam kavite prensipleri
Amalgam kavite prensipleri Slidetodoc.com
Slidetodoc.com Heinrich prensipleri
Heinrich prensipleri Venner kron
Venner kron Sigortanın temel prensipleri
Sigortanın temel prensipleri Sagittal eksen
Sagittal eksen Futbolda hücum prensipleri
Futbolda hücum prensipleri Statiğin temel ilkeleri
Statiğin temel ilkeleri Depolama prensipleri
Depolama prensipleri Motor öğrenme prensipleri
Motor öğrenme prensipleri Box only kavite
Box only kavite Kaza zincirinin 5 temel faktörü
Kaza zincirinin 5 temel faktörü Organik kimya izomerlik
Organik kimya izomerlik Kantitatif rubrik nedir
Kantitatif rubrik nedir Adi karışım nedir
Adi karışım nedir Ideal gaz nedir
Ideal gaz nedir Derişim pilleri nernst
Derişim pilleri nernst Froma kimya
Froma kimya Entropi nedir
Entropi nedir Kimyasal hesaplamalar karışım problemleri
Kimyasal hesaplamalar karışım problemleri






























































