Genel KimyaII Moderin Kimyann Prensipleri ve Uygulamalar KONU





































![S. 1. Aluminyum-hava pilinin Epil 0 =2, 71 V dir. [Al(OH)4 ]- +3 e- S. 1. Aluminyum-hava pilinin Epil 0 =2, 71 V dir. [Al(OH)4 ]- +3 e-](https://slidetodoc.com/presentation_image_h/e621f178642da9b35201637d29217f1b/image-43.jpg)








![ELEKTROLİZ • 3. Problem (MS) (p. H=3 olan) HNO 3 aq [Ag+]=0, 1 [Pb ELEKTROLİZ • 3. Problem (MS) (p. H=3 olan) HNO 3 aq [Ag+]=0, 1 [Pb](https://slidetodoc.com/presentation_image_h/e621f178642da9b35201637d29217f1b/image-52.jpg)










- Slides: 65

Genel Kimya-II Moderin Kimyanın Prensipleri ve Uygulamaları. KONU : 21 Elektrokimya Philip Dutton University of Windsor, Canada N 9 B 3 P 4 Prentice-Hall © 2002 ⇄ ⇌ ‾ + ÷ ↑↓ ↕ | ǁ |│║ │∫∑ √ ∛ ∜ ≤ ≥ ~ ∞ ≡ ≈ Δ δ π σ υ λ α β γ Ў ψ μ t τ ζ Ψ Ω θ Χ ε φ ω η ō Ō ½ ¼ ¾ ¼ ½ ¾ ΔGo , ΔSo , ΔHo 4. 12. 2020 22: 15 GK-II K. 21 1 / 65

İçindekiler 21 -1 21 -2 21 -3 21 -4 21 -5 21 -6 21 -7 21 -8 Elektro Potansiyelleri ve Elektro Potansiyellerinin Ölçümü Standart Elektro Potansiyelleri Epil, ΔG, ve Kd Epil in Derişime Bağımlılığı Piller Kimyasal Tepkimelerden Elektrik Üretimi Korozyon: İstenmeyen Volta Hücreleri Elektroliz : İstemsiz Kimyasal Tepkimelerin Oluşum Nedeni Endüstriyel Elektroliz İşlemleri Özel Konu Membran Potansiyelleri GK-II K. 21 2

GK-II 21. KONU ELEKTRO KİMYA • Elektro kimya Elektriğin kimyasal reaksiyonla üretimini ve elektriğin kimyasal reaksiyonlara etkisini inceleyen bilimdalıdır. • Elektrik yüklü partiküllerin hareketiyle meydana gelen bir enerjidir. Doğada en bol olan, en kolay ve en hızlı hareket edebilen yüklü partikül éolduğu için tek anlamıyla yeryüzündeki ELEKTRİK de, é hareketiyle oluşur. Oluştuğu ortamda ısınma , manyetizma ve kimyasal değişmeler meydana gelir. Isınma, yüklü partiküllerin hareketi sırasındaki çarpışma ve sürtünmelerden, manyetizma ise sıralanmalardan kaynaklanır. Kimyasal reaksiyonlar ise é alıp verildiği zaman oluşur ve daha çok iyonik iletme olayının olduğu ELEKTROLİZ olayında görülür. • Elektriği iletmeyen maddelere YALITKAN adı verilir bunların iç yapısı yüklü partiküllerin hareketine izin vermezler, dirençleri >108 ohm /cm dır. • Elektriği ileten maddelere İLETKEN adı verilir, 5 tür iletken vardır: GK-II K. 21 3

İLETKENLER • • • Elektriği ileten maddelere İLETKEN adı verilir, 5 tür iletken vardır: 1. sınıf (metalik, elektronik )iletkenler e’ hareketliliği büyük olan metallerdir. öz dirençleri 10 -6 ohm. cm ile 10 -3 ohm. cm arasındadır. grafit bazı sülfür ve oksijende bu sınıfa girer. 2. sınıf (elektrolitik, iyonik) iletkenler. bunlar asit baz ve tuzların aq çözeltileri olup iyon hareketliliği elektrik iletimi sağlanır. İletkenlik, sıcaklıkla 1. sınıfta azalır. 2. sınıfta artış gösterir. 3 -Yarıiletkenler (Yİ) (semicondüktors ): öz dirençleri 109– 102 ohm. cm arasında olan Si, Ge ve bazı element ve bileşiklerde gölülür. Kirlenme durumuna göre n ve p tipi Yİ oluşur. n ve p tipi Yİ ile elektrik akımını istenildiği gibi yönlendirebilir, frenleyebilir. Böylece elektronik sanayinin temel elemanları direnç diyot, triyod ve entegre devreler oluşturulur. 4 -Karma iletkenler: Değişik sıcaklıklarda metalik ve iyonik iletkenlik gösterebilen maddelerdir. Örneğin Cu. I 240ºC > tº ise metalik t ºC = 240 ºC -340 ºC karma 380 ºC üstünde iyonik iletkenlik gösterir. 5 -Süper iletkenler: Sıfır veya sıfıra yakın dirençle é hareketine izin veren maddelerdir. Genellikle bir çok metal 0ºK civarında süper iletkendir. Bazı alaşımlar yüksek basınç altında daha yüksek sıcaklıkta süper iletken özellikte yapılar oluşturabilmektedir. 300 atm basınç altında oluşturulan Seramik Cu-O alaşımı 75ºK de süper iletkenlik gösterebilmektedir, bu sıcaklık sıvı N 2 ile ekonomik olarak sağlandığı için oldukça önemlidir. Seramik Cu-O yapısı normalde 35º K, YBa 2 Cu 3 O 7 yapısı 95ºK de süper iletkendir. Süper iletkenler birçok elektronik malzemede, çok güçlü elektro mıknatıs yapımı, süper hızlı tren teknolojisi, güçlü görüntüleme cihazlarında oldukça önemlidir. Bi 2 Sr 2 Ca. Cu 2 O 8→ 110ºK , Tl. Ba 2 Ca 3 Cu 4 Oy → 125ºK 4

1. SINIF (METALİK) = (ELEKTRONİK) İLETKENLER: • • • 1. SINIF (METALİK)=(ELEKTRONİK) İLETKENLER: Delekolize e’ yapıları nedeniyle metallerde bir gerilim (potansiyel) farkı oluşturulduğunda é lar metal üzerinde kolayca akar, metal üzerinde birikim olmadan bir uçtan gerilim farkı ile pompalanan é lar diğer uçtan akarak elektrik iletimi sağlanır. Ancak metalin direnci ısınma v. s. gibi nedenlerle çok azda olsa bir é kaybı olur ve iletim esnasında iletken çevresinde elektrik akımı oluşturur. Pompalanan é iletildiği için Atom ve moleküllerde herhangi bir é alış-verişi ve kimyasal reaksiyon olmaz. . Kaynaktan verilen é hızına yakın hızda metalden é akışı meydana gelir. Bir iletkende é akımının şiddeti (é akış hızı) AKIM ŞİDDETİ=I=Q/t (amper = columb) / san. ) olup bir noktadan san’de geçen Coulomb yük miktarıdır. 1 Coulomb elektrik yükü = 6, 24 x 1018 é yüküne eşittir. V=Ix. R 1 volt gerilim (potansiyel farkı) 1 amper şiddetinde akımın, direnci 1 ohm olan iletkenden geçişinde oluşur. V(volt)=I. R=W (watt =joule/san) /Q(coulomb , 1 e’ yükü ~ 96500 /6, 023 x 1023 =1, 6 x 10 -19 Coulomb 1 ekv-g madde için yani NA=6, 023 x 1023 adet é alış-verişiyle 1 Faraday ~96500 coulomb akım miktarı kullanılır. Volta temas nazariyesi : farklı iki metal birbirine değer veya herhangi bir şekilde é iletebilecek şekilde birleştirilirse daha az soy olan é verir yükseltgenir (anot olur), daha soy olan é alır ve indirgenir (katot olur) En soydan metalden en aktif metale doğru Soyluk sırası Ag-Au-Pt-Cu-H-Pb- Sn-Fe-sn-Al –Mg-Na-Li 5

2. sınıf (iyonik= elektrolitik) iletkenlik, PİL-AKÜ Cu(k) + 2 Ag+(aq) Cu 2+(aq) + 2 Ag(k) Ters yönde olmaz Cu(k) + Zn 2+(aq) bu yönde rx vermez, Ters yönde olur 2. sınıf (iyonik= elektrolitik) iletkenlik , elektrik akımı çözeltilerde veya bazı tip iyonik katılarda serbestçe hareket edebilen atom, molekül ve iyonların é alış-verişi ile olan redoks rx’larıyla oluşur, dolayısıyla redoks rx’larıyla PİL-AKÜ gibi düzeneklerden elektrik üretilir. Öte yandan , bir kaynaktan sağlanan elektrik akımıyla é verilerek normalde istemsiz olan ELEKTROLİZ rx oluşur. REDOKS Reaksiyonları ile é (ELEKTRİK) üretimi - PİL VE AKÜ Bir metal kendi tuzunun çözeltisine batırılırsa bir yarı hücre oluşur. Burada metale yük. n+ elektrot, çözeltiye elektrolit adı verilir. Etkileşim dolayısıyla M(k) ind. ⇄ M (aq) + ne dengesi olur, metal aktifse rx sağa doğrudur (YÜK. ). Metal soysa (az aktif) rx sola doğrudur (İND. ) Bu şekilde aynı veya iki farklı konsantrasyonda yarı hücre bir tuz köprüsü veya iletkenlikle birleştirilirse GERİLİM (Potansiyel=Voltaj) farkı nedeniyle é yük yoğunluğu fazla olan hücreden daha az olan hücreye doğru é akışı, ELEKTRİK meydana gelir. 6

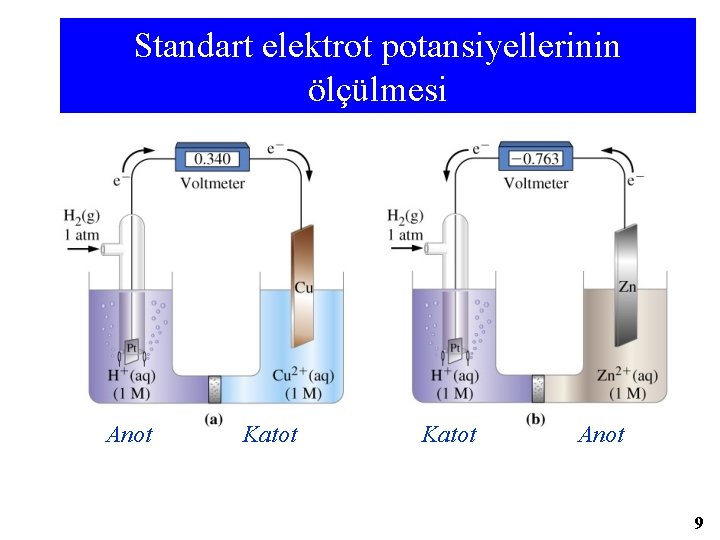
Elektrot Potansiyelleri ve Elektrot Potansiyellerinin Ölçümü Elektrokimyasal Pil – SHE (Standart Hidrojen Elektrot) ELEKTROT ÇEŞİTLERİ pillerde üç tip elektrot kullanılır. 1 -AKTİF ELEKTROT rx iştirak eder ve çözünür veya çöker. Cu, Ag, Zn, vs gibi. 2 -İNERT(ASAL) ELEKTROT: pil rx’da değişmez Pt ve C (grafit ) elektrotlar gibi. 3 -GAZ ELEKTROT. Genellikle bir gaz ile doyurulmuş metaldir. SHE (standart H-elektrot) Pt yüzeyinin 1 atm H 2 basıncında doyurulmasıyla oluşur. H 2 ⇄ 2 H+ +2é Eº=0 alınır Pt(k) | H 2(g, 1 atm ) | H+ 1 M (aq) Eº=0. Pt(k)|H 2(g, 1 bar)|H+(a = 1) EMK (Eº=standart pil potansiyeli) ÖLÇÜMÜ : Bir metalle oluşturulan yarı pil standart H-elektrotla eşlenerek meydana gelen pilin voltajı (EMK)ölçülür ve tablolar yapılır. Eº ind ‘e göre yapılan tablolardan iki yarı pilden hangisinin ANOT (yükseltgenme) hangisinin KATOT(indirgenme) olacağı belirlenebilir ve bu değerlere göre pil oluşturulup E pil bulunup şeması yazılabilir. E ind tablodan alınır eğer gerekirse E ind = - E yük yapılır. 7

PİL ŞEMASI –PİL rx. - PİL VOLTAJI PİL Şeması A(-) Zn (k) | Zn 2+(aq) || Ni 2+(aq) | Ni (k) (+)K < Elektrot Potansiyelleri Eo. Zn 2+ /Zn =-0, 763 v Eo. Ni 2+/Ni= - 0, 25 v (İnd) A. SOL(-) kutup ANOT Yük. (Elkrt Zn (k) | Zn 2+(aq) Elklt)-Eo. Zn /Zn 2+ = 0, 763 v K. SAĞ (+) kutup KATOT İnd. Elklt Ni 2+(aq) | Ni (k) Elkrt Eo. Ni 2+/Ni= - 0, 25 v Toplam pil rx = Anot rx+Katot rx Ni 2+ + Zn 2+ + Ni Pil voltajı Eopil = Eo. Sağ. İnd. + Eo. Sol. Yük = Eo. Kat. İnd. - Eo. An. İnd. = -0, 25+0, 763 = 0, 513 v Anot ve Katotta Fiziksel ayrı kısımlar Tekli çizgi ( | ) , Elektrolitleri birbirine bağlayan Tuz Köprüsü ikili çizgi (||) ile gösterilir. Eğer çözeltiler Standart Halde (1 M) ise (aq) yeterlidir. Farklı konsantrasyonlar ise Mutlaka belirtilir. 8

Standart elektrot potansiyellerinin ölçülmesi Anot Katot Anot 9

Standart hücre potansiyelleri Pt|H 2(g, 1 bar) | H+(a=1) || Cu 2+(1 M) | Cu(s) E°pil= 0, 340 V E°pil = E°indsağ - E°indsol = Eo. Kat. İnd. - Eo. An. İnd. = Eo. Kat. İnd. + Eo. An. Yük E°pil = E°Cu 2+/Cu - E°H+/H 2 0. 340 V = E°Cu 2+/Cu - 0 V E°Cu 2+/Cu = +0. 340 V H 2(g, 1 atm) + Cu 2+(1 M) → H+(1 M) + Cu(s) E°pil = 0. 340 V 10 / 65

11

İndirgenme Yarı-reaksiyonların (y. rx. ) Toplamı ÖR: İndirgenme Yarı rx E°Fe 2+/Fe = -0. 440 V , E°Fe 3+/Fe 2+ = 0. 771 V Reaksiyonlar Birleştirerek oluşan Toplam rx. ’nu ve ΔG°= ? E° = ? 1) Fe 2+(aq) + 2 e- → Fe(k) E°Fe 2+/Fe = -0. 440 V ΔG° 1 = +0. 880 J 2) Fe 3+(aq) + e- → Fe 2+(aq) E°Fe 3+/Fe 2+ = 0. 771 V ΔG° 2 = -0. 771 J 1+2) Fe 3+(aq) + 3 e- → Fe(s) ΔG° 1+2= +0. 109 J E° 3+ = +0. 331 V Fe /Fe ΔG° = +0. 109 V = -n. FE° E°Fe 3+/Fe = +0. 109 V /(-3 F) = -0. 0363 V Ancak bir PİL oluşturmak üzere iki rx birleştirirse E A<EK olur ve A(-)…. (+)K şemasına göre pil olursa E°pil = E°indsağ - E°indsol = Eo. Kat. İnd. - Eo. An. İnd. = Eo. Kat. İnd. + Eo. An. Yük olacaktır. 12

YARI-Reaksiyonların Pil oluşturması • Tüm REDOKS rx. ları iki yarı rx. dan oluşur. Zn 2+(aq) + 2é → Zn(s E 0 ind = - 0, 763 V YÜKSELTGENEN ( - sol kutup, Anot) Cu 2+(aq) + 2 e- → Cu(s) E 0 ind = + 0, 340 V İNDİRGENEN ( + sağ kutup, Katot) Pil şeması -ANOT yük. Zn(k) | Zn 2+(aq) ║ Cu 2+ (aq) | Cu +KATOT ind Toplam Pil rx: Cu 2+(aq) + Zn(s) → Cu(s) + Zn 2+(aq) Pil voltajı Eopil = sol kt. E 0 ind - sağ kt. E 0 ind 0, 340 -(-0, 763) = 1, 103 v. 13

yarı-rx ile Pil rx. (olabilen toplam redoks rx) ve Elektroliz rx. şeklinde yazımı. A) Fe 2+(aq) + 2 e- → Fe(k) E° Fe 2+ /Fe =0. 44 V Pil rx Fe 2+(aq) + Cu(k)→ Fe(k)+ Cu 2+(aq) B) Cu 2+(aq) + 2 e- → Cu(k) Eº Cu =0, 34 V 2+→Cu El. rx Fe(k) + Cu 2+(aq) → Fe 2+(aq) + Cu(k) ********************************** C) 2 Br- (aq) → Br 2(aq)+ 2 e- -E° Br- /Br 2= -1, 065 V Pil rx 2 Br -(aq)+ Cl 2 (aq) → Br 2(aq)+ 2 Cl-(aq) D) Cl 2 (aq) + 2 e- → 2 Cl- (aq) EºCl 2→Cl-= 1, 36 V El. rx. Br 2(aq)+ 2 Cl-(aq) → 2 Br -(aq)+ Cl 2 (aq) ******************************** E) Cl- (aq) → Cl. O 3 - (aq) +6 e- } * 5 -E°Cl- /Cl. O 3 -= -1, 07 V F) Mn. O 4 - (aq) +5 e- → Mn+2(aq)}* 6 EºMn. O 4 - →Mn 2+= 1, 51 V Olabilecek Toplam rx: 5 Cl- (aq)+6 Mn. O 4 -(aq) +18 H+ (aq) → 5 Cl. O 3 -(aq)+ 6 Mn+2 (aq) + 9 H 2 O(s) ********************************** SORU : Zn(k), E 0 ind = - 0, 763 V Zn’un katot olduğu bir volta pilinde Anot aşağıdakilerden hangileri olabilir? a)Mn, E 0 ind= 0, 417 v, b) Po, E 0 ind= - 1, 13 v, c) Ti, E 0 ind = 0, 87 v, d. ) E 0 ind = 0, 37 v CEVAP : Zn 2+ indirgendiği için, diğer metal yükseltgenecektir. Eo. M ind<Eo. Zn ind= -0, 763 v. olur. a) E 0 pil= E 0 Zn(ind) - E 0 Mn(İnd) = - 0, 737 v - 0, 417 v = - 1, 180 v b) E 0 pil=E 0 Zn(ind) - E 0 Po(ind) = - 0, 737 v – (- 1, 13 v) = + 0, 37 v c) E 0 pil= E 0 Zn(ind) - E 0 Ti (ind) = - 0, 737 v - 0, 87 v = - 1, 63 v d) E 0 pil = E 0 Zn(ind) - E 0 V(ind) = - 0, 737 v - 0, 37 v = - 1, 13 v Görüldüğü gibi Uygun olan Anot B şıkkıdır. 14

Çözümlü Sorular Eºind Zn 2+/Zn = - 0, 76 v Eºind. Cl 2 /Cl-= 1, 36 v çalışan pil oluştur, rx ve şemasını yaz Eºpil=? ÖRNEK 21/2 739 ÇÖZÜM : Eºind. Cl 2 /Cl-= 1, 36 v > Eºind Zn 2+/Zn =0. 76 olduğu için İND. ( KATOT) Cl 2, YÜK. (ANOT) Zn olur. Zn(k)|Zn 2+(aq) ║Cl- (aq) |Cl 2 |Pt +KATOT ind. Epil=Eºsağind -Eºsolind =Eºsağind +Eºsolyük=1. 36 + (0. 76)= 2. 12>0 olur. Pil reaksiyonu: Zn (k) + Cl 2 (g) →Zn Cl 2 (aq) Pil şeması -ANOT yük. A) Eºyük Fe 2+ → Fe 3+ = -0, 77 V B) Eºind. Mn. O 4‾→Mn 2+=1. 51 V Çalışan Pil oluşturunuz. ÖRNEK 21 -2/ 739 ÇÖZÜM : Bind>Aind olduğundan B İND. KATOT A YÜK. ANOT tarafını oluşturur. 15

Asit ortamda yarı rx. lardan oluşan PİL, Pil rx, Epil, şema ? Anot rx : Fe 2+ → Fe 3+ + e‾ Eºsolyük = -0. 77 V Katot rx : Mn. O 4‾+8 H+ + 5é → Mn 2+ +4 H 2 O Eºsağind =1, 51 v TOPLAM PİL rx 5 Fe 2+aq+ Mn. O 4‾aq+ 8 H+→ 5 Fe 3+ + Mn 2+aq+4 H 2 O Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 0, 77) = 0, 74 V PİL ŞEMASI -ANOT Fe | Fe 2+aq║ Mn. O 4‾aq|H+| C (k) KATOT+ ÖRNEK 21 -2 A/507 A) Eºyük. Fe 2+→Fe 3+ = - 0, 77 v B) Eºind Cl 2→Cl ‾ = 1, 36 v rx yaz, Epil=? ÇÖZÜM : 2 Fe 2+ (aq) +Cl 2 (g) → 2 Fe 3+(aq) + 2 Cl‾(aq) Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 36 + (-0, 77) = 0, 59 v. 16

REDOKS REAKSİYONLARININ DENKLEŞTİRİLMESİ A) YÜK DENKLİĞİ ile DENKLEŞTİRME : Önce (Aé=Vé) yapılır. ve H ve O dışındaki atomlar (Aé=Vé)’ göre denkleştirilir. Yüke bakılır, YÜK DENKLİĞİ sağlanacak şekilde Asit Ort. da H+, Baz Ort. da OH- ilave edilip Uygun tarafa H denkliği oluşacak şekilde H 2 O ilave edilir. B)YARI RX (Aé=Vé) YÖNTEMİ (The. Half-Reaction (Ion-Electron)Method İND. ve YÜK. YARI rx. lar ayrı yazılıp denkleştirilir. ASİDİK ortamda O fazlası olan tarafa H+ , karşıya H 2 O eklenir. BAZİK ortamda O fazla olan tarafa H 2 O, karşıya OH- eklenir Aé=Vé şeklinde her iki yarı rx. Ayarlanır. Denkleşmiş ve Aé=Vé yapılmış olan iki yarı rx TOPLANIR ve SADELEŞTİRİLİR. ATOM sayıları ve YÜK DENKLİĞİ son kez kontrol edilip bir hata olup olmadığına bakılır. 17

ASİT/BAZ ORTAMDA DENKLEŞTİRME ÖRNEK: SO 32 -(aq) + Mn. O 4 -(aq)→ SO 42 -(aq) + Mn 2+(aq) rx’unu asit/Baz ortamda denkleştiriniz. A) SO 32 -(aq)+H 2 O(s) →SO 42 -(aq) +2 H+(aq) +2 e- *5 -Eo= + 0, 17 v B) B) Mn. O 4 -(aq) + 8 H+(aq)+5 e- → Mn 2+(aq) + 4 H 2 O(s) *2 Eo= + 1, 51 v Top. 5 SO 32 - (aq)+2 Mn. O 4 - (aq) +5 H 2 O(s)+16 H+ (aq)→ 5 SO 42 - (aq) +2 Mn 2+ (aq) +8 H 2 O (s) +10 Asit. Ort. 5 SO 32 -(aq) + 2 Mn. O 4 -(aq) + 6 H+(aq) → 5 SO 42 - (aq) + 2 Mn 2+(aq) + H+ (aq) 3 H 2 O(s) • YÜK DENGESİ için Önce Aé=Vé yapılır. A)’da Vé=2é, B)’de Aé=5é, olduğuna göre A* 5 ile B*2 yapılır. Sonuçda Sol tarafta -12 yük, Sağ tarafta (-10+4= - 6) yük olduğundan Asit Ort. için sola (+6 H+ ), H eşitliği için Asit ort. da sağa (+ 3 H 2 O)ilave edilir. • Baz Ort. isteniyorsa sağa (+6 OH - ), H eşitliğini sağlamak içinde sola (+ 3 H 2 O) ilave edilmelidir. Baz Ort. 5 SO 32 -(aq) + 2 Mn. O 4 -(aq) + 3 H 2 O(s) → 5 SO 42 - (aq) + 2 Mn 2+(aq) + 6 OH -(aq) • Eopil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 0, 17) = 1, 34 V>0 18

ASİT/BAZ ORTAMDA DENKLEŞTİRME Cl -(aq) → Cl. O 3 - (aq) , Mn. O 4 - (aq) → Mn 2+ (aq) yarım rx’ları Asit/Baz ort. birleştiriniz. A) Yük. : {Cl-(aq) + H 2 O(s) → Cl. O 3 - (aq)+ 6 H+(aq) +6 e- } * 5 -E°Cl- /Cl. O 3 -= -1, 07 V B) İnd. : {Mn. O 4 - (aq) +8 H+(aq) +5é→ Mn+2(aq)+4 H 2 O(s) } * 6 EºMn. O 4 - →Mn 2+= 1, 51 V • Toplam rx 5 Cl- (aq) + 6 Mn. O 4 - (aq) + 48 H+ (aq) +5 H 2 O (s) • → 5 Cl. O 3 - (aq) + 6 Mn+2 (aq) + 24 H 2 O (s) + 30 H+ (aq) Asit Ort. Tp. Net: 5 Cl-(aq)+6 Mn. O 4 -(aq) +18 H+ (aq) → 5 Cl. O 3 -(aq) + 6 Mn+2 (aq) + 9 H 2 O(s) Eopil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 1, 07) = 0, 34 V>0 • Yük dengesi için Önce Aé=Vé yapılır. Vé=6é, Aé=5 olduğuna göre A*5 ve B*6 yapılır. Sağ tarafta + 7 yük, Sol tarafta (– 11) yük olduğundan • Asit Ort. için sola (+18 H+ ), H eşitliğini sağlamak için de sağa (+ 9 H 2 O) yazılır. Baz Ort. için sağa (+18 OH - ) , ve H eşitliği için de sola (+ 9 H 2 O) ilave edilmelidir. Baz Ort. Tp. Net: 5 Cl-(aq) + 6 Mn. O 4 - (aq)+ 9 H 2 O(s) → 5 Cl. O 3 -(aq) +6 Mn+2(aq) + 18 OH- (aq) 19

ASİT/BAZ ORTAMDA DENKLEŞTİRME Yük. rx : Fe 2+ → Fe 3+ + e‾ (Asit ortam) -Eºsolyük = -0. 77 V İnd. rx : Mn. O 4‾+8 H+ + 5é → Mn 2+ +4 H 2 O (Asit ortam) Eo= + 1, 51 V Asit Ort. da 5 Fe 2+aq+ Mn. O 4‾aq+ 8 H+→ 5 Fe 3+ + Mn 2+aq+4 H 2 O Baz Ort. da 5 Fe 2+aq+ Mn. O 4‾aq+ 4 H 2 O→ 5 Fe 3+ + Mn 2+aq+8 OH- • Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük =1, 51 + (- 0, 77) = 0, 74 V ÖRNEK Mo→Mo. O 4= ve Sb 2 O 5→ Sb. H 3 yarı rx. asit/baz ort. denkleştiriniz. ? • CEVAP: 8/ Mo + 4 H 2 O → Mo. O 4= + 8 H+ + 6é - Eºyük = 0, 08 v - E ind =1, 77 v • Asit Top. rx. 8 Mo+3 Sb 2 O 5 +17 H 2 O → 8 Mo. O 4= + 6 Sb. H 3 + 16 H+ olur. • 3/ Sb 2 O 5+ 16 H+ + 16 é → 2 Sb 3+H 3+ 5. H 2 O • Yük dengesi ile denkleştirmek için önce Aé=Vé yapılır, Sağda -16 yük olduğundan Asit ort. için sağa (+16 H+), H dengesi için de sola +17 H 2 O ilave edilir. Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = 1, 77 + 0, 08 = 1. 85 v >0 • Baz ort. için sola (+16 OH - ) ve H dengesi için de sola +H O ilave edilmelidir. 2 Baz Top. rx. 8 Mo+3 Sb 2 O 5 + H 2 O + 16 OH - → 8 Mo. O 4= + 6 Sb. H 3 olur. 20 / 65

ASİT/BAZ ORTAMDA DENKLEŞTİRME ÖRNEK : Mn. O 4 -(aq) → Mn. O 2(k) ve CN-(aq) → OCN-(aq) yarı rx larından Baz/Asit ortamda tam ve denk rx oluşturunuz. A) (Mn 7+O 4)-(aq)+2 H 2 O + 3é → Mn 4+O 2(k) + 4 OH - (aq) *2 Eºind = - 1, 695 v (C 2+N 3 - )- (aq) + 2 OH -(aq) → (O=C 4+N 3 - )- (aq) + H 2 O + 2 e- *3 - Eºyük = 1, 98 v B) 2(Mn. O 4)-(aq) + 4 H 2 O + 6 e- → 2 Mn. O 2(k) + 8 OH - (aq) 3 CN- (aq) + 6 OH - (aq) → 3 OCN- (aq) +3 H 2 O + 6 e-_______ C) 2 Mn. O 4 -(aq) + 3 CN- (aq) + 6 OH - (aq)+ 4 H 2 O + 6 e- → 2 Mn. O 2(k) + 8 OH – +3 OCN- (aq) +3 H 2 O + 6 e- Baz Ort. 2 Mn. O 4 -(aq) + 3 CN-(aq) + H 2 O → 2 Mn. O 2(k) +3 OCN -(aq) + 2 OH - (aq) Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = -1, 695 + 1, 98 = 0, 285 V > 0 Yük dengesi ile denkleştirmek için. Önce Aé=Vé yapılır. Aé=3, Vé=2é olduğu için A*2, B*3 yapılır, Sonuçda Sol tarafta ise -5 yük, Sağ tarafta -3 yük olduğundan dengenin sağlanması için BAZ Ort. da sağa (+2 OH - ) ve H eşitliği için sola + H 2 O yaz. Asit Ort. İçin sola + 2 H+ , sağa + H 2 O yazılır. Asit Ort. 2 Mn. O 4 -(aq) + 3 CN-(aq) + 2 H+ (aq) → 2 Mn. O 2(k) +3 OCN -(aq) + H 2 O 21

ASİT/BAZ ORTAMDA DENKLEŞTİRME Cr. O 4 = (aq) + S 2 O 4 = (aq) Cr(OH)3 (s) + SO 3 = (aq) rx bazik ortamda denkleştiriniz. b) 100 L atık su için [Cr. O 4 =] = 0, 0148 M içeren çözeltiye harcanacak Na 2 S 2 O 4 (174 g/n) kütlesi ne kadar olur? (08 Yaz V 1) a) • CEVAP a) Cr+6 O 4=(aq) + 4 H 20 + 3é Cr+3(OH)3 + 5 0 H- (-2 -3é=X=- 5 OH-)olur Eºind = - 0, 13 v b) S 2+3 O 4=(aq)+4 0 H- 2 S 4+O 3 = (aq)+2 H 20 + 2é (-2 -X=-(2*2)-2 X=4 OH-olur - Eºyük = 2, 03 v 2 Cr. O 4=(aq) + 8 H 20 + 3 S 2 O 4=(aq)+12 0 H- 2 Cr(OH)3 + 10 0 H- + 6 SO 3=(aq) +6 H 2 O - Baz Ort. için 2 Cr. O 4=(aq) + 3 S 2 O 4=(aq) + 2 H 20 + 2 0 H 2 Cr(OH)3 + 6 SO 3=(aq) Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = -0, 13 + 2, 03 = 1, 9 V > 0 b) Na 2 S 2 O 4=174 g/n 1 L için 0, 0148 x 174 x 3/2=12, 528 g gerekli 100 L için 1, 2528 kg gerekir. Yük dengesi ile denkleştirmek için. Önce Aé=Vé yapılır. Aé=3 Vé=2é olduğuna göre 2 ve 3 ile çarpılır. Sonuç da Sağ da tp (– 12) yük, solda ise ( - 10) yük olduğundan, Baz ort. için sola (+2 OH - ) ve H dengesi için yine sola + 2 H 0 yazılır. 2 Asit ort. için sağa (+2 H+) ve H dengesi için de yine sola + 4 H 20 yazılır. Asit Ort. için 2 Cr. O 4=(aq) + 3 S 2 O 4=(aq) + 4 H 20 2 Cr(OH)3 + 6 SO 3=(aq) + 2 H+ 22

ASİT/BAZ ORTAMDA DENKLEŞTİRME (09 Güz V 1) Cr. I 3 (aq) + H 2 O 2 (aq) Cr. O 4 = (aq) + IO 4 - (aq) rx bazik ortamda denkleştiriniz. CEVAP a) Cr+3 I-3(aq) +32 OH- [Cr+6 O 4]=(aq+ 3 I 7+O 4 - +16 H 2 O +[3é +(3*8=)24é] *2 b) H 2 O-2 (aq) 2 O=H-(aq) + 2é olur *27 Toplam rx 2 Cr. I +64 OH-+ 27 H O 3(aq) 2 - Eºyük = 0, 13+1, 74=1, 87 v Aé=Vé için 2 a+27 b yapılıp toplanırsa 2 (aq) 2 Eºind = 0, 93 v Cr. O 4=(aq) + 6 IO 4 - +32 H 2 O+ 54 OH-(aq) - Baz Ort. 2 Cr. I 3(aq)+ 27 H 2 O 2 (aq) + 10 OH 2 Cr. O 4=(aq)+ 6 IO 4 - + 32 H 2 O olur. Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = 0, 93 + 1, 87 = 2, 8 V > 0 Yük dengesi ile denkleştirmek için Önce Aé=Vé yapılır. Vé=27é Aé=2 olduğuna göre uygun maddeler 2 ile ve 27 ile çarpılır. Sağ tarafta toplam -10 yük, sol tarafta herhangi bir( - ) yük olmadığı için dengenin sağlanması için BAZ Ort. da sola ( +10 OH- ) yazılır, H dengesi için de sağa + 32 H 2 O ilave edilir. Asit Ort. için sağa ( +10 H+ ) yazılır, H dengesi için de sağa + 22 H 2 O ilave edilir. - + Asit Ort. 2 Cr. I 3(aq)+ 27 H 2 O 2 (aq) 2 Cr. O 4=(aq)+ 6 IO 4 + 10 H + 22 H 2 O olur 23

ASİT/BAZ ORTAMDA DENKLEŞTİRME Kandaki alkol (C 2 H 5 OH) miktarı, kan plazmasının Asit ortamda Cr 2 O 72 -aq) ile titrasyonuyla bulunur. 28 g plazma için 26 m. L 0, 03 M. Cr 2 O 72 - (aq) çözeltisi sarf edildiğine göre, kandaki alkolün % nedir? Titrasyon rx Cr 2 O 72 -(aq)+ C 2 H 5 OH(aq) → Cr 3+(aq)+ CO 2(g) ➨CEVAP: m. Et. Al=0, 03*26*10 -3*(1/2)*46*(100/28) =0, 069 %Et. Al Yün Dengesi ile 2 Cr 6+2 O 72 -(aq)+ C 2 -2 H 5 OH(aq) +16 H+ (± 12é) → 4 Cr 3+(aq)+ 2 C 4+O 2(g)+ 11 H 2 O Solda -4 yük, Sağda +12 yük var ASİT Ort. da Yük Dengesi için sola +16 H+, sağa +11 H 2 O BAZ Ort. İçin de sağa +16 OH- sola + 5 H 2 O yazılırsa, Yük ve madde dengesi oluşur. YARI REAKSİYON YÖNTEMİ Asit Ortamda İLE DENKLEŞTİRME : 2/ Cr 6+2 O 72 -(aq)+ 14 H+ +6é → 2 Cr 3+(aq)+ 7 H 2 O Eºind = 1, 33 v C 2 -2 H 5 OH(aq+ 3 H 2 O → 2 C 4+O 2(g) +12 H+ +12é - Eºyük = 0, 24 v 2 Cr 6+2 O 72 -(aq)+ C 2 -2 H 5 OH(aq) + 16 H+ (± 12é) → 4 Cr 3+(aq)+ 2 C 4+O 2(g)+ 11 H 2 O YARI REAKSİYON YÖNTEMİ Baz Ortamda İLE DENKLEŞTİRME : 2 Cr 6+2 O 72 -(aq)+ C 2 -2 H 5 OH(aq) )+ 5 H 2 O (± 12é) → 4 Cr 3+(aq)+ 2 C 4+O 2(g+ 16 OH- Epil=Eºsağind -Eºsolind =Eºsağind + Eºsolyük = 1, 33 + 0, 24 = 1, 57 V > 0 24

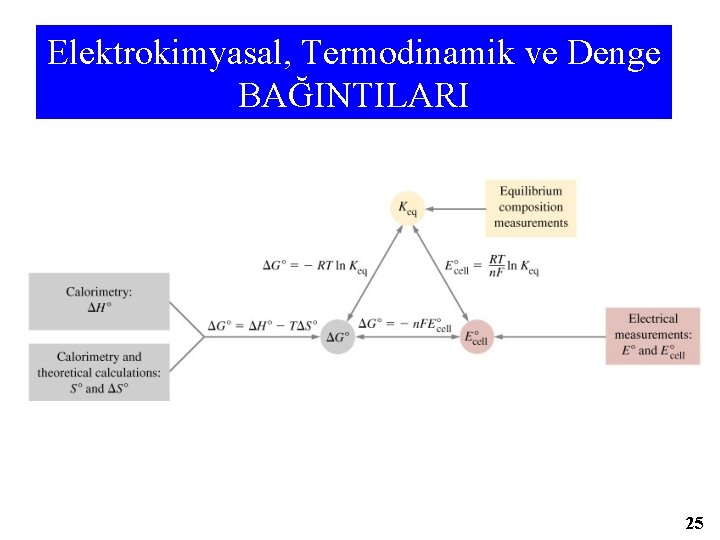
Elektrokimyasal, Termodinamik ve Denge BAĞINTILARI 25

ELEKTRİKSEL İŞ Welk=n F Epil ΔG=-n. F Epil ΔGº= - n. F Eºpil n: elektrotlar arasında alışverişi yapılan e’(mol) sayısı F = FARADAY SABİTİ~96500 coulomb 1 ekv-g madde(NA sayıda é alınıp verilmesi ile gerekli elektronik yük miktarıdır. ΔGo = -RTln. K = -n. FΔEopil NERST DENKLEMİ ΔEpil RT ln. K 0. 0592 log K = = n. F ΔG= ΔGº + (RT/n. F) x (ln. Q) Eºpil +RT ln. Q n -n. FEpil=-n. F Epil=Eºpil- (RT/n. F) x ln. Q 26

İSTEMLİ HAL- ELEKTRİKSEL İŞ E pil > 0 istemli rx ΔG<0 olur. ΔG=0 Denge halidir. Epil< 0, ΔG > 0 İSTEMSİZ HAL NERST DENKLEMİ Epil = Eopil - R T/n. F. ln. K log Q E pil = Eºpil - RT ln. K = Eºpil - 0, 0592 n n. F Dengede ΔG = -n. FEpil = ΔGº+RT ln K = 0 olup ΔGº= - n. FEºpil = - RT ln K olur E°pil = RT 0, 0592 x ln K = n n. F log. Q olur. 27

Reaksiyonların Olabilirliği • SS SORU : I-(aq) ve Br-(aq) içeren çöz. ye I 2 ve Br 2 eklendiğinde. Ortamdaki her bir iyonun kons. 1 M olursa çözeltide hangi rx. lar olacaktır. Neden ? Ters rx ne zaman mümkündür? Eo(I-/I )= - 0, 54 v , Eo(Br-/Br )= - 1, 09 v 2 2 • CEVAP) : 2 I-(aq) + Br 2 2 Br-(aq) + I 2 olduysa Eorx= -0, 54 -(-1, 09) = + 0, 55 v olur. Ohalde çözeltide oluşabilecek rx budur. Çünkü Eorx= + 0, 55 v >0 dır. • Tersinde Eorx= - 0, 55 v < 0 olacağından bu rx. ’nun tersinin bu şartlarda çözeltide olması mümkün değildir. • Tersi rx Epil = -0, 55 – 0, 06/2. log. Q >0 olursa mümkün olur Bunun içinde log. Q < -20 olmalıdır. 28

Çözümlü Sorular ÖRNEKLER) Aşağıdaki yarı tepkimelerden pil oluşturup ΔG° değerlerini belirleyiniz 1 A) {Al(k)→ 2 Al 3+(aq)+3 e-}*2 E 0=+1, 676 V 1 B) {3 Cu 2+(k)+2 e-→Cu(k)}*3 E 0=0, 337 V Toplam pil rx) 2 Al(k)+3 Cu 2+(aq) → 2 Al 3+(aq)+ 3 Cu(k) Epil 0 =+2, 013 V ΔG°=-n. FEpil 0 = - (6 mol e-)(96485 C/mol e-)(2. 013 V) =-1, 165*103 kj 2 A) : {2 I-(aq)→I 2(k)+2 e-}*2 Toplam pil rx) E 0=-0, 535 V 2 B) { O 2(g)+4 H+(aq)+4 e-→ 2 H 2 O(s)} O 2(g)+4 I-(aq)+4 H+(aq) → 2 H 2 O(s)+2 I 2(k ) E 0=1, 229 Epil 0 =+0, 694 V ΔG°=-n. FEpil 0 =-(4 mol e-)(96485 C/mol e-)(0, 694 V) =-2, 68*105 j=-268 kj 3 A) {Ag(k)→Ag+ (aq)+ e-}*6 E 0=-0, 800 V 3 B) Cr 2 O 72 - (aq)+14 H+(aq)+6 e- → 2 Cr 3+(aq)+7 H 2 O(s) E 0=1, 33 V Toplam pil rx) Cr 2 O 72 - (aq)+14 H+(aq)+6 Ag(k) → 2 Cr 3+(aq)+6 Ag+ (aq)+7 H 2 O(s) Epil 0 =+0, 53 ΔG°=-n. FEpil 0 =-(6 mol e-)(96485 C/mol e-)(0, 53 V) =-3, 1*102 kj 29

Çözümlü Sorular S) Cu (k) + 2 Fe 3+(aq)→ Cu 2+(aq)+ 2 Fe 2+(aq) rx için SŞ. da E°pil = 0, 434 V dır K=? CV) E°pil = 0, 0592/n log K = 0, 434 = 0, 0592/2 log K = 14, 6622 K = 1014, 6622 = 4, 6 x 1014 SORU) Cd(k)|Cd 2+(aq), 1 M║Cu 2+ (aq) 1 M|Cu(k) Eºpil= 0, 74 v. Eºind Cu 2+→Cu =0, 34 v EºCd 2+→ Cd=? CEVAP) Eºpil=0, 74 = 0, 34 - Eºind. Cd 2+→ Cd den Eºind. Cd 2+→ Cd =- 0, 4 V S) 8 Mo+3 Sb 2 O 5 +17 H 2 O → 8 Mo. O 4= + 6 Sb. H 3 + 16 H+(İSTEMLİMİ ? OLABİLİRMİ ? ) W=? ΔG=? K=? CV) Mo→Mo. O 4= için-Eºyük =0, 08 v<Sb 2 O 5→ Sb. H 3 için Eind=1, 77 v Epil=1, 77+0, 08=1, 85 v >0İstemli ANOT 8/ Mo+4. H O → Mo. O = +8 H++6é KATOT 3/Sb O +16. H++16é → 2. Sb 3+H + 5. H O 2 4 2 5 3 2 • Yukarıdaki reaksiyon doğrudur , pil çalışır. Epil=1. 85>0 olur. • ΔG= W=- 48 x 96487 x 1, 85= - 8 568 048 j= -8 568 KJ =ΔG= - RTln. K den K= SORU) Cu|Cu 2+ aq║Fe 2+aq|Fe 3+|Pt Epil= 0, 434 v. , Cu(k) →Cu 2+ aq için E=-0, 34 v, Fe 3+→ Fe 2+aq için E=+0. 77 v dir. Pil rx yazınız ve K=? CEVAP) Epil= Eºpil – 0. 0592/n. log. K= 0, 434 v =0. 0592/2 xlog K den log. K= 14, 7 ve K=5 x 1014 olur. Top rx: Cu(k)+ Fe 3+→ Cu 2+ aq+Fe 2+aq 30 / 65

ÖRNEK : 21 -8 Fe 2+ (aq) →Fe 3+(aq) Eº=- 0, 771 v, Ag+ (aq)→Ag (k) Eº= 0, 8 v. Pil rx yaz ve Epil =? Anot Fe 2+ (aq) → Fe 3+(aq) Eº=-0, 771 v, Katot Ag+ (aq) → Ag (k) Eº=0, 8 v Eopil= Eo. Kat - Eo. An. = 0, 8 – 0, 771 = 0, 029 v Pil rx Fe 2+(aq)+Ag+(aq) → Fe 3+(aq)+Ag(s) PİL ŞEMASI ) Pt|Fe 2+(0. 10 M), Fe 3+(0. 20 M)||Ag+(1. 0 M)|Ag(s) 0. 0592 V Epil = Epil° - log Q n 0. 0592 V [Fe 3+] Epil = Epil° - log [Fe 2+] [Ag+] n Epil = 0. 029 V – 0. 018 V = 0. 011 V > 0 pil çalışır 21 -9 (746) Pt | Fe 2+(0. 015) , Fe 3+ ( 0. 35) ║Ag+(0. 25 M) Ag ise Epil= -0. 09< 0 pil çalışmaz. 31

21 -5 Piller. Kimyasal Tepkimelerden Elektrik Üretimi • Birinci ticari piller. – Hücre tepkimesi tersinir dağildir. tepkenlerin büyük kısmı ürünlere dönüştüğünde, artık daha fazla elektrik üretilmez ve pil ölür • İkinci ticari piller – (akümülatörler). Hücre tepkimesi aküden elektrik geçirilerek tersine çevrilebilir(yükleme). Böyle bir pil her boşalışından sonra yüklenerek birkaç yüz kez kullanılabilir • Akış piller ve yakıt piller. – Bu tür piller, içlerinden tepkenler, ürünler ve elektrolitler geçerken kimyasal enerjiyi elektrik enerjisine dönüştüren düzeneklerdir 32

PİLLER- PRİMER PİLLER • PİLLER Kimyasal rx. lardan elektrik üretimi sağlayan düzeneklerdir. Anot ve Katot görevini gören iki elektrot ve arasına galvanometre / voltmetre bağlayarak Epil ölçülebilir. ANOT yükseltgenme olan kutup KATOT indirgenme olan kutuptur. Yarı reaksiyonların Eº değerine bakılarak Eº(ind)B > Eº(ind)A büyük olan katot (-) kutuptur. Eº(yük)A > Eº(yük)B büyük olan anot (+) kutuptur. A) PRİMER PİLLER İçindeki maddelerden biri bitinceye kadar çalışıp elektrik enerjisi üretir. Tek elektrolitli veya cift elektrolitli olabilir. • 1º- VOLTA PİLİ (-) Zn| H 2 SO 4 | Cu (+) ΔEº= 1. 0 V Tek elektrolitli pildir. • 2º- DANİELL PİLİ (-) Zn| Zn. SO 4 1 M║Cu. SO 4|Cu(+) ΔEº= 1. 0 V cift elektrolitlidir. • 3º- KURU PİL (Leclanche pili) (-) Zn|NH 4 Cl %20║Mn. O 2|Cu(+) ΔEº=1, 5 v • anot rx Zn → Zn 2+ + 2é • katot rx 2 Mn. O 2 +2 NH 4+ +2é → Mn 2 O 3 +2 NH 3 + H 2 O • volta pilindeki gibi H+ + é → 1/2 H 2 katodu pasifleştirebilir ancak bu Mn. O 2 ile önlenir. NH 4 Cl içine jelatin, amyant vs. konulduğunda verim artar. Zn kap bitinceye kadar aynı H 2 gibi NH 3 de katoda zarar verir. bu Zn 2+ aq + 2 NH 3(g) +2 Cl- aq →[Zn(NH 3)2]Cl 2 kompleksi şeklinde tutularak zarar önlenir. . 33

PRİMER PİLLER 3. Leclanche Pili(Kuru Pil) 3º- KURU PİL (Leclanche pili) (-) Zn|NH 4 Cl %20║Mn. O 2|C(+) • ΔEº= 1. 5 V (-) kutup ANOT Zn kaptır. • anot rx Zn → Zn 2+ + 2é (+) KATOT ortaki grfit çubuktur katot rx 2 Mn. O 2 +2 NH 4+ +2é → Mn 2 O 3 +2 NH 3 + H 2 O ELEKROLİT NH 4 Cl(aq) emdirilmiş jelatin, amyant karışımı olup Mn. O 2 ile karışıktır. • 4º ALKALİ PİL( lalende pili ) (-) Zn |Na. OH %20 | Cu. O|Cu(+) burada NH 4 Cl yerine Na. OH alındığında Zn (k) + 2 OH- → Zn (OH)2 (k) +2é olur bu ise daha iyi verimlidir. 34

PRİMER PİLLER Gümüş-Çinko Pili ( Düğme Pil) Zn(s), Zn. O(s)|KOH(sat’d)|Ag 2 O(s), Ag(s) Zn(s) + Ag 2 O(s) → Zn. O(s) + 2 Ag(s) Epil = 1, 8 V • 5º Ni- Cd pilleri (-) Cd |Na. OH %20 | Ni 2 O 3 (+) |Ni Eºpil= 1. 4 V • pil Rx Cd + Ni 2 O 3 +2 H 2 O→Ni(OH)2 +Cd(OH)2 35

Primer PİLLER 6º YAKIT PİLLERİ (-) C| Na. OH (erimiş) |Fe, O 2 (+) Eºpil= 1, 0 V C+ O 2→CO 2 oluşuyla elektrik üretilir. • A(-) C | H 2 (g) | Na. OH eriyik | O 2(g) |C+ K pil rx, 2 H 2 +O 2→ 2 H 2 O • H 2+ 2. OH- → 2. H 2 O + 2é ½ O 2+ H 2 O +2é → 2 OH • Bu pillerde H 2, CO, CH 4 gibi gazlar yakılarak %60 -70 verimle elektrik üretilebilir. • Ancak yüksek sıcaklıkta çalışıldığı için tesis ve malzeme masrafı çoktur. • Özellikle uzay araçlarında kullanılır. (Sonraki slaytta şekil ve rx. lar var) 7º KONSANTRASYON (Derişim) PİLLERİ ΔE=ΔEº - RT ln. K = ΔEº - 0, 0592 log [A’] • n. F n [A] • (-) A Ag | Ag+ 0. 01 M ║Ag+ 1 M | Ag (+) Epil=0, 12 V ΔE = ΔEº- 0, 0592 log 0, 01 = 0, 12 V >0 • 1 1 • olduğu için çalışır. Görüldüğü gibi farklı konsantrasyonlu aynı madde Eº=0 çözeltilere arasında bir pil oluşturup çalıştırmak mümkündür. 13 e 8º HAVA PİLİ (-) Al | Na. OH 1 M , O 2 1 atm (hava) | C (+) anot 4 Al(k)+ 4 OH- aq →[Al(OH)4] • katot 3 O 2+ 6 H 2 O + 12é → 4 OH- (2 Sonraki slaytta şekil ve rx. lar var) 9º- DÜĞME PİL gümüş –çinko pili A - Zn(k) , Zn. O(k) | KOH doy | Ag 2 O(k) , Ag+ K (+) • • anot rs. Zn(k) + 2 OH- →Zn. O(k) +2. H 2 O + 2é q katot Rs Ag 2 O(k)+ H 2 O +2é → 2. Ag (k) + 2. OH-aq pil reaks. Zn (k)+ Ag 2 O(k) →Zn. O(k)+ Ag(k) cok az elektrolitle verimli çalışır. Akü cinsleri de vardır. Pb aküden 6 kat verimlidir. ( 3 sonraki slaytta şekli var. ) 36

PRİMER PİLLER 6 -Yakıt Pilleri O 2(g) + 2 H 2 O(l) + 4 e- → 4 OH-(aq) 2{H 2(g) + 2 OH-(aq) → 2 H 2 O(l) + 2 e-} 2 H 2(g) + O 2(g) → 2 H 2 O(l) E°cell = E°O 2/OH- - E°H 2 O/H 2 = 0. 401 V – (-0. 828 V) = 1. 229 V = ΔG°/ ΔH° = 0. 83 37

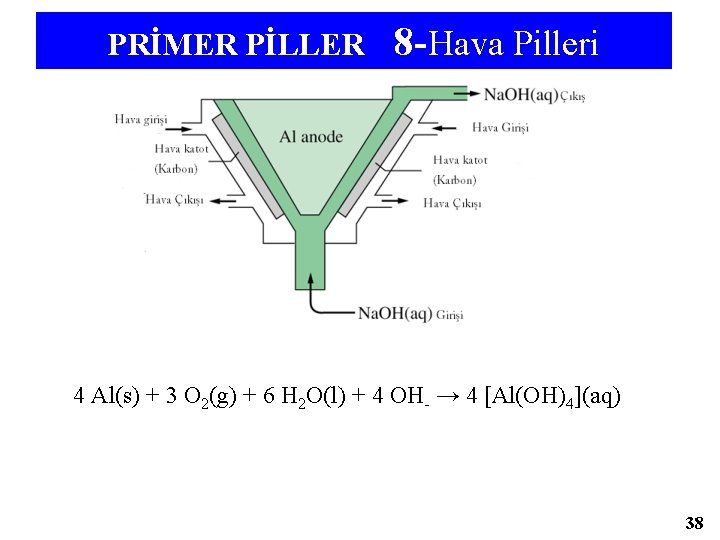
PRİMER PİLLER 8 -Hava Pilleri 4 Al(s) + 3 O 2(g) + 6 H 2 O(l) + 4 OH- → 4 [Al(OH)4](aq) 38

2 - SEKONDER PİLLER (AKÜLER) SEKONDER PİLER (AKÜLER) Bittiğinde şarj edilerek yeniden kullanılır. 1º Pb akü –A Pb | H 2 SO 4 % 27 -39 | Pb. O 2 kaplı (Pb–Sb) +K (Sonraki slaytta şekli var. ) Elektroliti H 2 SO 4 % 27 -39 d=1, 2 -1, 22 (27 -30ºBé) Katot: Pb. O 2 kaplı (Pb–Sb) alaşımıdır. Anot Pb - 2é →Pb(+2) SO 4 Katot Pb(+4)O 2 + 4 H+ +SO 4= + 2é → Pb(+2)SO 4 + 2 H 2 O toplam pil rs Pb+ Pb. O 2+ 2 H 2 SO 4→ 2 Pb. SO 4+ 2 H 2 O • 2º EDİSON AKÜ -A Cd| KOH , Li. OH aq | Ni 2 O 3 , Ni +K Epil=1. 3 V • Cd + Ni 2 O 3→Cd. O + 2 Ni. O 3º ANDREA(Gümüş) AKÜSÜ Zn| K 2 Sn. O 3 (%20 KOH içinde)| Ag 2 O 2, Ag Eº=1, 5 V Anotta 2 Zn+ 4 OH - → 2 Zn(OH)2 + 4é Katotta Ag 2 O 2 +2 H 2 O + 4é → 2 Ag+ 4. OH • Toplam pil rx 2 Zn + Ag 2 O 2+2 H 2 O → 2 Ag + 2 Zn (OH)2 pahalı akülerdir. ÖRNEK : 762 C 3 H 8 (propan) kullanan bir yakıt pilinin Eºind= ? pil rx anot ve katot rx yazınız. • C 3 H 8 (g) +5 O 2(g) → 3 CO 2(g)+4 H 2 O(s) Anot rx C 3 H 8+ 6 H 2 O → 3 CO 2 + 20 H+ + 20 é • Katot rx 5 O 2 +2 O H+ +20 e’ → 10 H 2 O • ΔGº=-n. F Eºpil • -2108000=-20 x 96485 x Eºpil= 1, 092 V =Eºsagind + Esol yük =1, 23 V +Esol yük • E anotyük =0, 138 V Eind anot =0, 138 V olur. 39

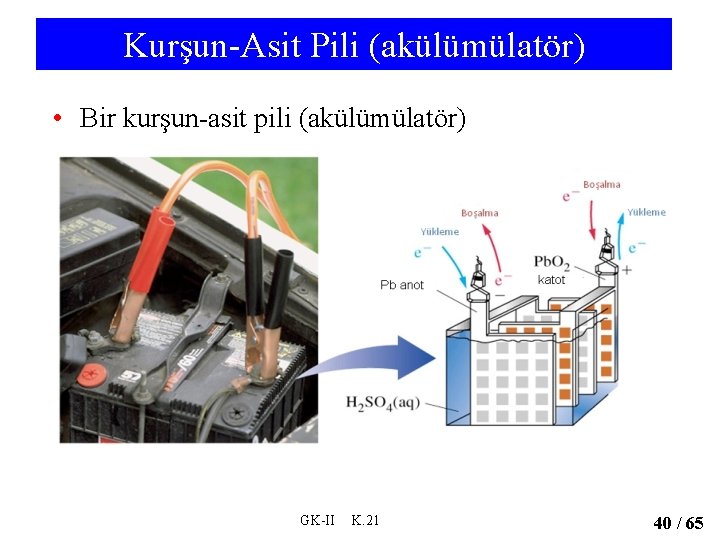
Kurşun-Asit Pili (akülümülatör) • Bir kurşun-asit pili (akülümülatör) GK-II K. 21 40 / 65

Nikel-Kadmiyum Pili (Şarjlı Pil) Cd(s) + 2 Ni. O(OH)(s) + 2 H 2 O(L) → 2 Ni(OH)2(s) + Cd(OH)2(s) 41

(ÖRNEK 21 -10) 2 Ag elektrotla Ag. I(k/aq) suspansiyonunda SŞ. da ölçülen Epil= 0, 417 v Kçç=? Ag+(aq 0, 10 M) + I-(aq) → Ag. I(katı çökeltili doymuş süspansiyon) 0. 0592 V [Ag+]doygun Ag. I Epil = Epil° - log + [Ag ]0. 10 M çözelti n x 0. 0592 V Epil = Epil° - log 0. 100 n 0. 0592 V (log x – log 0. 100) 0. 417 = 0 - 1 0. 417 log x = log 0. 100 = -1 – 7. 04 = -8. 04 0. 0592 x = 10 -8. 04 = 9, 1. 10 -9 Kçç = x 2 = 8. 3 x 10 -17 42
![S 1 Aluminyumhava pilinin Epil 0 2 71 V dir AlOH4 3 e S. 1. Aluminyum-hava pilinin Epil 0 =2, 71 V dir. [Al(OH)4 ]- +3 e-](https://slidetodoc.com/presentation_image_h/e621f178642da9b35201637d29217f1b/image-43.jpg)
S. 1. Aluminyum-hava pilinin Epil 0 =2, 71 V dir. [Al(OH)4 ]- +3 e- →Al(k)+4 OH- (aq) indirgenme yarı tepkimesi nedir? Net hücre tepkimesini 2 ayrı tepkimeye ayırırız. Yüks: {Al(k)+4 OH- (aq)→[Al(OH)4 ]-(aq)+3 e- }*4; -E 0{ [Al(OH)4 ]- (aq)/Al(k)} İnd: {O 2 (g)+2 H 2 O(s)+4 e- → 4 OH- (aq)}*3; E 0 =+0, 401 V Net: 4 Al(k)+3 O 2 (g)+6 H 2 O(s) +4 OH- (aq) → 4[Al(OH)4 ]- (aq) Epil 0 =2, 71 V=0, 401 V- E 0 {[Al(OH)4 ]- (aq)/Al(k)} →E 0{[Al(OH)4 ]- (aq)/Al(k)} = -2, 31 V S. 2. 2 Cu+(aq)+Sn 4+(aq)→ 2 Cu 2+(aq)+Sn 2+(aq), Epil 0=-0, 0050 V tepkimesi için 298 K de dört iyonun herbirinin derişiminin 0, 500 M olduğu çözelti hazırlanabilir mi? b. Hazırlanmazsa, tepkime hangi yönde oluşur? (-)Epil 0(-0, 0050 V), ΔG°=-n. FEpil 0 in pozitif oldugunu gösterir. ΔG°değerinin (+) olması ile Kden degeri birden küçük(Kden <1, 00); ΔG°=-n. FEpil 0 Kden =[Cu 2+ ]2[Sn 2+ ]/[Cu+ ]2 [Sn 4+ ] Böylece, bütün derişimler aynı oldugu zaman iyon çarpımı Q=1, 00 olur. Standart pil potansiyelinin negatif değerli olmasından dolayı Kden değerinin 1 den biraz küçük olacağı açıktır. Öyleyse bütün derişimler 0, 500 M olamaz. b. Dengenin kurulabilmesi için, yani iyon çarpımının 1, 00 den küçük ve denge sabiti değerine eşit olması için ürünlerin derişimi azalmalı, tepkimeye girenlerin ki artmalıdır. Bu durumda Sola doğru net bir tepkime gerçekleşir. 43

S: 3. a. Zn(k)+Cu 2+(aq)→Zn 2+(1, 0 M)+Cu(k) ise rx’nun ileri yönde mümkün olabilmesi için gerekli en düşük Cu 2+ derişimi nedir? b. Cu 2+ (aq) nin Zn 2+ (k ) ile yer değiştirmesi tamamlanmalı mıdır? Açıklayınız. Yük. : Zn(k) → Zn 2+ (aq)+ 2 e- -E 0 =+0, 763 V ind. Cu 2+ + 2 e- → Cu(k) E 0 =+0, 337 V Net: Zn(k)+ Cu 2+ (aq) → Cu(k)+ Zn 2+ (aq) Epil 0 =+1, 100 V a. E=0, 000 V, [Zn 2+ ]=1, 00 M alınınca ve [Cu 2+ ] Nernst’ten bulunur. Epil= Epil 0 -0, 0592/2 log[Zn 2+ ]/[Cu 2+ ] ; 0, 000 = 1, 100 -0, 0296 log 1, 0 M/[Cu 2+ ]=0, 000 -1, 100/-0, 0296=37, 2 ; [Cu 2+ ]= 6*10 -38 M b. Soruyu diğer yolla çözersek, başlangıç derişimlerini [Cu 2+]baş=1, 0 M ve [Zn 2+]baş=0, 00 M alarak [Cu 2+]son=6*10 -38 M ve [Zn 2+]son =1, 0 M elde ederiz. Tepkime tamamlanmaya meyillidir. 44

S: 4. Biri 1 M H+ çözeltisine, diğeri 0, 65 M KOH çözeltisine daldırılmış iki H-elektrottan yapılmış Derişim Pilinde. a. Oluşan tepkimenin Epil değerini belirleyin. b. Bu değeri, H 2 O nun bazik çözeltide H 2 (g) e indirgenmesindeki E 0 degeri ile karşılaştırınız ve bunlar arasındaki ilişkiyi açıklayınız. a. İki yarı tepkime ve hücre tepkimesi aşağıda verilmiştir. Konsantrasyon pili olduğu için Epil 0 =0, 00 V. dur. Yüks: H 2(g)→ 2 H+(0, 65 KOH)+2 eİndr: 2 H+ (1, 00)+2 e-→H 2(g) Net: 2 H+(1, 00)→ 2 H+(0, 65 KOH) [H+ ] baz = Ksu /[OH-]=1, 00*10 -14 /0, 65= 1, 5*10 -14 M Epil=Epil 0 – (0, 0592 / 2). (log[H+]2 baz/log[H+]2 asit ) Epil=0, 000 -0, 0592/2 log(1, 5*10 -14)2 /(1, 0)2 = 0, 818 v 45

SORU: a) Aşağıdaki volta pili için Sn(k) |Sn 2+(0, 075 M)|| Pb 2+ (0, 600 M)| Pb(k) Epil =? CEVAPa) Yüks: Sn(k)→Sn 2+(0, 075 M)+2 e- -E 0=+0, 137 V İnd: Pb 2+(0, 600 M)+2 e-→Pb(k) E 0 = -0, 125 V Toplam rx: Sn(k)+Pb 2+(0, 600 M)+ 2 e- → Pb(k) + Sn 2+(0, 075 M); Epil 0 =+0, 012 V Epil = Epil 0 -0, 0592/2 log [Sn 2+ ]/[Pb 2+ ]= 0. 012 -0, 0296 log 0, 075/0, 600=0, 039 V b. SORU Pil çalıştığında Epil zamanla artar mı, azalır mı, sabit mi kalır, neden? CEVAP b) Epil degeri zamanla azalır, çünkü tepkimede [Sn 2+ ] artar ve [Pb 2+ ] azalır. c. SORU : Pb 2+ derişimi 0, 500 M a düştüğünde Epil değeri ne olur? CEVAPc) Tepkimenin stokiyometrisi Sn 2+ ve Pb 2+ için 1: 1 olduğundan [Pb 2+ ] = 0, 500 M = 0, 600 M - 0, 100 M, [Sn 2+ ] = 0, 075 M + 0, 100 M=0, 085 M olur Epil = Epil 0 -0, 0592/2 log [Sn 2+ ] / [Pb 2+ ] = 0. 012 - 0, 0296 log 0, 085 / 0, 500 = 0, 035 V d. SORU : Epil =0, 020 V olduğ. unda [Sn 2+ ] ne olacaktır. CEVAP d) Tepkime : Sn(k) + Pb 2+(aq) → Pb(k) + Sn 2+(aq) Başlangıç: 0, 600 M 0, 075 M Değişim: -x M +x M Son durum (0, 600 -x)M (0, 075+x)M Epil = Epil 0 -0, 0592/2 log [Sn 2+ ]/[Pb 2+ ] = 0, 020 = 0, 012 - 0, 0296 log 0, 075+x / 0, 600 -x den x= 0, 162 M bulunur ve [Sn 2+ ]=0, 075+0, 162=0, 217 M olur. 46

ELEKTROLİZ • Elektroliz işleminde kendiliğinden mümkün olmayan rx’lar elektrik enerjisi ile gerçekleşir. Üretecin (+) Kutbuna bağlanan kutup (+) Kutup (pilin tersi)ANOT olur ve burada pilde olduğu gibi YÜKSELTGEME olur. (+) Kutup olan ANOT’un çektiği ANYONlar burada é vererek YÜKSELTGENİRler. • Üretecin (-) Kutbuna bağlanan kutup (-) Kutup olup burası KATOT’tur. Buraya üreteçden é pompalanır ve (-) kutup olan KATOT’un çektiği Katyonlar buraya gelir ve é alarak İNDİRGENİRler. • Hücre kendiliğinden çalıştığında elektronlar çinkodan bakıra doğru gider. Bu durumda volta hücresindeki toplam kimyasal değişim aşağıdaki gibidir. Zn(k) + Cu 2+ (aq) → Zn 2+ (aq) + Cu(k) E°pil = 1, 1 v Şimdi aynı hücreyi 1, 1 v dan daha büyük voltajlı bir dış elektrik kaynağına bağlarsak, elektronlar bakır elektrottan ayrılıp çinko elektroda doğru gitmeye zorlanır. Bu durumdaki toplam tepkime volta hücresi tepkimesinin tersi olup, E°pil negatiftir. • İndirgenme : Katot (-Kutup Pilin tersi) Zn 2+ (aq) + 2 e- → Zn(k) Yükseltgenme : Anot (+ Kutup Pilin Tersi) Cu(k) → Cu 2+(aq) + 2 e • ------------------------- • Net Tepkime : Cu(k) + Zn (aq) → Cu 2+(aq) + Zn(k) • E°pil = E°Zn 2+/Zn - E°Cu 2+/Cu = -0, 763 V – 0, 340 V = -1, 103 v • • Böylece, elektron akışının yönünü tersine çevirerek, volta hücresini bir elektroliz hücresine dönüştürebiliriz. 47

S. 1) Tüm tepkenler ve ürünler standart koşullarda iken, aşağıdaki tepkimelerin hangileri kendiliğinden, hangileri yalnızca elektrolizle oluşturulabilir? Elektroliz gerektirenler için gereken minimum voltaj nedir? a) Her bir kimyasal tepkimenin standart pil potansiyelini belirleriz. Negatif işaretli voltajlar, elektroliz gerektiren tepkimelere aittir. Yük. : 2 H 2 O(s)→ 4 H+(aq)+O 2(g)+4 e- -E 0=-1, 229 V İnd. : {2 H+(aq)+4 e- →H 2(g)} *2 E 0 =0, 000 Net: 2 H 2 O(s)→ 2 H 2(g)+O 2(g)Epil 0 =-1, 229 V rx 1, 229 dan büyük V’da elektroliz edilir b) Zn(k)+Fe 2+(aq) → Zn 2+(aq) +Fe(k) Yük: Zn(k) → Zn 2+(aq) + 2é- -E 0=+: 0, 763 v İndr Fe 2+(aq) +2é→Fe(k) E 0 =-0, 44 v. Net: Zn(k) +Fe 2+(aq) → Zn 2+(aq) +Fe(k) Epil 0 =+0, 323 Bu istemli bir tepkimedir c) 2 Fe 2+(aq) +I 2 (k) → 2 Fe 3+(aq) +2 I- (aq) Yük: {Fe 2+(aq) → Fe 3+(aq) + e- } *2 -E 0=-0, 771 İnd: I 2 (k) + 2 e- → 2 I- (aq) E 0 =+0, 535 V Net: 2 Fe 2+(aq) +I 2 (k) → 2 Fe 3+(aq) +2 I- (aq) Epil 0 =-0, 236 V Bu tepkime, +0, 236 V dan daha büyük bir voltajla elektrolizi gerektirir. S. 2). Aşağıdaki elektrolizlerin için belirtilen nicelikleri hesaplayınız a) Zn 2+(aq)’dan 1, 87 v. akım 42, 5’ geçirildiğinde katotta toplanan Zn nun kütlesi nedir? Zn 2+ (aq) + 2 e- →Zn(k) Zn kütlesi=42, 5 dk*60 s/1 dk*1, 87 C/1 s*1 mol e-/96485 C*1 mol Zn/2 mol e 65, 39 g Zn/1 mol Zn =1, 62 g Zn b) KI(aq)’dan 1, 75 A lik akım geçirildiginde anotda 2, 79 g I 2 oluşması için gerekli zaman nedir? 2 I- (aq) → I 2 (k)+2 e- Geçerli süre=2, 79 g I 2*1 mol I 2/253, 8 g I 2 *2 mol e-/1 mol I 2 *96485 C/1 mol e - 1 s/1, 75 C * 1 dk/60 s = 20, 22’ 48

S. 3) Aşağıdaki sulu çözeltilerin elektrolizinde 2, 15 A lik akım 75 dk çözeltiden geçirildiğinde katotta toplanan top. Metal kaç gr’dır? (Zn 2+, Al+3, Ag+ , Ni 2+ ) Geçen toplam yükü ve elektron mol sayısını hesaplarız mol e- =75 dk*60 s/1 dk*2, 15 C/1 s*1 mol e- /96485 C=0, 10 mol e- Zn kütlesi=0, 10 mol e-*1 mol Zn 2/2 mol e- *1 mol Zn/1 mol Zn 2+*65, 39 g Zn/1 mol. Zn=3, 3 g Al kütlesi=0, 10 mole-*1 mol Al+3 /3 mol e- *1 mol Al/1 mol Al+3 * 26, 98 g Al/1 mol. Al= 0, 90 g Ag kütlesi=0, 10 mol e-*1 mol Ag+/1 mol e- *1 mol Ag/1 mol Ag+* 107, 9 g. Ag/1 mol Ag=11 g Ni kütlesi=0, 10 mol e-*1 mol Ni 2+/2 mol e- *1 mol Ni/1 mol Ni 2+* 58, 69 g Ni/1 mol Ni= 2, 9 g S. 4) Aşağıdaki hücre diyagramı verilen Epil =1, 250 V dur. Hücredeki Ag+ derişimi ne olmalıdır? Zn(k)|Zn 2+(1, 00 M)||Ag+(*M)|Ag(k) Yüks: Zn(k)→Zn 2+ (aq)+2 e- -E 0=+0, 763 V İnd: {Ag+ (aq)+ e-→Ag(k)} *2 E 0=0, 800 V Net: Zn(k)+2 Ag+ (aq)→ Zn 2+ (aq)+ 2 Ag(k) Epil 0 =1, 563 E= Epil 0(-0, 0592/n)log{[Zn 2+ ]/[Ag+ ]2}=+1, 563 V-0, 0592/2 log 1, 00 M/x 2 =+1, 250 V Log 1, 00 M/x 2 =-2(1, 250 -1, 563)/0, 0592 =10, 6; x=5*10 -6 M 49

ELEKTROLİZ (0. 5 N Cd. Cl 2)aq Pt ve Cd elektrotlarla elektrolizinde kutupları Eºelektroliz =? Notral çözeltide Eº(H+→ 1/2 H 2) = 0, 83 V Eºind(Cd 2+→Cd) =-0, 403 V Eºind (Cl 2/Cl-) =-1, 36 V Eºind (O 2/OH-) =0, 401 V • ELEKTROLİZ • ÇÖZÜM Elektrolit (0, 5 N Cd. Cl 2)aq olduğundan çöz’de Cd 2+, H+, OH-, Cl-iyonları olduğunda, sol elektrot K’da (ind) Cd 2+→Cd -0. 403 V > H+→ 1/2 H 2 -0. 83 V sağ elektrot A’da (yük) Cd→ Cd 2+ 0, 403 v H 2 O→ 1/2 O 2 + 2. H+ -1. 23 -0. 47= -1. 7 V • Cl-→ 1/2 Cl 2 -1, 36 V Anot Cd metali olursa olabilir. • Eºelek= Eºsag ind + Eº sol yük = 1. 36 +(0. 403) =1. 763 V 50 / 65

ELEKTROLİZ • 1. SORU (MS) 25 x 50 cm boyutunda kalınlığı ihmal edilen saç levhayı Cu kaplamak için 0, 15 amper/dm 2 akım yoğunluğunda 2µ kaplama ne sürede oluşur. Cu= 63, 5 d. Cu =7, 8 gr/m. L CEVAP) • • levhanın toplam alanı St= (25 x 50)x 2=2500 cm 2 =2, 5 dm 2 3, 75 x t x 63, 5 W(Cu) = = 2500 x 2 x 10 -4 x 7, 8 g/m. L=3, 9 g 96485 x 2 t = 3160, 5’’=52, 7’=0, 88 h 2. SORU) ELEKTROLİZ: 5 amper akımla kaplama banyosunda 10 h kalan katot üzerinde (Ag. NO 3) aq elektrolit ise kac gram Ag birikir. CEVAP) W = 5 x 10 x 60 x 108 = 201, 45 g 96485 x 1 • 51
![ELEKTROLİZ 3 Problem MS p H3 olan HNO 3 aq Ag0 1 Pb ELEKTROLİZ • 3. Problem (MS) (p. H=3 olan) HNO 3 aq [Ag+]=0, 1 [Pb](https://slidetodoc.com/presentation_image_h/e621f178642da9b35201637d29217f1b/image-52.jpg)
ELEKTROLİZ • 3. Problem (MS) (p. H=3 olan) HNO 3 aq [Ag+]=0, 1 [Pb 2+]=0, 02 [Zn 2+]=0, 05 ise Pt elektrotlu elektroliz kabında Ayrışma sırasını ve ayrışma voltajını belirleyiniz. EºAg+/ Ag=0, 8 v EºPb 2+/Pb = -0, 126 v EºZn 2+/Zn =-0, 763 V • CEVAP) • (+) anot yük sadece EH 2 O→ 1/2 O 2+OH -= 0, 4 v • (-)katot (ind) H+ olusunda katyonlar kendi deşarj voltajında ayrılırlar. E (Ag) =Eº(Ag+/Ag ) + 0, 0592 log Q=0, 8+0, 06=0, 74 v E(Pb) = -0, 126 - 0, 06 log 0, 02 • n 2 =-0, 177 v E(Zn) = -0, 763 +0, 06 log 0, 05 =0, 802 v katyon deşarj sırası • 2 E (Ag)=0, 74 v E (Pb)=-0, 177 v E (Pb)=-0, 802 v • seklinde gerçekleşir. Ag ayrıldıktan sonra Ag elektrolit olur. Daha sonra Pb en sonrada Zn elektrotta olur. E (H+) = 0+0. 06 log 10 -3= -0, 18 v aşırı direnç (Ag elektrotta 0, 2 v), • (Pb 0, 4 v) (Zn 0, 7 v)olduğu için. E(Ag)=-0, 18 -0, 2= -0, 38 v, • E(Pb) =0, 18 -0, 4 =-0, 58 v, E(Zn)=-0, 18 -0, 7= -0, 88 v da gerçekleşir. 52

4. SORU) H 2 SO 4(aq) (veya Na. OH(aq) elektrolizinde 7. 5 amper akımla seri bağlı 10 hücrede 8 h de oluşan H 2 kaç litredir. CEVAP) VL=(22. 4*7. 5*8*60*60*10)/(2*96485)= 251 L H 2 5. SORU) bir nikelaj banyosunda 4 x 4 x 0. 1 lik saç üzerine 15 amp akımda % 60 verimle 1 h kaplama yapılırsa kaplama kalınlığı ve oluşan V(H 2)=? Ni=58, 71 Ni=8. 9 g/m. L CEVAP) Katotta indirgenme Ni 2+ Ni Anotta yük 2 H+ H 2 • WNi = (58, 71*15*60*60*0, 60) / (2*96485) = 9, 86 g Ni kaplama alanı (4 x 4)x 2+ 4 x 0. 1 x 4 =32+1. 6 =33. 6 cm 2 katot top V(Ni) = 9. 86 / 8. 9=1, 11 cc kaplama kalınlığı = 1. 11 / 33. 6 = 0, 033 cm VH 2= (22. 4*15*60*60*0. 60 ) / (2*96485) = 3, 76 L 53

21 -8 Endüstriyel Elektroliz İşlemleri 54

KOROZYON • KOROZYONUN TANIMI • Metal ve alaşımların çevreleri ile kimyasal ve elektrokimyasal reaksiyonları sonucu bozulmalarını korozyon deyimi olarak tanımlarız. Korozyon deyimi yalnız metalik malzemeleri kapsar ve oluşumunu sağlayan reaksiyonun cinsine göre iki cins korozyon türü vardır. 1)Elektrokimyasal korozyon, 2) Kimyasal Korozyon, 1)Elektrokimyasal korozyon, Elektrokimyasal pil oluşumuyla meydana gelen korozyondur. Sistem ortamda iletkenliği sağlayan elektrolit ile, anot ve katot olabilen iki metalden oluşur. Sistemde meydana gelen olay, elektrik ayrımı ile oluşan anyon ve katyonların reaksiyonudur. Olayın neticesinde elektrot olan metallerden biri korozyona uğrar. Kimyasal korozyon, metalik malzemelerin asidik veya bazik gazlarla reaksiyonu olarak tanımlanır. Korozyon neticesinde metal malzemeler hasar görür. 55

Teknelerde korozyon • Tekne korozyonuna genel bakış : • Deniz suyu büyük hacimli bir elektrolit olup dünya yüzeyinin büyük kısmını kaplar. Genel olarak üniform bileşime sahiptir. Gemi teknesi düşük dirence sahip bu elektrolit içinde yüzdüğünden ve oksijen ile atmosferik reaksiyonlara maruz kaldığından korozyon için mükemmel bir ortam teşkil eder. Çelik, deniz suyunda korozyona uğrayarak demir iyonları haline geçer. Bunların oksitlenmesi halinde pas teşekkül eder ki bütün yüzeyi kaplayan bu pas korozyonun ilerleme hızını azaltıcı rol oynar. Korozyon, metalin çeşitli yerlerinde değişen elektrik potansiyellerin tesiri altında elektrokimyasal yolla meydana gelir. Farklı elektrik potansiyeller çeşitli nedenlerden oluşabilir. • 1) Metallerin kristal yapılarının farklı olmasından, • 2) Kaynak, perçin, bükme yerlerinden, • 3) Farklı Metal yüzeylerinde, • 4) Deniz suyu bileşimleri arasındaki farklardan dolayı, • elektrik akımı, farklı potansiyellerdeki sahalar arasında daha kolay akar ve çözelti içinde pil oluşumu kolaylaşır böylece korozyon çok kolaylaşır. 4. 12. 2020 22: 16 56

Korozyon Olayı 57

KOROZYON VE KORUNMA • • Fe nin paslanması Anot Fe → Fe+2, Katot ½O 2+H 2 O→ 2. OH-} PİL rx Fe + ½. O 2+H 2 O→ Fe(OH)2 ileri rx 2 Fe(OH)2+1/2. O 2+ H 2 O→ 2 Fe(OH)3 →Fe 2 O 3. H 2 O (PAS)+ 2 H 2 O • KOROZYON VE KORUNMA • Özellikle Fe malzemelerin atmosferdeki nemin ve O 2 etkisiyle bozulması , paslanıp, kırılgan bir hal almasına KOROZYON denir. Ortamı p. H ı yabancı iyonlar ve nem korozyonun hızlandırır. Ayrıca malzemelerin yapısında azda olsa bulunan safsızlıklarda korozyonu hızlandırmakta veya bazen de yavaşlatabilmektedir. • Fe in paslanması Anot Fe(k) → Fe +2+2é Eº=0, 44 v katot O 2+ H+ → 2. H 2 O Eº=1, 23 V böylece pil oluşur. rx nem katkısıyla ilerler 2 Fe 2++3/2 O 2 + 3 H 2 O →Fe 2 O 3. H 2 O (Pas) +2 H 2 O • Deniz kıyısında çamurlu ve pis ortamlarda korozyon daha hızlı ilerler. • KORUMA Kuru veya O 2 siz ortamlarda paslanma olmadığı için malzeme boya, seramik polimer kaplama veya başka metalle kaplamak suretiyle O 2 ve nemle teması önlenerek korunabilir. Ancak kaplamadaki ve boyadaki çok küçük delikler yavaşta olsa olayı devam ettirir. Fe , Cu veya Sn gibi daha az aktif metalle kaplandığında bu kaplama hatasında kendini hemen gösterir ve Fe hızlı şekilde paslanır. • KATODİK KORUMA Fe kendisinden daha az aktif olan Zn Al , Mn gibi bir metalle kaplanırsa veya yana bağlanırsa anot bu element olur ve Fe katot olur. Bu elementler yükseltgenir ancak bunların oksitleri kendisi icin koruyucu oldugu icin fazla yıpranmazlar. Zn ile kaplama galvaniz olayında veya Fe malzemeye Al, Mg gibi aktif bir metal bağlamada KATODİK KORUMA meydana gelir. Anot olan etkin metale Kurban anot adı verilir. USA da her yıl 5. 5 milyon kg Mg kurban anot olarak kullanılmaktadır. Anot Zn -2é → Zn+2 Katot 1/2. O 2+ H 2 O +2é→ 2. OH top rx Zn(k) ½. O 2 + H 2 O → Zn(OH)2 • Benzer rx’lar Mg ve Al da oluşur. Ve oluşan hidroksit ve oksitler koruyucu olur. 58

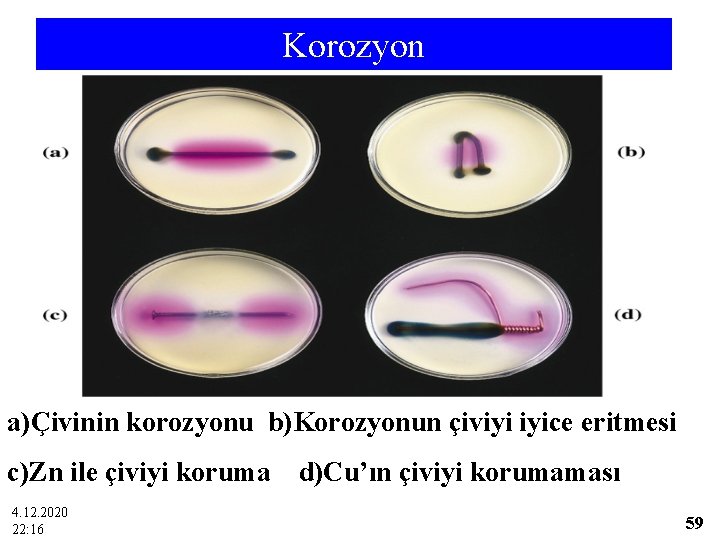
Korozyon a)Çivinin korozyonu b)Korozyonun çiviyi iyice eritmesi c)Zn ile çiviyi koruma 4. 12. 2020 22: 16 d)Cu’ın çiviyi korumaması 59

Elektrokaplama 60 / 65

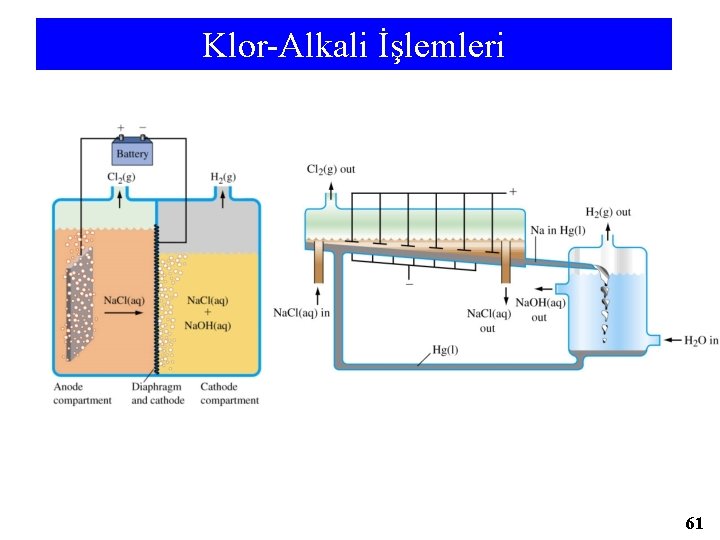
Klor-Alkali İşlemleri 61

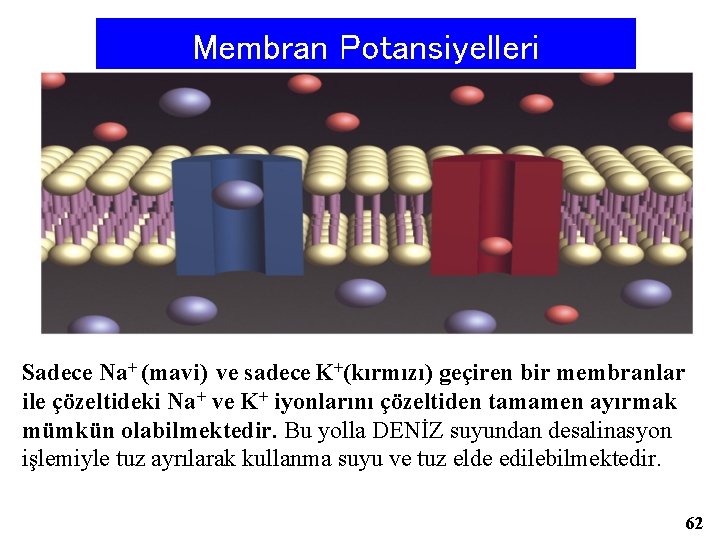
Membran Potansiyelleri Sadece Na+ (mavi) ve sadece K+(kırmızı) geçiren bir membranlar ile çözeltideki Na+ ve K+ iyonlarını çözeltiden tamamen ayırmak mümkün olabilmektedir. Bu yolla DENİZ suyundan desalinasyon işlemiyle tuz ayrılarak kullanma suyu ve tuz elde edilebilmektedir. 62

Nernst Potensiyel, Δ Membran Potansiyelinin oluşumuuyla, a)KCl (aq)’de hem K+ hem de Cliyonlarını geçiren membran seçilirse bir tarafta daha çok KCl’ün biriktiği gözlenir. b)Sadece K+ geçiren bir membran seçilirse bir tarafta daha çok K+’ün biriktiği gözlenir. Bu yolla DENİZ suyundan desalinasyon işlemiyle tuz ayrılarak kullanma suyu ve tuz elde edilebilmektedir GK-II K. 21 63

SORU) -A Pt(k)|Cl 2(1 atm)|Cl- 1 M ||Cu 2+ 1 M|Cu + K E°Cu 2+/Cu =0, 337 v, E°Cl 2/ ½ Cl-=1, 36 v Pil calısır mı? CEVAP) ΔEpil= E°ind sağ- E°ind sol =0. 337 -( 1. 36) =- 1, 203 çalışmaz tersi çalışır. SORU) 2 Fe 3++2 I- 2 Fe 2++ I 2 rx göre pil oluştur, Şemayı çiz. ΔE°pil=? K=? E°Fe 3+/Fe 2+=0, 8 v, E°I 2 /I- =0, 54 v. CEVAP) Pil şeması -A Pt | I 1 M , I 2 ||Fe 3+ 1 M, Fe 2+ 1 M|Fe +K ΔEpil= 0. 8 -0. 54 =0. 26 V >0 çalışır ΔE°= 0, 26= 0. 06 /2 log k K = 4, 6 x 107

KONU: 21’de ÇÖZÜLMESİ TAVSİYE EDİLEN SORULAR SORU) : Ag Cl doymuş çöz ile hazırlanan kons pili ΔE°pil= 0. 56 V dir Kç =? CEVAP) Nerst Formülü ΔE°pil=0. 56= ΔE°- 0. 0671 log Kc = 4, 6 x 10 -10 Öncelikle konu içinde verilmiş olan 1 adedi çözülmüş 2 adedi çözülecek örnek sorular üzerinde titizlikle durulması tavsiye edilir. KONU SONUNDA YER ALAN SORULARDAN ÖNERİLENLER : 6 - 8 -11 -13 -14 -15 -16 -17 -18 - 19 - 21 - 23 -2527 -29 -31 - 33 -35 -37 - 39 -41 - 43 -49 -53 - 55 63 - 67 -71 - 73 -98 -100 -101 4. 12. 2020 22: 16 GK-II K. 21 65 / 65
 İşlem adımlarıyla ebelikte klinik uygulamalar
İşlem adımlarıyla ebelikte klinik uygulamalar Sare değirmenci
Sare değirmenci Sıcak-soğuk uygulamalar ppt
Sıcak-soğuk uygulamalar ppt Internet ve temel uygulamalar
Internet ve temel uygulamalar Okul içi gözlem ve uygulamalar
Okul içi gözlem ve uygulamalar Black3 kavite
Black3 kavite Motor öğrenme prensipleri
Motor öğrenme prensipleri Kazaya çanak tutulması kuramı
Kazaya çanak tutulması kuramı Parsiyel veneer kronlar
Parsiyel veneer kronlar Amalgam kavite prensipleri
Amalgam kavite prensipleri Elleçleme prensipleri
Elleçleme prensipleri Hücum prensipleri
Hücum prensipleri Statiğin temel prensipleri
Statiğin temel prensipleri Cem samut
Cem samut Depolama prensipleri
Depolama prensipleri Iyot hekzaflorür formülü
Iyot hekzaflorür formülü Sigortanın temel prensipleri
Sigortanın temel prensipleri Heinrich prensipleri
Heinrich prensipleri Bütünlük nedir teknoloji tasarım
Bütünlük nedir teknoloji tasarım Araştırma modelleri
Araştırma modelleri Making simple inquiries
Making simple inquiries Konu daraltma örnekleri
Konu daraltma örnekleri Problem alanlarına göre rehberlik
Problem alanlarına göre rehberlik Question without auxiliaries
Question without auxiliaries Konu daraltma örnekleri
Konu daraltma örnekleri Konu daraltma örnekleri
Konu daraltma örnekleri Narrative tenses past perfect continuous
Narrative tenses past perfect continuous Program tasarım yaklaşımları
Program tasarım yaklaşımları Being + past participle clauses
Being + past participle clauses Sosyobilimsel konu örnekleri
Sosyobilimsel konu örnekleri Duygusal ifadeler 5. sınıf
Duygusal ifadeler 5. sınıf Reported speech emir cümleleri
Reported speech emir cümleleri Konu tasarımı disiplin tasarımı
Konu tasarımı disiplin tasarımı Düzgün beşgen konu anlatımı
Düzgün beşgen konu anlatımı Somutlama ne demek
Somutlama ne demek Sınırlandırılmış konu örnek
Sınırlandırılmış konu örnek Belirtke tablosu nedir kpss
Belirtke tablosu nedir kpss Pareto optimalitesi kriterleri
Pareto optimalitesi kriterleri Tapu kadastro genel m?d?rl?g?
Tapu kadastro genel m?d?rl?g? Topraksu genel müdürlüğü
Topraksu genel müdürlüğü Alifatik ve aromatik hidrokarbonlar
Alifatik ve aromatik hidrokarbonlar Kısa cevaplı yazılı yoklamalar
Kısa cevaplı yazılı yoklamalar Genel kareler toplamı
Genel kareler toplamı özel yetenek testleri
özel yetenek testleri Bektaş tepe genel biyoloji
Bektaş tepe genel biyoloji Sesbilgisel gelişim evreleri
Sesbilgisel gelişim evreleri Gazlarda yoğunluk formülü
Gazlarda yoğunluk formülü Banka hesap planı
Banka hesap planı Kan gruplar
Kan gruplar Finansal durum tablosu
Finansal durum tablosu Topraksu genel müdürlüğü
Topraksu genel müdürlüğü Genel hedef uzak hedef
Genel hedef uzak hedef Adaptasyon uyum yaklaşımları
Adaptasyon uyum yaklaşımları Darphane ve damga matbaası
Darphane ve damga matbaası Rickettsia vitamin d
Rickettsia vitamin d Yazılı sınavların avantajları ve dezavantajları
Yazılı sınavların avantajları ve dezavantajları Genel iskontolu fatura örneği
Genel iskontolu fatura örneği Korunabilirlik hızı
Korunabilirlik hızı Tapu kadastro genel m?d?rl?g?
Tapu kadastro genel m?d?rl?g? Kavram ağları örneği
Kavram ağları örneği Ilişkisel tarama modeli
Ilişkisel tarama modeli Lcw genel yetenek sınavı
Lcw genel yetenek sınavı Bütirik aldehit
Bütirik aldehit Dorsiflexion nedir
Dorsiflexion nedir 327 milli emlak genel tebliği
327 milli emlak genel tebliği Genel hedef örnekleri
Genel hedef örnekleri