Genel Kimya Principles and Modern Applications Petrucci Harwood




![ZAYIF ASİTLERDE p. H [H+] = [H 3 O+] = √(Ka. CHA) Tamamen iyonlaşmayan ZAYIF ASİTLERDE p. H [H+] = [H 3 O+] = √(Ka. CHA) Tamamen iyonlaşmayan](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-8.jpg)


![- Zayıf Bazların p. H [OH ] = √(Kb. Cb) Aynı kurallar zayıf bazlar - Zayıf Bazların p. H [OH ] = √(Kb. Cb) Aynı kurallar zayıf bazlar](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-12.jpg)











![[HA] = [Na. A] olan ASİDİK TAMPON ÇÖZELTİ • [CH 3 CO 2 H] [HA] = [Na. A] olan ASİDİK TAMPON ÇÖZELTİ • [CH 3 CO 2 H]](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-26.jpg)
















![50 m. L Na. OH (Eşd. Nok. ) [HCl] = (0, 1 x 0, 50 m. L Na. OH (Eşd. Nok. ) [HCl] = (0, 1 x 0,](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-46.jpg)






- Slides: 56

Genel Kimya Principles and Modern Applications Petrucci • Harwood • Herring 8 th Edition Ünite 18: Asit Baz Dengeleri ⇄ ⇌ ⇥ ↔↑↓ ⇅ ÷ ≠ ∞ ≈ ≤≥ ≡ ∑ ║│ √ ∛ ∜ ∫ ∫ ± ∆ λ Ӯ ϑ π ½ ¼ ¾ α β γ ∂ δ σ ε ζ η θ μ φ ψ ω ƌ ð У Ω. Philip Dutton University of Windsor, Canada N 9 B 3 P 4 Prentice-Hall © 2002 3. 11. 2020 08: 47 GK-II K. 18 1 / 56

İÇİNDEKİLER 18 -1 18 -2 18 -3 18 -4 18 -5 18 -6 Asit Baz Dengelerinde Ortak İyon Etkisi Tampon Çözeltiler Asit-Baz İndikatörleri Nötürleşme Tepkimeleri ve Titrasyon Eğrileri Çok Protonlu Asit Tuzlarının Çözeltileri Asit-Baz Denge Hesaplamaları: Özet Özel Konu KANDA TAMPON ⇄ ⇌ ⇥ ↔↑↓ ⇅ ÷ ≠ ∞ ≈ ≤≥ ≡ ∑ ║│ √ ∛ ∜ ∫ ∫ ± ∆ λ Ӯ ϑ π ½ ¼ ¾ α β γ ∂ δ σ ε ζ η θ μ φ ψ ω ƌ ð У Ω 2

Asit-Baz Denge Hesaplamaları Asit-Baz karışımlarına ait hesaplamalarda 16 ve 17. Bölümlerde verilen temel esaslarla çözüm yapılır. Bunun için özellikle şunlara dikkat edilmelidir: • 1 - Çözeltide hangi tür iyonlar önemlidir ve derişimleri nedir? Örneği HCl+HA karışımında H+, Cl -, HA ve A- bulunur. Burada en önemli olan HCl den gelen H+ miktarı olup ortamı o belirler. HA iyonlaşması ortak iyon etkisiyle azaldığı için HA’dan gelen H+ rahatça ihmal edilebilir düzeydedir. • 2 -Çözeltide bulunan türler arasında herhangi bir tepkime söz konusu ise buna dikkat edilmesi gerekir ve sonuç tepkime neticesinde ortamın durumuna ve etkin olacak türe göre hesaplanır. • 3 - rx neticesinde ortam nedir? Kuv. Asit mi? Kuv. Baz mı ? , Zayıf Asit mi? , Zayıf Baz mı ? , Asidik Tuz mu? , Bazik Tuz mu ? Nötral mi ? Amfoter mi ? Tampon mu? Mutlaka Doğru belirlenmeli ve ona göre hesaplama yolu seçilmelidir. Asidin etkin olduğu karışımlarda [H+] , bazın etkin olduğu karışımlar da ise [OH -] hesaplandığını Asit Ortm. p. H<7 , Baz ortm. p. H>7 olduğunu unutmamak gerekir. 3

ZAYIF ELEKTROLİTLERDE p. H • ZAYIF ELEKTROLİTLERDE ZAYIF ASİT HA ⇄ H+ + A- Ka = [H+] [A-] / [HA] = [H+]2 / CHA den [H+] çekilerek, bulunur. ZAYIF BAZ BOH ⇄ B+ + OH- Kb = ([B+] [OH- ] / [BOH] - Kb = [OH- ]2 / Cb – [ OH- ] Kb = [ OH ]2 / Cb dan bulunur. ASİDİK TUZ Khidroliz= Ksu / Kb BAZİK TUZ Khidroliz= Ksu / Ka 4 / 81

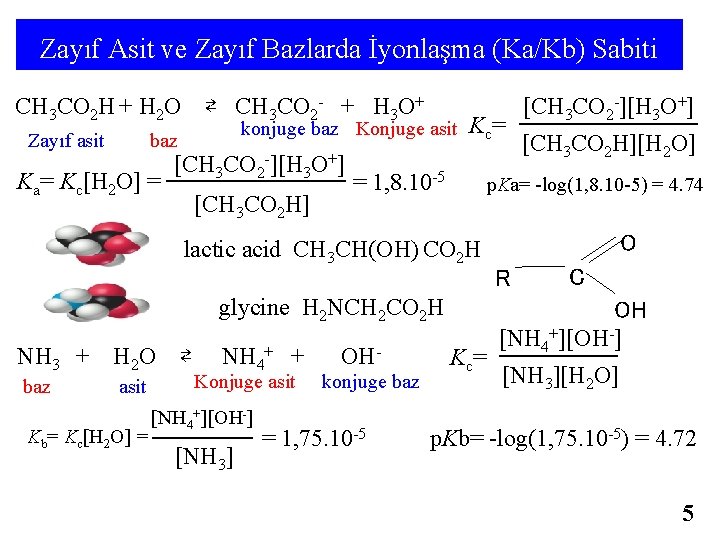
Zayıf Asit ve Zayıf Bazlarda İyonlaşma (Ka/Kb) Sabiti CH 3 CO 2 H + H 2 O Zayıf asit ⇄ CH 3 CO 2 - + H 3 O+ konjuge baz Konjuge asit baz Ka= Kc[H 2 O] = [CH 3 CO 2 -][H 3 O+] [CH 3 CO 2 H] K c= = 1, 8. 10 -5 glycine H 2 NCH 2 CO 2 H baz H 2 O asit Kb= Kc[H 2 O] = ⇄ NH 4+ + Konjuge asit [NH 4+][OH-] [NH 3] OHkonjuge baz = 1, 75. 10 -5 [CH 3 CO 2 H][H 2 O] p. Ka= -log(1, 8. 10 -5) = 4. 74 lactic acid CH 3 CH(OH) CO 2 H NH 3 + [CH 3 CO 2 -][H 3 O+] K c= O R C OH [NH 4+][OH-] [NH 3][H 2 O] p. Kb= -log(1, 75. 10 -5) = 4. 72 5

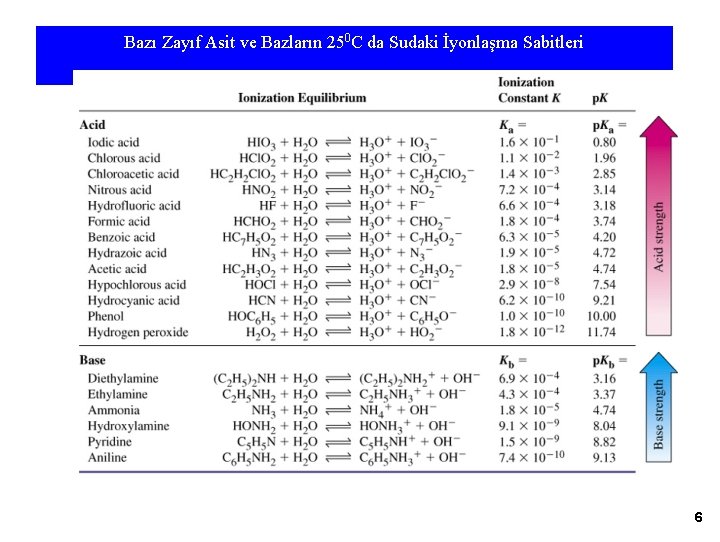
Bazı Zayıf Asit ve Bazların 250 C da Sudaki İyonlaşma Sabitleri 6

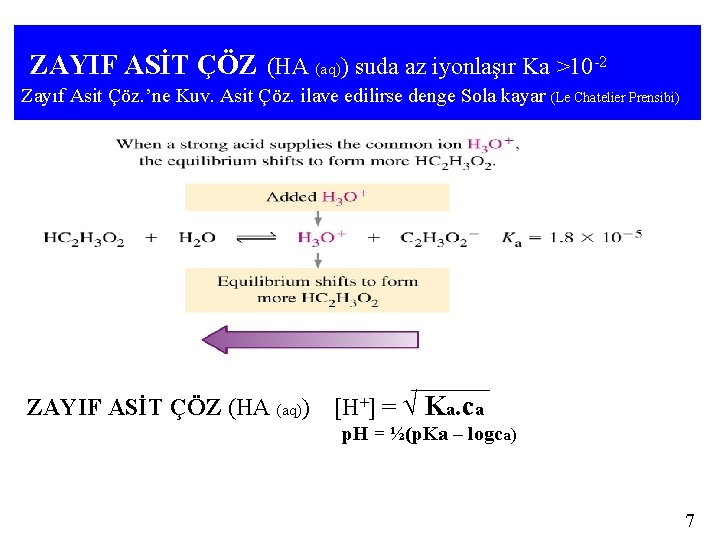
ZAYIF ASİT ÇÖZ (HA (aq)) suda az iyonlaşır Ka >10 -2 Zayıf Asit Çöz. ’ne Kuv. Asit Çöz. ilave edilirse denge Sola kayar (Le Chatelier Prensibi) ZAYIF ASİT ÇÖZ (HA (aq)) [H+] = √ Ka. ca p. H = ½(p. Ka – logca) 7
![ZAYIF ASİTLERDE p H H H 3 O Ka CHA Tamamen iyonlaşmayan ZAYIF ASİTLERDE p. H [H+] = [H 3 O+] = √(Ka. CHA) Tamamen iyonlaşmayan](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-8.jpg)
ZAYIF ASİTLERDE p. H [H+] = [H 3 O+] = √(Ka. CHA) Tamamen iyonlaşmayan (%α<10 için asitlere ve bazlara zayıf asit veya baz denir. Zayıf asitler HA, zayıf bazlarda BOH ile gösterilir. HA + H 2 O ⇄ H 3 O+ + A- Ka = [H 3 O+] [A-] / [HA] = [H 3 O+]2 / CHA den [H 3 O+] çekilerek, [H+] = [H 3 O+] = √(Ka. CHA) bulunur Aynı çözelti için 2 H O ⇄ H O+ + OH- K = [H + 2 3 su 3 O ] [ OH ] alınır. Eğer Ka değeri 10 -4 ile 10 -9 arasında ve asidin başlangıç derişimi 1 -10 -3 M arasında ise, suyun iyonlaşma dengesinin p. H ye etkisini olmadığı kabul edilir. Sadece Ka denge ifadesini kullanarak hidronyum derişimi hesaplanabilir. Dengede [HA] = CHA - [H 3 O+] yazılabilir. Aynı zamanda [A- ] = [H 3 O+] olduğundan Ka = [H 3 O+]2 / (CHA - [H 3 O+]) den [H 3 O+] bulunur. Bu tür problemlerin çözümünde diğer bir kabul ise başlangıç derişiminin Ka’ya oranı, (CHA / Ka)> 10 ise asidin iyonlaşması ile başlangıç derişiminin fazla değişmediği düşünülebilir ve paydadaki H 3 O+ derişimi CHA yanında ihmal edilebilir. 8

Zayıf Asit p. H Hesabı Örnek: Derişimi 0. 10 M olan Asetik asit ( CH 3 COOH) çözeltisinin p. H si nedir? Ka = 1, 75 x 10 -5 (25 o. C) Çözüm: CH 3 COOH veya genel formülü ile HA suda HA + H 2 O ⇄ H 3 O+ + A- Başlangıç: 0, 10 M 0 Değişim -x +x Dengede: (0, 10 -x) M +x Ka = [H 3 O+]2 / CHA =1, 75 x 10 -5 = x 2 / (0, 10 -x) Son kabulümüzün uygulanabilirliği test edildiği zaman 0, 10 / 1, 75. 10 -5 >103 (bin katından büyük) Asidin iyonlaşması ile başlangıç derişiminin fazla değişmediği düşünülebilir ve paydadaki H 3 O+ derişimi CHA yanında ihmal edilebilir. 1, 75 x 10 -5 = x 2 / 0, 10 x 2 = 1, 75 x 10 -6 [H 3 O+] = x = 1, 32 x 10 -3 M p. H = -log 1, 32 x 10 -3 = 2, 88 9

Zayıf bir asit çözeltisinin p. H’ının bulunması Butirik asit, HC 4 H 7 O 2 yapay tatlandırıcılar ve şuruplarda kullanılan bileşiklerin elde edilmesinde kullanılır. 0, 250 M HC 4 H 7 O 2 çözeltisinde p. H=2, 72 bulunmuştur. Butirik asidin Ka değerini hesaplayınız. HC 4 H 7 O 2 + H 2 O ⇄ C 4 H 77 O 2 + H 3 O+ Ka =? Çözüm : HC 4 H 7 O 2 + H 2 O ⇄ C 4 H 7 O 2 + H 3 O+ HC 4 H 7 O 2 nın KA değeri Ksu dan çok daha büyük olacağından, suyun iyonlaşmasını ihmal ederiz. Başlangıç derişimi: 0. 250 M 0 0 Değişme: K a= +x M +x. M Denge derişimi: (0. 250 -x) M x. M p. H= -log[H+]=2, 72 [H+]=10 -2. 72 =1, 9 x 10 -3 =x dan x. M [H 3 O+] [C 4 H 7 O 2 -] [HC 4 H 7 O 2] -x M = 1, 9. 10 -3 · 1, 9. 10 -3 (0. 250 – 1, 9. 10 -3) = 1, 5. 10 -5 Ka >> KW İYONLAŞMA YÜZDESİ %α =100. x/c=0, 19/0, 25=0, 76 10 / 56

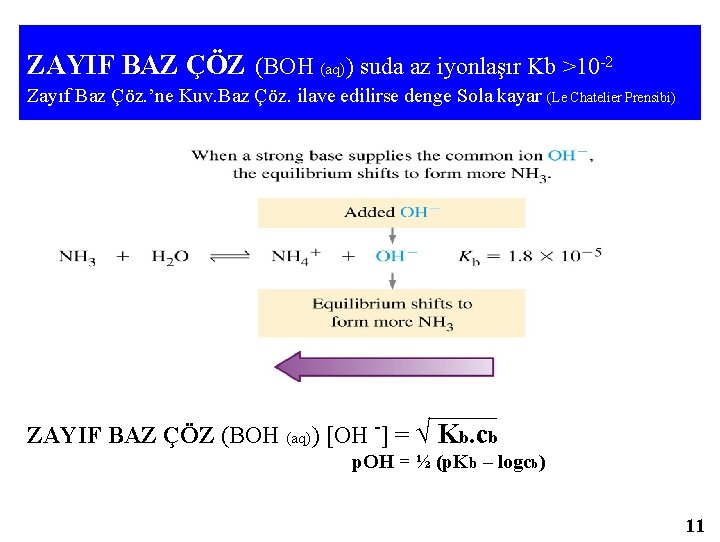
ZAYIF BAZ ÇÖZ (BOH (aq)) suda az iyonlaşır Kb >10 -2 Zayıf Baz Çöz. ’ne Kuv. Baz Çöz. ilave edilirse denge Sola kayar (Le Chatelier Prensibi) ZAYIF BAZ ÇÖZ (BOH (aq)) [OH -] = √ Kb. cb p. OH = ½ (p. Kb – logcb) 11
![Zayıf Bazların p H OH Kb Cb Aynı kurallar zayıf bazlar - Zayıf Bazların p. H [OH ] = √(Kb. Cb) Aynı kurallar zayıf bazlar](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-12.jpg)
- Zayıf Bazların p. H [OH ] = √(Kb. Cb) Aynı kurallar zayıf bazlar içinde geçerlidir. B + H 2 O ⇄ BH+ + OH- Kb = ([BH+] [OH-] / [B] 2 H 2 O ⇄ H 3 O+ + OH- Ksu = [H 3 O+] [OH-] Kb = [OH- ]2 / CB – [OH-] Kb = [OH-]2 / CB Eğer Kb değeri 10 -9 dan küçük ve bazın derişimi de 10 -3 M dan daha küçük ise suyun iyonlaşma etkisini göz önüne almak zorundayız. [OH-] = [OH-]zayıf baz + [OH-]su Zayıf bazdan gelen [OH-] aynı zamanda [BH+] ya, sudan gelen [OH-] ise suyun [H 3 O+] ya eşittir. Dolayısıyla [OH-] = [BH+] + [H 3 O+] olur. [BH+] = Kb. [B] / [OH-] [H 3 O+] = Ksu / [OH-] değerler yerine konulduğunda [OH-] = Kb [B] / [OH-] + Ksu / [OH-]2 = Kb[B] + Ksu [OH-] = (Kb. [B] + Ksu)1/2 olur. Baz zayıf olduğundan dengedeki B derişimi, bazın başlangıç derişimine eşit olarak düşünülebilir. Böylece eşitlik [OH-] = (Kb. Cb+ Ksu)1/2 haline gelir. Kb. Cb >> Ksu olduğunda eşitlik [OH-] = (Kb. Cb)1/2 şeklini alır. 12

Çok Seyreltik Zayıf Bazların p. H Hesabı Örnek: 2, 5 x 10 -5 M anilin, C 6 H 5 NH 2, çözeltisindeki türlerin derişimlerini ve p. H değerlerini bulunuz. Kb = 4, 30 x 10 -10 Dikkat edilmesi gereken husus Kb değerinin 10 -9 dan, baz derişimin ise 10 -3 M dan küçük olduğudur. C 6 H 5 NH 2 + H 2 O ⇄ C 6 H 5 NH 3+ + OH [OH-] = (Kb. Cb)1/2 = (4, 30 x 10 -10 x 2, 5 x 10 -5 + 1. 10 -14)1/2 = [OH-] = (1, 08 x 10 -14 + 1. 10 -14)1/2 = 1, 44 x 10 -7 M ➪ p. OH=6, 84 ➪ p. H=7, 16 bulunur. veya [OH-] = [C 6 H 5 NH 3+] = 1, 44 x 10 -7 M [C 6 H 5 NH 2] = 2, 5 x 10 -5– 1, 44 x 10 -7 = 2, 49 x 10 -5 M [H 3 O+] = Ksu / [OH- ] = 1. 10 -14 / 1, 44 x 10 -7 = 6, 94 x 10 -8 M p. H= -log 6, 94 x 10 -8 = 7, 16 bulunur. 13

• Zayıf Asitler ve Zayıf Bazların p. H • 1 - Na. F çürümeyi önleyici olarak Diş macunlarında kullanılır. 0, 1 M Na. F(aq) p. H=? Ka. HF=6, 6*10 -4 • ➨ CEVAP: Na. F Zayıf Asidin BAZİK karekterli tuzu olup [OH-]= √Khyd. Bx c. B. tuz = √(10 -14/6, 6*10 -4)*0, 1 • [OH-] =1, 2*10 -6 ➪ p. OH=5, 92 ➪ p. H=8, 08 ********************************** • 2 - 0, 035 M Triklorasetik Asit (HTka) İyonlaşma Derecesi= α =? ve %α =? p. KHTka= 0, 52 • CEVAP: p. KHTka= 0, 52 p. Ka<2 (Ka>10 -2) olduğundan HTka KUVVETLİ ASİTtir. Kuvvetli asitlerde p. Ka<<2 (Ka>>10 -2) ise [H+] ≈ C olur. %α ≈100 olur. ➨ • KHTka= 10 -0, 52 =0, 302= x 2 / (0, 035 -x) • x = 0, 032 = [H+] α =x/c=0, 032 / 0, 035 =0, 91 %α = 91 ********************************** • 3 - 0, 1 M Laktik Asit (HC 3 H 5 O 3) SŞ’da p. H=2, 44 Ka=? p. Ka=? %α =? • ➨ CEVAP: HC 3 H 5 O 3 ⇄ H+ + C 3 H 5 O 3 - [H+ ] = 10 -2, 44= 3, 6. 10 -3 • Ka=[H+ ]. [C 3 H 5 O 3 - ] / [HC 3 H 5 O 3] = (3, 6. 10 -3)2 /(0, 1 - 3, 6. 10 -3) =1, 37. 10 -4 ➪ p. Ka=3, 86 ➪%α =3, 6. 10 -3 x 100/0, 1=3, 6 14

. Kuv. Asit ve Zayıf Asit Bulunan Bir Çöz. nin Kuvvetli Bazla Titrasyonu Örnek 0, 15 M HCl asit ve 0, 10 M HA zayıf asidi bulunmaktadır. Toplam hacmi 25 m. L olan bu çözelti 0, 12 M Na. OH çözeltisi ile titre ediliyor. Bu titrasyonun titrasyon eğrisini oluşturalım. Ka =1, 75. 10 -5 Başlangıçta hiç baz eklenmediği zaman ortamdaki [H 3 O+], HCl asitten ve HA asitinin iyonlaşması sonucu ortaya çıkan [H 3 O+]’ nun toplamlarına eşittir. [H 3 O+] = CHCl + [A- ] Başlangıç anında HA dan gelen [H 3 O+] kuvvetli asidin yanında ihmal edilebilecek kadar azdır. Böylelikle ortamın p. H = - log 0, 15 = 0, 82 Ama yinede HA dan gelen [H 3 O+] derişimine bir bakalım. Kuvvetli asit yanında HA dan gelen [A- ] iyonu ihmal edilebileceğinden ortamdaki [H 3 O+] sadece kuvvetli asitten geliyormuş gibi düşünülür. HA + H 2 O ⇄ H 3 O+ + A- [H 3 O+] = [A- ] Ka = [H 3 O+] x [A- ] / [HA] = Ka / [H 3 O+] [A- ] / [HA] =1, 75. 10 -5 / 0, 15 = 2, 62. 10 -6 0, 10 = [HA] + [A- ] 0, 10 = [A- ] / 2, 62. 10 -6 + [A- ] dan [A- ] = 1, 31. 10 -7 bulunur bu değer gerçekten 0, 15 M yanında ihmal edilebilecek bir değerdir. 10 m. L 0, 12 M sodyum hidroksit (Na. OH) eklendiğinde (eşdeğerlik noktasından önce) Burada hala ilk basamakta yaptığımız varsayım geçerlidir. Ortamdaki [H 3 O+] sadece kuvvetli asitten geliyormuş gibi düşünülür. Fakat baz ilave edildiği için derişiminde bir azalma olacaktır. 15

CHCl = (0, 15 x 0, 025) – (0, 12 x 0, 010) / 0, 035 = 0, 0729 M p. H= – log 0, 0729= 1, 14 Burada da her ihtimale karşı HA’nın iyonlaşmasından gelen [H 3 O+] derişimi hesaplanır. 30 m. L 0, 12 M sodyum hidroksit (Na. OH) eklendiğinde Bu tür tepkimelerde eşdeğerlik noktasını şu hesapla bulabiliriz. Masit x Vasit = Mbaz x Vbaz den Vbaz bulunarak eşdeğerlik noktasına gelmek için kaç m. L baz ekleneceği hesaplanır. 0, 15 x 0, 025 = 0, 12 x Vbaz = 0, 03125 L = 31, 25 m. L baz harcandığı zaman eşd. Nok’na ulaşılacak. Eğer 30 m. L baz eklersek eşdeğerlik noktasına çok yaklaşılacak ve artık HA dan gelen [H 3 O+] ihmal edilemeyecek. Eklenen baz HCl’yi nötrleştirdiği için CHCl = (0, 15 x 0, 025) – (0, 12 x 0, 030) / 0, 055 = 2, 72. 10 -4 HA = (0, 1 x 0, 025) / 0, 055 = 0, 045 [H 3 O+] = [A-] dan [H 3 O+] =CHCl+[A- ] = = 2, 72. 10 -4 + [A- ] Ka = [H 3 O+] x [A- ] / [HA] = Ka / [H 3 O+] dan [HA] = [H 3 O+]x[A-] / Ka ([H 3 O+] x [A- ] / 1, 75. 10 -5) + [A- ] = 0, 045 [A- ] = 7, 85. 10 -7 / ( [H 3 O+] + 1, 75. 10 -5 eşitliğini [H 3 O+] = 2, 72. 10 -4 + [A- ] = 2, 72. 10 -4 +[ 7, 85. 10 -7 / ( [H 3 O+]+1, 75. 10 -5 ] [H 3 O+]2 - 2, 54. 10 -4[H 3 O+] – 7, 90. 10 -7 = 0 eşitliğinden [H 3 O+] = 1, 30. 10 -3 dan p. H = -log 1, 30. 10 -3 = 2, 87 bulunur. Eşdeğerlik noktasında eklenen bazın hepsi kuvvetli asiti nötürleştirecektik. Ortamda sadece zayıf asit kalacaktır. Bundan sonra problemin çözümü zayıf asit baz titrasyonu gibi yapılır. 16 / 55

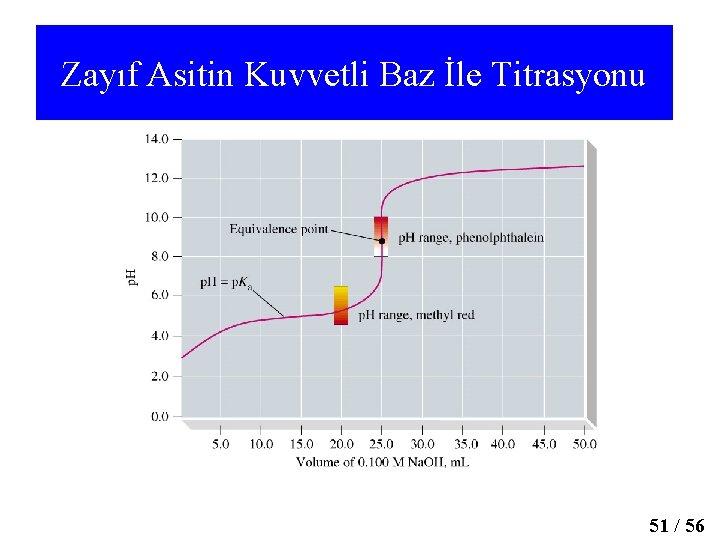
Zayıf bir Asidin Kuvvetli bir Bazla Titrasyonu Asit baz titrasyonlarında hesaplanması gereken dört temel nokta vardır. 1 -Başta HA Ka=1, 75. 10 -5=[H 3 O+] [A-]/ [HA]= x 2 / 0, 05 x=[H 3 O+]= 9, 35 x 10 -4 p. H =3, 03 2 - EKİVALENS (Eşdeğerlik) Noktası önce 50 m. L 0, 05 M Na. OH eklendiğinde HA/Na. A tampon olur [ HA] =(0, 100 x 0, 05)- (0, 050 x 0, 05) / (0, 100+0, 05)= 0, 017 [ A-] = (0, 050 x 0, 05) / (0, 100+0, 05) =0, 017 Ka = [H 3 O+]. [A-] / [HA] [H 3 O+]=1, 75. 10 -5 x 0, 017/0, 017 = 1, 75. 10 -5 p. H = 4, 76 3 - Ekv. Nok. da 100 m. L 0, 05 M sodyum hidroksit (Na. OH) eklendiğinde (eşdeğerlik noktasında) Eşdeğerlik noktasında HA’ nın tamamı A- dönüşür. A- + H 2 O ⇄ OH- + HA Burada Ka x Kb = Ksu Kb= Ksu / Ka denklemleri hatırlanmalı. Kb = ([OH- ] [HA] ) / [A- ] = 1. 10– 14/ 1, 75. 10 -5 = 5, 71. 10 -10 Ekv. noktasında ortamda yalnızca A- var fakat hacım 200 m. L olduğu için [A- ] derişimi yarıya düşer (hacim iki katına çıktı) Kb = x 2/ 0, 025 x=[OH- ] = (5, 71. 10 -10 x 0, 025)1/2 = 3, 78. 10 -6 p. OH = 5, 42 p. OH + p. H = 14 – 5, 42 = 8, 58 17

4 - 150 m. L 0, 05 M sodyum hidroksit (Na. OH) eklendiğinde (eşdeğerlik noktasından sonra) Eşdeğerlik noktasından sonra ortamda bulunan [OH - ] kaynağı hem eklenen baz hemde A- iyonudur. Ortamda kuvvetli baz baskın olduğu için A- iyonundan gelecek olan [OH- ] katkısı azdır. [OH- ] = [(0, 150 x 0, 05) - (0, 100 x 0, 05)]/0, 250 = 0, 01 p. OH = 2 p. H =14 – 2 =12 18

Zayıf Asitin Kuvvetli Baz İle Titrasyonu 19

TUZLAR Nötralleşme rx’ları sonucunda oluşurlar ve nötralleşen asit ve bazın kuvveti birbirine denk ise nötr tuz, değilse kuvvetli olanın karekterinde tuz oluşur. Tuzun su ile kendini meydana getiren asit ve bazı oluşturması nötralleşmenin tersi olup HİDROLİZ adı verilir. Asidik Tuz HCl + NH 3(aq) NH 4 Cl(aq) zayıf asitlerde olduğu gibi p. H hesaplanır. [H+]2 = Kat. Cat Hidroliz sabiti = Kat = 10 -14/ Kb alınır. ÖR : 0, 1 M NH 4 Cl(aq) p. H=? C: [H+]2 = 10 -14/ 10 -5. 0, 1 =10 -10 p. H=5 olur. (aq) Bazik Tuz Na. OH + HA(aq) Na. A(aq)+ H 2 O için [OH- ]2 =Kbt*Cbt • Hidroliz sabiti = Kbt = 10 -14/ Ka dir. (aq) ÖR: 0, 1 M Na. A(aq) p. H=? CEVAP : [OH- ]2=10 -14/10 -5. 0, 1=10 -10 p. OH=5 p. H = 9 bulunur. • Nötr Tuzların asit ve bazları birbirlerine eşit veya çok yakın kuvvette olduğu için p. H’ları 7 civarındadır. Daha kuvvetli asit ve bazlar yanında ihmal ediliebilirler. 20 / 56

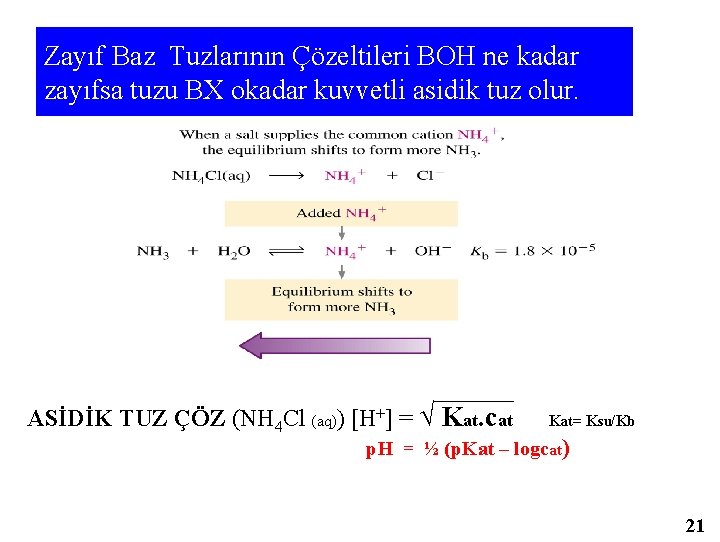
Zayıf Baz Tuzlarının Çözeltileri BOH ne kadar zayıfsa tuzu BX okadar kuvvetli asidik tuz olur. ASİDİK TUZ ÇÖZ (NH 4 Cl (aq)) [H+] = √ Kat. cat Kat= Ksu/Kb p. H = ½ (p. Kat – logcat) 21

Zayıf Asit Tuzlarının Çözeltileri HA ne kadar zayıfsa tuzu Na. A okadar kuvvetli bazik tuz olur. BAZİK TUZ ÇÖZ (Na. A(aq)) [OH -] =√ Kbt. cbt Kbt= Ksu/Ka p. OH = ½ (p. Kbt – logcbt) 22

03. 04. TAMPON ÇÖZELTİLER p. H sı belli olan, seyrelmeyle veya az miktarda kuvvetli asit veya baz ilavesi sonucu p. H sı değişmeyen çözeltilere tampon çözeltiler denir. Tampon çözelti zayıf bir asit ve konjüge bazını veya zayıf baz ve konjüge asidini içeren bir çözeltidir. ASİDİK TAMPON : Zayıf asit + Tuzu karışımı olup (HA+Na. A)aq dır. BAZİK TAMPON : Zayıf baz + Tuzu karışımı olup (NH 3+NH 4 Cl)aq dır. Genellikle oldukça derişik çözeltilerle çalışıldığından, Ka=10 -4 -10 -9 arasında suyun iyonlaşma etkisi ihmal edilebilir [H 3 O+] = Ka*[HA]/ [A-] formülünden [H 3 O+] ve oradan da ortamın p. H’sı hesaplanır. Tampon hazırlamayı değişik örneklerle açıklayabiliriz. ÖRNEK 1. 1 M sodyum format (Na. HCOO) ve 0, 5 M formik asit (HCOOH) içeren çözeltinin p. H’sı nedir? Ka = 1, 80 x 10 -4 Öncelikle formik asidin HCOOH iyonlaşması rx yazılır. HCOOH ⇄ H+ + HCOO- Ka= [H+ ]. Ct/Ca dan [H+ ]=Ka. Ca/Ct bulunur. [H+ ]=Ka. Ca/Ct=1, 80. 10 -4( 0, 5/1) [H 3 O+] = 9. 10 -5 dan p. H= 4, 04 bulunur. 23

Henderson-Hasselbalch Eşitliği HA+ Na. A ASİDİK TAMPON için HA + H 2 O ⇄ A- + H 3 O+ -log. Ka=-log[H 3 O+]-log p. Ka = p. H - log K a= [A-] [HA] [H 3 O+] [A-] [HA] Ka= [H 3 O+] -log. Ka=-log[H 3 O+] - log p. H = p. Ka + log BOH+BX BAZİK TAMPON için [A-] [HA] p. OH=p. Kb + log [B+] [BOH] 0, 1< Tampon ORANI <10 arasında, [HA] / [BOH]>100*Ka/b olmalıdır. Yani M-x ≈ M olmalıdır. Eğer olmazsa yukardaki eşitlik kullanılamaz. 24

Ör 2. 200 m. L 0, 4 M NH 3 ve 0, 1 M NH 4+çözeltisi p. H=? [OH- ]=Kb x [NH 3] / [NH 4+] = 1, 75. 10 -5 x (0, 4 / 0, 1) = 7. 10 -5 p. OH = 4, 15 p. OH + p. H =14 p. H = 14 - 4, 15 = 9, 845 A) Bu çöz. ’ye 50 m. L 0, 025 M HCl eklendiğinde oluşacak çöz. p. H=? Baz çözeltisine HCl asit çözeltisi eklenir, , [NH 3] eklenen asit kadar azalır ve konjüge asidi olan [NH 4+] de eklenen asit kadar artar. Diğer bir dikkat edilmesi gereken konu ise çözeltinin son hacminin değiştiği. Toplam hacim arttığı için NH 4+ ve NH 3 derişimleri de değişecek. [NH 3] =[(0, 4 x 0, 2) – (0, 025 x 0, 05)] /0, 250 = 0, 315 [NH 4+] = [(0, 1 x 0, 2) + (0, 025 x 0, 05)] /0, 250 = 0, 085 NH 3 + H 2 O ⇄ NH 4+ + OH- Ka x Kb = Ksu Kb= Ksu / Ka Kb= 1, 75. 10 -5 Kb= [NH 4+] x [OH- ] /[NH 3] dan [OH- ]=Kb x [NH 3] / [NH 4+] =1, 75. 10 -5 (0, 315 x / 0, 085) = 6, 48. 10 -5 p. OH = 4, 19 p. OH + p. H =14 p. H = 14 - 4, 19 = 9, 81 B) Aynı çöz. ’ye 50 m. L 0, 025 M Na. OH eklendiğinde oluşacak çöz. p. H=? [OH- ]=Kb x [NH ] / [NH +] =1, 75. 10 -5 (0, 325 x / 0, 01875) = 3, 033. 10 -4 3 4 p. OH = 3, 518 p. OH + p. H =14 p. H = 14 – 3, 518 = 10, 482 25
![HA Na A olan ASİDİK TAMPON ÇÖZELTİ CH 3 CO 2 H [HA] = [Na. A] olan ASİDİK TAMPON ÇÖZELTİ • [CH 3 CO 2 H]](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-26.jpg)
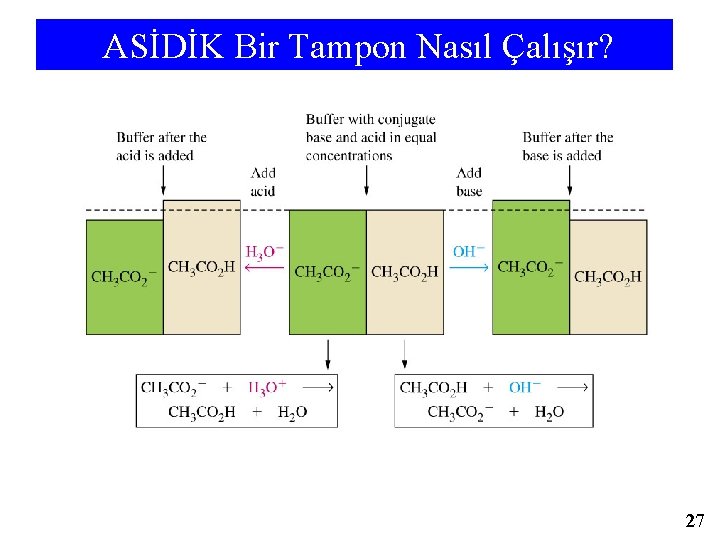
[HA] = [Na. A] olan ASİDİK TAMPON ÇÖZELTİ • [CH 3 CO 2 H] = [CH 3 CO 2 -] K a= [H 3 O+] [CH 3 CO 2 -] [C 3 CO 2 H] [H 3 O+] = Ka [CH 3 CO 2 -] [C 3 CO 2 H] = 1, 8 x 10 -5 p. H = -log[H 3 O+] = -log. Ka = -log(1, 8 x 10 -5) = 4. 74 26

ASİDİK Bir Tampon Nasıl Çalışır? 27

Örnek İstenen p. H da Bir Tampon Çözelti Hazırlanması. p. Hsı 5, 09 olan Asidi bir Tampon çözelti 0. 300 L 0. 25 M HC 2 H 3 O 2 (HA)içinde ne kadar Na. C 2 H 3 O 2 (Na. A) çözerek hazırlanabilir? (Çözelti hacminin 0. 300 L de sabit kaldığını varsayınız. ) Denge İfadesi: HC 2 H 3 O 2 + H 2 O ⇄ C 2 H 3 O 2 - + H 3 O+ +] = 10 -5. 09 = 8, 1 x 10 -6 [H O 3 [C 2 H 3 O 2 ] Ka= [H 3 O+] = 1, 8 x 10 -5 [HC 2 H 3 O 2] = 0. 25 M [HC 2 H 3 O 2] Çözüm için [C 2 H 3 O 2 -] 0. 25 [HC 2 H 3 O 2] 5 [C 2 H 3 O 2 ] = Ka = 0. 56 M = 1. 8 x 10 6 + 8. 1 x 10 [H 3 O ] 0, 3 L çöz’e katılacak Na. A g miktarı=0, 56 mol / L x 82 g/mol x 0, 3 L=14 g Na. A. 28

Tampon Kapasitesi ve Aralığı • Tampon kapasitesi, tampon çözeltinin p. H sı önemli oranda değişmeye uğramadan nötürleştirebileceği asit ya da baz miktarıdır. – Maksimum tampon kapasitesine [HA] ve [A-] büyük ve birbirine yaklaşık eşitse ulaşılır. • Tampon aralığı, eklenen asit ve bazların tampon p. Hı üzerine etkisinin az olduğu ve dolayısıyla p. H değerinin hemen sabit kaldığı p. H aralığıdır. 29

SINAV SORUSU • SORU : Elinizde 0, 1 L 0, 1 M HA(aq) olduğuna göre bunu p. H=4 olan tampon çözelti haline dönüştürünüz. • KHA=10 -5 katı Na. A=82 g/mol • CEVAP: 0, 1 M HA(aq) [H+]2 = 0, 1*10 -5=10 -3 den p. H=3 dür. • p. H=4 olan ASİDİK TAMPON da [H+]=10 -5 (0, 1/Ct)=10 -4 • den Ct==10 -2 bulunur. Ohalde O, 1 L 0, 1 M HA(aq) içine katı Na. A=82 g/mol dan 0, 082 g. çözülürse p. H=4 olan Tampon çözelti oluşur. • Not: 0, 1 M HA(aq) içinde katı 0, 082 g. Na. A çözülmesiyle gelebilecek hacım değişikliği ihmal edilebilecek kadar küçük olup p. H’ı değiştirmez. 30 / 56

SINAV SORUSU • SORU : Elinizde 0, 1 L 0, 1 M NH 3(aq)’nız olduğuna göre p. H=10 olan tampon çözeltiyi nasıl hazırlarsınız. • KNH 3=10 -5 katı NH 4 A=53, 5 g/mol • CEVAP: 0, 1 M NH 3(aq)[OH ]2 = 0, 1*10 -5=10 -3 den p. OH=3, p. H= 11 dür. • p. H=10 olan BAZİK TAMPON da [OH-]=10 -5 (0, 1/Ct)=10 -4 • den Ct==10 -2 bulunur. Ohalde O, 1 L 0, 1 M NH 3(aq) içine katı NH 4 A=50 g/mol dan 0, 0545 g. çözülürse p. H=10 olan Tampon çözelti oluşur. • Not: 0, 1 L 0, 1 M NH 3(aq) içinde katı 0, 0535 g. NH 4 A çözülmesiyle gelebilecek hacım değişikliği ihmal edilebilecek kadar küçük olup p. H’ı değiştirmez. 31

SINAV SORUSU • A) 0, 4 M NH 3 (aq) p. H=? B) 0, 1 M NH 4+(aq) p. H=? C) A ve B den 100’er m. L alınarak oluşturulan karışımın p. H=? D) C’de oluşan 200 m. L karışıma 50 m. L 0, 025 M HCl asit eklenirse p. H=? KNH 3=10 -5 E) C’de oluşan 200 m. L karışıma 50 m. L 0, 025 M Na. OH(aq) eklendiğinde oluşacak çöz. p. H=? • CEVAP) A) 0, 4 M NH 3 (aq) [OH- ]2=10 -5*0, 4 = 4. 10 -6 den [OH- ]=2. 10 -3 ve p. OH = ~ 2, 7 den p. H = ~ 11, 3 olur. B ) 0, 1 M NH 4+(aq) [H+]2= (10 -14/10 -5)*0. 1 = 10 -10 den p. H=5 bulunur. 32

SINAV SORUSU CEVABININ DEVAMI C) A ve B den 100’er m. L alınarak oluşturulan karışım BAZİK TAMPON [OH- ]= 10 -5*(0, 4/0, 1) den p. OH=4, 4 dan p. H=9, 6 bulunur. D) C’de oluşan 200 m. L karışıma 50 m. L 0, 025 M HCl asit eklenirse p. H=? KNH 3=10 -5 [NH 3]=(0, 2 x 0, 2)–(0, 05 x 0, 025)]/0, 250 = 0, 155 [NH 4+] = (0, 05 x 0, 2) + (0, 05 x 0, 25)] /0, 250 = 0, 09 BAZİK TAMPON [OH- ]= 10 -5*(0, 155/0, 09) den p. OH=4, 76 dan p. H=9, 23 bulunur. 33

SINAV SORUSU CEVABININ DEVAMI E) 200 m. L 0, 2 M NH 3 ve 0, 05 M NH 4+karışımı olmuştur buna 50 m. L 0, 025 M Na. OH(aq) ilavesinde çöz. p. H=? Tampon çözeltiye kuv. baz çözeltisi eklenince, [NH 4+] eklenen baz kadar azalır. , [NH 3] eklenen baz kadar artar. Burada dikkat edilmesi gereken çözeltinin son hacminin değişikliğidir. Toplam hacim arttığı için [NH 4+] ve [NH 3] derişimleri de değişecektir. [NH 3] = (0, 2 x 0, 2)+(0, 05 x 0, 025)]/0, 250 = 0, 165 [NH 4+] = (0, 05 x 0, 2) - (0, 05 x 0, 025)] /0, 250 = 0, 00875 oluşan karışım Bazik bir Tampondur ohalde : BAZİK TAMPON [OH- ]= 10 -5*(0, 165/0, 009) den p. OH=3, 74 dan p. H=10, 26 bulunur. 34

Kanda Tampon Kan p. H=7, 4 olan TAMPON bir çözeltidir. Bu p. H’ın onda bir bile değişmesi şiddetli hastalık hatta ölüme sebep olabilmektedir. ASİDOSİS olayı p. H<7, 4 olması hali olup kalp yetmezliği, Böbrek yetersizliği, ishal ve protein yetersizliği nedeniyle, ALKOLOSİS p. H>7, 4 olması hali olup kusma, hiperventilasyon, aşırı yükseklikte O 2 yetersizliği nedeniyle oluşur. İnsan kanının tamponlama kapasitesi yüksektir. 0, 01 mol HCl 1 L kanın p. H’ını 7, 2 yaparken 1 L izotonik Karışım ( %1 Na. Cl(aq))’ın p. H’ını 2’e kadar düşürür. Metabolik rx’lar neticesin de kanda oluşan CO 2, H 2 CO 3 ve HCO 3 - akciğerler tarafından kana devamlı pompalanır ve kanın Tampon gücünün temelini oluşturur. Ayrıca canlıların bünyesinde bulunan Fosfat Tamponu ve Plazma Proteinleri de bu Tampon Tesirine katkıda bulunurlar. CO 2(g) + H 2 O ⇄ H 2 CO 3(aq) Ka 1 = 4. 4 x 10 -7 p. Ka 1 = 6. 4 3. 11. 2020 08: 48 H 2 CO 3(aq) + H 2 O(s) ⇄ HCO 3 -(aq) p. H = 7. 4 = 6. 4 +1. 0 GK-II K. 18 p. H= p. Ka 1+log [HCO 3 -] / [H 2 CO 3] 35 / 43

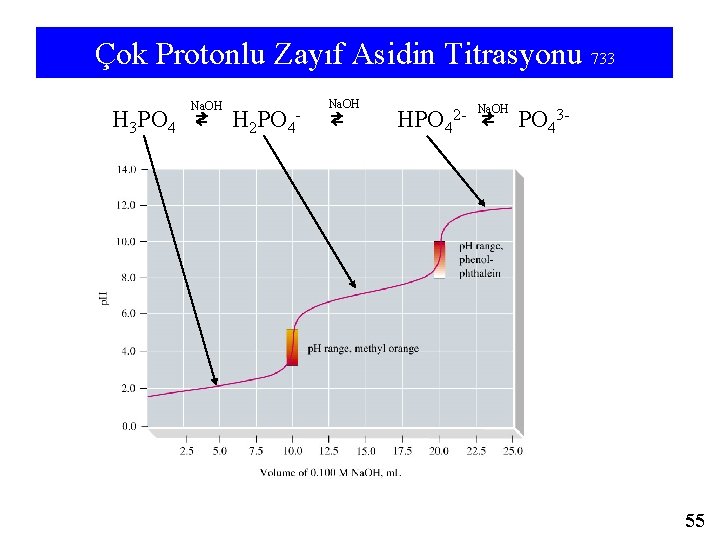
POLİPROTİK ASİT VE BAZLARIN p. H Çözeltide iyonlaştığında birden fazla hidronyum iyonu (H 3 O+ ) veren asitlere poliprotik veya polifonksiyonlu asitler denir. Poliprotik asitlere, fosforik asit (H 3 PO 4), karbonik asit (H 2 CO 3) , (H 2 SO 4), okzalik asit ( H 2 C 2 O 4) örnek verilebilir. Örnek olarak fosforik asiti verecek olursak , fosforik asit iyonlaştığı zaman 3 tane H 3 O+ iyonu verebiliyor. H 3 PO 4 + H 2 O ⇄ H 2 PO 4 - + H 3 O+ Ka 1 = 7, 11 x 10 -3 H 2 PO 4 - + H 2 O ⇄ HPO 42 - + H 3 O+ Ka 2 = 6, 34 x 10 -8 HPO 42 - + H 2 O⇄ PO 43 - + H 3 O+ Ka 3 = 4, 20 x 10 -13 Ka 1 >> Ka 2 >> Ka 3 2 H’lide Genel gösterim; H 2 A + H 2 O ⇄ HA- + H 3 O+ için Ka 1 HA - + H 2 O ⇄ A 2 - + H 3 O+ için Ka 2 olan poliprotik asitlerde zayıf asitlere benzer şekilde bir takım yaklaşımlarda bulunmamız gerekiyor Eğer Ka değerleri 10 -4 – 10 -9 arasında ve derişim 1 -10 -3 M arasında ise suyun ayrışma dengesini düşünmemize gerek yoktur. Diğer taraftan Ka 1 ve Ka 1 arasındaki oran 103 ve daha fazla ise 1. dengeyi düşünür, ikinci dengeyi ihmal edebiliriz. Ve problem monoprotik bir asit çöz. deki p. H hesabına dönüşür. 36

Çok protonlu asitler Fosforik asit: üç protonlu bir asittir 3 kademede iyonlaşır H 3 PO 4 + H 2 O ⇄ H 3 O+ + H 2 PO 4 - Ka 1 = 7, 1*10 -3 p. Ka 1 = 2, 15 H 2 PO 4 - + H 2 O ⇄ H 3 O+ + HPO 42 - Ka 2 = 6, 3*10 -8 p. Ka 2 = 7, 20 HPO 42 - + H 2 O ⇄ H 3 O+ + PO 43 Ka 3 = 4, 2*10 -13 Ör 17 -9 3. 0 M H 3 PO 4 için çözümleri hesaplayınız: (a) [H 3 O+]; (b) [H 2 PO 4 -]; (c) [HPO 42 -] (d) [PO 43 -] Başlangıç derişimi 3. 0 M değişme -x M +x M Denge derişimi (3. 0 -x) M Ka 1=7, 1*10 -3 =x 2/ 0 0 x. M p. Ka 3 = 12, 38 +x M 3 -x=x 2 /3. 0 x = [H 3 O+]= [H 2 PO 4 -]= 0. 14 M Ka 2=6, 3*10 -8=(0, 14+y)*y/ 0, 14 -y=0, 14. y /0, 14 y=[H 3 O+]=[HPO 4=]= 6, 3*10 -8 M Ka 3 = 4, 2*10 -13=(0, 14+z)*z / 6, 3*10 -8–z z = [PO 43 -] = 1, 9*10 -19 M 37

Çok Protonlu Zayıf Asidin Titrasyonu Na. OH H 3 PO 4 ⇄ H 2 PO 4 - Na. OH ⇄ Na. OH HPO 42 - ⇄ PO 43 - 38

SORU: 0, 10 M karbonik asit (H 2 CO 3) çözeltisinin p. H’ı nedir? Ka 1 = 4, 45 x 10 -5, p. KA 1=4, 35 , Ka 2 = 4, 69 x 10 -11 p. KA 2=10, 33 Çözüm: H 2 CO 3 + H 2 O ⇄ HCO 3 - + H 3 O+ Ka 1 = 4, 45 x 10 -5 p. KA 1=4, 35 - + H O ⇄ CO 2 - + H O+ Ka 2 = 4, 69 x 10 -11 p. KA 2=10, 33 HCO 3 2 3 3 Ka değerlerinden görüldüğü gibi suyun ayrışma dengesinin etkisini düşünmeye gerek yoktur. Ka 1 / Ka 2 >> 103 olduğundan sadece 1. iyonlaşma dengesini düşünerek [H 3 O+] bulunabilir ve p. H hesaplanır. H 2 CO 3 + H 2 O ⇄ HCO 3 - + H 3 O+ Başlangıç: 0, 10 M 0 Değişim -x +x Dengede: (0, 10 -x) M +x Ka 1= [HCO 3 -]x[H 3 O+] / [H 2 CO 3]x[H 2 O] ➪ Burada [H 2 O] ihmal edilerek ➪ Ka 1 = 4, 45 x 10 -5 = (x 2) / (0, 10 -x) Bu eşitliğin çözümünden x bulunur. x 2 +4, 45 x 10 -5 - 4, 45 x 10 -6= 0 ➪ x = 0, 0298 = [H 3 O+] ➪ p. H = -log 2, 98 x 10 -2 = 2 -log 2, 98 = 1, 53 bulunur. Eğer poliprotik asitlerde Ka 2, Ka 1’e göre ihmal edilebilecek kadar küçük olmakla beraber asitlik değeri oldukça yüksekse yani 10 -4 den büyükse problemi monoprotik asit sistemine indirgeyerek çözümleyemeyiz. Bunun en iyi örneği H 2 SO 4 aq dır 39

Asit Yağmuru CO 2 + H 2 O H 2 CO 3 + H 2 O 3. 11. 2020 08: 48 ⇄ H 2 CO 3 3 NO 2 + H 2 O ⇄ 2 HNO 3 + NO ⇄ HCO 3 - + H 3 O+ 40 / 56

AMFOTER MADDELER AMFOTER Asitler karşısında baz, bazlar karşısında asit olarak davranan maddelerdir. Bazı elementler (S, Pb. As, Sb gibi), bazı sülfürler (As 2 S 3, Sb 2 S 3 gibi), bazı hidroksitler (Al, Zn, Sn, Pb, As, Sb hidroksitler gibi), ve poliasitler ve polibazların ara tuzları Na. HCO 3, Na. HS, Na. H 2 PO 4, , Na 2 HPO 4 gibi maddeler AMFOTER’dir. Poliasitlerin ara tuzları için Denge rx. dan [H+]2 =KA 1* KA 2 den p. H= ½ (p. KA 1+ p. KA 2) bulunur. Burada açıkca görüldüğü gibi ortamın p. H’ına maddenin konsantrasyonu etkili değildir. Bu da biyolojik rx. lar için önemlidir. Örnek : 0. 1 M Na. HCO 3 p. H=? (H 2 CO 3 için p. KA 1=4, 35 p. KA 2=10, 33 ) p. H = ½ ( 4, 35 + 10, 33) = 7, 34 bulunur. 41

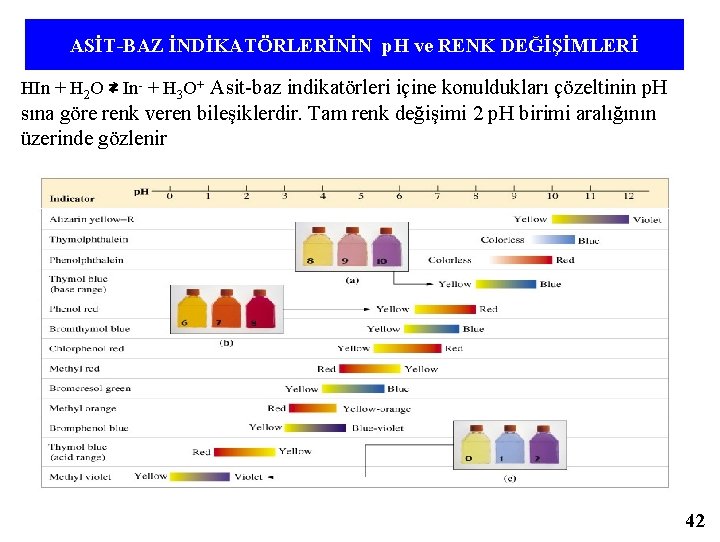
ASİT-BAZ İNDİKATÖRLERİNİN p. H ve RENK DEĞİŞİMLERİ HIn + H 2 O ⇄ In- + H 3 O+ Asit-baz indikatörleri içine konuldukları çözeltinin p. H sına göre renk veren bileşiklerdir. Tam renk değişimi 2 p. H birimi aralığının üzerinde gözlenir 42

18 -4 Nötürleşme Tepkimeleri ve Titrasyon Eğrileri • Eşdeğerlik noktası: Reaksiyonda asitin ve bazın tükendiği noktadır. Ne asitin ne de bazın aşırısı kalmaz. • Dönüm noktası: İndikatörün renk değiştirdiği noktaya denir. • Titrasyon: Derişimi bilinmeyenin bilinen ile tayinidir. • Titrasyon eğrisi: titrasyon çözeltisi ilavesindeki p. H değişimi grafiğidir. – İlave edilen hacim ile oluşan p. H değişimini gösteren grafiktir. . – MİLİMOL miktarı : Molar çözeltinin 1 m. L. ’deki mol miktarıdır. 43

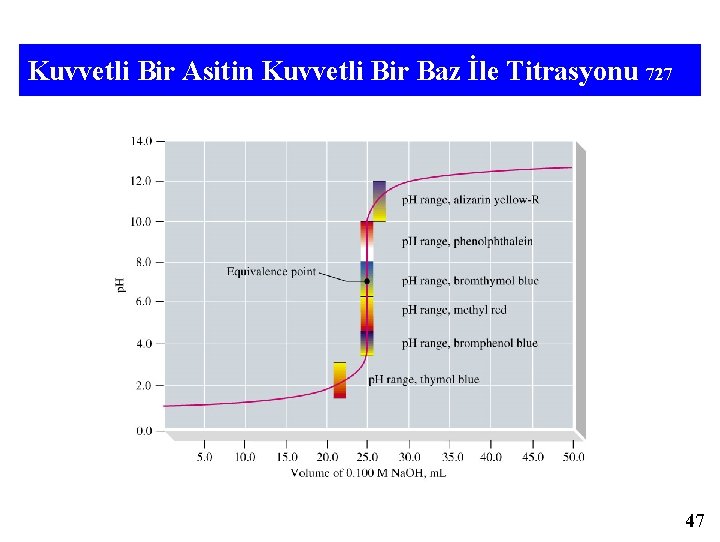
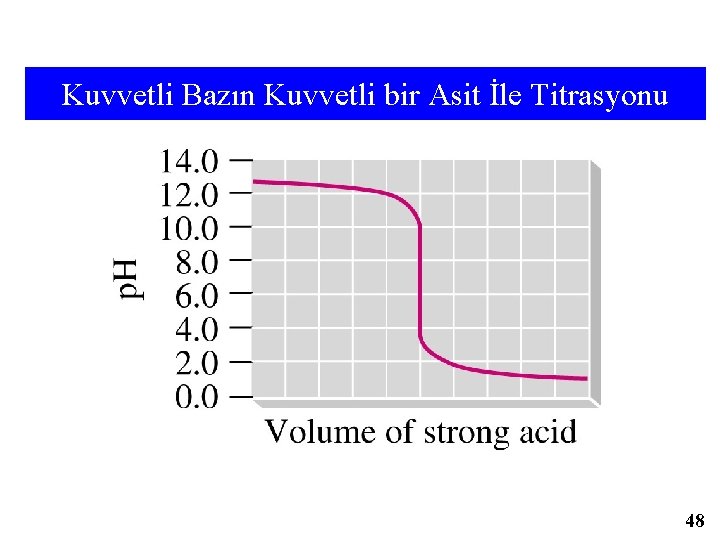
Kuvvetli Bir Asitin Kuvvetli Bir Baz İle Titrasyonu 727 • Başlangıçta p. H düşük bir değere sahip. • p. H değeri yavaşca değişir – Eşdeğerlik noktası öncesine kadar. • p. H hızla yükselir. – Bu yükselme 0, 1 m. L baz eklenmesiyle 6 p. H birimi kadar olabilir. • Eşdeğerlik noktasından sonra p. H yükselmesi yavaşlar. • Renk değişimi p. H=4 -10 aralığına düşen bir indikatör bu titrasyon için uygundur. 44

ASİT VEYA BAZLARIN TİTRASYON EĞRİLERİ 04. 01. Kuvvetli Bir Asidin Kuvvetli Bir Bazla Titrasyonu Asit baz titrasyonlarında hesaplanması gereken dört temel nokta vardır. A- Başlangıç p. H sı , B- EKİVALENS (Eşdeğerlik) noktasından önceki hesaplar, C- Ekv. Nok. Hesapları, D- Ekv. Nok. dan sonraki hesaplar Örnek : A- 100 m. L 0, 025 M HCl asidin 0, 050 M Na. OH ile titrasyonu sonucunda oluşacak titrasyon eğrisinin çizilmesi Başlangıçta asit üzerine hiç baz eklenmediğinde ortamın p. H’ı direk asidin p. H’ına eşittir. p. H = -log[H 3 O+] = -log 0, 025 = 1, 60 B- 25 m. L Na. OH eklendiği zaman (Eşdeğerlik noktasından önce) Asit üzerine baz eklendiğinde, eklenen baz asidin bir kısmını nötralleştirecektir. Böylelikle ortamdaki asit derişimi azalacaktır. Kalan asidin derişimide direk ortamın p. H’sına eşit olacaktır. Diğer dikkat edilmesi gereken konu ise çözeltinin son hacminin değiştiğidir. Bunun için asidin mol sayısı bulunarak (M x V) toplam hacme (L) bölünerek son derişim bulunur. [HCl] = (0, 1 x 0, 025 – 0, 025 x 0, 050) / 0, 1+0, 025 = 0, 01 p. H = -log 0, 01= 2 45
![50 m L Na OH Eşd Nok HCl 0 1 x 0 50 m. L Na. OH (Eşd. Nok. ) [HCl] = (0, 1 x 0,](https://slidetodoc.com/presentation_image/474ef1c8bd877ba9f2115edb9e0661fa/image-46.jpg)
50 m. L Na. OH (Eşd. Nok. ) [HCl] = (0, 1 x 0, 025– 0, 050 x 0, 050)/ 0, 1+0, 050 [HCl] = 0 Buda asit baz konsantrasyonlarının o anda eşit olduğunu gösterir. Ortam nötrdür. Ksu= [H 3 O+] x [OH-] [H 3 O+] =√ Ksu [H 3 O+] = √ 1 x 10 -14 = 1 x 10 -7 p. H = 7 olur. 75 m. L Na. OH (Eşd. Nok. dan sonra) Eklenen baz, asitten fazla olduğu için bütün asit nötrleşir ve ortamda sadece baz kalır. [Na. OH] = (0, 075 x 0, 050 – 0, 10 x 0, 025) / 0, 1+0, 075 = 0, 0071 p. OH= 2, 15 p. H = 11. 85 Aynı mantık ve kurallar kuvvetli bir bazın kuvvetli bir asitle titrasyonunda da geçerlidir. Sadece başlangıçta ortam bazik olacak ve asit eklendikçe ortamdaki bazın derişimi eklenen asit kadar azalacaktır. 46

Kuvvetli Bir Asitin Kuvvetli Bir Baz İle Titrasyonu 727 47

Kuvvetli Bazın Kuvvetli bir Asit İle Titrasyonu 48

18 -04 Zayıf bir Asidin Kuvvetli bir Bazla Titrasyonu Zayıf Asitin kuvvetli bir bazla titrasyonunda dört temel nokta hesaplanır. 1 -cb=0 HA Ka=1, 75. 10 -5=[H 3 O+] [A-]/ [HA]= =[H 3 O+]*2/0, 05 [H 3 O+]= 9, 35. 10 -4 p. H =3, 03 2 - EŞD. NOKTASI’ndan ÖNCE 50 m. L 0, 05 M Na. OH eklendiğinde HA/Na. A tampon olur [ HA] =(0, 100 x 0, 05)- (0, 050 x 0, 05) / (0, 100+0, 05)= 0, 017 [ A-] = (0, 050 x 0, 05) / (0, 100+0, 05) =0, 017 Ka = [H 3 O+] [A-] / [HA] ➪[H 3 O+]=1, 75. 10 -5 x 0, 017/0, 017 = 1, 75. 10 -5➪p. H =5 –log 1, 75= 4, 76 3 - EŞD. NOK. da 100 m. L 0, 05 M sodyum hidroksit (Na. OH) eklendiğinde (eşdeğerlik noktasında) Eşdeğerlik noktasında HA’ nın tamamı zayıf bazik tuz’a döner. A- +H O ⇄ OH- + HA Burada Kb= Ksu / Ka göz önüne alınırsa 2 Kb = ([OH-] [HA] ) / [A-] =10 – 14/ 1, 75 x 10 -5 = 5, 71 x 10 -10 bulunur. Eşdeğerlik noktasında ortamda yalnızca A- var fakat hacim 200 m. L olduğu için A- derişimi yarıya düşer (hacim iki katına çıktı) Kb = [OH-]*2 / 0, 025 ➪ [OH-] = (5, 71 x 10 -10 x 0, 025)1/2 = 3, 78 x 10 -6 ➪ p. OH = 6 – log 3, 78= 5, 42 ➪ p. OH + p. H = 14 ➪ p. H = 14 – 5, 42 = 8, 58 49

4 - 150 m. L 0, 05 M sodyum hidroksit (Na. OH) eklendiğinde (eşdeğerlik noktasından sonra) Eşdeğerlik noktasından sonra ortamda bulunan [OH- ] kaynağı hem eklenen baz hemde A- iyonudur. Ortamda kuvvetli ba baskın olduğu için A- iyonundan gelecek olan [OH- ] katkısı azdır. [OH-] = [(0, 15 x 0, 05)- (0, 10 x 0, 05)] /0, 25 = 0, 01 ➪ p. OH = 2 p. H =14 – 2 =12 50 / 56

Zayıf Asitin Kuvvetli Baz İle Titrasyonu 51 / 56

Kuv. Asit ve Zayıf Asit Bulunan Bir Çöz. nin Kuvvetli Bazla Titrasyonu Örnek 0, 15 M HCl asit ve 0, 10 M HA zayıf asidi bulunmaktadır. Toplam hacmi 25 m. L olan bu çözelti 0, 12 M Na. OH çözeltisi ile titre ediliyor. Bu titrasyonun titrasyon eğrisini oluşturalım. Ka =1, 75 x 10 -5 Başlangıçta hiç baz eklenmediği zaman ortamdaki [H 3 O+], HCl asitten ve HA asitinin iyonlaşması sonucu ortaya çıkan [H 3 O+]’nun toplamlarına eşittir. [H 3 O+]= CHCl + [A - ] Başlangıç anında HA dan gelen [H 3 O+] kuvvetli asidin yanında ihmal edilebilecek kadar azdır. Böylelikle ortamın p. H = - log 0, 15 = 0, 82 Ama yinede HA dan gelen [H 3 O+] derişimine bir bakalım. Kuvvetli asit yanında HA dan gelen A- iyonu ihmal edilebileceğinden ortamdaki [H 3 O+] sadece kuvvetli asitten geliyormuş gibi düşünülür. HA + H 2 O ⇄ [H 3 O+] + A- ➪ [H 3 O+] = [A- ] ➪ Ka = [H 3 O+] x [A-] / [HA] [A- ] / [HA] = Ka / [H 3 O+] ➪ [A- ] / [HA] =1, 75 x 10 -5 / 0, 15 = 2, 62 x 10 -6 0, 10 = [HA] + [A-] ➪ 0, 10 = [A-] / 2, 62 x 10 -6 + [A- ] ➪ [A- ] = 1, 31 x 10 -7 bu değer gerçekten 0, 15 M yanında ihmal edilebilecek bir değerdir. 10 m. L 0, 12 M sodyum hidroksit (Na. OH) eklendiğinde (eşdeğerlik noktasından önce) Burada hala ilk basamakta yaptığımız varsayım geçerlidir. Ortamdaki [H 3 O+] sadece kuvvetli asitten geliyormuş gibi düşünülür. Fakat baz ilave edildiği için derişiminde bir azalma olacaktır. 52

CHCl = (0, 15 x 0, 025) – (0, 12 x 0, 010) / 0, 035 = 0, 0729 M p. H = – log 0, 0729= 1, 14 Burada da her ihtimale karşı HA’nın iyonlaşmasından gelen [H 3 O+] derişimi hesaplanır. 30 m. L 0, 12 M sodyum hidroksit (Na. OH) eklendiğinde Bu tür tepkimelerde eşdeğerlik noktasını şu hesapla bulabiliriz. M asit x Vasit = Mbaz x Vbaz bulunarak eşdeğerlik noktasına gelmek için kaç m. L baz eklenmelidir sorusuna yanıt bulabiliriz. 0, 15 x 0, 025=0, 12 x. Vbaz ➪Vbaz = 0, 03125 L = 31, 25 m. L baz harcandığı zaman eşd. Nok’na ulaşılacak. Eğer 30 m. L baz eklersek eşdeğerlik noktasına çok yaklaşılacak ve artık HA dan gelen [H 3 O+] ihmal edilemeyecek. Eklenen baz HCl’yi nötrleştirdiği için CHCl = (0, 15 x 0, 025) – (0, 12 x 0, 030) / 0, 055 = 2, 72 x 10 -4 HA = (0, 1 x 0, 025) / 0, 055 = 0, 045 ➪ [H 3 O+] = [A-] dan [H 3 O+] =CHCl + [A-] = 2, 72 x 10 -4 + [A-] Ka = [H O+]x[A- ] / [HA] ➪ [A- ] / [HA] = Ka / [H O+] ➪ [HA] = [H O+]x[A-] / Ka 3 3 - - + -5 O ]x[A-] / 1, 75 x 10 ) + [A ] = 0, 045 ➪ [A ] = 7, 85 x 10 -7 /([H 3 + O ]+1, 75 x 10 -5 ([H 3 3 + -4 -4 -7 + den [H 3 O ] = 2, 72 x 10 + [A-] = 2, 72 x 10 +[ 7, 85 x 10 / ( [H 3 O ] + 1, 75 x 10 -5 ] [H 3 O+]2 - 2, 54 x 10 -4[H 3 O+] – 7, 90 x 10 -7 = 0 ➪ [H 3 O+] = 1, 30 x 10 -3 p. H = -log 1, 30 x 10 -3 = 2, 87 Eşdeğerlik noktasında eklenen bazın hepsi kuvvetli asiti nötürleştirecektik. Ortamda sadece zayıf asit kalacaktır. Bundan sonra problemin çözümü zayıf asit baz titrasyonu gibi yapılacaktır. 53

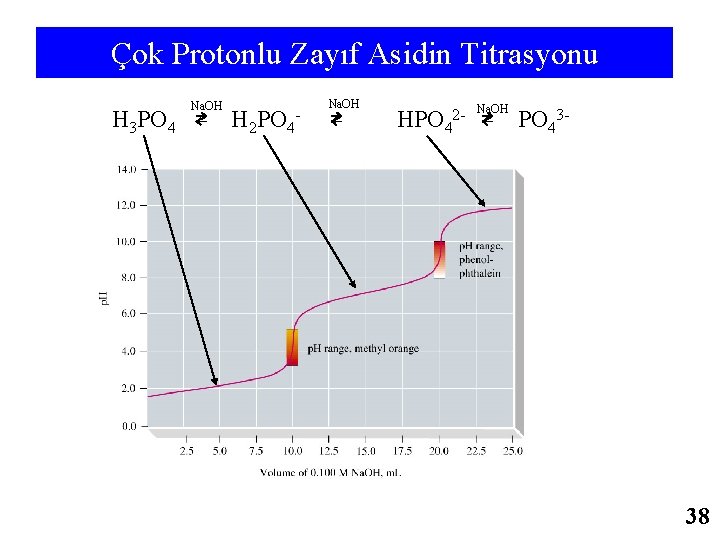
Çok Protonlu Asit Tuzlarının Çözeltileri • Fosforik asit üçüncü eşdeğerlik noktasına kuvvetli bazik çözeltide ulaşabilir. • Bu noktanın p. H’ını hesaplamak zor değil. – Bunun nedeni Na 3 PO 4 (aq) ve PO 43 - ın yalnızca baz olarak hidroliz olmasıdır. ÖRNEK 18 -9/735 : 1. 0 M Na 3 PO 4 (aq) p. H =? PO 43 - + H 2 O ⇄ OH- + HPO 42 - ➨ Ka 3 = 4, 2 x 10 -13 ➨ Kb 1 = Ksu/Ka 3 = 10 -14/ 4, 2 x 10 -13 = 0, 0238>0, 01 Ka/kb>0, 01 ise Kuv. Elektrolit kabul edilebilir. Bu halde x ≈ c ≈ 1 den p. OH=0 ➨ p. H=14 bulunur. ➨Kitaptaki çözüm : x 2/1 -x =0, 0238 ➨ x 2+0, 0238 x-0, 0238=0 ➨ x=0, 14 ➨ p. OH =0, 85 ➨ p. H=13, 15 bulunur. 54

Çok Protonlu Zayıf Asidin Titrasyonu 733 Na. OH H 3 PO 4 ⇄ H 2 PO 4 - Na. OH ⇄ Na. OH HPO 42 - ⇄ PO 43 - 55

KONU: 18’de ÇÖZÜLMESİ TAVSİYE EDİLEN SORULAR Öncelikle konu içinde verilmiş olan 1 adedi çözülmüş 2 adedi çözülecek örnek sorular üzerinde titizlikle durulması tavsiye edilir. Sınav soruları genellikle onlardan seçilmeye çalışılacaktır. Konunun daha iyi anlaşılması açısından konunun sonunda yer alan aşağıdaki sorulara da bakılırsa iyi olur. 4 -5 -7 -8 -9 -11 -12 -15 -17 -18 -1921 -23 -27 -31 -33 -39 -41 -47 -4951 -55 -59 -63 -67 -69 -71 -98 -99 56 / 56
 Gazlarda yoğunluk formülü
Gazlarda yoğunluk formülü Kimya modern atom teorisi
Kimya modern atom teorisi Alan petrucci
Alan petrucci Petrucci
Petrucci Petrucci
Petrucci Organik kimya adlandırma öncelik sırası
Organik kimya adlandırma öncelik sırası Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Doug harwood
Doug harwood Hawthorne araştırmaları
Hawthorne araştırmaları Crusher hire harwood
Crusher hire harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Gwen harwood selected poems
Gwen harwood selected poems Joe harwood
Joe harwood Leigh harwood
Leigh harwood 3 metil siklopenten
3 metil siklopenten Sikloalkin
Sikloalkin Alkan alken alkin kaynama noktası sıralaması
Alkan alken alkin kaynama noktası sıralaması Sabun ve deterjan kimya
Sabun ve deterjan kimya Alkanların yer değiştirme tepkimeleri
Alkanların yer değiştirme tepkimeleri R sabiti
R sabiti Trans izomeri
Trans izomeri Hız sabitinin birimi
Hız sabitinin birimi Meltem kimya akhisar
Meltem kimya akhisar Artan madde problemleri kimya
Artan madde problemleri kimya Homojen nedir
Homojen nedir Yaygın bileşikler ve formülleri
Yaygın bileşikler ve formülleri Ersağ kazanç tablosu
Ersağ kazanç tablosu Can kimya
Can kimya çok atomlu iyonlar tablosu
çok atomlu iyonlar tablosu Aromatik kimya
Aromatik kimya Kovalent bağ
Kovalent bağ Organik kimya solomon ders notları
Organik kimya solomon ders notları Sınırlayıcı tepken nedir
Sınırlayıcı tepken nedir Korozyon türleri
Korozyon türleri Entropi nedir
Entropi nedir Organik kir nedir
Organik kir nedir Kimya nedir
Kimya nedir Kantitatif rubrik nedir
Kantitatif rubrik nedir Gazlarda normal koşullar
Gazlarda normal koşullar Kimya güvenlik sembolleri
Kimya güvenlik sembolleri Bileşik nedir
Bileşik nedir Molar derişim formülü
Molar derişim formülü Anlamlı sayılar kimya
Anlamlı sayılar kimya Froma kimya
Froma kimya Froma kimya
Froma kimya Alkolmetre sıcaklık düzeltmesi
Alkolmetre sıcaklık düzeltmesi Terahertz spectroscopy principles and applications
Terahertz spectroscopy principles and applications Sport management principles and applications
Sport management principles and applications Principles and applications of electrical engineering
Principles and applications of electrical engineering Pearson engineering
Pearson engineering Learning principles and applications
Learning principles and applications Principles of network applications in computer networks
Principles of network applications in computer networks Principles of network applications
Principles of network applications özel yetenek testleri
özel yetenek testleri Tapu kadastro genel m?d?rl?g?
Tapu kadastro genel m?d?rl?g? Gruplar arası kareler toplamı hesaplama
Gruplar arası kareler toplamı hesaplama Genel muhasebe borç alacak kavramı
Genel muhasebe borç alacak kavramı