Genel Kimya Principles and Modern Applications Petrucci Harwood













![[BH+] = Kb [B] / [OH-] ➪ [H 3 O+] = Ksu / [OH-] [BH+] = Kb [B] / [OH-] ➪ [H 3 O+] = Ksu / [OH-]](https://slidetodoc.com/presentation_image_h/7780b0de582b15511b4b1567023bbebd/image-18.jpg)
























- Slides: 49

Genel Kimya Principles and Modern Applications Petrucci • Harwood • Herring 8 th Edition Ünite 17: Asitler ve Bazlar ⇄ ⇌ ‾ + ÷ ↑↓ ↕ | ǁ |│║ │∫∑ √ ∛ ∜ ≤ ≥ ~ ∞ ≡ ≈ Δ δ π σ υ λ α β γ ψ μ t τ ζ Ψ Ω θ Χ ε φ ω η ō Ō ½ ¼ ¾ ¼ ½ ¾ ΔGo , ΔSo , ΔHo Bu Slaytların hazırlanmasında emeği geçen 060050129 -ÇAĞLA TÖREN’e TEŞEKKÜRLER Philip Dutton University of Windsor, Canada N 9 B 3 P 4 Prentice-Hall © 2002

İçindekiler 17 - ASİTLER ve BAZLAR 17 -1 17 -2 17 -3 17 -4 17 -5 17 -6 17 -7 17 -8 665 Asit ve Baz Tanımı-Arrhenius- Kuramı: Sunuş Asit ve Baz Tanımı Bronsted-Lowry Kuramı Suyun İyonlaşması ve p. H Eşeli Kuvvetli Asitler ve Bazlar Zayıf Asitler ve Bazlar Çok Protonlu Asitler Asit ve Baz Özelliği Gösteren İyonlar Molekül Yapısı ve Asit-Baz Davranışı Lewis Asit ve Bazları Özel Konu Asit Yağmuru Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 2 of 47

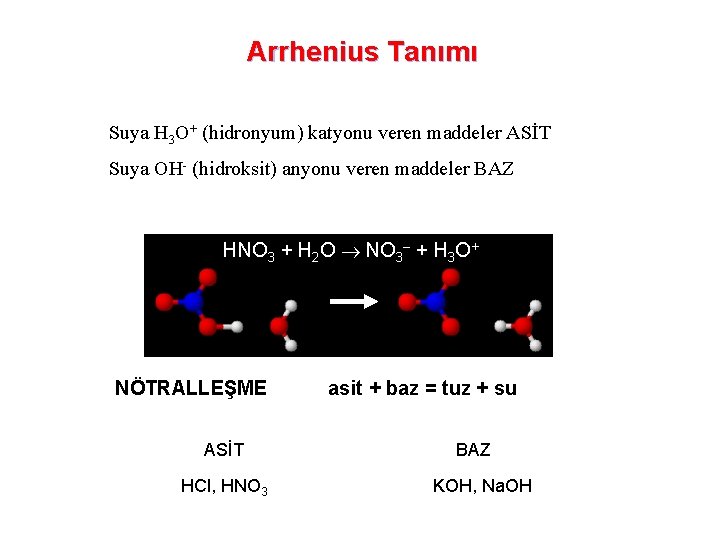
17 -1 Asit ve Bazların Tanımı Arrhenius Kuramı: Sunuş 1. 1 - ARRHENİUS’a göre Asitler yapısında hidrojen bulunan ve sudaki çözeltisine hidrojen iyonu (H+) veren maddelerdir. En belirgin özellikleri ekşi tatda olmaları ve asit-baz indikatörü denilen bazı organik boya maddelerinin rengini değiştirmeleridir. Örneğin turnusolün mavi rengi asitle kırmızıya dönüşür. Örnek olarak hidroklorik asit, HCl, verebiliriz. HCl (g)+ H 2 O H+ (aq) + Cl- (aq) veya HCl (g) + H 2 O H 3 O+ (aq) + Cl- (aq) Bazlar yapısında hidroksil bulunan ve sudaki çözeltisine hidroksil iyonu (OH-) veren maddelerdir. Elde kayganlık hissi uyandıran ve yine asit-baz indikatörlerinin rengini değiştiren maddelerdir. Örneğin turnusolün kırmızı rengi bazlarla maviye dönüşür. Örnek olarak sodyum hidroksit, Na. OH, verilebilir. Na. OH (k) Na+ (aq) + OH- (aq) Asit ve bazlar birbirlerini nötralleştirir su ve tuz oluşur. HCl (aq) + Na. OH (aq) Na+Cl- (aq) + H 2 O Burada esas rx H+ (aq) + OH- (aq) H 2 O NÖTRALLEŞME rx denir. Arrhenius kuramı amonyağın baz oluşunu açıklayamaz. Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 3 of 47

Arrhenius Tanımı Suya H 3 O+ (hidronyum) katyonu veren maddeler ASİT Suya OH- (hidroksit) anyonu veren maddeler BAZ HNO 3 + H 2 O NO 3– + H 3 O+ NÖTRALLEŞME asit + baz = tuz + su ASİT HCl, HNO 3 BAZ KOH, Na. OH

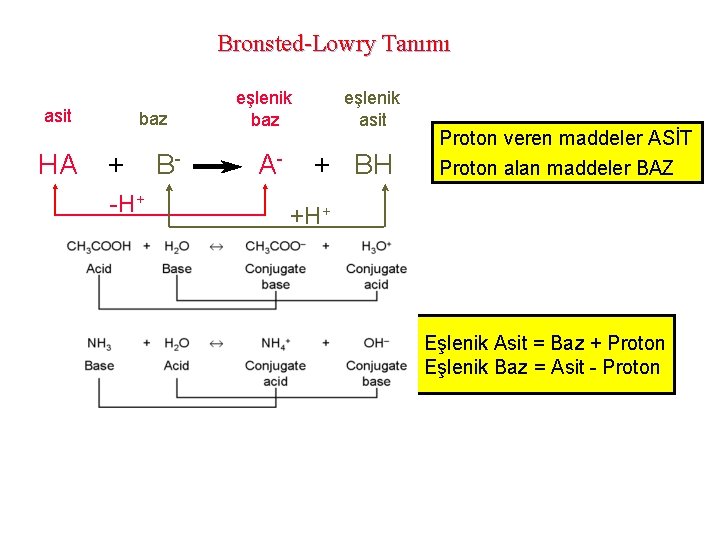
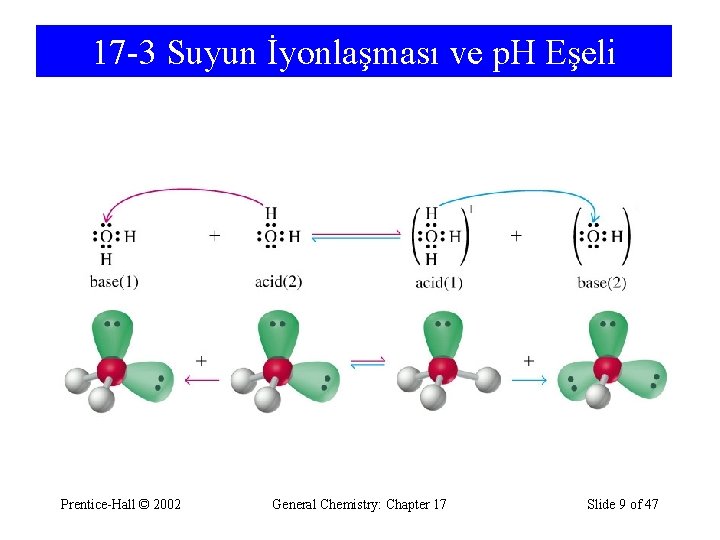
17 -2 Asit ve Bazların Brønsted-Lowry Kuramı • Asit, proton veren maddedir. • Baz, proton alan maddedir. NH 3 + H 2 O ⇄ NH 4+ + OHbaz asit Kon. baz 1. 2 - BRONSTED-LOWRY’ye göre asitler proton veren, bazlar ise proton alan maddelerdir. HCl + H 2 O → H 3 O+ + Cl- Burada HCl proton verdiğine göre asit, H 2 O ise proton aldığına göre bazdır. HCl ve H 2 O arasındaki tepkime sonucunda konjüge asit ve bazlar oluşur. Ancak H+ iyonunun suda serbest halde bulunması olası değildir. Su molekülleriyle sarılması beklenir. Yaklaşık dokuz su molekülüyle sarılan H+ iyonu, bunlardan birisi ile de sıkıca bağlanır. Bundan dolayısıyla suda, H+ yerine H 3 O+ hidronyum iyonu da denilmektedir. Arrhenius' a göre baz olması beklenmeyen NH 3 (aq) (amonyak çözeltisi) bu tanıma göre bazdır, bu da aşağıdaki tepkime ile verilebilir. NH 3 (aq) + H 2 O ⇄ NH 4+ (aq) + OH- (aq) baz (1) asit(2) konjüge asit(1) konjüge baz (2) (eşlenik asit) (eşlenik baz) Yukarıdaki tepkimeye bakacak olursak, NH 3 proton aldığı için baz, H 2 O ise proton verdiği için asittir. Aynı zamanda NH 4+ , NH 3 ün konjüge asidi, OH- ise H 2 O nun konjüge bazıdır. Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 5 of 47

Bronsted-Lowry Tanımı asit baz eşlenik asit HA + B- A- + BH -H+ Proton veren maddeler ASİT Proton alan maddeler BAZ +H+ Eşlenik Asit = Baz + Proton Eşlenik Baz = Asit - Proton

17 -2. Suda Asit ve Baz Dengeleri Bir asit veya baz suda çözüldüğünde iyonlaşır (dissosiye olur). İyonlaşmanın derecesi asit veya bazın kuvvetiyle ilişkilidir. % 10’dan daha fazla iyonlaşan Kuvvetli bir asitin tamamen iyonlaştığı kabul edilir. Zayıf bir asit ise kısmen iyonlaşır. Aynı durum bazlar için de geçerlidir. HCl, HBr, HI, HNO 3, HCl. O 4 ve H 2 SO 4 gibi asitler kuvvetli asitlerdir. Zayıf asit ve bazlar ise suda kısmen iyonlaşırlar. Genel olarak zayıf bir asit HA genel formülü ile gösterilir. Su ile olan rx HA (aq) + H 2 O ⇄ H 3 O+ + A- şeklinde veya genel olarak HA (aq) ⇄ H+ + A- şeklinde yazılır. Bu rx’un denge sabiti=Kdenge = [Ürünler]/ [Reaktifler] = Ka = [H 3 O+] [A-] / [HA] [H 2 O] şeklindedir. [H 2 O] sabit olduğu için Kdenge sabitine dahil edilerek Kdenge. [H 2 O] = Ka = [H 3 O+] [A-] / [HA] Aynı şekilde tek proton alabilen zayıf bir baz B ise B + H 2 O ⇄ BH+ + OH Denge sabiti =Kdenge = [BH+] [OH-]/ [B] [H 2 O] = Kb = Kdenge. [H 2 O] = [BH+] [OH-] / [B] bazlık sabiti denir.

03. Suyun İyonlaşma Sabiti ve p. H Eşeli Suyun iyonlaşma dengesini H 2 O + H 2 O ⇄ H 3 O+ + OH- veya kısaca H 2 O ⇄ H+ + OH- yazılır Kdenge = ([H 3 O+] [OH-]) / ([H 2 O]2 Kdenge. [H 2 O]2 = Ksu = [H 3 O+] [OH-] 25°C da Ksu nın değeri 1, 00. 10 -14 dür. Sıcaklık arttıkça iyonlaşma yüzdesi artacağından Ksu yükselir. Saf suda hidronyum ve hidroksit iyonu derişimlerinin aynı olacağı kesindir, dolayısıyla [H 3 O+] = [OH-] Ksu = [H 3 O+]2 = [OH-]2 [OH-] = [H 3 O+] = (1. 10 -14)1/2 = 1. 10 -7 M dir. Sulu çöz. de asitlik ve bazlık p. H veya p. OH ile verilir. p. H = -log [H 3 O+] =-log [H+], p. OH = -log [OH-] , p. Ksu = -log Ksu=14, p. Ka = -log Ka, p. Kb = -log Kb şeklinde ifade edilir. 25 o. C da saf suda p. H + p. OH = 14= p. Ksu p. H değeri 0 -7 olan çöz. ASİT, 7 -14 olan çöz. ise BAZdır. p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 p. OH 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 ASİT ORTAM NÖTR BAZİK ORTAM

17 -3 Suyun İyonlaşması ve p. H Eşeli Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 9 of 47

03. 01. Kuvvetli Asitler ve Kuvvetli Bazların p. H (%α≥ 10 için derişimi, [H 3 O+] (hidronyum) iyonu veya [OH-] (hidroksit) iyonu derişimine eşittir. p. H = -log Ca Derişimi 1 x 10 -6 M dan daha büyük kuvvetli asit çözeltilerinde kuvvetli asit veya kuvvetli baz tamamen iyonlaştığı kabul edilir Örnek: 0, 05 M HCl (aq) p. H=? nedir? Çözüm: HCl + H 2 O → H 3 O+ + Cl- [H 3 O+] = [HCl] = 0, 05 M p. H = -log 0, 05 = 1, 30 Aynı durum kuvvetli bazlar için de geçerlidir. p. OH = -log Cbdir Derişimin 10 -6 M dan küçük olması durumunda suyun iyonlaşma etkisini göz önüne alacağımızdan çözeltideki OH- derişimi için aşağıdaki eşitliliği yazmamız gerekir. [OH-] = Cb + [OH-]su = [H 3 O+]su = C olduğundan Ksu = (Cb+C). C = 1. 10 -14 C 2 + Cb. C – 1. 10 -14 = 0 dır. Bu eşitliğin çözümü ile C yani sudan gelen hidroksit iyonu derişimi bulunur, Cb ye eklenerek çözeltideki hidroksit derişimine geçilir ve p. OH hesaplanır.

Örnek: 100 ml 0, 050 M Na. OH ile 100 ml 0, 020 M Ca(OH)2 çözeltileri karıştırılıyor. Elde edilen çözeltinin p. OH ve p. H değerleri nedir? Çözüm: Na. OH (aq) → Na+ + OH- Ca(OH)2 (aq) → Ca 2+ + 2 OH- 0, 050 020 0, 020 2 x(0, 020) İki ayrı baz çözeltisinin karıştırılması ile oluşan yeni çözeltide hidroksit iyonu derişimi şöyle bulunur. Çözeltideki toplam OH - iyonu, Na. OH ve Ca(OH)2 tarafından verilir. Her iki çözeltiden 100’er m. L alındığından çözeltinin son hacmi 200 m. L olur. M = n/V formülünde hacim değiştiği için molarite de değişecek. Öncelikle M x V formülünden yeni mol sayısı (n) bulunur. Daha sonra bu mol sayısı (n) toplam hacime (V) bölünerek yeni derişim bulunur. [OH-] = (100 x 0, 050+ 100 x 0, 040) / 200 = 4, 50. 10 -2 M p. OH = -log 4, 50. 10 -2 = 2 -log 4, 50 = 2 -0, 65 = 1, 35 p. H = 14 -p. OH = 14 -1, 35 = 12, 65

03. 02. Zayıf Asitler ve Zayıf Bazların p. H Tamamen iyonlaşmayan (%α<10 için asitlere ve bazlara zayıf asit veya baz denir. Zayıf asitler HA, zayıf bazlarda B ile gösterilir. HA + H 2 O ⇄ H 3 O+ + A- Ka = [H 3 O+] [A-] / [HA] 2 H 2 O ⇄ H 3 O+ + OH- Ksu= [H 3 O+] [ OH-] Eğer Ka değeri 10 -4 ile 10 -9 arasında ve asidin başlangıç derişimi 1 -10 -3 M arasında ise, suyun iyonlaşma dengesinin p. H ye etkisini olmadığı kabul edilir. Sadece Ka denge ifadesini kullanarak hidronyum derişimi hesaplanabilir. Dengede [HA] = CHA - [H 3 O+] yazılabilir. Aynı zamanda [A-] = [H 3 O+] olduğundan Ka = [H 3 O+]2 / (CHA - [H 3 O+]) den [H 3 O+] bulunur. Bu tür problemlerin çözümünde diğer bir kabul ise başlangıç derişiminin Ka’ya oranı, (CHA / Ka)> 10 ise asidin iyonlaşması ile başlangıç derişiminin fazla değişmediği düşünülebilir ve paydadaki H 3 O+ derişimi CHA yanında ihmal edilebilir. Ka = [H 3 O+]2 / CHA formülünden [H 3 O+] çekilerek, [H 3 O+] = √(Ka. CHA) bulunur

Zayıf Asit ve Zayıf Bazlarda İyonlaşma (Ka/Kb) Sabiti CH 3 CO 2 H + H 2 O [CH 3 CO 2 -][H 3 O+] konjuge baz Konjuge asit Kc= Zayıf asit baz [CH 3 CO 2 H][H 2 O] + [CH 3 CO 2 ][H 3 O ] = 1, 8. 10 -5 Ka= Kc[H 2 O] = p. Ka= -log(1, 8. 10 -5) = 4. 74 [CH 3 CO 2 H] O lactic acid CH 3 CH(OH) CO 2 H C R glycine H 2 NCH 2 CO 2 H OH +][OH-] [NH 4 NH 3 + H 2 O ⇄ NH 4+ + OHK c= [NH 3][H 2 O] Konjuge asit konjuge baz asit Kb= Kc[H 2 O] = ⇄ CH 3 CO 2 - + H 3 O+ [NH 4+][OH-] Prentice-Hall © 2002 [NH 3] = 1, 75. 10 -5 p. Kb= -log(1, 75. 10 -5) = 4. 72 General Chemistry: Chapter 17 Slide 13 of 47

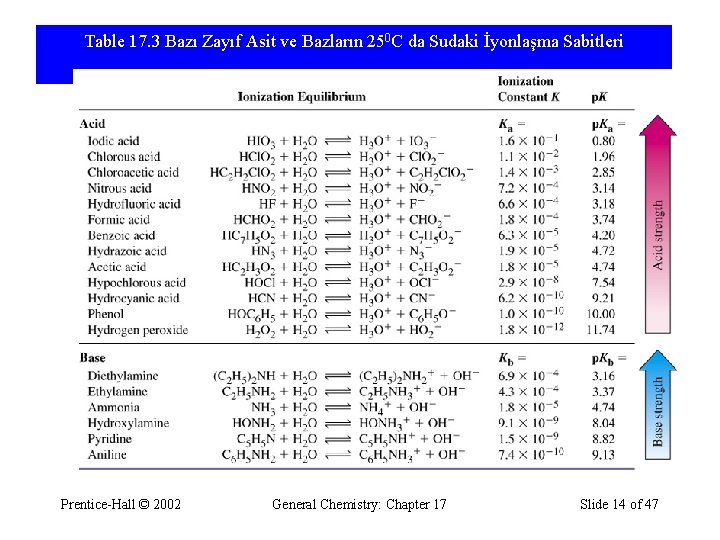
Table 17. 3 Bazı Zayıf Asit ve Bazların 250 C da Sudaki İyonlaşma Sabitleri Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 14 of 47

Örnek 17 -5 Zayıf bir asit çözeltisinin p. H’ının bulunması Butirik asit, HC 4 H 7 O 2 yapay tatlandırıcılar ve şuruplarda kullanılan bileşiklerin elde edilmesinde kullanılır. 0, 250 M HC 4 H 7 O 2 çözeltisinde p. H=2, 72 bulunmuştur. Butirik asidin Ka değerini hesaplayınız. HC 4 H 7 O 2 + H 2 O ⇄ C 4 H 77 O 2 + H 3 O+ Ka = ? Çözüm : HC 4 H 7 O 2 + H 2 O ⇄ C 4 H 7 O 2 + H 3 O+ HC 4 H 7 O 2 nın KA değeri Ksu dan çok daha büyük olacağından, suyun iyonlaşmasını ihmal ederiz. Başlangıç derişimi: Değişme: 0. 250 M -x M 0 +x M Denge derişimi: (0. 250 -x) M 0 +x. M p. H= -log[H+]=2, 72 [H+]=10 -2. 72 =1, 9 x 10 -3 =x K a= [H 3 O+] [C 4 H 7 O 2 -] [HC 4 H 7 O 2] = 1, 9 x 10 -3 · 1, 9 x 10 -3 (0. 250 – 1, 9 x 10 -3) = 1, 5 x 10 -5 Ka >> KW İYONLAŞMA YÜZDESİ %α =100. x/c=0, 19/0, 25=0, 76 General Chemistry: Chapter 17 Slide 15 of 47

Örnek: Derişimi 0. 10 M olan Asetik asit ( CH 3 COOH) çözeltisinin p. H si nedir? Ka = 1, 75 x 10 -5 (25 o. C) Çözüm: CH 3 COOH veya genel formülü ile HA suda HA + H 2 O ⇄ H 3 O+ + A- Başlangıç: 0, 10 M 0 Değişim -x +x Dengede: (0, 10 -x) M +x Ka = [H 3 O+]2 / CHA =1, 75 x 10 -5 = x 2 / (0, 10 -x) Son kabulümüzün uygulanabilirliği test edildiği zaman 0, 10 / 1, 75. 10 -5 >103 (bin katından büyük) Asidin iyonlaşması ile başlangıç derişiminin fazla değişmediği düşünülebilir ve paydadaki H 3 O+ derişimi CHA yanında ihmal edilebilir. 1, 75 x 10 -5 = x 2 / 0, 10 x 2 = 1, 75 x 10 -6 [H 3 O+] = x = 1, 32 x 10 -3 M p. H = -log 1, 32 x 10 -3 = 2, 88

Aynı kurallar zayıf bazlar içinde geçerlidir. B + H 2 O ⇄ BH+ + OH- Kb = ([BH+] [OH-] / [B] 2 H 2 O ⇄ H 3 O+ + OH- Ksu = [H 3 O+] [OH-] Kb = [OH- ]2 / Cb – [OH-] Kb = [OH-]2 / Cb Eğer Kb değeri 10 -9 dan küçük ve bazın derişimi de 10 -3 M dan daha küçük ise suyun iyonlaşma etkisini göz önüne almak zorundayız. [OH-] = [OH-]zayıf baz + [OH-]su Zayıf bazdan gelen [OH-] aynı zamanda [BH+] ya, sudan gelen [OH-] ise suyun [H 3 O+] ya eşittir. Dolayısıyla [OH-] = [BH+] + [H 3 O+] olur. [BH+] = Kb. [B] / [OH-] [H 3 O+] = Ksu / [OH-] değerler yerine konulduğunda [OH-] = Kb [B] / [OH-] + Ksu / [OH-]2 = Kb. Cb + Ksu [OH-] = (Kb. [B] + Ksu)1/2 olur. Baz zayıf olduğundan dengedeki B derişimi, bazın başlangıç derişimine eşit olarak düşünülebilir. Böylece eşitlik [OH-] = (Kb. Cb+ Ksu)1/2 haline gelir. Kb. Cb >> Ksu olduğunda eşitlik [OH-] = (Kb. Cb)1/2 şeklini alır.
![BH Kb B OH H 3 O Ksu OH [BH+] = Kb [B] / [OH-] ➪ [H 3 O+] = Ksu / [OH-]](https://slidetodoc.com/presentation_image_h/7780b0de582b15511b4b1567023bbebd/image-18.jpg)
[BH+] = Kb [B] / [OH-] ➪ [H 3 O+] = Ksu / [OH-] Bu değerler yerine konulduğunda [OH-] = Kb [B] / [OH-] + Ksu / [OH-] [OH- ]2 = Kb[B] + Ksu [OH-] = (Kb[B] + Ksu)1/2 Baz zayıf olduğundan dengedeki B derişimi, bazın başlangıç derişimine eşit olarak düşünülebilir. Böylece eşitlik [OH-] = (Kb. Cb+ Ksu)1/2 haline gelir. Kb. Cb >> Ksu olduğunda eşitlik [OH-] = (Kb. Cb)1/2 şeklini alır. Örnek: 2, 5 x 10 -5 M anilin, C 6 H 5 NH 2, çözeltisindeki türlerin derişimlerini ve p. H değerlerini bulunuz. Kb = 4, 30 x 10 -10 Dikkat edilmesi gereken husus Kb değerinin 10 -9 dan, baz derişimin ise 10 -3 M dan küçük olduğudur. C 6 H 5 NH 2 + H 2 O ⇄ C 6 H 5 NH 3+ + OH [OH-] = (Kb. Cb)1/2 = (4, 30 x 10 -10 x 2, 5 x 10 -5 + 1. 10 -14)1/2 = [OH-] = (1, 08 x 10 -14 + 1. 10 -14)1/2 = 1, 44 x 10 -7 M ➪ p. OH=6, 84 ➪ p. H=7, 16 [OH-] = [C 6 H 5 NH 3+] = 1, 44 x 10 -7 M [C 6 H 5 NH 2] = 2, 5 x 10 -5– 1, 44 x 10 -7 = 2, 49 x 10 -5 M [H 3 O+] = Ksu / [OH- ] = 1. 10 -14 / 1, 44 x 10 -7 = 6, 94 x 10 -8 M p. H= -log 6, 94 x 10 -8 = 7, 16

17 - 06. Poliprotik Asitler ve p. H Çözeltide iyonlaştığında birden fazla hidronyum iyonu (H 3 O+ ) veren asitlere poliprotik veya polifonksiyonlu asitler denir. Poliprotik asitlere, fosforik asit (H 3 PO 4), karbonik asit (H 2 CO 3) , (H 2 SO 4), okzalik asit ( H 2 C 2 O 4) örnek verilebilir. Örnek olarak fosforik asiti verecek olursak , fosforik asit iyonlaştığı zaman 3 tane H 3 O+ iyonu verebiliyor. H 3 PO 4 + H 2 O ⇄ H 2 PO 4 - + H 3 O+ Ka 1 = 7, 11 x 10 -3 H 2 PO 4 - + H 2 O ⇄ HPO 42 - + H 3 O+ Ka 2 = 6, 34 x 10 -8 HPO 42 - + H 2 O⇄ PO 43 - + H 3 O+ Ka 3 = 4, 20 x 10 -13 Ka 1 >> Ka 2 >> Ka 3 2 H’lide Genel gösterim; H 2 A + H 2 O ⇄ HA- + H 3 O+ için Ka 1 HA - + H 2 O ⇄ A 2 - + H 3 O+ için Ka 2 olan poliprotik asitlerde zayıf asitlere benzer şekilde bir takım yaklaşımlarda bulunmamız gerekiyor Eğer Ka değerleri 10 -4 – 10 -9 arasında ve derişim 1 -10 -3 M arasında ise suyun ayrışma dengesini düşünmemize gerek yoktur. Diğer taraftan Ka 1 ve Ka 1 arasındaki oran 103 ve daha fazla ise 1. dengeyi düşünür, ikinci dengeyi ihmal edebiliriz. Ve problem monoprotik bir asit çöz. deki p. H hesabına dönüşür.

Örnek: 0, 10 M karbonik asit (H 2 CO 3) çözeltisinin p. H sı nedir? Ka 1 = 4, 45 x 10 -5 Ka 2 = 4, 69 x 10 -11 Çözüm: H 2 CO 3 + H 2 O ⇄ HCO 3 - + H 3 O+ Ka 1 = 4, 45 x 10 -5 HCO 3 - + H 2 O ⇄ CO 32 - + H 3 O+ Ka 2 = 4, 69 x 10 -11 Ka değerlerinden görüldüğü gibi suyun ayrışma dengesinin etkisini düşünmeye gerek yoktur. Ka 1 / Ka 2 >> 103 olduğundan sadece 1. iyonlaşma dengesini düşünerek [H 3 O+] bulunabilir ve p. H hesaplanır. H 2 CO 3 + H 2 O ⇄ HCO 3 - + H 3 O+ Başlangıç: 0, 10 M 0 Değişim -x +x Dengede: (0, 10 -x) M +x Ka 1= [HCO 3 -]x[H 3 O+] / [H 2 CO 3]x[H 2 O] ➪ Burada [H 2 O] ihmal edilerek ➪ Ka 1 = 4, 45 x 10 -5 = (x 2) / (0, 10 -x) Bu eşitliğin çözümünden x bulunur. x 2 +4, 45 x 10 -5 - 4, 45 x 10 -6= 0 ➪ x = 0, 0298 = [H 3 O+] ➪ p. H = -log 2, 98 x 10 -2 = 2 -log 2, 98 = 1, 53 bulunur. Eğer poliprotik asitlerde Ka 2, Ka 1’e göre ihmal edilebilecek kadar küçük olmakla beraber asitlik değeri oldukça yüksekse yani 10 -4 den büyükse problemi monoprotik asit sistemine indirgeyerek çözümleyemeyiz. Bunun en iyi örneği H 2 SO 4 aq dır

17 -6 Çok protonlu asitler Fosforik asit: üç protonlu bir asittir 3 kademede iyonlaşır H 3 PO 4 + H 2 O ⇄ H 3 O+ + H 2 PO 4 - Ka 1 = 7, 1*10 -3 p. Ka 1 = 2, 15 H 2 PO 4 - + H 2 O ⇄ H 3 O+ + HPO 42 - Ka 2 = 6, 3*10 -8 p. Ka 2 = 7, 20 HPO 42 - + H 2 O ⇄ H 3 O+ + PO 43 Ka 3 = 4, 2*10 -13 p. Ka 3 = 12, 38 Örnek 17 -9 3. 0 M H 3 PO 4 için çözümleri hesaplayınız: (a) [H 3 O+]; (b) [H 2 PO 4 -]; (c) [HPO 42 -] (d) [PO 43 -] Başlangıç derişimi 3. 0 M değişme -x M +x M Denge derişimi (3. 0 -x) M 0 0 x. M +x M Ka 1 = 7, 1*10 -3 =x 2/ 3 -x=x 2 /3. 0 x = [H 3 O+]= [H 2 PO 4 -]= 0. 14 M Ka 2 = 6, 3*10 -8=(0, 14+y)*y/ 0, 14 -y=0, 14. y /0, 14 y=[H 3 O+]=[HPO 4=]= 6, 3*10 -8 M Ka 3 = 4, 2*10 -13=(0, 14+z)*z / 6, 3*10 -8–z z = [PO 43 -] = 1, 9*10 -19 M Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 21 of 47

Çözelti Denge Hesaplarına Genel Bir Yaklaşım • Çözeltide bulunan tüm türleri belirleyiniz (Su molekülleri hariç). • Bu türleri içeren eşitlikleri yazınız. • Denge sabiti ifadeleri • Kütle denkliği eşitlikleri • Yük denkliği koşulu • Eşitlikleri bilinmeyenler için çözünüz. Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 22 of 47

17 -7 Asit ve Baz Özelliği Gösteren İyonlar CH 3 CO 2 - + H 2 O ⇄ CH 3 CO 2 H + OHbaz asit Kb= K a= [CH 3 CO 2 -] K a= NH 4+ + H 2 O ⇄ NH 3 + H 3 O+ acid [CH 3 CO 2 H][OH-] [NH 3] [H 3 O+] [NH 4+] base [NH 3] [H 3 O+] [NH 4+] = Ksu Kb [H 3 O+] *[OH-]=Ksu Prentice-Hall © 2002 = Ksu = Ka 1, 0*10 -14 1, 8*10 -5 =? = 5, 6*10 -10 = Ka Kb General Chemistry: Chapter 17 Slide 23 of 47

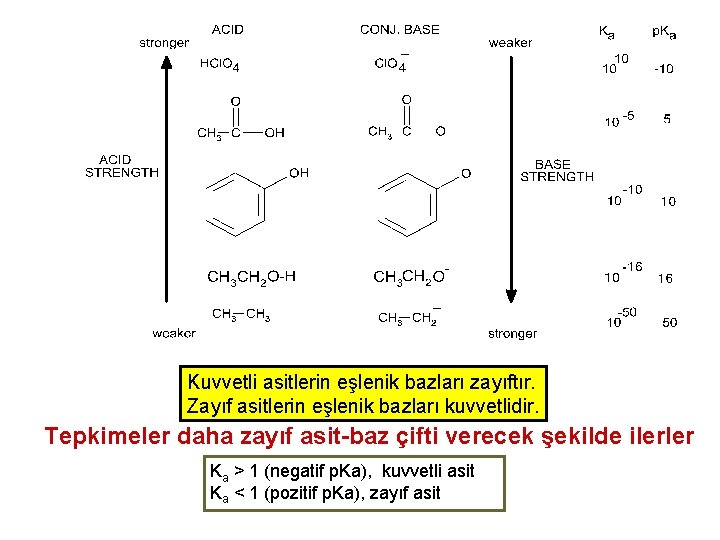
İkili Asitlerin Kuvvetleri HI HBr HCl HF Bağ uzunluğu 160. 9 > 141. 4 > 127. 4 > 91. 7 pm Bağ enerjisi 297 < 368 k. J/mol Asit kuvveti 109 > 108 > 1. 3 106 >> 6. 6 10 -4 < 431 < 569 HF + H 2 O → [F-·····H 3 O+] F- + H 3 O+ ion pair H-bonding Prentice-Hall © 2002 free ions General Chemistry: Chapter 17 Slide 24 of 47

Kuvvetli asitlerin eşlenik bazları zayıftır. Zayıf asitlerin eşlenik bazları kuvvetlidir. Tepkimeler daha zayıf asit-baz çifti verecek şekilde ilerler Ka > 1 (negatif p. Ka), kuvvetli asit Ka < 1 (pozitif p. Ka), zayıf asit

HCl ve NH 3 örnekleriyle reaksiyona giren su molekülü, HCl’ye karşı baz olarak (proton alan), NH 3’ e karşı ise su asit olarak (proton veren) davranmaktadır. Buda su molekülünün rx’a girdiği maddeye göre asit veya baz olarak davrandığını gösterir. Bu tür maddelere amfoter maddeler denir. Amfoter maddelere örnek olarak HO, ROH, HCO 3 -, H 2 PO 4 -, HPO 42 - verilebilir. 1. 3 - ÇÖZÜCÜYE göre ASİTLER, içinde çözündüğü çözücünün iyonlaşmayla katyon derişimini artırır, BAZLAR ise çözücüde anyon derişimini artıran maddelerdir. Örneğin H+=H 3 O+iyonu suyun katyon derişimini artırdığı için asit, OH- iyonu suyun, NH 2 - iyonu ise Amonyağın anyon derişimini artırdığı için bazdır. HCl. O 4 oldukça kuvvetli proton (katyon) verici asit olup içine bundan daha zayıf bir asit mesela HF atılırsa HF burada proton veremeyeceği için proton almaya zorlanır ve HCl. O 4 karşısında baz gibi davranır. HCl. O 4 (asit) + HF(baz) → H 2 F+ (süperasit) + Cl. O 4 - (baz)

ÇÖZÜCÜLER Kimyasal rx’ların nerdeyse tamamı çözeltide gerçekleşir. Su polar maddeler için iyi bir çözücü olmasına karşılık apolar maddeler için iyi bir çözücü değildir. Bundan dolayı organik maddeler için alkol, eter, aseton, kloroform, benzen, toluen, ksilen, CS 2, CCl 4 gibi çözücüler kullanılır. Bir polar maddeyi suda çözünmüyorsa sudan daha polar karekterli asit veya bazlarla çözmek mümkün olur. Çözücü tercihini çözünen maddenin yapısını değiştirmeyen, geniş kullanım sıcaklığı, dielektrik sabiti (polarlık), uygun asitlik veya bazlık, iyonlaşma derecesi gibi özellikler belirler. Çözücüler genel olarak 1 -Apolar (iyonlaşmayan) düşük dipol momentli çözücülerdir CCl 4 gibi. 2 - Polar (iyonlaşabilen) yüksek dipol momentli çözücüler a)Protik (asidik) iyonlaşanlar, H 2 O, NH 3, HCl, Et. OH gibi b) İyonlaşmayanlar SO 2, DMF, DMSO olarak gruplandırılır.

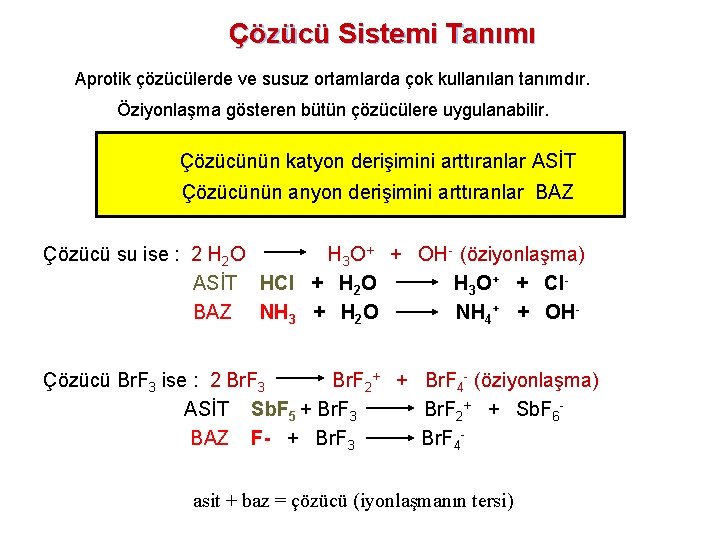
Çözücü Sistemi Tanımı Aprotik çözücülerde ve susuz ortamlarda çok kullanılan tanımdır. Öziyonlaşma gösteren bütün çözücülere uygulanabilir. Çözücünün katyon derişimini arttıranlar ASİT Çözücünün anyon derişimini arttıranlar BAZ Çözücü su ise : 2 H 2 O H 3 O+ + OH- (öziyonlaşma) ASİT HCl + H 2 O H 3 O+ + Cl- BAZ NH 3 + H 2 O NH 4+ + OH- Çözücü Br. F 3 ise : 2 Br. F 3 Br. F 2+ + Br. F 4 - (öziyonlaşma) ASİT Sb. F 5 + Br. F 3 Br. F 2+ + Sb. F 6 - BAZ F- + Br. F 3 Br. F 4 - asit + baz = çözücü (iyonlaşmanın tersi)

Bu şekilde oluşan SÜPERASİTler çok kuvvetli proton verici olup (Ho=Hammet Asitliği: -11) en kuvvetli asitten bile onlarca kat daha kuvvetli proton vericidirler. Bunlarla en kuvvetli asitlerle dahi protonlanamıyan aromatik maddeler ve hidrokarbonlar bile protonlanabilmektedir. Benzer şekilde edilen HSO 3 F de bir süperasittir. HSO 3 F/Sb. F 5 1: 1 karışımına SİHİRLİ ASİT denir karışımda oluşan H 2 SO 3 F+ daha da kuvvetli bir proton vericidir ve Ho asitliği -19 dur. Bunlarla, normal şekilde edilemiyen Karbonyum iyonları (CH 3)3 C+, Halojen Katyonları (I 2+, I 3+) ve Polinükleer Katyonlar (S 42+, S 82+, Se 42+, Te 42+) elde edilebilmektedir. Ho asitliği=Hammett Asitliği kabaca sıfırın altına genişletilmiş p. H skalasıdır. Süperasitler mutlak susuz sistemlerdir. Çünkü suyun DÜZEYLEYİCİ ETKİSİ vardır ve sulu ortamda bulunabilecek en kuvvetli asit H+=H 3 O+ iyonu , en kuvvetli baz ise OH- iyonudur. Kuvvetli asitlerden daha kuvvetli olan süperasitler suyun düzeyleme etkisiyle H+=H 3 O+ olur, OH-‘dan daha kuvvetli baz olan H-, O 2 -, NH 2 - ise suyun düzeyleme etkisiyle OH- olur. Görüldüğü gibi çözücünün farklandırma tesiri çok önemlidir. Suya karşı zayıf bir asit olan HA, NH 3’a karşı kuvvetli bir asit gibi davranır.

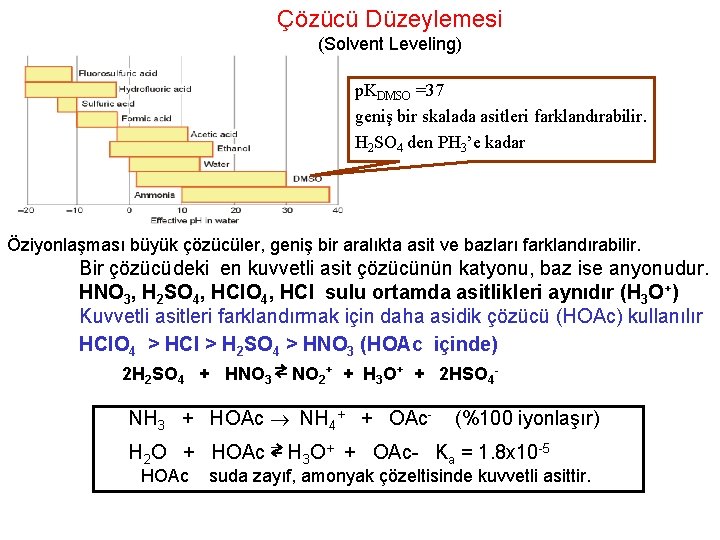
Çözücü Düzeylemesi (Solvent Leveling) p. KDMSO =37 geniş bir skalada asitleri farklandırabilir. H 2 SO 4 den PH 3’e kadar Öziyonlaşması büyük çözücüler, geniş bir aralıkta asit ve bazları farklandırabilir. Bir çözücüdeki en kuvvetli asit çözücünün katyonu, baz ise anyonudur. HNO 3, H 2 SO 4, HCl sulu ortamda asitlikleri aynıdır (H 3 O+) Kuvvetli asitleri farklandırmak için daha asidik çözücü (HOAc) kullanılır HCl. O 4 > HCl > H 2 SO 4 > HNO 3 (HOAc içinde) 2 H 2 SO 4 + HNO 3 ⇄ NO 2+ + H 3 O+ + 2 HSO 4 - NH 3 + HOAc NH 4+ + OAc- (%100 iyonlaşır) H 2 O + HOAc ⇄ H 3 O+ + OAc- Ka = 1. 8 x 10 -5 HOAc suda zayıf, amonyak çözeltisinde kuvvetli asittir.

ASİTLİK GÜCÜ Ka değeri ve Asitlik gücü p. Ka< -10 Süper Asit - p. Ka< -8 Çok Kuvvetli Asit - p. Ka<2 Kuvvetli Asit- p. Ka>2 Zayıf. Asit - p. Ka>7 Çok Zayıf Asit. Süperasitler, H 2 SO 4 den daha kuvvetlidir. Kuvvetli asitlerin (HF) protonlanması ile elde edilir. 2 HF + 2 Sb. F 5 H 2 F+ + Sb 2 F 11 - (Floroantimonik asit) Ho=Hammet Asitliğine göre Oksijen sayısı arttıkça, asitlik gücü artar. HCl. O 4 > HCl. O 3 > HCl. O 2 > HCl. O Ametalin elektronegatifliği arttıkça asitlik artar. H 2 SO 4 > H 2 Se. O 4 > H 2 Te. O 4

Susuz Oksitler 1. Asidik Oksitler- Ametal Oksitler CO 2 + H 2 O H 2 CO N 2 O 5 + H 2 O 2 HNO 3 SO 3 + H 2 O H 2 SO 4 Yağmur suyu asidiktir 9 Kasım 2020 Pazartesi 2. Bazik Oksitler-Metal Oksitler Na 2 O + H 2 O 2 Na. OH Mg. O + 2 H 3 O+ Mg 2+ + 3 H 2 O (Mg. O asidik ortamda çözünür) 3. Amfoter oksitler Al 2 O 3(k) + 3 H 2 O + H 3 O+(aq) 2[Al(OH 2)6]3+(aq) Al 2 O 3(k) + 3 H 2 O + 2 OH-(aq) 2[Al(OH)4]-(aq) Katyonların çapı küçüldükçe ve yükü büyüdükçe asitlik gücü artar. Alkali metaller asit değildir. Toprak alkali metaller zayıf asittir. 2+ geçiş elementleri zayıf asittir. 3+ geçiş elementleri kuvvetli asittir. 4+ ve daha yüksek metaller çok kuvvetli asittir. (Mx. Oy) BX 3 Lewis Asitliği Gözlenen sıralama BF 3 < BCl 3 < BBr 3 Beklenen sıralama (Elektronegatiflik ve sterik etkiye göre ) BF 3 > BCl 3 > BBr 3 Organik Aminlerin BAZLIĞI yapı simetrikleştikçe azalır. Antisimetrik yapılarda Bazlık daha Kuvvetlidir.

Oksiasitlerin Kuvvetleri • Oksitlerin bağıl kuvvetlerini belirleyebilmek için, O-H bağı elektronlarının merkez atomuna doğru çekilmesini inceleyelim: – Merkez atomun elektronegatifliği(EN) – Asit molekülündeki O atomlarının sayısı. Prentice-Hall © 2002 H-O-Cl H-O-Br ENCl = 3. 0 ENBr= 2. 8 Ka = 2. 9 10 -8 Ka = 2. 1 10 -9 General Chemistry: Chapter 17 Slide 33 of 47

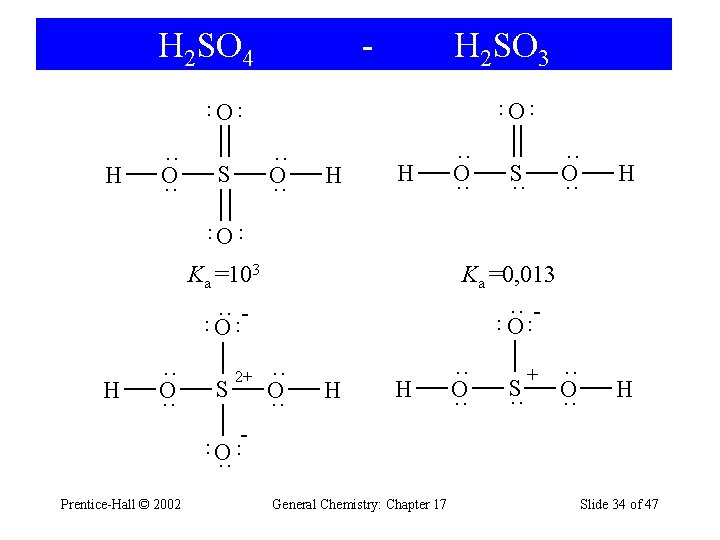
H 2 SO 4 - H 2 SO 3 O ·· ·· O H ·· O ·· S H H ·· O ·· S ·· ·· O ·· H ·· ·· O Ka =103 Ka =0, 013 ·· O ·· ·· ·· O H ·· O ·· S ·· O ·· H H ·· O ·· S ·· + - ·· ·· O ·· 2+ Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 34 of 47

Organik Asitlerin Kuvvetleri H C O ·· ·· H C H Asetik asit Ka = 1, 8. 10 -5 Prentice-Hall © 2002 H ·· O ·· H H H C C H H ·· O ·· H Etanol Ka =1, 3. 10 -16 General Chemistry: Chapter 17 Slide 35 of 47

Aminlerin Bazlık Kuvvetleri H H C NH 2 H H C C H H NH 2 H H C C C H H H metilamin propylamine p. Kb = 4, 74 p. Ka = 3, 38 p. Kb = 3, 37 Prentice-Hall © 2002 General Chemistry: Chapter 17 NH 2 Slide 36 of 47

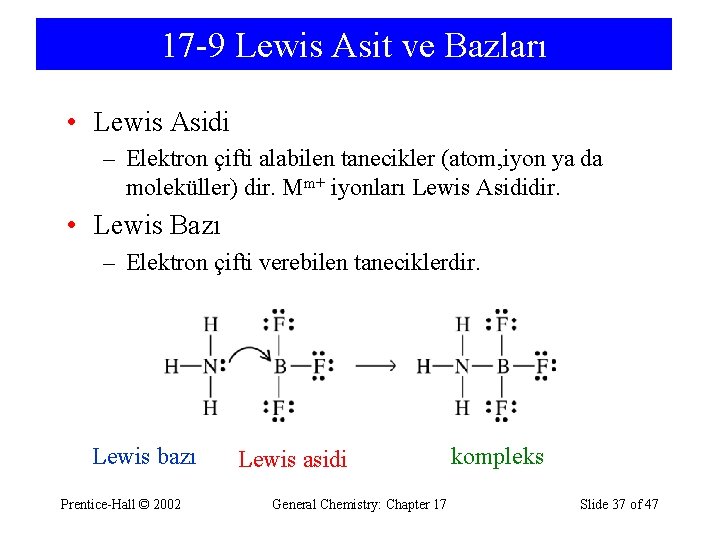
17 -9 Lewis Asit ve Bazları • Lewis Asidi – Elektron çifti alabilen tanecikler (atom, iyon ya da moleküller) dir. Mm+ iyonları Lewis Asididir. • Lewis Bazı – Elektron çifti verebilen taneciklerdir. Lewis bazı Prentice-Hall © 2002 Lewis asidi General Chemistry: Chapter 17 kompleks Slide 37 of 47

Lewis Tanımı ASİT electron-çifti alıcı (acceptor) nükleofil BAZ elektron-çifti verici (donor) elektrofil ASİT BAZ Kompleks 1. 4 - LEWİS' e göre ise ASİT elektron çifti alabilen, BAZ ise elektron çifti verebilen maddedir. Baz grubuna genellikle elektron verebilen oksijen veya azot içeren maddeler girer. Diğer taraftan hidrojen içermeyen maddeler asit olabilir. Örneğin bor triflorür, BF 3, bir asittir, çünkü elektron eksikliği vardır ve bunu tamamlamak ister. Öte yandan NH 3 veya diğer azotlu maddelerde ortaklanmamış elektron çiftleri bulunur, dolayısıyla bazdır. 3+ + 6 CN- ➔ [Fe(CN) ]3 Lewis Asitleri Bütün katyonlar Lewis Asitidir Fe Lewis Asitleri 6 3+ 3 Oktet boştuğu olan bileşikler Al + 6 F ➔ [Al(F)6] Hipervalent oluşturabilen bileşikler Sn. Cl 4 + 2 Cl- ➔ [Sn(Cl)6]2 Çok katlı π-bağlara sahip bileşikler CO 2 + OH- ➔ HCO 3 -, F-, S-2…) H+ + OH- ➔ H O Lewis Bazları Bütün anyonlar: (OH Lewis Bazları 2 2+ No é çifti içeren nötral bileşikler (H 2 O, NH 3 gibi. . ) Cu + 4 H 2 O ➔ [Cu(H 2 O)4]2+ Çok katlı π-bağlara sahip bileşikler Ag+ + C 2 H 4 ➔ [Ag(C 2 H 4)]+ MOT göre: ASİT: Düşük enerjili LUMO, BAZ : Yüksek enerjili HOMO olan komplexlerdir.

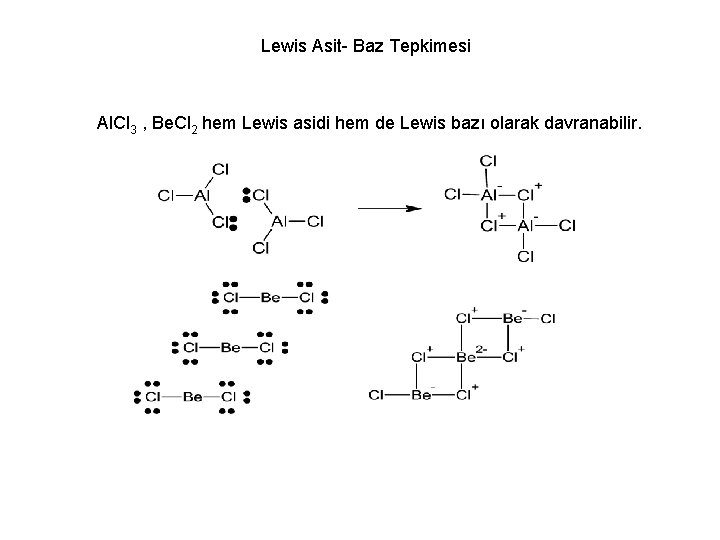
Lewis Asit- Baz Tepkimesi Al. Cl 3 , Be. Cl 2 hem Lewis asidi hem de Lewis bazı olarak davranabilir.

Lux-Flood Asit Baz Tanımı 1. 5 - Lux-Flood Tanımı göre ametal oksitler ASİT olup oksit alıcıdır , metal oksitler BAZ olup oksit vericidir. Örneğin; Ba. O (baz) + Si. O 2 (asit) → Ba(Si. O 3) Na 2 O (baz) +CO 2 (asit) → Na 2 CO 3 gibi… Oksit anyonu alan bileşikler ASİT Oksit anyonu veren bileşikler BAZ Ca. O + Si. O 2 Ca. Si. O 3 Pb. O + SO 3 Pb. SO 4 Ti. O 2 + Na 2 S 2 O 7 Na 2 SO 4 + Ti. OSO 4 Usanowich Asit-Baz Tanımı 1. 6 - USANOVİCH’ e göre ASİTLER rx’da katyon verir, anyon veya e- alır ve bazlarla rx girer, BAZLAR ise rx’da anyon veya e- verir, katyon alır ve asitlerle rx’a girerler. Bu tanım bundan evvel ki aşağı yukarı tüm tanımları kapsamaktadır Katyon veren bileşikler ASİT Anyon alan bileşikler BAZ Büyün kimyasal tepkimeler asit-baz tepkimesi olarak kabul edilebilir.

Kimyasal Yapı ve Asit-Baz İlişkisi Asitler ve bazlar birbirleriyle kolay rx verebilmeleri dolayısıyla tüm rx verebilen maddeler birbirlerine karşı asit ve baz karekterleriyle belirlenebilir dolayısıyla Asitliğin bazlarla rx sonucu pozitif karekteri azalır, bazlıkta ise negatif karekterde azalma olur. Böylece MO (Metal. Oksit)lerin asitliği ve bazlığı, Aminlerin bazlığı, Oksiasitlerin asitliği, M’nin elektronegatifliği ile asitliğinin artması, Yükseltgenme Basamağı ve Formal Yük ile asitliğin artması, poliasitlerde asitliğin gittikçe azalması, M’nin r’nın değişiminin asitliği bazen artırıp bazen azaltması gibi özellikler yapıyla asit-baz ilişkisini gösterir

Asit-Baz Tanımlarının Karşılaştırılması Asit Baz Lavoiser (1789) Oksitlenmiş Madde* Oksitlenecek madde Arrhenius (1887) H+ kaynağı OH- kaynağı Bronsted-Lowry (1923) H+ verici H+ alıcı Lewis (1923) Elektron çifti alıcı (Elektrofil) Elektron çifti verici (Nükleofil) HOMO/LUMO (1960) Düşük LUMO Yüksek HOMO Lux-Flood Ametal Oksitler Metal Oksitler Usanovich Negatif iyon alıcı Pozitif iyon verici Pozitif iyon alıcı Negatif iyon verici *oksijen: asit oluşturucu, HNO 3, H 2 SO 4 gibi

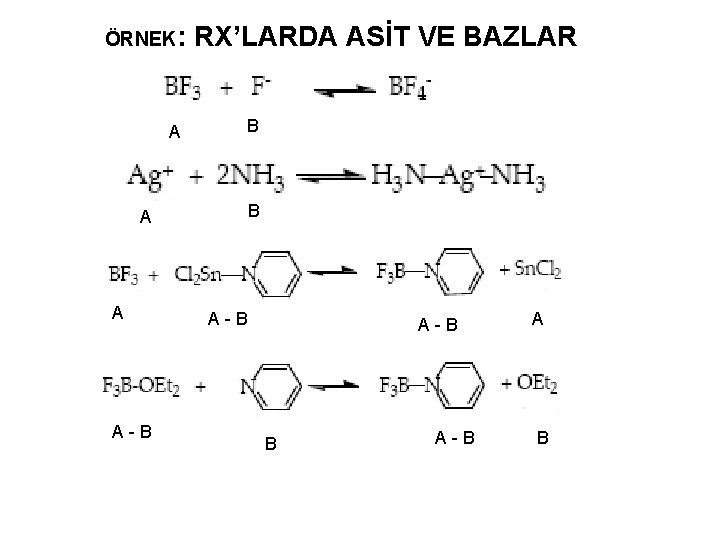
ÖRNEK: RX’LARDA ASİT VE BAZLAR A A - B B B A - B A B

Asit Yağmuru CO 2 + H 2 O H 2 CO 3 3 NO 2 + H 2 O 2 HNO 3 + NO H 2 CO 3 + H 2 O HCO 3 - + H 3 O+ Bu Slaytların hazırlanmasında emeği geçen 060050129 -ÇAĞLA TÖREN’e TEŞEKKÜRLER Prentice-Hall © 2002 General Chemistry: Chapter 17 Slide 44 of 47

→ ← ↑ ↓ ⇄ ⇌ ↔ ⇥ ➔ ➪ ➨⁂║│Å ℃ Ӯ ϑ υ ν τ ε δ ζ α β γ ∂ σ б Ө ψ Δ ∇ π Ω χ φ ρ Ψ ω μ η λ ū ≠√ ∛ ∜ ∑ ∫ ∞ ≈ ~ ÷ ¯ PROBLEMLER 1) 200 m. L %31 Na. OH (aq) (d=1, 33) nasıl %14 Na. OH (aq) yapılır? ➨CEVAP: 323 m. Lsu katarak 2) 25 m. L suda 4 g Na 3 PO 4(k) (Mw=164 g/n) çözüldüğünde 27, 8 m. L Na 3 PO 4(aq) oluşur. Oluşan Na 3 PO 4(aq) d=? , %=? , %c=? ➨CEVAP: d=1, 043 - %=13, 79 - %c=14, 39 . 3) 35 g %25 KCl (aq) (d=1, 22 - Mw=74 g/n) üzerine 56 g %15 KCl (aq) (d=1, 11) ilavesinde oluşan çözeltinin d=? %=? %c=? M=? m=? , %n=? Bu oluşan çözelti %17 KCl (aq) nasıl yapılır? ➨CEVAP: d=1, 15 - %18, 85 - %c= 21, 67 - M=2, 91 - m= 3, 86 - %n= 6, 02 - Bu çözelti üzerine 9, 88 m. L su ilavesiyle %17 KCl (aq) oluşur . 4) %15 Na. OH (aq) (d=1, 17) ve %28 Na. OH (aq) (d=1, 3) kütlece ve hacımca eşit karıştırılırsa oluşacak Na. OH (aq) d=? , %c=? , %v=? , M=? , N=? , m=? , %n=? ➨CEVAP: Kütlece Eşit karışım d=1, 23 - % 21, 5 ➪ hacımca eşit karışım d=1, 235 %21, 84 . 5) %15 H 2 SO 4(aq) (d=1, 103) ve %45 H 2 SO 4(aq) (d=1, 352) ile su eşit hacımlarda karıştırılırsa meydana gelen H 2 SO 4(aq) d=? , %c=? , %v=? , M=? , N=? , m=? , %n=? ➨CEVAP: d=1, 151 - % 22, 4 -%c=25, 78 - %v=10, 69 - M=2, 65 - N=5, 30 - m=2, 95 - %n=5, 04 . 6) %40 H 2 SO 4(aq) (d=1, 3) su ile kütlece ve hacımca 3: 1 oranında karıştırılırsa meydana gelen H 2 SO 4(aq) d=? , %=? , %c=? , %v=? , M=? , N=? , m=? , %n=? ➨CEVAP: Kütlece 3: 1 karışımın d=1, 21 - % 30 ➪ hacımca 3: 1 karışımın d=1, 225 %31, 84 . 7) % 12 HCl(aq) ve %36 HCl (aq) ağırlıkça hangi oranda karıştırılırsa %20 HCl (aq) oluşur ? ➨CEVAP: 12 16 g % 12 HCl (aq) üzerine 8 g % 36 HCl(aq) ilavesiyle yani w 1: w 2= 2: 1 oranında karışım % 20 HCl olur. 20 36 8 g %36 HCl (aq) veya w 1. c 1=w 2. c 2 (2 x 0, 12) + (w 2 x 0, 36)= (2+w 2). 0, 20 ➪ w 2=1 bulunur. ************************************************ 8) 400 g % 40 Na. NO dan %60 Na. NO yapabilmek için kaç g Na. NO katılır ? 3(aq) 3(k) ➨CEVAP: (400 x 0, 40) + w 2 / (400 + w 2)= 0, 60 ➪ w 2= 200 g Na. NO 3(k) ************************************************ 9) 400 cc % 85 KNO 3(aq) içindeki katı KNO 3(k) tuzu kaç g. dır ? ➨CEVAP: (400 x 1, 84 = 736 g % 85 KNO 3(aq) ) içinde ➪ 736 x 0, 85=625, 6 g katı KNO 3(k) tuzu vardır ************************************************ 10) 0, 5 kg %49 H SO ‘ne yeteri kadar Mg çubuk atıldığında kaç L H gazı çıkar? H SO + Mg ➔ Mg. SO + H 2(g) 2 4(aq) 2 ➨CEVAP: 500 x 0, 49 / 98 = 2, 5 mol H 2 gazı ➪ x 22, 4 L/ mol = 56 L H 2 gazı çıkar 2 4(aq

→ ← ↑ ↓ ⇄ ⇌ ↔ ⇥ ➔ ➪ ➨⁂║│Å ℃ Ӯ ϑ υ ν τ ε δ ζ α β γ ∂ σ б Ө ψ Δ ∇ π Ω χ φ ρ Ψ ω μ η λ ū ≠√ ∛ ∜ ∑ ∫ ∞ ≈ ~ PROBLEMLER 11) 400 g % 20 Na. OH(aq) içine yeteri kadar toz Al katılınca 17 o. C de 2 atm basınçda kaç L H 2(g) oluşur? ➨CEVAP: 3 Na. OH(aq) + Al ➔ Na 3 Al. O 3(aq)+3/2 H 2(g) n. Na. OH=400 x 0, 20/40 =2 mol ➨ 2 x. V = 3 x 0, 082 x 290 ➨ V=35, 67 L 12) % 60 HA (aq) (d=1, 07 - Mw=60 g/n) ‘ine hacmının 2 katı su katılınca oluşan çözeltinin d, %, %c, %v, M, m, %n=? ➨CEVAP: 100 m. L %60 HA(aq) =107 g %60 HA(aq)= (107 x 0, 6=)64, 2 g HA + 42, 8 g H 2 O=57, 2 m. L HA + 42, 8 m. LH 2 O Bu çözeltiye 200 m. L su ilavesinde oluşan 300 m. L toplam çözelti = 57, 2 m. L HA + 242, 8 m. L su ➪ 307 g toplam çözelti = 64, 2 g HA + 242, 8 g su dan oluşur. Ohalde d=307/300=1, 023 %=64, 2 x 100 / 307 =20, 912 - %c= 64, 2 x 100 / 300 = 21, 4 - %v=57, 2 x 100 / 300=19, 067 - M=64, 2: 60/0, 3=3, 567 - m=64, 2: 60 / 0, 2428=4, 41 %n=(64, 2: 60) x 100 / (64, 2: 60) **************************************************************** 13) % 95 H 2 SO 4(aq) ile %30 Oleum ( 100 g=30 g H 2 S 2 O 7+70 g H 2 SO 4) ne oranda karıştırılırsa %20 Oleum olur? ➨CEVAP: 100 g %95 H 2 SO 4(aq) (100 g=95 g H 2 SO 4+5 g H 2 O) üzerine ilave edilecek % 30 Oleum miktarı=A ise 0, 20 Oleum = 0, 30 x. A - (5 x 178: 18) / 100+ A ➪ A = 694, 44 g %30 Oleum +100 g % 95 H 2 SO 4(aq) ≈ 7/1 oranı 14) 80 g % 98 H 2 SO 4(aq) ile 150 g %20 Oleum ( 100 g=20 g H 2 S 2 O 7+80 g H 2 SO 4) karıştırılırsa ne oluşur ? ➨CEVAP: 80 g %98 H 2 SO 4(aq) = (80 x 0, 98=) 78, 4 g H 2 SO 4+1, 6 g H 2 O içerir 178 g/n 18 g/n 2 x 98=196 150 g %20 Oleum = (150 x 0, 20=)30 g H 2 S 2 O 7+120 g H 2 SO 4 içerir H 2 S 2 O 7 + H 2 O ➔ 2 H 2 SO 4 (1, 6 x 178/18=15, 82) Artan H 2 S 2 O 7 miktarı = 30 - 15, 82 = 14, 18 g/230 g ➪ NETİCE % 6, 16 OLEUM çözeltisi oluşur 15) % 10 Oleum ile % 50 H 2 SO 4(aq), % 95 H 2 SO 4(aq) eldesi için ne oranda karıştırılmalıdır ? ➨CEVAP: A g % 50 H 2 SO 4(aq) alınıp buna 100 g %10 Oleum alınırsa H 2 S 2 O 7 + H 2 O ➔ 2 H 2 SO 4 10 g H 2 S 2 O 7 ➪ 1, 011 g H 2 O harcar ➪ 11, 011 g H 2 SO 4 oluşturur. Ohalde H 2 O’a göre=0, 5 A - 1, 011/100+A=0, 05 ➪ A=13, 36 g % 50 H 2 SO 4(aq)100 g%10 Oleum katılır % 95 H 2 SO 4(aq) olur H 2 SO 4’a göre=0, 5 A + 90 + 11, 011/100+A=0, 95 ➪ A=13, 36 g % 50 H 2 SO 4(aq)100 g%10 Oleum katılır % 95 H 2 SO 4(aq) olur.

4 → ← ↑ ↓ ⇄ ⇌ ↔ ⇥ ➔ ➪ ➨⁂║│Å ℃ Ӯ ϑ υ ν τ ε δ ζ α β γ ∂ σ б Ө ψ Δ ∇ π Ω χ φ ρ Ψ ω μ η λ ū ≠√ ∛ ∜ ∑ ∫ ∞ ≈ 16 -)1, 5 g katı Ag 2 Cr. O 4(k) (331, 73) elde etmek için aşırı Ag. NO 3(aq) içine kaç m. L 0, 25 M K 2 Cr. O 4(aq) eklenir? ➨CEVAP: : 2 Ag. NO 3(aq) + K 2 Cr. O 4(aq) ➔ Ag 2 Cr. O 4(k) + 2 KNO 3(aq) V K 2 Cr. O 4(aq)=1, 5 / 331, 73 mol Ag 2 Cr. O 4 *1 mol K 2 Cr. O 4 /1 mol Ag 2 Cr. O 4 *1 L/0, 25 mol K 2 Cr. O 4 =0, 0181 L ➨ 18, 1 m. L K 2 Cr. O 4(aq) ****************************************************************1 7 -)İnsan kanındaki alkol (C 2 H 5 OH) seviyesi, kan plazmasının Cr 2 O 72 -(aq) ile Asit ortamda titrasyonu ile bulunur. 8 Cr 6+2 O 72 -(aq)+ 3 C 4 -2 H 5 OH(aq) + 76 H+ (± 48 e-) → 16 Cr 3+(aq)+ 6 C 4+O 2(g)+ 47 H 2 O (denkleşmemiş - denkleşmiş) 28 g plazma için 35, 46 m. L 0, 06 M Cr 2 O 72 - çözeltisi sarf edildiğine göre, kandaki alkolün %kütlesi nedir? ➨CEVAP: m. Et. Al=0, 06*25, 46*10 -3*(3/8)*46*(100/28) =5, 46*10 -3=0, 094 %Et. Al 8/ Cr 6+2 O 72 -(aq)+ 14 H+ +6 e- → 2 Cr 3+(aq)+ 7 H 2 O 8 Cr 6+2 O 72 -(aq)+ 3 C 4 -2 H 5 OH(aq) + 76 H+ (± 48 e-) → 16 Cr 3+(aq)+ 6 C 4+O 2(g)+ 47 H 2 O 3/ C 4 -2 H 5 OH(aq -16 e- → 2 C 4+O 2(g) + 12 H+ **************************************************************** 18 -)Ca(OH)2(k) + 2 HCI(aq) Ca. Cl 2(aq) + H 2 O(s) tepkimesi veriliyor, 421 m. L 0, 467 M HCI(aq) çözeltisi 10 g Ca(OH)2 ile rx verdiğinde 8, 42 g Ca. Cl 2 elde edilmiştir ( HCl=36, 5 g/mol, Ca(OH)2=74 g/mol, Ca. Cl 2=111 g/mol). a) Sınırlayıcı bileşeni, b)Kuramsal, c)Gerçek, d) Yüzde verimi bulunuz, e) rx sonra hangi maddeden ne kadar artmıştır? ➨CEVAP: Ca(OH)2(k) (74 g/n) + 2 HCI(aq) (2*36, 5) Ca. Cl 2(aq) (111 g/n) + H 2 O(s) 10 g/74 g/n=0, 135 n 0, 421 L* 0, 467 M=0, 197 n 8, 42 g /111 g/n=0, 076 n a) Sınırlayıcı rf (reaktif=bileşen) HCIaq b) Kuramsal (teo. )Verim (0, 197/2)n*111 g/n=10, 9335 g c)Gerçek Verim 8, 42 g /111 g/n=0, 076 n d)Yüzde Verimi 8, 42 g/10, 9335 g = 0, 076/(0, 197/2) =0, 77 ➪ %77 e) rx’dan sonra Ortamda artan madde Ca(OH)2(k) 0, 135 -(0, 197/2)=0, 0365 n ➪ *74=2, 701 g

19 - % 92. 5 Na. OH ve % 7. 5 Ca. O içeren katı karışımdan 0. 239 g alınıp suda çözülerek HCl(aq) çözeltisi ile titre edildiğinde indikatörün dönümü 45. 6 m. L HCl(aq) sarfiyatında oluyor. HCl(aq) molaritesi nedir? ➨CEVAP: nt=[OH]-Na. OH (=0, 235*0, 925/40 = 0, 00543 mol) + [OH]-Ca. O(=0, 235*0, 075*2 / 56 = 0, 00048 mol) =0, 00591 [HCl] = 0, 00591 mol OH- * 1 mol HCl / 1 mol OH - * 1/ 0, 0456 L = 0, 130 M HCl **************************************************************************** 20 - A) % 20 HCl (aq) (d=1, 1 g/m. L) B) % 40 KOH (aq) (d= 1, 42 g/ml) A ve B den eşit ağırlıkta karıştırıldığında oluşan tepkimeyi yazınız. Tepkimeden evvel ve sonra karışımdaki madde miktarlarını Molarite olarak belirtiniz. Rx’dan sonraki karışım çözeltinin kütlece yüzdesini tepkimede artan maddeye göre bulunuz. Çözeltinin p. H=? Kütle numaraları H=1 , O=16 , Cl = 35, 5 , K=39. . g/mol ➨CEVAP: HCl (100*0, 2/36, 5=0, 548 mol) + KOH (100*0, 4/56=0, 714 mol) ➔ KCl + H 2 O rx’dan sonra ortamdaki artan maddeler [OH-]= 0, 166 mol / (100/1, 1 + 100/ 1, 42=161, 333. 10 -3 L ) =1, 029= [KOH] p. OH=0, 01 p. H=13, 99 [KCl] = [Cl-]=0, 548/0, 161333=3, 397 [K+] =3, 397+1, 029=4, 426 M %KOH=1, 029*5, 6=5, 762 **************************************************************************** 21 - (07. Yaz. V 1) %98, 5 K 2 Cr 2 O 7 (294 g/n) içeren 62, 5 g numune %30 HCl(aq)(d=1, 15 g/cc)’in 325 m. L ile rx’dan kaç g Cl 2(g) oluştuğunu rx yazıp denleştirerek bulunuz. (Atom Kütleleri H=1, O=16, Cl=35, 5, K=39, Cr=52…g/n) ➨CEVAP: K 2 Cr 2 O 7 + 14 HCl (aq) ➔ 2 KCl(aq)+ 2 Cr. Cl 3(aq) + 3 Cl 2(g) + 7 H 2 O (62, 5*0, 98) / 294=0, 21 n (325*1, 15*0, 3)/36, 5=3, 082 n ➪ 0, 21 n K 2 Cr 2 O 7 x 14=2, 94 n HCl gerekir. HCl fazladır ve sınırlayıcı bileşen K 2 Cr 2 O 7 olup K 2 Cr 2 O 7’nin mol miktarına göre çıkan Cl 2(g) miktarı=0, 21 x(3/1)x 71 = 44, 73 g. dır.

KONU: 17’de ÇÖZÜLMESİ TAVSİYE EDİLEN SORULAR Öncelikle konu içinde verilmiş olan 1 adedi çözülmüş 2 adedi çözülecek örnek sorular üzerinde titizlikle durulması tavsiye edilir. Sınav soruları genellikle onlardan seçilecektir. Konunun daha iyi anlaşılması açısından konunun sonunda yer alan aşağıdaki sorulara da bakılırsa iyi olur. 9 -12 -14 -17 -19 -31 -35 -3941 -45 -49 -51 -57 -61 -65 -69 -71 -73 -75 - 83 -105 -106
 Genel kimya petrucci harwood herring
Genel kimya petrucci harwood herring Kuantum sayıları çıkmış sorular
Kuantum sayıları çıkmış sorular Alan petrucci
Alan petrucci Petrucci
Petrucci Petrucci
Petrucci Organik kimya adlandırma öncelik sırası
Organik kimya adlandırma öncelik sırası Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Doug harwood
Doug harwood Hawthorne araştırmaları sonuçları
Hawthorne araştırmaları sonuçları Crusher hire harwood
Crusher hire harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Gwen harwood selected poems
Gwen harwood selected poems Joe harwood
Joe harwood Leigh harwood
Leigh harwood Bromlu suyun rengini giderenler
Bromlu suyun rengini giderenler Sikloalkin
Sikloalkin Alkan alken alkin kaynama noktası sıralaması
Alkan alken alkin kaynama noktası sıralaması Sabun ve deterjan kimya
Sabun ve deterjan kimya Halojenasyon
Halojenasyon Avogadro hipotezi
Avogadro hipotezi Organik kimya izomerlik
Organik kimya izomerlik Molekülerite tepkime derecesi
Molekülerite tepkime derecesi Gksel
Gksel Artan madde problemleri
Artan madde problemleri Normal koşullar
Normal koşullar Li2s sistematik adı
Li2s sistematik adı Ersa kimya
Ersa kimya Can kimya
Can kimya Trihidrojen mono nitrür formülü
Trihidrojen mono nitrür formülü Aromatik kimya
Aromatik kimya Kovalent bağ
Kovalent bağ Organik kimya solomon ders notları
Organik kimya solomon ders notları 2al(k) + 6hcl(suda) →2alcl3(suda) + 3h2(g)
2al(k) + 6hcl(suda) →2alcl3(suda) + 3h2(g) Kavitasyon korozyonu
Kavitasyon korozyonu Entalpi değişimi formülü
Entalpi değişimi formülü Organik kir nedir
Organik kir nedir Analitik yöntem örnekleri
Analitik yöntem örnekleri Bürete
Bürete Gaz kanunları
Gaz kanunları çevreye zararlı işareti
çevreye zararlı işareti Element modeli
Element modeli Anot kabına su eklemek
Anot kabına su eklemek Anlamlı rakamlar kimya
Anlamlı rakamlar kimya Froma kimya
Froma kimya Froma kimya
Froma kimya Ber kimya
Ber kimya Terahertz spectroscopy principles and applications
Terahertz spectroscopy principles and applications Sport management principles and applications
Sport management principles and applications Principles and applications of electrical engineering
Principles and applications of electrical engineering Principles and applications of electrical engineering
Principles and applications of electrical engineering