General Chemistry Principles and Modern Applications Petrucci Harwood











![Oktahedral Kristallerde yarılma [Mn. F 6]3 - Kompleksi 3+ d 4 yapısı 25 Mn Oktahedral Kristallerde yarılma [Mn. F 6]3 - Kompleksi 3+ d 4 yapısı 25 Mn](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-19.jpg)



![İZOMERİZASYON 1 -)İonizasyon İzomerisi [Cr. SO 4(NH 3)5]Cl [Cr. Cl(NH 3)5]SO 4 pentaaminsulfatochromium(III) chloride İZOMERİZASYON 1 -)İonizasyon İzomerisi [Cr. SO 4(NH 3)5]Cl [Cr. Cl(NH 3)5]SO 4 pentaaminsulfatochromium(III) chloride](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-25.jpg)






![Aşağıdaki komplekslerden hangisinin Kol değeri en büyüktür ve neden? [Co(NH 3)6]3+, [Co(en)3]3+, [Co(H 2 Aşağıdaki komplekslerden hangisinin Kol değeri en büyüktür ve neden? [Co(NH 3)6]3+, [Co(en)3]3+, [Co(H 2](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-35.jpg)
![Aşağıdakilerden hangisi Brønsted-Lowry asidi olarak etki eder neden? [Cu(NH 3)4]+2(aq) , [Fe. Cl 4]- Aşağıdakilerden hangisi Brønsted-Lowry asidi olarak etki eder neden? [Cu(NH 3)4]+2(aq) , [Fe. Cl 4]-](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-36.jpg)

- Slides: 37

General Chemistry Principles and Modern Applications Petrucci • Harwood • Herring 8 th Edition Konu 25: Philip Dutton KOORDİNASYON BİLEŞİKLERİ University of Windsor, Canada N 9 B 3 P 4 Prentice-Hall © 2002 ⇄ ⇌ ‾ + ÷ ↑↓ ↕ | ǁ |│║ │∫∑ √ ∛ ∜ ≤ ≥ ~ ∞ ≡ ≈ Δ∇ δ π σ υ λ α β γ Ў ψ μ t τ ζ Ψ Ω θ Χ ε φ ω η ō Ō ½ ¼ ¾ ¼ ½ ¾ ΔGo , ΔSo , ΔHo 30. 11. 2020 01: 55 Prentice-Hall © GK-II Konu : 25 Slide 1 of 47

25. KONU İÇİNDEKİLER 25 -1 Werner’in Koordinasyon Bileşikleri Kuramı 985 25 -2 Ligantlar 988 25 -3 Adlandırma 990 25 -4 İzomeri 992 25 -5 Kompleks İyonlarda Bağlanma: Kristal Alan Kuramı 998 25 -6 Koordinasyon Bileşiklerinin Manyetik Özellikleri 1002 25 -7 Renk ve Komplekslerin Renkleri 1004 25 -8 Kompleks İyon içeren Dengeler 1007 25 -9 Kompleks İyonların Asit-Baz Tepkimeleri 1009 25 -10 Bazı Kinetik Olgular 1010 25 -6 Koordinasyon Kimyasının Uygulamaları 1011 Özel Konu Mücevher Taşlarının Rengi 1016 30. 11. 2020 01: 55 Prentice-Hall © GK-II Konu : 25 Slide 2 of 47

Koordinasyon Kimyası Tavsiye Edilen Kitaplar Türkçe H. Ölmez, V. T. Yılmaz, Anorganik Kimya, Ondokuz Mayıs Üniversitesi, Samsun N. K. Tunalı, S. Özkar, Anorganik Kimya, Gazi Üniversitesi Yayınevi B Çetinkaya, Kavramlarla Anorganik Kimya, İnönü Üniversitesi Fen-Ed. Fak. Yayınları Çeviri D. F. Shriver, P. W. Atkins, C. H. Langford, Inorganic Chemistry, Oxford Chemistry, G. L. Miessler, D. A. Tarr, Inorganic Chemistry, Prentice. Hall, İngilizce C. E. Housecroft, A. G. Sharpe, Inorganic Chemistry, 1 st Ed, Prentice. Hall, 2001 J. E. Huheey, E. A. Keiter, R. L. Keiter, Inorganic Chemistry, 4 th Ed. , Harper. Collins, 1993 30. 11. 2020 01: 55 GK-II Konu : 25 3

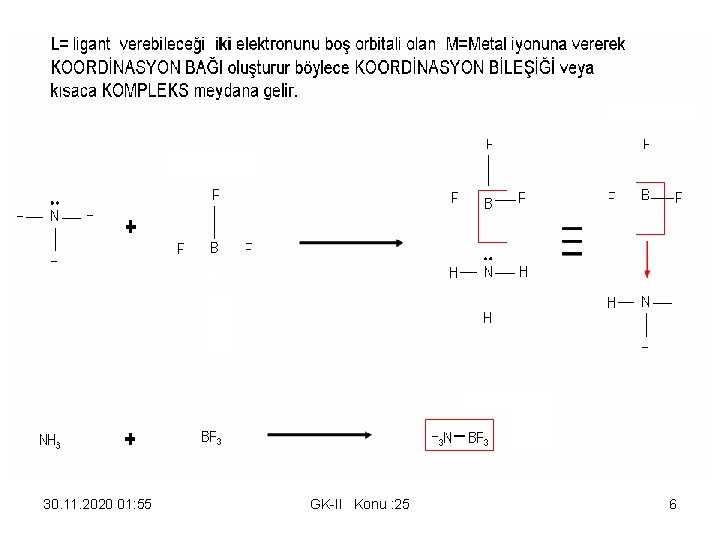
KOORDİNASYON KİMYASI M=Merkez Atom-L= Ligantlar ve Koordinasyon Bileşiklerinin Oluşumu M=METAL iyonu (é alıcı olup boş orbitali vardır), L= LİGANT , é verici olup üzerinde kolayca verebileceği 1 (veya daha fazla) çift é vardır ve bu é’ları M’e vererek KOORDİNASYON BAĞI oluşturur böylece KOORDİNASYON BİLEŞİĞİ veya kısaca KOMPLEKS meydana gelir. Koordinasyon bileşiklerinin çoğu renkli, paramanyetik, katalitik özelliktedir. Koordinasyon bileşikleri veya Kopleksler genel olarak gösterilebilir. [M+m L-n ]m-n Ag. Cl(k) + 2 : NH 3 (aq) [H 3 N – Ag – NH 3]+ Cl- 30. 11. 2020 01: 55 GK-II Konu : 25 4

Geçiş metali nedir? d- veya f- değerlik elektronuna sahip elementler, d-blok veya f-blok metalleri d-blok: geçiş elementleri f-blok: İç geçiş elementleri 30. 11. 2020 01: 55 GK-II Konu : 25 5

30. 11. 2020 01: 55 GK-II Konu : 25 6

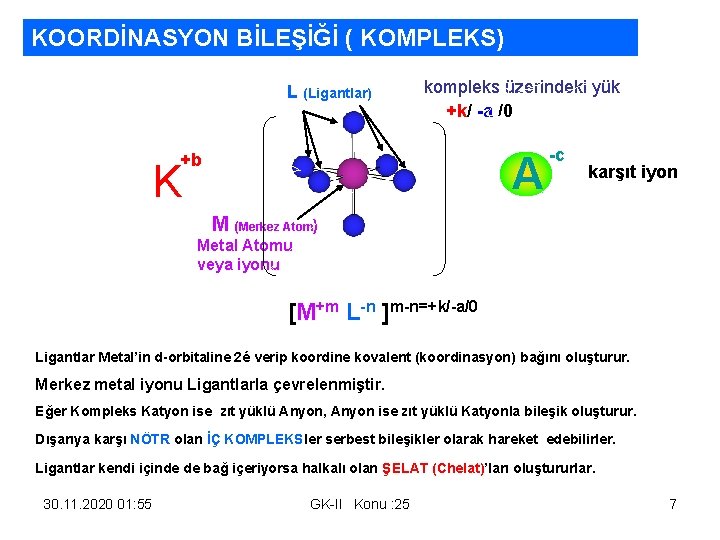
KOORDİNASYON BİLEŞİĞİ ( KOMPLEKS) L (Ligantlar) kompleks üzerindeki yük +k/ -a /0 A +b K -c karşıt iyon n M (Merkez Atom) Metal Atomu veya iyonu [M+m L-n ]m-n=+k/-a/0 Ligantlar Metal’in d-orbitaline 2é verip koordine kovalent (koordinasyon) bağını oluşturur. Merkez metal iyonu Ligantlarla çevrelenmiştir. Eğer Kompleks Katyon ise zıt yüklü Anyon, Anyon ise zıt yüklü Katyonla bileşik oluşturur. Dışarıya karşı NÖTR olan İÇ KOMPLEKSler serbest bileşikler olarak hareket edebilirler. Ligantlar kendi içinde de bağ içeriyorsa halkalı olan ŞELAT (Chelat)’ları oluştururlar. 30. 11. 2020 01: 55 GK-II Konu : 25 7

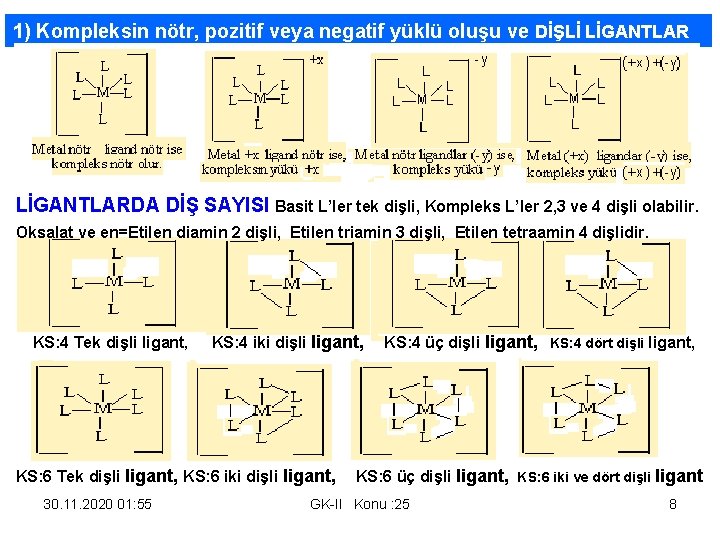
1) Kompleksin nötr, pozitif veya negatif yüklü oluşu ve DİŞLİ LİGANTLARDA DİŞ SAYISI Basit L’ler tek dişli, Kompleks L’ler 2, 3 ve 4 dişli olabilir. Oksalat ve en=Etilen diamin 2 dişli, Etilen triamin 3 dişli, Etilen tetraamin 4 dişlidir. KS: 4 Tek dişli ligant, KS: 4 iki dişli ligant, KS: 4 üç dişli ligant, KS: 4 dört dişli ligant, KS: 6 Tek dişli ligant, KS: 6 iki dişli ligant, KS: 6 üç dişli ligant, KS: 6 iki ve dört dişli ligant 30. 11. 2020 01: 55 GK-II Konu : 25 8

2) Kompleks oluşumlarında renk değişikliği gözlenir. Örneğin: Co. Cl 3. 6 NH 3 sarı, Co. Cl 3. 5 NH 3 mor, Co. Cl 3. 4 NH 3 yeşil, Co. Cl 3. 5 NH 3. H 2 O kırmızı, Cr. Cl 3. 6 NH 3 beyaz renklidirler. 30. 11. 2020 01: 56 GK-II Konu : 25 9

3) İletkenlikleri farklıdır. Werner teorisine göre her elementin 2 tip değerliği vardır. Bunlar ; a) Birincil değerlik ( yükseltgenme basamağı) b) İkincil değerlik (koordinasyon sayısı) Her element birincil ve ikincil değerliliğini doyurmak ister. İkincil değerlik dolayısıyla kompleksler uzayda belirli bir yönlenme oluştururlar. A kompleksinde (Co. Cl 3. 6 NH 3) Co’ın ligandlar tarafından aşağıdaki şekilde sarıldığı ve klorların daha uzak pozisyonlarda yerleştiği ileri sürülür. Ag. NO 3 ile tepkimeye sokulursa ve iletkenliği ölçülürse 4 iyon iletkenliği ölçülür. A B Kompleksinde ise (Co. Cl 3. 5 NH 3 ) aşağıdaki şekilde Co ligandlar tarafından sarılır. Bu kompleks Ag. NO 3 ile tepkimeye sokulursa ve iletkenliği ölçülürse 3 iyon iletkenliği ölçülür. Burada 2 tane klor koordinasyon küresinin dışındadır ve Ag. NO 3 ile Ag. Cl şeklinde çöker. Sonuçta iletkenlik iyon sayısı ile doğru orantılı olduğu için A kompleksi olan Co. Cl 3. 6 NH 3 daha iletkendir. B 30. 11. 2020 01: 56 GK-II Konu : 25 10

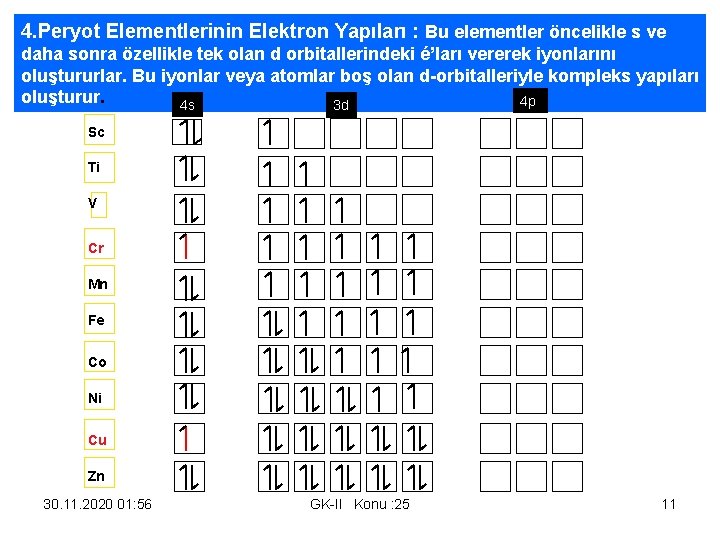
4. Peryot Elementlerinin Elektron Yapıları : Bu elementler öncelikle s ve daha sonra özellikle tek olan d orbitallerindeki é’ları vererek iyonlarını oluştururlar. Bu iyonlar veya atomlar boş olan d-orbitalleriyle kompleks yapıları oluşturur. 4 p 4 s 3 d Sc Ti V Cr Mn Fe Co Ni Cu Zn 30. 11. 2020 01: 56 GK-II Konu : 25 11

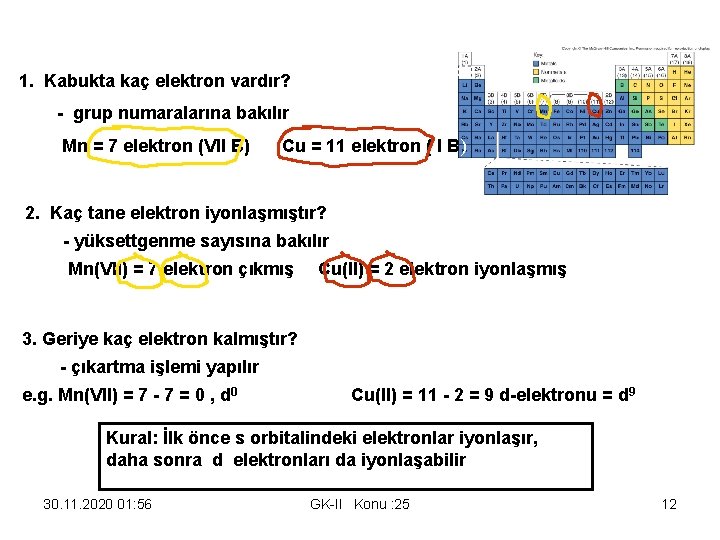
d elektron sayısının hesap edilmesi: 1. Kabukta kaç elektron vardır? - grup numaralarına bakılır Mn = 7 elektron (VII B) Cu = 11 elektron ( I B) 2. Kaç tane elektron iyonlaşmıştır? - yüksettgenme sayısına bakılır Mn(VII) = 7 elektron çıkmış Cu(II) = 2 elektron iyonlaşmış 3. Geriye kaç elektron kalmıştır? - çıkartma işlemi yapılır e. g. Mn(VII) = 7 - 7 = 0 , d 0 Cu(II) = 11 - 2 = 9 d-elektronu = d 9 Kural: İlk önce s orbitalindeki elektronlar iyonlaşır, daha sonra d elektronları da iyonlaşabilir 30. 11. 2020 01: 56 GK-II Konu : 25 12

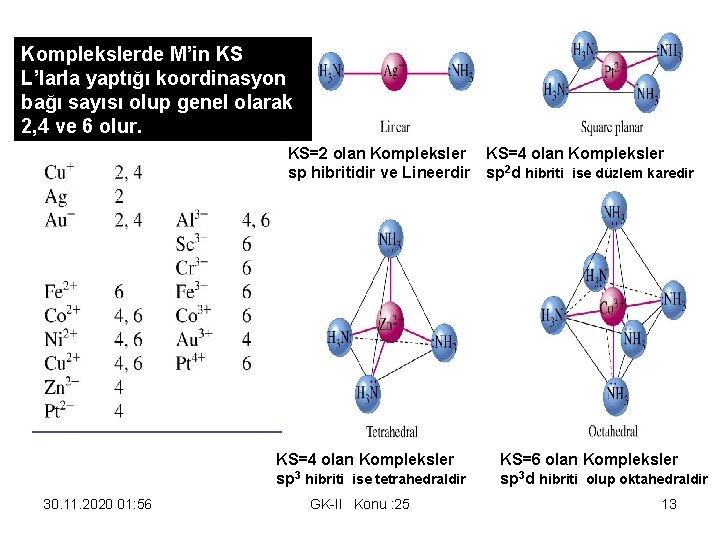
Komplekslerde M’in KS L’larla yaptığı koordinasyon bağı sayısı olup genel olarak 2, 4 ve 6 olur. KS=2 olan Kompleksler KS=4 olan Kompleksler sp hibritidir ve Lineerdir sp 2 d hibriti ise düzlem karedir KS=4 olan Kompleksler KS=6 olan Kompleksler 3 sp hibriti ise tetrahedraldir sp 3 d hibriti olup oktahedraldir 30. 11. 2020 01: 56 GK-II Konu : 25 13

02. KOORDİNASYON BİLEŞİKLERİN ADLANDIRILMASI 1) Bir kompleks içerisinde önce ligandlar daha sonra metal iyonu adlandırlır. 2) Yapıda birden fazla ligand var ise önce en pozitif L den en negatif L’a doğru yazılır, okunurken tersten okunur. Basit L sayıları mono, di, tri, tetra, penta, heksa… ön ekleriyle , kompleks ve organik L sayıları ise bis, tris, terakis, pentakis, heksakis… diye Latince sayıların sonuna -is eki takılarak okunur. 30. 11. 2020 01: 56 GK-II Konu : 25 14

3) Anyonik ligandların sonuna o eki getirilerek okuma yapılır Anyon ismi Ligand okunuşu Cl- klorür kloro Br - bromür bromo CN- syanür syano O 2 - oksit okso O 22 - peroksit perokso O 2 - süperoksit süperokso CO 32 - karbonat karbonato SO 42 - sülfat sülfato S 2 O 32 - tiyosülfat tiyosülfato (SCN)-, tiyosyanür izotiyosiyanoto (NCS) C 2 O 42 -okzalat okzalato CH 3 COO- asetat asetato NH 2 - amino Amido N 3 - azid azido SCN - tiyosiyanato NO 2 - nitrito (NO 2), izonitrito (O 2 N) NO 3 - nitrat nitrato CO (karbon monoksit) karbonil 4) Nötral ligandlar nötral moleküller gibi okunur. Etilendiamin (H 2 NCH 2 NH 2) gibi. Fakat bu duruma aykırı iki istisna vardır. H 2 O ligand olduğu zaman aqua, NH 3 ligand olduğu zaman amin adını alır. 5) Anorganik Ligandların sayısı belirtilirken mono, di, tri, tetra, penta, hekza, hepta. . ifadeleri kullanılır. Cl 3 - trikloro , (H 2 O)6 - heksa aqua gibi Organik ve kompleks ligandlar numralandırılırken bis, tris, tetrakis, pentakis, hehsakis… ifadeleri kullanılır. [Co(en)3)]2(SO 4)3 Tris(etilendiamin)kobalt(III) sülfat 6) Negatif kompleks iyonlarda metal atomun Latince veya İngilizce adının sonuna at eki konur. Al (alimünat) , Cr (kromat), Mn (manganat), Ni (nikelat), Co (cobaltat), Zn (çinkat), Mo (molibdat), Hg (merkürat), Fe (ferrat), Pb (plumbat), Cu (kuprat), 30. 11. 2020 01: 56 GK-II Konu : 25 15 Ag (Argentat), Sn (stannat)…. vs gibi.

7) Komplekteki metalin yükseltgenme basamağı metalin adından sonra parantez içerisinde romen rakamı ile yazılır. [Co(H 2 O)6]3+ heksa aquakobalt(III), 8)Önce anyonik ligandlar sonra nötr ligandlar okunur. K 3[Fe(CO)(CN)5] potasyum pentasiyanokarbonilferrat(II) gibi. Örnekler: [Ag(NH 3)2]+Cl - Diamingümüş(I)klorür M=Ag+ (KS=2) L=NH 3 Lineer Molekül K 2[Ni(CN)4]2 - Potasyum tetrasyanonikelat(II) M=Ni 2+ L=CN- KS: 4 Kare düzlem yapı K 2[Ni(Cl)4]2 - Potasyum tetrakloronikelat(II) M=Ni 2+ L=Cl- KS: 4 tetrahedral yapı [Co(NH 3)6]Br 2 Heksaminkobalt(II) bromür M=Co 2+ L=NH 3 KS: 6 oktahedral yapı [Co(en)3)]2(SO 4)3 Tris(etilendiamin)kobalt(III) sülfat KS: 6 Oktahedral kompleks [Pt(NH 3)2(NO 2)Cl]CO 3 Kloro nitrito diamin platin(IV) karbonat KS: 4 Kare yapı [Pd(H 2 O)2(ONO)2 I 2] Diiyodo dinitrito diakua palladyum(IV) KS: 6 oktahedral NH 4[Cr(SCN)4(NO)2] Amonyum dinitrozil tetrakis(tiyosiyanato)kromat(III) KS: 6 Na 3[Cr. OF 4] Sodyum tetraflorooksokromat(III) KS: 6 oktahedral yapı K 3[Cu(S 2 O 3)2] Potasyum bis(tiyosülfato)kübrat(I) KS: 4 tetrahedral yapı [Co(NH 3)5(N 3)] SO 4 Azido. Pentaaminkobalt(III) sülfat KS: 6 oktahedral yapı NH 4[Cr(NH 3)2(SCN)4] Amonyumtetrakis(tiyosiyanato)diaminkromat(III) KS: 6 Na 2[Fe(CN)5 NO] Sodyum nitrozilpentasiyanoferrit(III) KS: 6 oktahedral yapı Fe 4[Fe(CN)6]3 Ferri heksasiyano ferrat(II) (Berlin Mavisi) KS: 6 oktahedral yapı Fe 3[Fe(CN)6]2 Ferro heksasiyano ferrit(III) (Trunbull Mavisi) KS: 6 oktahedral yapı K [Al(C 2 O 4)2] potasyum bisokzalatoalimünat (III) KS: 4 Tetrahedral yapı 30. 11. 2020 01: 56 GK-II Konu : 25 16

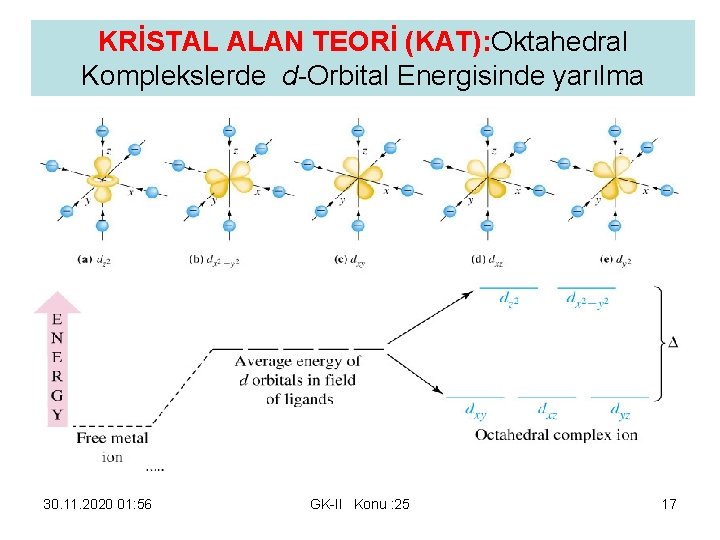
KRİSTAL ALAN TEORİ (KAT): Oktahedral Komplekslerde d-Orbital Energisinde yarılma 30. 11. 2020 01: 56 GK-II Konu : 25 17

LİGANT ALAN TEORİ (LAT) KUVVETLİ ALAN LİGANTLARI CN- > NO 2 - > en > py >NH 3 > EDTA 4 - > SCN- ZAYIF ALAN LİGANTLARI H 2 O > ONO- > ox 2 - > OH- > F- > SCN- > Cl- > Br- > I[Fe. F 6]4 - Kompleksi High Spin 2+ d 6 yapısı Zayıf Alan 26 Fe Low Spin d 5 yapısı [Fe(CN)6]3 - yapısı Fe [Ar]3 d 6. 4 s 2 Fe 3+ [Ar]3 d 5 Kuv. Alan Komp. High Spin d 8 yapısı [Ni. Cl 4]2 - yapısı Ni [Ar]3 d 8. 4 s 2 Ni 2+ [Ar]3 d 8 Zayıf Alan Komp. Low Spin d 8 yapısı [Ni(CN)4]2 - yapısı Ni [Ar]3 d 8. 4 s 2 Ni 2+ [Ar]3 d 8 Kuv. Alan Komp. Tetrahedral yapıda ve Düzlem Kare yapılarda d 8 yapılarında elektron dağılımları 18
![Oktahedral Kristallerde yarılma Mn F 63 Kompleksi 3 d 4 yapısı 25 Mn Oktahedral Kristallerde yarılma [Mn. F 6]3 - Kompleksi 3+ d 4 yapısı 25 Mn](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-19.jpg)
Oktahedral Kristallerde yarılma [Mn. F 6]3 - Kompleksi 3+ d 4 yapısı 25 Mn [Mn(CN)6]3 - Kompleksi P Δ Δ High Spin Kompleks Hali (Zayıf Alan Ligantlarıyla) Δ < P high spin d 4 hali Low Spin Kompleks (Kuvvetli Alan Ligantlarıyla) Δ > P low spin d 4 Δ < P high spin d 4 hali [Fe. F 6]4 - Kompleksi High-Spin 2+ d 6 yapısı Zayıf Alan 26 Fe [Fe(CN)6]4 - Kompleksi 2+ d 6 yapısı Kuvvetli Alan 26 Fe 19

Kristal Alan Teo. e göre Tetrahedral Kristallerde d-orbitali yarılması Kristal Alan Teo. e göre Düzlem Kare Kristallerde d-orbitali yarılması 30. 11. 2020 01: 56 GK-II Konu : 25 20

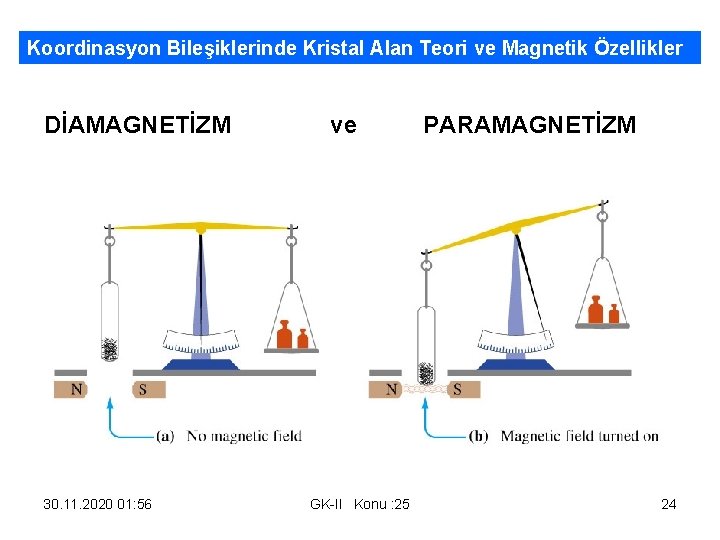
Manyetik Özellikler • 1 -DİAMANYETİK ÖZELLİK: – Atom, molekül veya iyonlara ait Orbitallerdeki tüm é’lar eşleşmiş yani çift haldedir ve bunlar birbirlerinin manyetik etkilerini yok ederler. – Diyamanyetik maddeler manyetik alandan çok az etkilenir ve alandan kaçar gibi hareket ederler. Yani alan tarafından sanki itilirler. μ=0 dır. • 2 -PARAMANYETİK ÖZELLİK : – Atom, molekül veya iyonlara ait Orbitallerdeki bazı é’lar tek yani eşleşmemiş haldedir ve bunların manyetik etkileri vardır buda bunların manyetik alan tarafından çekilmesine neden olur. Tek é sayısı ne kadar çoksa bu çekim okadar kuvvetli olur. Bir atomun Spin Manyetik Momentumu μ = √ t 2+2 t BM (Bohr Manyeton) t=tek é sayısı – Örnek: μNa = √ 12+2 x 1= √ 3=1, 73 BM , μMg = √ 22+2 x 2= √ 8=2, 83 BM 3 - FERROMANYETİK Özellik Fe grubu (8 B) de görülür kendileri de mıknatıs olabilen maddelerdir. Manyetik Alan tarafından kuvvetle çekilir alan kalktığı zamanda yönlenmiş spinli bölgeler oluşmasıyla bu tür maddelerde mıknatıslık devam eder. 30. 11. 2020 01: 56 Prentice-Hall © GK-II Konu : 25 Slide 21 of 50 21

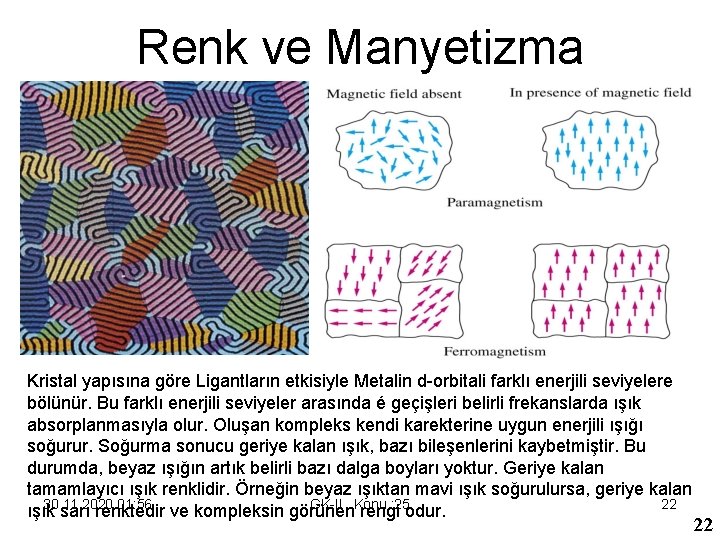
Renk ve Manyetizma Kristal yapısına göre Ligantların etkisiyle Metalin d-orbitali farklı enerjili seviyelere bölünür. Bu farklı enerjili seviyeler arasında é geçişleri belirli frekanslarda ışık absorplanmasıyla olur. Oluşan kompleks kendi karekterine uygun enerjili ışığı soğurur. Soğurma sonucu geriye kalan ışık, bazı bileşenlerini kaybetmiştir. Bu durumda, beyaz ışığın artık belirli bazı dalga boyları yoktur. Geriye kalan tamamlayıcı ışık renklidir. Örneğin beyaz ışıktan mavi ışık soğurulursa, geriye kalan 30. 11. 2020 01: 56 GK-II Konu : 25 22 ışık sarı renktedir ve kompleksin görünen rengi odur. 22

Paramanyetizma ve Diamanyetizma Paramanyetik maddelerde SPİN MANYETİK MOMENTUMU μ=√t 2+2. t μMn=√ 52+2 x 5= √ 35=5, 92 BM=μMn 2+ μMn 3+= √ 42+2 x 4= √ 24=4, 9 BM DİAMANYETİZMA Mn 7+ = [Ar] = 1 s 2. 2 s 22 p 6. 3 s 23 p 6 Diamanyetik maddelerde tüm orbitaller é’larla tam doludur ve μ=0 dır. Diamanyetik maddelerde Spin Manyetik Momentumu μ=√t 2+2. t = 0 30. 11. 2020 01: 56 Prentice-Hall © GK-II Konu : 25 dır. Slide 23 of 50 23

Koordinasyon Bileşiklerinde Kristal Alan Teori ve Magnetik Özellikler DİAMAGNETİZM ve PARAMAGNETİZM 30. 11. 2020 01: 56 GK-II Konu : 25 24
![İZOMERİZASYON 1 İonizasyon İzomerisi Cr SO 4NH 35Cl Cr ClNH 35SO 4 pentaaminsulfatochromiumIII chloride İZOMERİZASYON 1 -)İonizasyon İzomerisi [Cr. SO 4(NH 3)5]Cl [Cr. Cl(NH 3)5]SO 4 pentaaminsulfatochromium(III) chloride](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-25.jpg)
İZOMERİZASYON 1 -)İonizasyon İzomerisi [Cr. SO 4(NH 3)5]Cl [Cr. Cl(NH 3)5]SO 4 pentaaminsulfatochromium(III) chloride pentaaminchlorochromium(III) sulfate 2 -) Koordinasyon İzomerisi [Co(NH 3)6][Cr. CN 6] hexaaminecobalt(III) hexacyanochromate(III) [Cr(NH 3)6][Co. CN 6] hexaaminechromium(III) hexacyanocobaltate(III) 3 -Bağlanma İzomerisi 30. 11. 2020 01: 56 GK-II Konu : 25 25

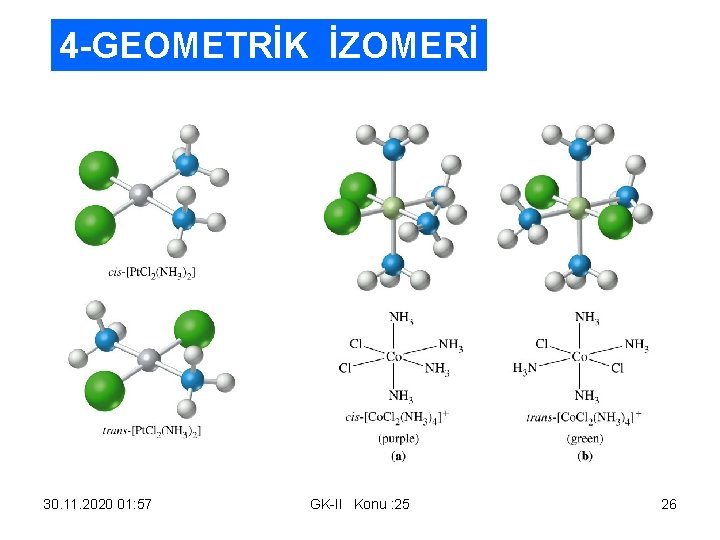
4 -GEOMETRİK İZOMERİ 30. 11. 2020 01: 57 GK-II Konu : 25 26

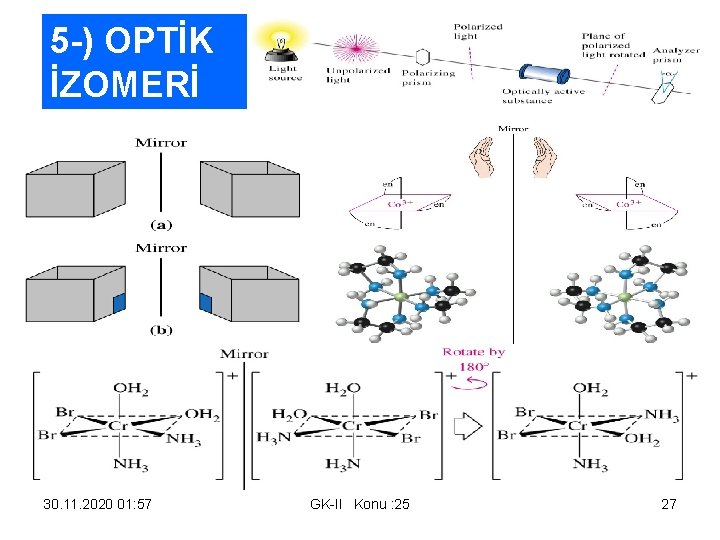
5 -) OPTİK İZOMERİ 30. 11. 2020 01: 57 GK-II Konu : 25 27

SORULAR VE CEVAPLARI - S 1)M=Cr 3+ olan iki NH 3 ve dört Cl içeren kompleksin formülü, adı, KS ve geometrik yapısı nedir? C: [Cr(NH 3)2 Cl 4]- diamintetraklorokromat(III) iyonu KS: 6 olup oktahedral yapıdadır. ************************************************ S 2)Katyonu NH 4+ M=Fe 2+ L= CN- olan kompleksin formülü, adı, KS ve yapısı nedir? C: (NH 4)+4 [Fe(CN)6]-4 Amonyumheksasiyonoferrat(III) KS: 6 Oktahedral yapıdadır. ********************************************** S 3)2 kompleksden oluşan bir koordinasyon bileşiğinde. Birincinin M= Cr 3+’ün L=etilendiamin (en) KS: 6 dır ve ikincinin ise M=Ni 2+’nin L=CN- ve KS=4 dir. Formülünü ve adını yazıp yapılarını belirtiniz. . C: [Cr(en)3]2[Ni(CN)4]3 tris(etilendiamin)krom(III) tetrasiyanonikel(II) kompleksi 1. kompleks KS: 6 oktahedraldir, 2. Kompleks KS: 4 Düzlem Kare yapılıdır. ********************************************** Aşağıda formülü verilen kompleks iyonları adlandırınız. KS ve geometrik yapılarını belirtiniz. (a) [Ag. I 2]- (a) diiyodogümüş(I) iyonu KS: 2 Lineer Yapı (b) [Al(H 2 O)3 (OH)]2+ (b) hidroksotriaquaaluminyum(III) iyonu KS: 4 Tetrahedral yapı (c) [Ni(CN)4]2 - (c) tetrasiyononikelat(II) iyonu KS: 4 Düzlem Kare yapıdadır. (d) [Pt(en)2]2+ (d) bis(etilendiamin)platin(II) iyonu KS: 4 Düzlem Kare yapıdadır (e) [Co(NH 3)4 (NO 2) Cl]+(e) kloronitrito-N-teraminkobalt(III) iyonu KS: 6 Oktahedral yapı (f) [Ag(CN)2]- (f) disiyanoarjentat(I) iyonu KS: 2 Lineer Yapı (g) Pt(NH 3)3 (NO 2)]+ (g) triaminnitrito-N-platin(II) iyonu KS: 4 Düzlem Kare yapıdadır (h) [Pd (en)2(H 2 O)2 Cl]+3 (h) klorodiaquabis(etilendiamin)Palladyum(IV) iyonu KS: 6 Oktahedral y (ı) K 4[Cr(CN)6] (ı) potasyumheksasiyanokromat(II) KS: 6 Oktahedral yapı 30. 11. 2020 01: 57 GK-II Konu : 25 28

SORULAR VE CEVAPLARI Formülü verilen komplekslerin ismini, Merkez Atomunu ve Ligantını, KS’nı, ve geometrik yapısını belirtiniz. a)[Co(NH ) ] 2+, b)[Al. F ] 3 -, c) [Cu(CN) ] 2 -, 3 6 6 4 d) [Cr(NH 3)4 Br 2]+, e)[Co(ox)3]4 -, f) [Au(S 2 O 3)2]-, g) [Au. Cl 4]-, h) g) [Pt. Cl 4]- CEVAPLAR : a) Heksaminkobalt(II) katyonu M=Co+2, olup, L=NH 3, KS=6 olup Oktahedral yapıdadır. b) Heksafloroaluminat(III) anyonu M=Al+3, L=F- KS=6 olup, Oktahedral yapıdadır. c) Tetrasiyonokübrat(II) anyonu M=Cu+2 L=CN- KS=4 olup, Tetrahedral yapıdadır. d) Dibromo. Tetraaminkrom(III) katyonu M=Cr+3 L=NH 3 ve Br - KS=6 Oktahedral yapı e) Trisoksalatokobaltat(II) anyonu M=Co+2 L=C 2 O 42 -(iki dişli ox=oksalat) KS=6 oktahedral f) Bistiyosülfatoaurat(III) anyonu M = Au+3 L=S 2 O 32 - (tiyosülfat) KS=4 Kare düzlem yapı g) Tetrakloroaurat(III) anyonu M = Au+3 L=Cl- KS=4 Kare düzlem yapı h) Tetrakloro. Platinat (II) anyonu M = Au+3 L=Cl- KS=4 Kare düzlem yapı 30. 11. 2020 01: 57 GK-II Konu : 25 29

SORULAR ve CEVAPLARI • SORU: Aşağıdaki terim ve simgeleri tanımlayınız. a)koordinasyon sayısı (b)amin kompleksi c)enantiyomer • CEVAP : (a)bir kompleksin koordinasyon sayısı, merkez metal iyonuna bağlanan ligand atomlarının sayısını ifade eder. Eğer bütün ligandlar tek dişli ise, koordinasyon sayısı doğrudan merkez metal iyonuna bağlanan ligand sayısına eşittir. • (b)amin kompleksi, amonyum molekül veya moleküllerinin ligand olarak kullanıldığı komplekslerdir. • (c)iki optik izomerin her biri enantiyomerdir; formülleri ve bağlanmaları aynı olup ayna görüntüleri üste çakıştırılamazlar *********************************************SORU : SORU: Aşağıda formülü verilen bileşiklerde kaç tür izomeri vardır? İzomeri olası değilse belirtiniz. (a)[Zn(NH 3)][Cu. Cl 4] b)[Fe(CN)5 SCN]4 - c)[Ni. Cl(NH 3)5]+ (d)[Pt. Br. Cl 2(py)]- e)[Cr(OH)3(NH 3)3]CEVAP (a) Koordinasyon izomeri gösterir. Diğer izomer ise [Cu(NH 3)4][Zn. Cl 4]’dir. (b) Bağlanma izomeri gösterir. Diğer izomer ise [Fe(CN)5 NCS]4 -’dir. (c) İzomeri yoktur. (d) Kompleks kare düzlem olduğundan geometrik izomeri gösterir. (e) cis- ve trans- izomerler olarak adlandırılan 2 Geometrik izomeri vardır. 30. 11. 2020 01: 57 GK-II Konu : 25 30

• Aşağıdaki tekdişli ligandlar için Lewis yapısını yazınız. (a)H 2 O a) 2 x 1+6=8 değerlik elektronu veya 4 çifte sahiptir. H-O-H (b)ONO- (b)2 x 6+5+1=18 değerlik elektronu veya 9 çifte sahiptir. • • Yapıda 1 - yük olması oksijenin N’a tek bağla bağlandığını gösterir. |O-N=O- (c) |S=C=N|- (c) 6+4+5+1=16 değerlik elektronu veya 8 çifte sahiptir. Bu yapıdaki N üzerinde 1 - yük vardır. SORU (a)Dörtyüzlü (b)kare düzlem c)doğrusal yapılı bir kompleks iyonda cis ve trans izomeri bekler misiniz? Açıklayınız. CEVAP (a) Düzgün dörtyüzlü yapıda bütün ligandlar birbirinden aynı açısal • • mesafeyle ayrıldıklarından, cis-trans izomerlik oluşmaz. Bir ligand diğerine göre merkez atomunun diğer tarafında bulunamaz. (b)Kare düzlem yapılar cis-trans izomerliği gösterebilir. (c)Doğrusal yapılarda iki ligandı merkez atomuna bağlamanın bir tek yolu olduğundan, cis-trans izomerlik gözlenmez. 30. 11. 2020 01: 57 GK-II Konu : 25 31

KRİSTAL ALAN KURAMI pek çok geçiş metali bileşiğinin rengini nasıl açıklar. Kristal alan kuramında merkez geçiş metal iyonunun 5 tane d-orbitali farklı enerjili iki veya daha fazla gruba bölünür. Bu gruplar arasındaki enerji farklı sıklıkta görünür ışığın bir fotonunun enerjisine karşılık gelir. Böylece kompleks iyonu bu boşluğa karşılık gelen enerji ışığı soğurur. Eğer kompleks iyon üzerine beyaz ışık düşürülürse, soğurma sonucu geriye kalan ışık, bazı bileşenleri kaybedecektir. Bu durumda, önceki beyaz ışıkta artık belirli bazı dalga boyları(soğurulan enerjilere karşılık gelen) bulunmayacaktır. Oluşan ışık renklidir. Örneğin, beyaz ışıktan mavi ışık soğurulursa, geriye kalan ışık sarı renktedir. 30. 11. 2020 01: 57 GK-II Konu : 25 32

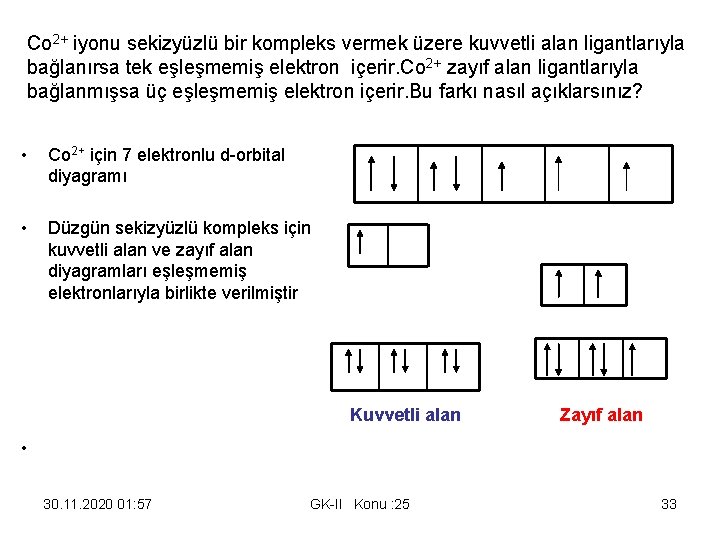
Co 2+ iyonu sekizyüzlü bir kompleks vermek üzere kuvvetli alan ligantlarıyla bağlanırsa tek eşleşmemiş elektron içerir. Co 2+ zayıf alan ligantlarıyla bağlanmışsa üç eşleşmemiş elektron içerir. Bu farkı nasıl açıklarsınız? • Co 2+ için 7 elektronlu d-orbital diyagramı • Düzgün sekizyüzlü kompleks için kuvvetli alan ve zayıf alan diyagramları eşleşmemiş elektronlarıyla birlikte verilmiştir Kuvvetli alan • Zayıf alan 30. 11. 2020 01: 57 GK-II Konu : 25 33

Aşağıdaki gözlemleri açıklayan eşitlikleri yazınız. (a) Mg(OH)2(k) ve Zn(OH)2(k) karışımları NH 3 ile etkinleştiriliyor. Zn(OH)2(k) çözünüyor fakat Mg(OH)2(k) geride kalıyor. (b) Na. OH(aq) Cu. SO’a ilave edildiğinde açık mavi renkli bir çökelek oluşuyor. NH 3 ilave edildiğinde, koyu mavi bir çökelek vermek üzere çökelek yeniden çözünüyor. Bu koyu mavi çözelti HNO 3(aq) ile asitlendirilince, renk açık maviye döner. • (a) Zn(OH)2(k) + 4 NH 3(aq) ⇄[Zn(NH 3)4]+2(aq) + 2 OH-(aq) • (b) Cu+2(aq) + 2 OH- ⇄ Cu(OH)2(k) Burada Mavi renk oluşan • [Cu(H 2 O)4] +2(aq) kompleksden kaynaklanmaktadır. • Cu(OH)2(k)+ 4 NH 3(aq) ⇄[Cu(NH 3)4]+2(aq) koyu mavi kompleks +2 OH-(aq) • [Cu(NH 3)4]+2(aq) + 4 H 3 O+(aq) ⇄ [Cu(H 2 O)4] +2(aq) +4 NH 4+(aq) 30. 11. 2020 01: 57 GK-II Konu : 25 34
![Aşağıdaki komplekslerden hangisinin Kol değeri en büyüktür ve neden CoNH 363 Coen33 CoH 2 Aşağıdaki komplekslerden hangisinin Kol değeri en büyüktür ve neden? [Co(NH 3)6]3+, [Co(en)3]3+, [Co(H 2](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-35.jpg)
Aşağıdaki komplekslerden hangisinin Kol değeri en büyüktür ve neden? [Co(NH 3)6]3+, [Co(en)3]3+, [Co(H 2 O)6]3+, [Co(H 2 O)4(en)]3+ • [Co(en)3]3+ en büyük ortalama Kol değerine sahip olmalıdır. Çok dişli ligandların oluşturduğu kompleks iyonların oluşum sabitleri, tek dişli ligandlarla olanlardan daha büyüktür. Bu kelat olayının bir ifadesidir. Çok dişli bir ligandın bir ucu merkez atoma bağlandıktan sonra, geriye kalan elektron çiftleri merkez metale zaten yakınlaşmış olduklarından bağlanmaları daha kolay olur(çözelti içerisinde belirli bir noktadan göç etmek zorunda değildir). 30. 11. 2020 01: 57 GK-II Konu : 25 35
![Aşağıdakilerden hangisi BrønstedLowry asidi olarak etki eder neden CuNH 342aq Fe Cl 4 Aşağıdakilerden hangisi Brønsted-Lowry asidi olarak etki eder neden? [Cu(NH 3)4]+2(aq) , [Fe. Cl 4]-](https://slidetodoc.com/presentation_image_h/c1f214fc9f7c409c68e9567546619eed/image-36.jpg)
Aşağıdakilerden hangisi Brønsted-Lowry asidi olarak etki eder neden? [Cu(NH 3)4]+2(aq) , [Fe. Cl 4]- , [Al(H 2 O]6]3+ , [Zn(OH)4]2 - [Al(H 2 O]6]3+(aq) ortama H+ verebilir. Bundan dolayı Brønsted -Lowry asidi olarak etki eder [Al(H 2 O]6]3+(aq)+H 2 O(s) ⇄[Al. OH(H 2 O)5]2+(aq)+H 3 O+(aq) İyonlaşma sabiti (p. Ka=5, 01) asetik asidinkine yakındır. 30. 11. 2020 01: 57 GK-II Konu : 25 36

KONU: 25’de ÇÖZÜLMESİ TAVSİYE EDİLEN SORULAR Öncelikle konu içinde verilmiş olan 1 adedi çözülmüş 2 adedi çözülecek örnek sorular üzerinde titizlikle durulması tavsiye edilir. Sınav soruları genellikle onlardan seçilmeye çalışılacaktır. Konunun daha iyi anlaşılması açısından konunun sonunda yer alan aşağıdaki sorulara da bakılırsa iyi olur. 2 -5 -6 -7 -11 -15 -17 -22 -29 -3137 -43 -49 -54 -59 -65 -67 -69 11/30/2020 1: 57 AMPrentice-Hall © GK-II Konu : 25 Slide 37 of 51
 Kısmi basınç
Kısmi basınç General chemistry ders notları
General chemistry ders notları Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Alan petrucci
Alan petrucci Petrucci
Petrucci Petrucci
Petrucci Doug harwood
Doug harwood Hawthorne araştırmaları
Hawthorne araştırmaları Crusher hire harwood
Crusher hire harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Gwen harwood selected poems
Gwen harwood selected poems Joe harwood
Joe harwood Leigh harwood
Leigh harwood Plastic scintillators: chemistry and applications
Plastic scintillators: chemistry and applications Terahertz spectroscopy principles and applications
Terahertz spectroscopy principles and applications Sport management principles and applications
Sport management principles and applications Principles and applications of electrical engineering
Principles and applications of electrical engineering Electrical engineering
Electrical engineering Learning principles and applications
Learning principles and applications 25 m/s
25 m/s Applications of nuclear chemistry
Applications of nuclear chemistry Uses of smart and modern materials
Uses of smart and modern materials Chapter 9 review stoichiometry
Chapter 9 review stoichiometry Chemical formulas and chemical compounds chapter 7 review
Chemical formulas and chemical compounds chapter 7 review Modern chemistry chapter 15 review answers
Modern chemistry chapter 15 review answers Modern chemistry chapter 14 review answers
Modern chemistry chapter 14 review answers Chapter 13 review ions in aqueous solutions
Chapter 13 review ions in aqueous solutions Chapter 12 review solutions answer key
Chapter 12 review solutions answer key Modern chemistry chapter 4
Modern chemistry chapter 4 Modern chemistry solutions
Modern chemistry solutions Ib chemistry functional groups
Ib chemistry functional groups Organic vs inorganic chemistry
Organic vs inorganic chemistry Principles of network applications in computer networks
Principles of network applications in computer networks Principles of network applications
Principles of network applications Purchasing and receiving
Purchasing and receiving General chemistry with qualitative analysis
General chemistry with qualitative analysis General chemistry thermochemistry
General chemistry thermochemistry General chemistry nomenclature
General chemistry nomenclature