General Chemistry Principles and Modern Applications Petrucci Harwood
















- Slides: 26

General Chemistry Principles and Modern Applications Petrucci • Harwood • Herring 8 th Edition KONU 20: İSTEMLİ DEĞİŞİMLER Entropi ve Serbest Enerji Philip Dutton University of Windsor, Canada N 9 B 3 P 4 Prentice-Hall © 2002 ⇄ ⇌ ⇅ ↑↓│║ ∫ ∑ ≠ ± ≡ ÷ ∑ Å ∞ ~ ≈ √ ∛ ∜ Ў ⊽ ν ƒ α γ β λ δ σ ρ б Δ υ π ∂ ψ τ μ η φ Ψ Φ χ ө ε Ω ¼ ½ ¾ E=h. ν= h. c/λ=h. c. Ў ΔHool J/g. o. C cal/g. o. C, ΔGo , ΔSo , ΔHo 2. 11. 2020 13: 48 GK-I I K. 20 1/26

İÇİNDEKİLER 20 20. 1 20. 2 20. 3 20. 4 20. 5 20. 6 20. 7 20. 8 İSTEMLİ DEĞİŞİMLER ENTROPİ VE SERBEST ENERJİ 782 İSTEMLİLİK: KENDİLİĞİNDEN OLAN DEĞİŞMENİN ANLAMI 783 ENTROPİ KAVRAMI 784 ENTROPİNİN VE ENTROPİ DEĞİŞİMİNİN BELİRLENMESİ 789 İstemli Değişme Ölçütleri TERMO DİNAMİĞİN 2. YASASI 793 STANDART SERBEST ENERJİ DEĞİŞİMİ ΔG 0 797 ΔG 0 SERBEST ENERJİ DEĞİŞİMİ VE DENGE 798 ΔG 0 VE K’NIN SICAKLIKLA DEĞİŞİMİ 808 ÇİFTLENİMLİ TEPKİMELER 811 ÖZEL KONU. Biyolojik Sistemlerde Çiftlenimli Tepkimeler 812 ⇄ ⇌ ⇅ ↑↓│║ ∫ ∑ ≠ ± ≡ ÷ ∑ Å ∞ ~ ≈ √ ∛ ∜ Ў ⊽ ν ƒ α γ β λ δ σ ρ б Δ υ π ∂ ψ τ μ η φ Ψ Φ χ ө ε Ω ¼ ½ ¾ E=h. ν= h. c/λ=h. c. Ў ΔHool J/g. o. C cal/g. o. C, ΔGo , ΔSo , ΔHo GK-I I K. 20 2

20. 1 İSTEMLİLİK : KENDİLİĞİNDEN OLAN DEĞİŞMENİN ANLAMI 783 4 Fe(k) + 3 O 2(g) → 2 Fe 2 O 3(k) H 2 O(k) H 2 O(s) Demirin paslanması oda sıcaklığında buzun erimesi kurmalı bir oyuncağın kurulduğu zaman hareket etmesi kendiliğinden olan (İSTEMLİ) olaylardır. İstemsiz Olay dışardan bir etki olmadan oluşamaz. Berthelot ve J. Thomsen ENTALPİNİN AZALDIĞI ΔHo < O olduğu yani sistem tarafından ısı verilen EKSOTERM OLAYLARIN daha istemli oluştuğunu ifade etmişler se de, sıvıların buharlaşması, katının EN üzerinde erimesi, çözünme, dağılma olayları buna ters oluşan istemli olaylardır. Ohalde sadece entalpi azalması ile istemlilik izah edilemez. GK-I I K. 20 3

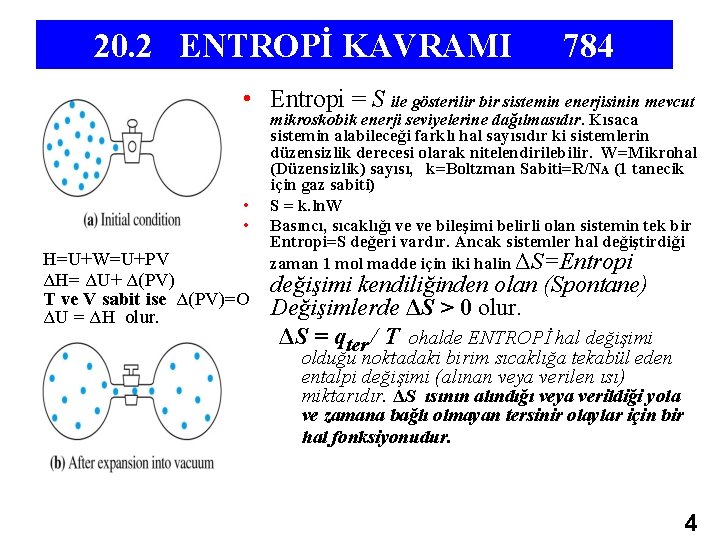
20. 2 ENTROPİ KAVRAMI 784 • Entropi = S ile gösterilir bir sistemin enerjisinin mevcut • • H=U+W=U+PV ΔH= ΔU+ Δ(PV) T ve V sabit ise Δ(PV)=O ΔU = ΔH olur. mikroskobik enerji seviyelerine dağılmasıdır. Kısaca sistemin alabileceği farklı hal sayısıdır ki sistemlerin düzensizlik derecesi olarak nitelendirilebilir. W=Mikrohal (Düzensizlik) sayısı, k=Boltzman Sabiti=R/NA (1 tanecik için gaz sabiti) S = k. ln. W Basıncı, sıcaklığı ve ve bileşimi belirli olan sistemin tek bir Entropi=S değeri vardır. Ancak sistemler hal değiştirdiği zaman 1 mol madde için iki halin ΔS=Entropi değişimi kendiliğinden olan (Spontane) Değişimlerde ΔS > 0 olur. ΔS = qter / T ohalde ENTROPİ hal değişimi olduğu noktadaki birim sıcaklığa tekabül eden entalpi değişimi (alınan veya verilen ısı) miktarıdır. ΔS ısının alındığı veya verildiği yola ve zamana bağlı olmayan tersinir olaylar için bir hal fonksiyonudur. 4

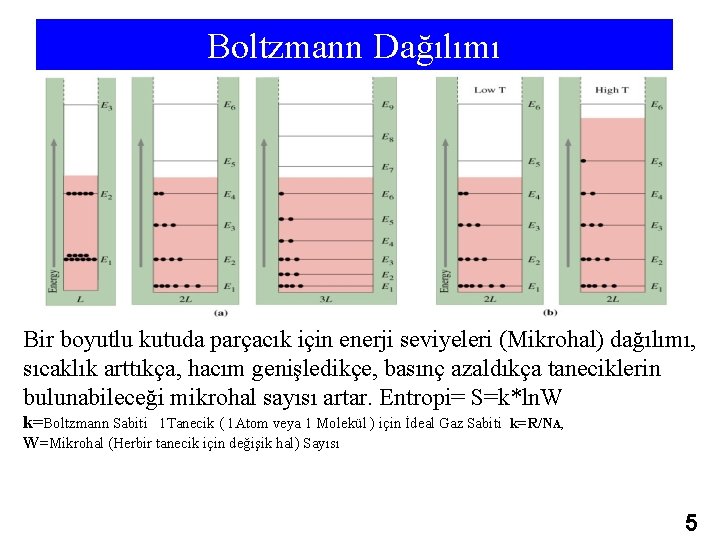
Boltzmann Dağılımı Bir boyutlu kutuda parçacık için enerji seviyeleri (Mikrohal) dağılımı, sıcaklık arttıkça, hacım genişledikçe, basınç azaldıkça taneciklerin bulunabileceği mikrohal sayısı artar. Entropi= S=k*ln. W k=Boltzmann Sabiti 1 Tanecik ( 1 Atom veya 1 Molekül ) için İdeal Gaz Sabiti k=R/NA, W=Mikrohal (Herbir tanecik için değişik hal) Sayısı 5

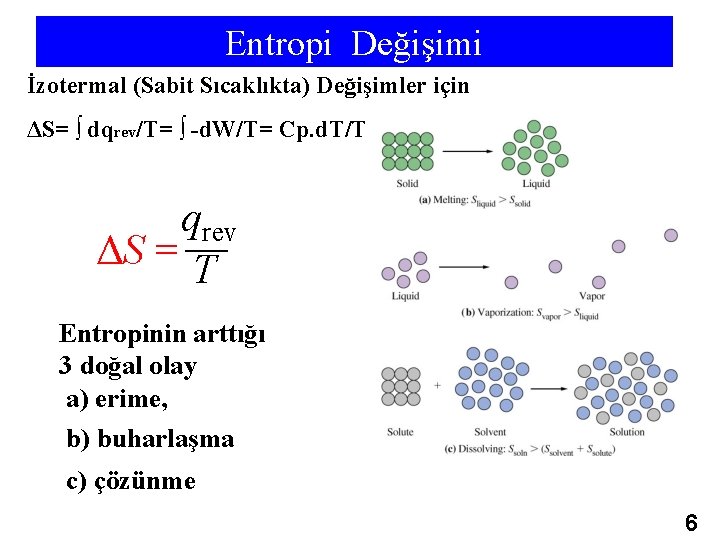
Entropi Değişimi İzotermal (Sabit Sıcaklıkta) Değişimler için ΔS= ∫ dqrev/T= ∫ -d. W/T= Cp. d. T/T qrev ΔS = T Entropinin arttığı 3 doğal olay a) erime, b) buharlaşma c) çözünme 6

Kimyasal Tepkimelerde Tahmini Entropi Değişimi 789 ΔSgaz> ΔSaq< ΔSsıvı> ΔSkatı olduğundan rx. lar için Δngaz veya Δnsıvı ile bir tahmin yapılabilir. ÖRNEK 20 -1 **Amonyum nitrat (gübre ve patlayıcı) bozunması: NH 4 NO 3 (k) 2 N 2(g) + 4 H 2 O (g) + O 2 (g) Sadece gazlar için Δngaz = ∑ ng. ürün - ∑ ng. reaktif = 7 -0>0 dan ΔS >0 olur. Entropi artar. **H 2 SO 4 üretiminde 2 SO 2(g) + O 2(g) 2 SO 3(g) oluşumu Δn= 2 -3= -1<0 olup ΔS <0 olur ve Entropi azalır **Şeker Ekstraksiyonunda C 12 H 22 O 11(aq) C 12 H 22 O 11(k) Δn= -1<0, ΔS <0 olur ve Entropi azalır. ** Su Gazı Oluşumu C(k) +H 2 O(g) Δ CO (g) + H 2 (g) Δn= 2 -1= 1>0, ΔS >0 olur ve Entropi Artar. ** Su Gazı Dönüşümü CO (g) +H 2 O (g) CO 2 (g) + H 2 (g) Δn= 2 -2= 0 olup Entropi belirsizdir. 7

**Fosil yakıtlardan SO 2 uzaklaştırma (Claus İşlemi) : 2 H 2 S (g) + SO 2 (g) 3 S(k) + 2 H 2 O (g) Δn= 2 -3= -1<0 olup Entropi azalır. **Hg. O bozunması Hg. O (k) Hg (s) + 1/2 O 2 (g) Δn= 1/2 > 0 ENTROPİ ARTAR. ** Ag Ayrılması Zn (k) + Ag 2 O (k) Zn. O (k) + 2 Ag (k) Δn= 0 olup Entropi belirsizdir. ** 2 Cl-(aq) +2 H 2 O (s) (Elektroliz) 2 OH-(aq) + H 2 (g) + Cl 2 (g) Δn= 4 -2=2 > 0, ΔS >0 olur. S=Entropi değeri H ve U’dan kolayca belirlenemediği için, yukarda rx. larda basit olarak tahmin edilmeye çalışıldı, ancak yanlız başına ΔS <0, ΔS >0, ΔS=0 olması rx. ların istemli olup olmadığının belirlenmesinde yeterli değildir. Ancak bir fikir verir. 8

20. 3 FAZ DEĞİŞİMLERİNDE ENTROPİ DEĞİŞİMİNİN BELİRLENMESİ 790 Suyun Oo. C de buz halinden sıvı hale geçerken ki ΔSerime =Erime ENTROPİ Değ. H 2 O(k, 1 atm) H 2 O(s, 1 atm) (qözerime=334, 5 J/g=80 cal/g) ΔHerime° =(334, 5*18=) 6, 02 k. J , 273 K ΔS=ΔH/T ΔSerime=6, 02/273 = 0, 022 k. J/n. K = 22 J/n. K (Jeb) ΔSerime= 22/4, 18=5, 26 cal/n. K (ceb) • Suyun KN=100 o. Cde sıvı halden buhar haline geçerken (qözbuh=2255 J/g=540 cal/g) olduğuna göre ΔH=? ΔE= ? Pbuh= ? ΔSbuh= ? (Jeb) ve (ceb) • Suyun ΔH=540*18= 9720 cal/g ΔE= ΔH-w = 9720 – p. Δ(Vbuh-Vsıvı) = 9720 – (0, 082*373 -0, 018)*24, 24 = 9720 -742 = 8978 cal Hg =1 Atm Pbuh= 760 mm- ΔSbuh= (2255*18=) 40 582 / (100+273=) 373 = 108, 8 J/n. K (Jeb) ΔSbuh= (540*18=) 9720/373=26 cal/n. K (ceb) 9

ETİL ALKOL ve BENZEN qözbuh. ΔSbuh Etil. Alkol KNEt. Al =78, 6 o. C Mw=46 g/n (qözbuh=856 J/g=204, 6 cal/g) ΔSbuh= (856*46=) 39376 / (78, 6+273=) 351, 6 = 112 J/n. K ΔSbuh= (204, 6*46=) 9412/ (78, 6+273=) 351, 6 =26, 8 cal/n. K BENZEN KNbenzen =80, 3 o. C Mw=78 g/n (qözbuh=394 J/g=95 cal/g) ΔSbuh= 95*78 / 273+80, 3 = 20, 97 cal/n. K Sbuh= 394*78/ 273+80, 3 = 86, 99 J/n. K 2. 11. 2020 13: 48 GK-I I K. 20 10/26

Trouton KURALI ΔSbuh = ΔHbuh/TKN ≈ 87 J/n. K ≈ 21 cal/n. K SORU- KN=35 o. C olan sıvının qÖz Buh. ısısı= 87, 4 cal/g ölçülmüştür ≈Mw =? CEVAP: 87, 4*Mw / (273+35) ≈ 21 fen Mw=74 g/n SORU (ÖRNEK ≈ 20 -2): KN: -30 o. C olan Soğutma Gazı (Karbon Klor Florür= CCl. F 2)’ün q özbuh=247 J/g ölçülmüştür Mw=? Cevap: 247*Mw/243 ≈87 den Mw=85, 6 g/n SORU (ÖRNEK 20 -3) : 2 NO(g) + O 2(g) 2 NO 2(g) S 210, 8 CEVAP 205, 1 ΔSrx=? 240, 1 J/n. K ΔSrx= ∑ üS. ürün - ∑ r. Sreaktif = (2*240, 1) - (2*210, 8 + 205, 1) = - 146, 5 J/n. K 11

İstemli Değişme Ölçütleri TERMODİNAMİĞİN 2. YASASI • TERMODİNAMİĞİN 2. KANUNU • ΔStop = ΔSevren = ΔS. sistem +ΔSçevre>0 • Evrende entropi dengesi kolayca olabilen istemli değişimlerde artma şeklinde gözlenir. • ΔSgaz> ΔSsıvı> ΔSkatı olduğuna göre EN altında maddelerin kendiliğinden donması ve KN altında buharın yoğunlaşması, kırağılaşma gibi olaylar • ΔSçev artışı, ΔSsis’deki azalıştan fazla olmasındandır. Hem ΔSsis hem ΔSçev ARTIYORSA değişim kesinlikle İSTEMLİdir, her ikisi de azalıyorsa istemsiz olur. 12

TERMODİNAMİĞİN 3. KANUNU • TERMODİNAMİĞİN 3. KANUNU. • Tüm kristal saf maddelerin 0 o K =MUTLAK SIFIR NOKTASINDA ENTROPİLERİ SIFIRDIR. (The entropy of a pure perfect crystal at is zero. ) • So =Standard molar entropi=25 o. C =298 o. K de maddenin entropisidir, cetvellerle verilir ve bir rx için ΔSo hal fonksiyonu özelliğinden faydalanılarak bu değerlerden hesaplanır. ΔS°rx = [∑ ü S°(ürünler) - ∑ r S°(reaktanlar] 13

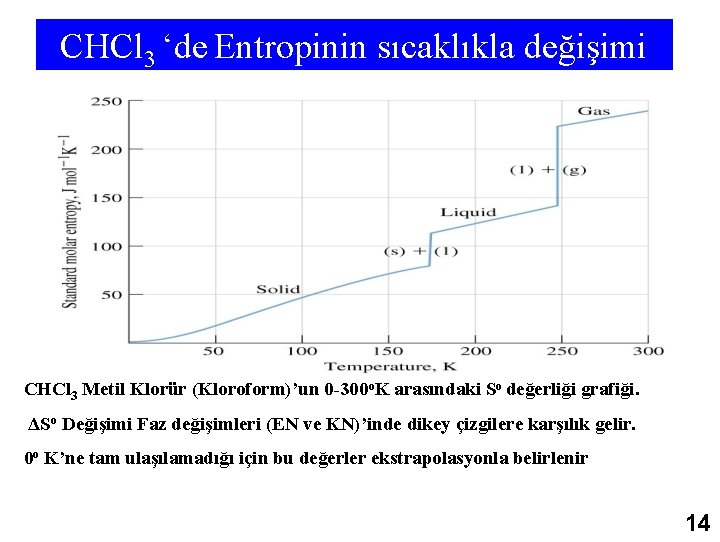
CHCl 3 ‘de Entropinin sıcaklıkla değişimi CHCl 3 Metil Klorür (Kloroform)’un 0 -300 o. K arasındaki So değerliği grafiği. ΔSo Değişimi Faz değişimleri (EN ve KN)’inde dikey çizgilere karşılık gelir. 0 o K’ne tam ulaşılamadığı için bu değerler ekstrapolasyonla belirlenir 14

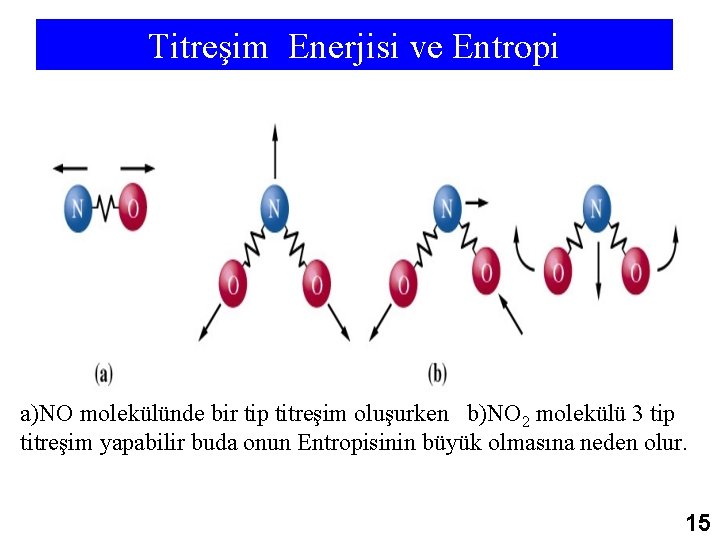
Titreşim Enerjisi ve Entropi a)NO molekülünde bir tip titreşim oluşurken b)NO 2 molekülü 3 tip titreşim yapabilir buda onun Entropisinin büyük olmasına neden olur. 15

STANDART SERBEST ENERJİ DEĞİŞİMİ ΔG 0 797 qçevre = -qp = -ΔHsis olduğunda T. ΔSevren = T. ΔSsis – ΔHsis = - ( -ΔHsis – T. ΔSsis) T. ΔSevren= ΔHsistem – T. ΔSsistem G = H – T. S ➨ ΔG = ΔH – T. ΔS = - T. ΔSevren olur. Burada, ΔGrx° = [∑ ü ΔGol°(ürünler) - ∑ r ΔGol°(reaktanlar)] ΔG < 0 ise değişim İSTEMLİ ΔG > 0 ise değişim İSTEMSİZ ΔG = 0 ise sistem DENGEdedir. 16

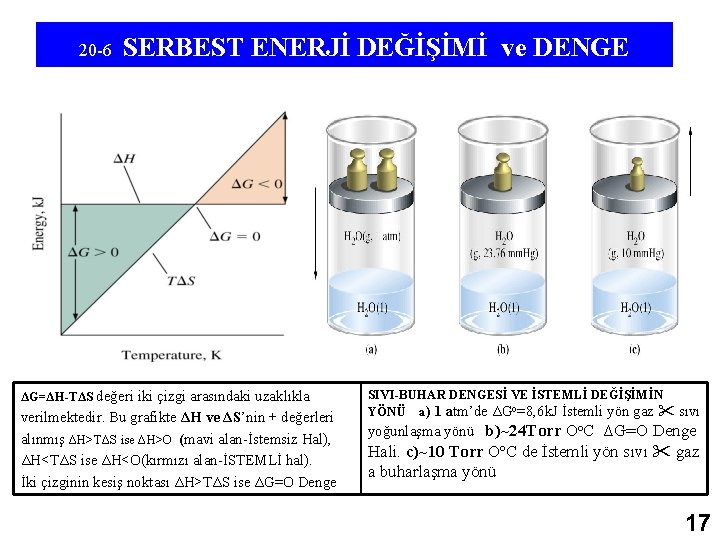
20 -6 SERBEST ENERJİ DEĞİŞİMİ ve DENGE ΔG=ΔH-TΔS değeri iki çizgi arasındaki uzaklıkla verilmektedir. Bu grafikte ΔH ve ΔS’nin + değerleri alınmış ΔH>TΔS ise ΔH>O (mavi alan-İstemsiz Hal), ΔH<TΔS ise ΔH<O(kırmızı alan-İSTEMLİ hal). İki çizginin kesiş noktası ΔH>TΔS ise ΔG=O Denge SIVI-BUHAR DENGESİ VE İSTEMLİ DEĞİŞİMİN YÖNÜ a) 1 atm’de ΔGo=8, 6 k. J İstemli yön gaz sıvı yoğunlaşma yönü b)~24 Torr Oo. C ΔG=O Denge Hali. c)~10 Torr Oo. C de İstemli yön sıvı gaz a buharlaşma yönü 17

STANDART Olmayan Koşullarda ΔGrx=rx Ser. En. Değ. ΔG = ΔH° - TΔS ΔSrxn = ΔS°rxn + Rln ΔG = ΔH° - TΔS°rxn – TR ln PN 22 PH 3 2 2 PNH 3 2 ΔG = ΔG° + RT ln PNH 3 2 3 PN 2 PH 2 Rx Denge Halinde ise: ΔG = ΔG° + RT ln Q ΔG = ΔG° + RT ln Keq= 0 ΔG° = -RT ln Keq 18

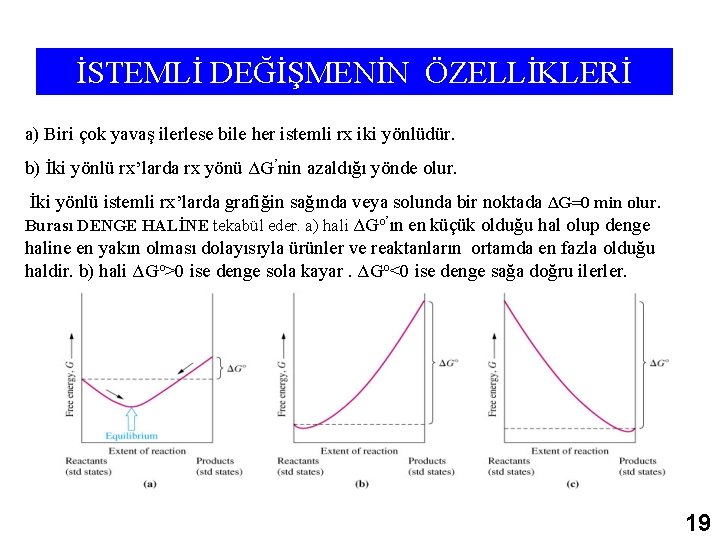
İSTEMLİ DEĞİŞMENİN ÖZELLİKLERİ a) Biri çok yavaş ilerlese bile her istemli rx iki yönlüdür. b) İki yönlü rx’larda rx yönü ΔG’nin azaldığı yönde olur. İki yönlü istemli rx’larda grafiğin sağında veya solunda bir noktada ΔG=0 min olur. Burası DENGE HALİNE tekabül eder. a) hali ΔGo’ın en küçük olduğu hal olup denge haline en yakın olması dolayısıyla ürünler ve reaktanların ortamda en fazla olduğu haldir. b) hali ΔGo>0 ise denge sola kayar. ΔGo<0 ise denge sağa doğru ilerler. 19

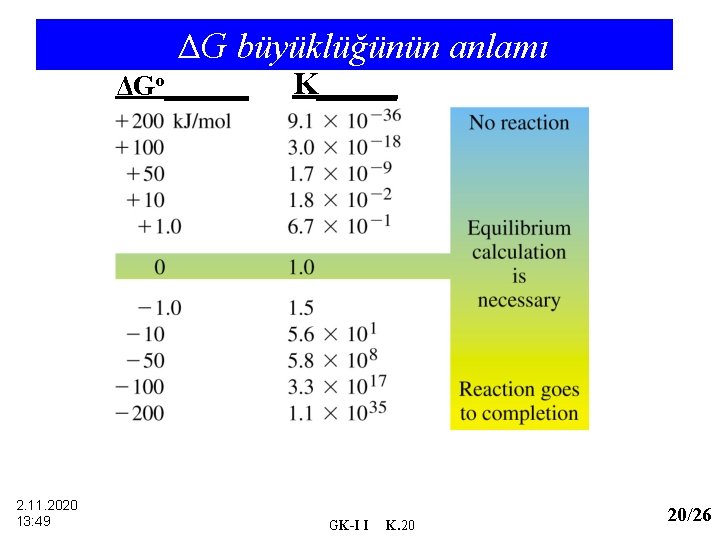
ΔG büyüklüğünün anlamı ΔGo______ 2. 11. 2020 13: 49 K_____ GK-I I K. 20 20/26

Termodinamik Denge Sabiti Aktiflikler İdeal gaz için 1. 0 bar basınçtaki STANDART HALİ referans alınır: Po=1 bar=0, 987 atm. ≈ 1 atm kabul edilebilir S=So-R. ln. P/Po=So-R. ln. P/1 PV=n. RT or P=(n/V)RT, İ. Gazlar için basınç P=a=Aktif Konsantrasyondur. Bundan dolayı çözeltiler için co=1 M hal referans kabul edildiğinde Saf katı ve sıvılar için a=1, İ. Gazlar P=1 bar , Çöz. için co=1 M alınır. Çözeltiler için S=So-R. lnc/co=So-R. lna a cinsinden hesaplandığında TERMODİNAMİK DENGE SABİTİ K=Kc=Kp=Keq ΔG= ΔGo+RTln ag. ah/aa. ab = ΔGo+RTln K Dengede ΔGo= - RTln K dır. 21

20 -7 ΔG° dan K değerinin sıcaklığa bağımlılığı VAN’T HOFF DENKLEMİ ≈ Clausius Clapeyron Denklemi ΔG° = ΔH° -TΔS° ΔG° = -RT ln K -ΔG° -ΔH° TΔS° ln K = = + RT RT RT -ΔH° ΔS° ln K = + RT R ln K 1 K 2 1 -ΔH° ΔS° -ΔH° 1 = + + = RT 1 R RT 2 R R T 1 T 2 22

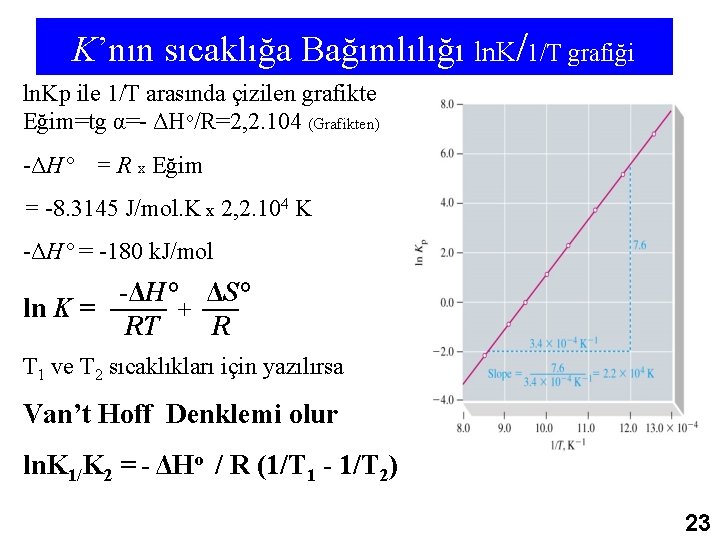
K’nın sıcaklığa Bağımlılığı ln. K/1/T grafiği ln. Kp ile 1/T arasında çizilen grafikte Eğim=tg α=- ΔHo/R=2, 2. 104 (Grafikten) -ΔH° = R x Eğim = -8. 3145 J/mol. K x 2, 2. 104 K -ΔH° = -180 k. J/mol -ΔH° ΔS° ln K = + RT R T 1 ve T 2 sıcaklıkları için yazılırsa Van’t Hoff Denklemi olur ln. K 1/K 2 = - ΔHo / R (1/T 1 - 1/T 2) 23

ÇİFTLENİMLİ REAKSİYONLAR • • İSTEMSİZ bir rx üç şekilde İSTEMLİ HALE getirilebilir. 1 -T sıcaklığı rx’nun oluşabileceği şarta ayarlanır. 2 -Uygun rx ise elektrolizle gerçekleştirilebilir. 3 -Kolay oluşabilen ΔG<0 olan bir rx ile birleştirerek (çiftlenimli yol) toplam rx ΔG<0 olan bir rx oluşturulur. ÖRNEK Cu 2 O(s) → 2 Cu(s) + ½ O 2(g) ΔG° 673 K = +125 k. J İstemsiz rx Cu 2 O(s) → 2 Cu(s) + ½ O 2(g) C(k) +1/2 O 2(g) CO(g) ΔGo = +125 k. J istemli rx ΔGo = -175 k. J istemli rx Toplam net rx : Cu 2 O(k) +C(k) Δ 2 Cu(k) +CO(g) ΔGo = -50 k. J istemli rx olur. 24

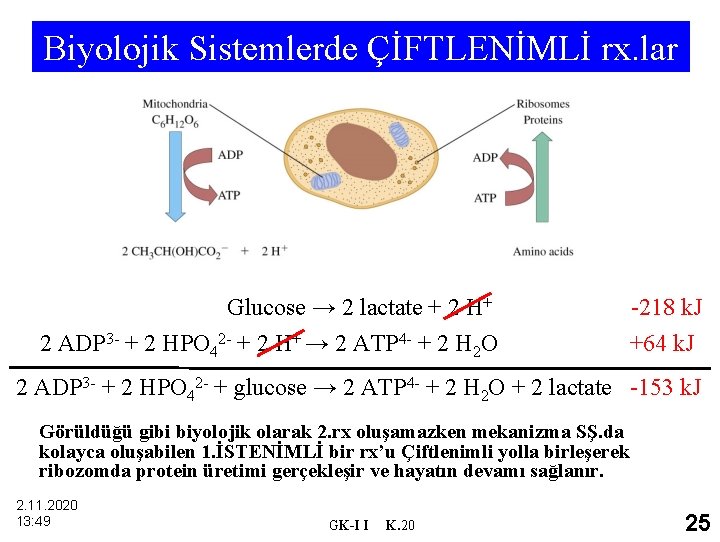
Biyolojik Sistemlerde ÇİFTLENİMLİ rx. lar Glucose → 2 lactate + 2 H+ 2 ADP 3 - + 2 HPO 42 - + 2 H+ → 2 ATP 4 - + 2 H 2 O -218 k. J +64 k. J 2 ADP 3 - + 2 HPO 42 - + glucose → 2 ATP 4 - + 2 H 2 O + 2 lactate -153 k. J Görüldüğü gibi biyolojik olarak 2. rx oluşamazken mekanizma SŞ. da kolayca oluşabilen 1. İSTENİMLİ bir rx’u Çiftlenimli yolla birleşerek ribozomda protein üretimi gerçekleşir ve hayatın devamı sağlanır. 2. 11. 2020 13: 49 GK-I I K. 20 25

KONU: 20’de ÇÖZÜLMESİ TAVSİYE EDİLEN SORULAR Sentez Gazından Biobenzin (Metanol) üretiminde 500 o. K de Kp=? ΔHool k. J/n ΔGool k. J/n CO(g) + 2 H 2(g) ⇌ CH 3 OH(g) -110, 5 -137, 2 0 0 -200, 7 -162, 0 CEVAP: ΔHorx = -200, 7 - (-110, 5)= - 90, 2 k. J ΔGorx= -162 - (-137, 2) = -24, 8 k. J SŞ daki ΔGo=-RT. ln. Kp ➪ ln. Kp= - ΔGo/RT = +24800/ 8, 31*298 = 10 ➨ Kp= 2, 2. 104 Van’t Hoff Denkleminden 500 o. K den➪ln K 1/22000= + 90200/ 8, 31(1/500 - 1/298) ➨ Kp / 22000= e -14, 7= 4. 10 -7 ➨ Kp = 9. 10 -3 Öncelikle konu içinde verilmiş olan 1 adedi çözülmüş 2 adedi çözülecek örnek sorular üzerinde titizlikle durulması tavsiye edilir KONU SONUNDA YER ALAN SORULARDAN ÖNERİLENLER : 4 - 8 - 14 - 19 - 21 - 24 - 32 - 38 - 45 - 55 - 60 - 66 - 72 - 86 - 91 - 96 2. 11. 2020 13: 49 GK-I I K. 20 26/26
 Genel kimya petrucci harwood herring
Genel kimya petrucci harwood herring Klorpentan
Klorpentan Quimica general petrucci 11 edicion pdf
Quimica general petrucci 11 edicion pdf Alan petrucci
Alan petrucci Petrucci
Petrucci Petrucci
Petrucci Doug harwood
Doug harwood Tavistock enstitüsü araştırması
Tavistock enstitüsü araştırması Crusher hire harwood
Crusher hire harwood Suburban sonnet gwen harwood
Suburban sonnet gwen harwood Gwen harwood: selected poems
Gwen harwood: selected poems Joe harwood
Joe harwood Leigh harwood
Leigh harwood Plastic scintillators: chemistry and applications
Plastic scintillators: chemistry and applications Terahertz spectroscopy principles and applications
Terahertz spectroscopy principles and applications Sport management principles and applications
Sport management principles and applications Principles and applications of electrical engineering
Principles and applications of electrical engineering Electrical engineering
Electrical engineering Learning principles and applications
Learning principles and applications Applications of nuclear chemistry
Applications of nuclear chemistry Irradiated food
Irradiated food Name the machine which is smart and modern
Name the machine which is smart and modern Chapter 9 review stoichiometry
Chapter 9 review stoichiometry Chapter 7 chemical formulas and chemical compounds
Chapter 7 chemical formulas and chemical compounds Modern chemistry chapter 15
Modern chemistry chapter 15 Chapter 14 acids and bases
Chapter 14 acids and bases Modern chemistry chapter 13
Modern chemistry chapter 13