Genel Kimya GAZLAR Gazlarn zellikleri Sv katlardan farkl





























- Slides: 44

Genel Kimya GAZLAR

Gazların Özellikleri • Sıvı katılardan farklı olarak, – – Bulundukları kabın hacmını kaplarlar. Sıkıştırılabilirler. Yoğunlukları çok azdır. Sıvılaşabilirler. Gazların sıvılaşabildiği sıcaklığa kritik sıcaklık, sıvılaşabildiği basınca kritik basınç denir. – Belirli şekil ve hacmi yoktur. – Birbirleriyle her oranda karışabilirler

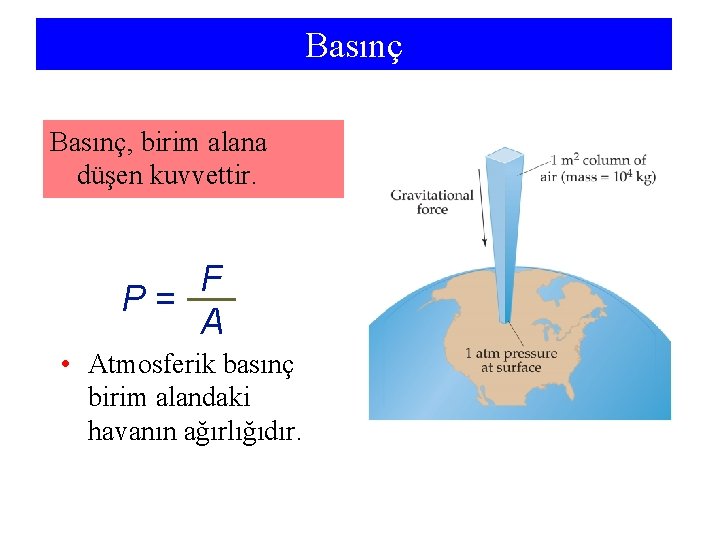
Basınç, birim alana düşen kuvvettir. F P= A • Atmosferik basınç birim alandaki havanın ağırlığıdır.

Gazların Özellikleri: Gazların Basıncı Basınç, birim alana düşen kuvvettir. • Gaz Basıncı Kuvvet (N) P (Pa) = Yüzey (m 2) Paskal, Pa; kilopaskal, k. Pa • Sıvı Basıncı P = g ·h ·d

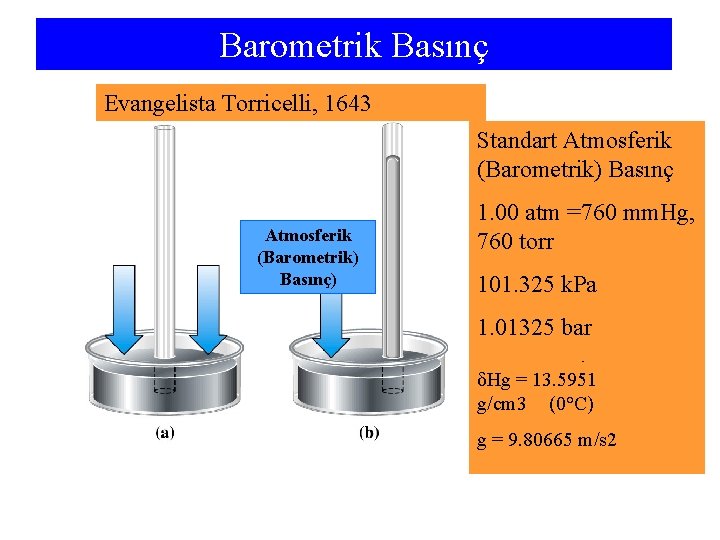
Barometrik Basınç Evangelista Torricelli, 1643 Standart Atmosferik (Barometrik) Basınç) 1. 00 atm =760 mm. Hg, 760 torr 101. 325 k. Pa 1. 01325 bar 1013. 25 mbar δHg = 13. 5951 g/cm 3 (0°C) g = 9. 80665 m/s 2

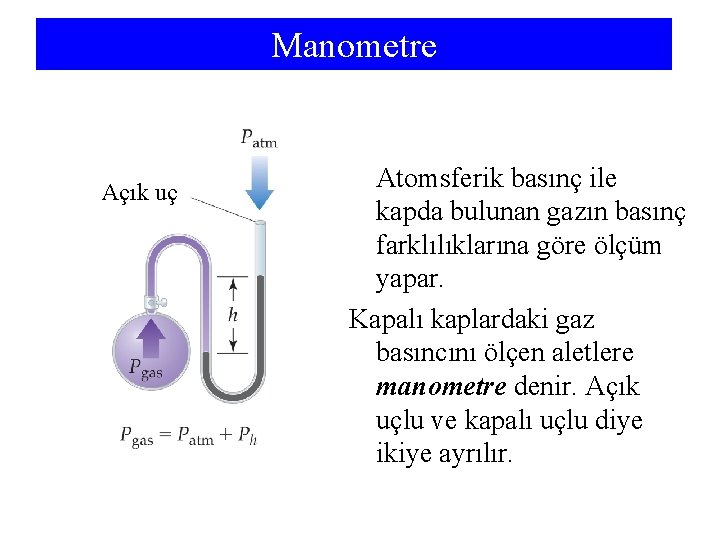
Manometre Açık uç Atomsferik basınç ile kapda bulunan gazın basınç farklılıklarına göre ölçüm yapar. Kapalı kaplardaki gaz basıncını ölçen aletlere manometre denir. Açık uçlu ve kapalı uçlu diye ikiye ayrılır.

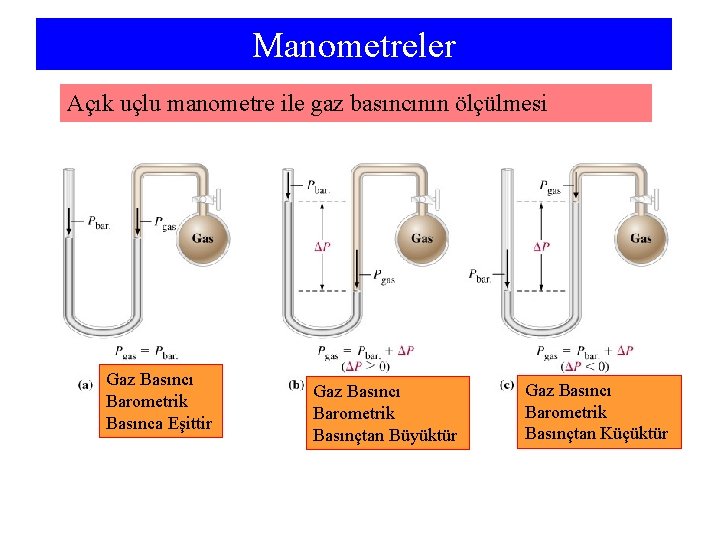
Manometreler Açık uçlu manometre ile gaz basıncının ölçülmesi Gaz Basıncı Barometrik Basınca Eşittir Gaz Basıncı Barometrik Basınçtan Büyüktür Gaz Basıncı Barometrik Basınçtan Küçüktür

• Gazların yapısına etki eden Basınç(P), Hacim(V), Sıcaklık(T) ve Mol sayısı(n) arasındaki ilişikleri inceleyen bilim adamları kendi adları ile anılan bazı gaz kanunları ortaya koymuşlardır. Bunlardan bazılarını inceleyelim.

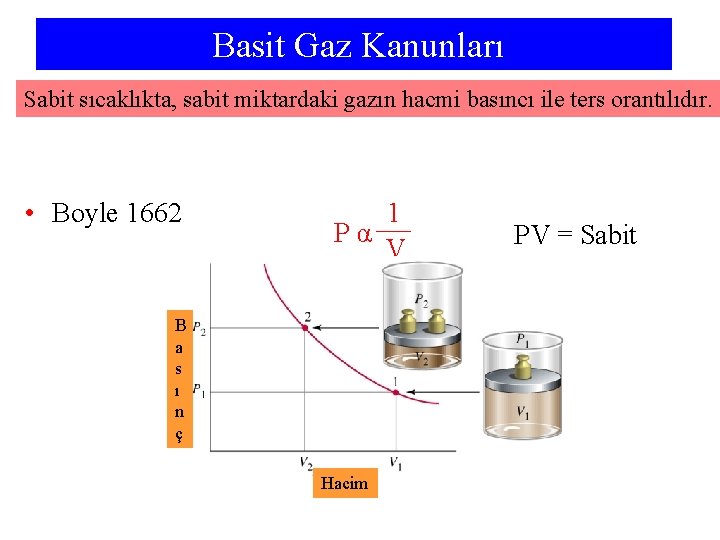
Basit Gaz Kanunları Sabit sıcaklıkta, sabit miktardaki gazın hacmi basıncı ile ters orantılıdır. • Boyle 1662 1 Pα V B a s ı n ç Hacim PV = Sabit

Boyle Yasası • PV = k • V = k (1/P) • Basınç ve Hacim ters orantılıdır

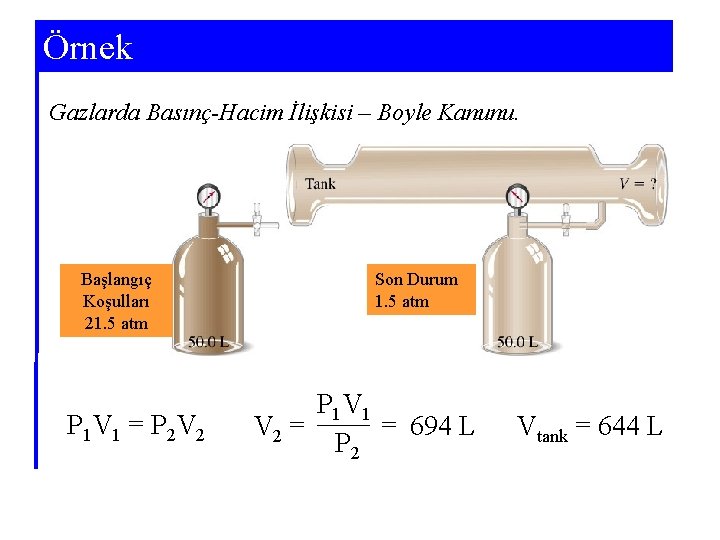
Örnek Gazlarda Basınç-Hacim İlişkisi – Boyle Kanunu. Başlangıç Koşulları 21. 5 atm P 1 V 1 = P 2 V 2 Son Durum 1. 5 atm P 1 V 1 = 694 L V 2 = P 2 Vtank = 644 L

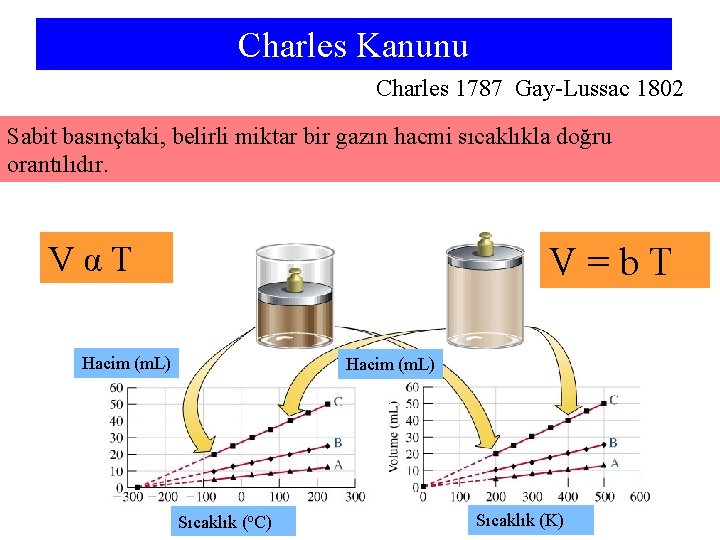
Charles Kanunu Charles 1787 Gay-Lussac 1802 Sabit basınçtaki, belirli miktar bir gazın hacmi sıcaklıkla doğru orantılıdır. VαT V=b. T Hacim (m. L) Sıcaklık (o. C) Sıcaklık (K)

Standart(Normal) Basınç ve Sıcaklık • Gazların özellikleri şartlara bağlıdır. • Normal Koşullar tanımı: P = 1 atm = 760 mm Hg T = 0°C = 273. 15 K

Avogadro Yasası • Sabit sıcaklık ve basınçdaki gazın hacmi gaz molekülü sayısı ile doğru orantılıdır. V = kn • Matematiksel olarak İki hacim hidrojen Bir hacim oksijen İki hacim su

Suyun oluşumu

Avagadro Kuramı • Aynı sıcaklık ve basınçta FARKLI gazların eşit hacimleri EŞİT sayıda molekül içerir. • Aynı sıcaklık ve basınçta FARKLI gazların EŞİT sayıda molekülleri EŞİT hacim kaplar

Avogadro Kanunu Sabit basınç ve sıcaklıkta: Vαn veya V=cn Normal Koşullarda (250 C, 1 atm) 1 mol gaz = 22. 4 L gaz

Gaz Kanunlarının Birleşmesi: İdeal Gaz Eşitliği ve Genel Gaz Eşitliği • Boyle Kanunu V α 1/P • Charles Kanunu VαT • Avogadro Kanunu V α n PV = n. RT Vα n. T P

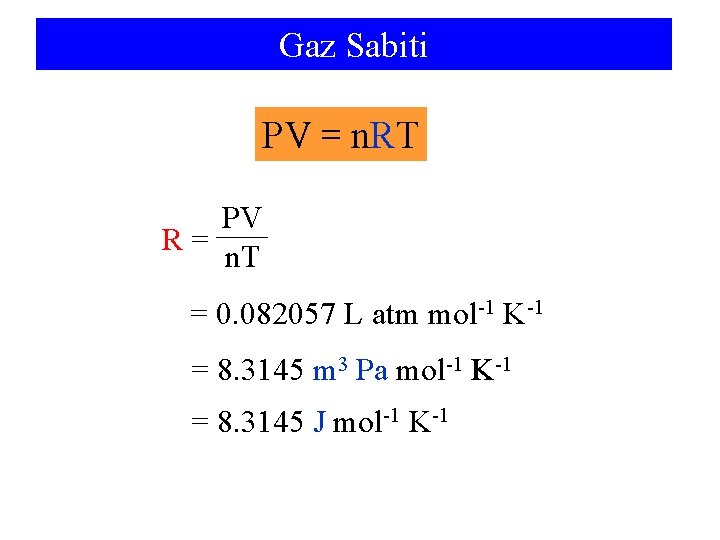
Gaz Sabiti PV = n. RT PV R= n. T = 0. 082057 L atm mol-1 K-1 = 8. 3145 m 3 Pa mol-1 K-1 = 8. 3145 J mol-1 K-1

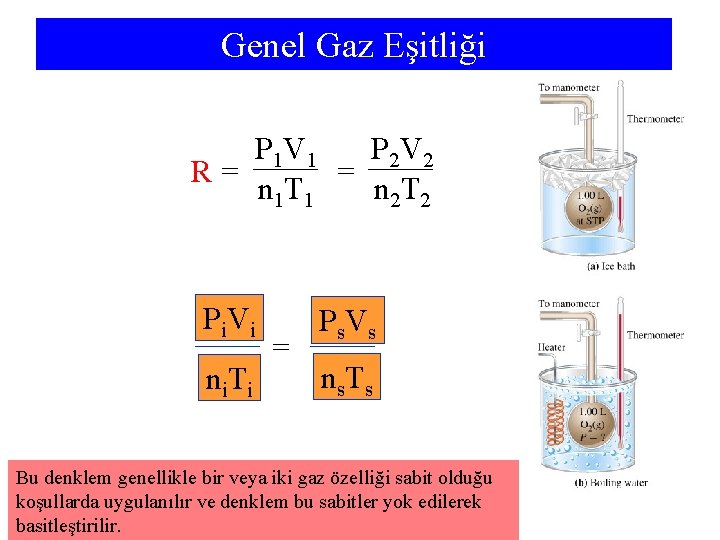
Genel Gaz Eşitliği P 1 V 1 P 2 V 2 R= = n 2 T 2 n 1 T 1 Pi Vi ni. Ti = P s. V s ns. Ts Bu denklem genellikle bir veya iki gaz özelliği sabit olduğu koşullarda uygulanılır ve denklem bu sabitler yok edilerek basitleştirilir.

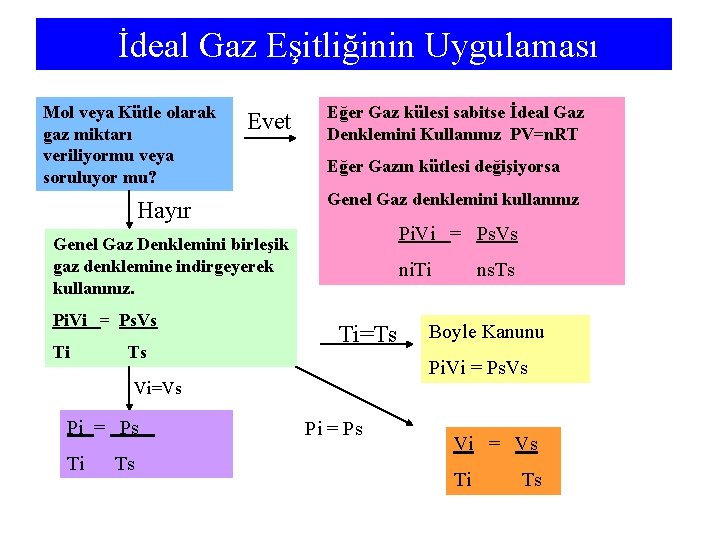
İdeal Gaz Eşitliğinin Uygulaması Mol veya Kütle olarak gaz miktarı veriliyormu veya soruluyor mu? Evet Hayır Eğer Gaz külesi sabitse İdeal Gaz Denklemini Kullanınız PV=n. RT Eğer Gazın kütlesi değişiyorsa Genel Gaz denklemini kullanınız Pi. Vi = Ps. Vs Genel Gaz Denklemini birleşik gaz denklemine indirgeyerek kullanınız. Pi. Vi = Ps. Vs Ti Ts ni. Ti Ti=Ts Ti Ts Boyle Kanunu Pi. Vi = Ps. Vs Vi=Vs Pi = Ps ns. Ts Pi = Ps Vi = Vs Ti Ts

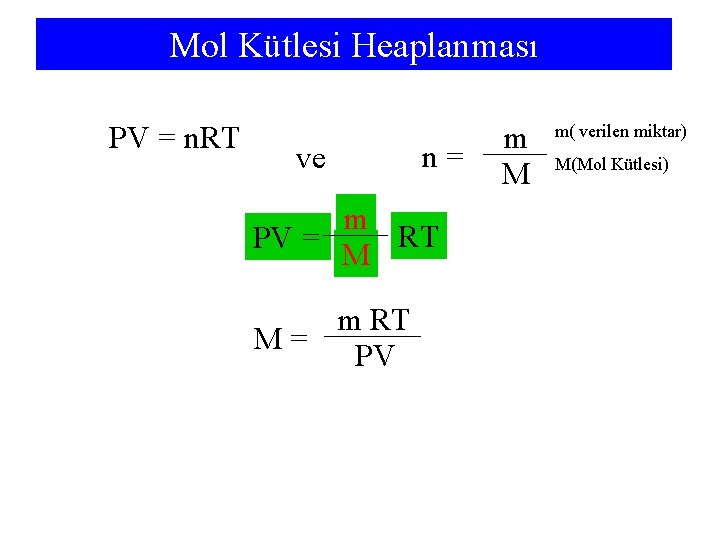
Mol Kütlesi Heaplanması PV = n. RT ve n= m RT PV = M m RT M= PV m M m( verilen miktar) M(Mol Kütlesi)

Mol Kütlesinin Ideal Gaz Eşitliği ile Bulunması Propilen endüstri için önemli bir kimyasaldır. Organik sentezlerde ve plastik üretiminde kullanılır. Cam bir kabın ağırlığı boş, temiz ve havasız iken 40. 1305 g, su ile doldurulduğu zaman 138, 2410 g (25°C deki δ=0, 9970 g/cm 3) ve Propilen gazı ile doldurulduğu zaman 740, 3 mm Hg basınç ve 24, 0°C de 40, 2959 g gelmektedir. Propilenin mol kütlesi nedir. Strateji: Vkab bulun, mgaz bulun, Gaz denklemini kullanın

Örnek Vkab: Vkab = m. H 2 O / d. H 2 O = (138. 2410 g – 40. 1305 g) / (0. 9970 g cm-3) mgaz: = 98. 41 cm 3 = 0. 09841 L mgaz = mdolu - mboş= (40. 2959 g – 40. 1305 g) = 0. 1654 g

Example 5 -6 Örnek Gaz Denklemi: PV = n. RT M= m RT PV = M m RT M= PV (0. 6145 g)(0. 08206 L atm mol-1 K-1)(297. 2 K) (0. 9741 atm)(0. 09841 L) M = 42. 08 g/mol

Gazların Yoğunlukları ve PV = n. RT m RT PV = M m m , n= d= M V MP m =d= V RT 1 - Gaz yoğunlukları önemli ölçüde basınç ve sıcaklığa bağlıdır; basınç arttıkça artar ve sıcaklık arttıkça azalır. Sıvı ve katıların yoğunlukları da sıcaklığa bağlı olmakla birlikte basınca çok az bağlıdır. 2 - Bir gazın yoğunluğu onun mol kütlesi ile orantılıdır. Sıvı ve katıların yoğunlukları ile mol kütleleri arasında hiçbir ilişki yoktur.

Kimyasal Reaksiyonlarda Gazlar • Stokiyometrik faktörlerin gaz miktarlarıyla olan ilişkisi diğer girenler veya ürünlerinki ile aynıdır. • Ideal gaz eşitliği gazların kütle, hacim, sıcaklık ve basınç hesaplamalarında kullanılır. • Birleşik gaz kanunu diğer gaz kanunları ile geliştirilebilir.

Birleşen Hacimler Kanunu • Tepken ve ürünlerin yada bunların bazılarının gaz olduğu tepkimelerde stokiyometrik hesaplamalar oldukça basittir. 2 NO(g) + O 2 (g) 2 NO 2 (g) 2 mol NO + 1 mol O 2 (g) 2 mol NO 2(g) T ve P nin sabit olduğunu varsayınız, bu durumda bir mol gaz belli 1 V hacmini, 2 mol gaz 2 V hacmini ve 3 mol gaz 3 V hacmini kaplayacaktır 2 NO(g) + O 2 (g) 2 L NO(g) + 1 L O 2 (g) 2 NO 2 (g) 2 L NO 2(g)

Örnek Ideal gaz Eşitliğinin Reaksiyon sitokiyometrisi hesaplamalarında kullanılması Yüksek sıcaklıkta sodyum azid, Na. N 3, bozunarak azot gazı N 2(g) oluşturur. Bu reaksiyon sistemleri hava yastıklarında kullanılır. 70. 0 g Na. N 3 in bozunmasıyla 735 mm Hg basınç ve 26°C sıcaklıkta ne kadar hacimde N 2(g), elde edilir. 2 Na. N 3(k) → 2 Na(s) + 3 N 2(g)

Örnek N 2 nin molünü hesaplayın: 1 mol Na. N 3 n. N 2 =70 g Na. N 3 x 65. 01 g Na. N 3 3 mol N 2 = 1. 62 mol N 2 x 2 mol Na. N 3 N 2 : nin hacmini hesaplayın n. RT (1. 62 mol)(0. 08206 L atm mol-1 K-1)(299 K) V= = P 1. 00 atm (735 mm Hg) 760 mm Hg = 41. 1 L

Gazların Karışımı • Gaz kanunları gaz karışımlarına uygulanabilir. • Bir kapta bulunan gaz karışımındaki her bir gazın kabı dolduracak şekilde genişlediğini ve kabın içindeki tek başına bulunduğu zaman uygulayacağı basınca eş değer bir basınç uygular. • Kısmi Basınç – Aynı kab içerisindeki bir gaz karışımındaki herbir gaz bileşeni kendi kısmi basıncını uygular. Ptop= Pa + Pb + Pc. . . .

Dalton Kısmi Basınç Kanunu Her gazı hacmi ve sıcaklığı aynı Gaz miktarları farklı olduğu için uyguladıkları basınç farklı Toplam basınç her bir gazın uyguladığı kısmi basınçların toplamına eşit

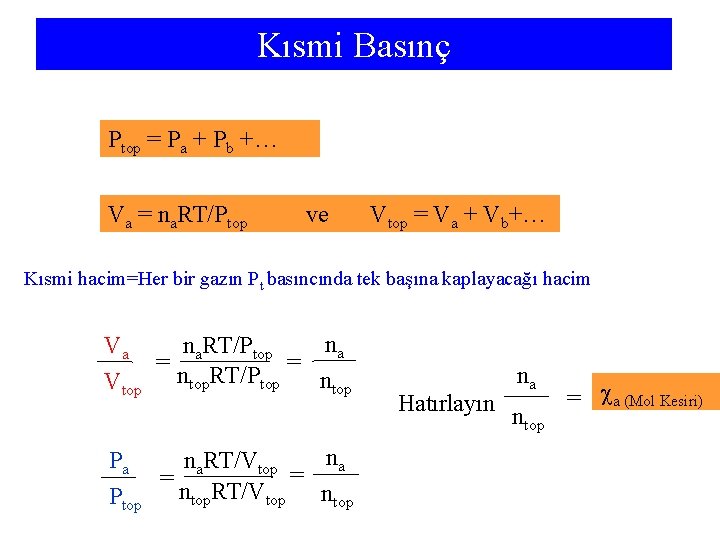
Kısmi Basınç Ptop = Pa + Pb +… Va = na. RT/Ptop ve Vtop = Va + Vb+… Kısmi hacim=Her bir gazın Pt basıncında tek başına kaplayacağı hacim na na. RT/Ptop Va = = n RT/P ntop Vtop top na na. RT/Vtop Pa = = ntop. RT/Vtop ntop Ptop Hatırlayın na ntop = a (Mol Kesiri)

Örnek • 1, 0 g H 2 ve 5, 00 g He karışımı 20 0 C de 5 L lik bir kaba koyulduğunda karışımın uyguladığı basınç nedir?

Örnek • 1, 0 g H 2 ve 5, 00 g He karışımı 20 0 C de 5 L lik bir kaba koyulduğunda H 2 ve He nin kısmi basınçları nedir?

Kinetik Moleküler Teori • Gaz partikülleri noktasal kütleli, sabit, rastgele ve doğrusal hareket yaparlar. • Gaz partikülleri birbirlerinden çok uzak mesafededirler. • Tüm çarpışmalar hızlı ve elastiktir. • Gaz partikülleri arasında herhangi bir kuvvet yoktur. • Toplam enerji sabit kalır.

Basıncın Bağlı Olduğu Kuvvetler • Öteleme kinetik Enerjisi, • Moleküllerin çarpışma frekansı, • Vurgu veya momentum transferi, • Basınç, momentum transferi ile çarpışma frekansının çarpımına eşittir.

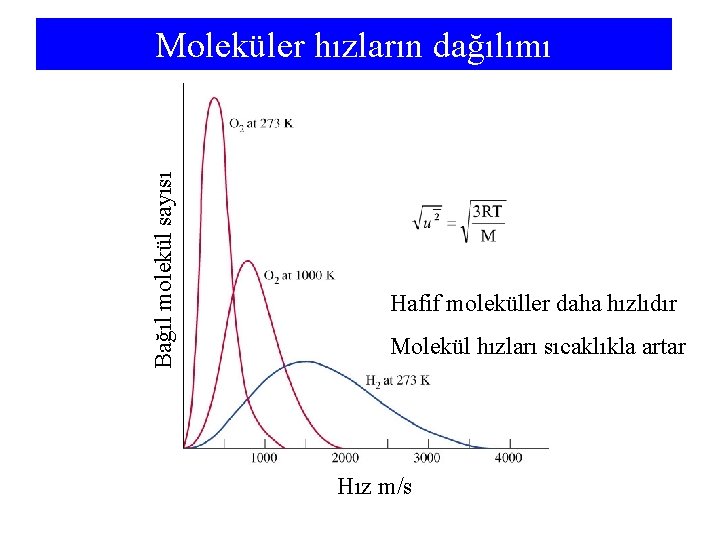
Bağıl molekül sayısı Moleküler hızların dağılımı Hafif moleküller daha hızlıdır Molekül hızları sıcaklıkla artar Hız m/s

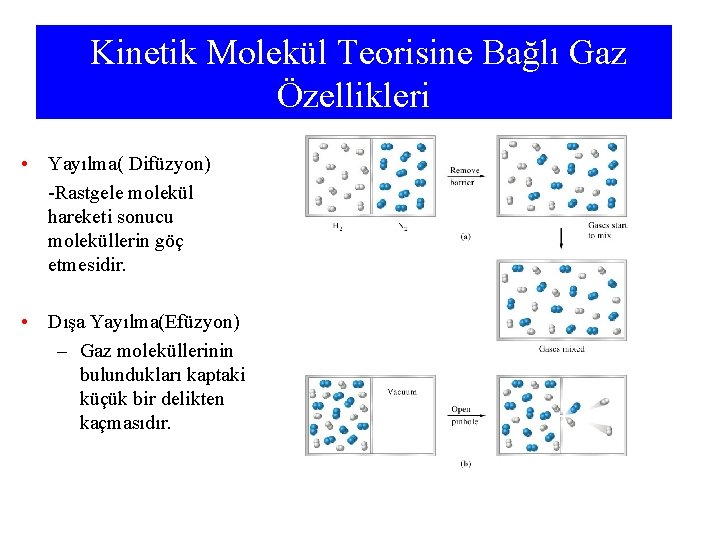
Kinetik Molekül Teorisine Bağlı Gaz Özellikleri • Yayılma( Difüzyon) -Rastgele molekül hareketi sonucu moleküllerin göç etmesidir. • Dışa Yayılma(Efüzyon) – Gaz moleküllerinin bulundukları kaptaki küçük bir delikten kaçmasıdır.

Graham Kanunu A nın dışa yayılma hızı B nin dışa yayılma hız İki farklı gazın dışa yayılma hızları mol kütlelerinin karekökü ile ters orantılıdır • Yalnızca düşük basınçtaki gazlar içindir. • Küçük bir delikten kaçma • Difüzyona uygulanmaz. • Oran: – Efüzyon hızı – Moleküler hızlar – Efüzyon zamanı – Moleküllerin aldığı yolu – Efüzyon olmuş gaz miktarları.

Gerçek Gazlar • Sıkıştırılabilirlik faktörü: PV/n. RT = 1 • Gerçek gazlardan sapma. – PV/n. RT > 1 – Moleküler hacim büyük ise. – PV/n. RT < 1 – moleküller arası etkileşim kuvveti. Gerçek gazlar yüksek sıcaklık düşük basınçda ideal gaz gibi davranırlar

Gerçek Gazlar –PV/n. RT > 1 – Moleküler hacim büyük ise. –PV/n. RT < 1 – moleküller arası etkileşim kuvveti.

van der Waals Denklemi n 2 a P+ V 2 V – nb = n. RT Bastırılamayan hacim-molekülerin hacmi ile ilgili Moleküller arası çekim kuvveti a ve b değerleri her gaz için farklıdır.

 Kimya r sabiti 0 082
Kimya r sabiti 0 082 Zellikleri
Zellikleri Yanıcı gazlar
Yanıcı gazlar Yakıcı madde işareti
Yakıcı madde işareti Katı maddelere şekil veremeyiz
Katı maddelere şekil veremeyiz Parlayıcı gazlardan havadan hafif
Parlayıcı gazlardan havadan hafif Asit yağmuru oluşturan gazlar
Asit yağmuru oluşturan gazlar Kimyasal boğucu gazlar
Kimyasal boğucu gazlar Gazlar bulundukları kabı tamamen doldurur mu
Gazlar bulundukları kabı tamamen doldurur mu Sabun ve deterjan kimya
Sabun ve deterjan kimya Ideal gaz denklemi
Ideal gaz denklemi Yanıcı madde sembolü
Yanıcı madde sembolü Adi karışım nedir
Adi karışım nedir Madde miktarlarından birinin verildiği sorular
Madde miktarlarından birinin verildiği sorular Kırmızı çökelek formülü
Kırmızı çökelek formülü Fragrance trends 2016
Fragrance trends 2016 Kimya nedir
Kimya nedir Can kimya
Can kimya Eliminasyon nedir organik kimya
Eliminasyon nedir organik kimya Cis trans organik kimya
Cis trans organik kimya Element modeli
Element modeli Modern atom teorisi alt başlıkları
Modern atom teorisi alt başlıkları Kavitasyon korozyonu
Kavitasyon korozyonu Anorganik kimya neyi inceler
Anorganik kimya neyi inceler Alkenlerde izomeri
Alkenlerde izomeri Froma kimya
Froma kimya Bürete
Bürete Trihidrojen mono nitrür nedir
Trihidrojen mono nitrür nedir Tepkime hızı
Tepkime hızı Klorpentan
Klorpentan Pil gerilimi hesaplama
Pil gerilimi hesaplama Organik kimya solomon ders notları
Organik kimya solomon ders notları Entropi kimya
Entropi kimya Iyot hekzaflorür formülü
Iyot hekzaflorür formülü Eliminasyon nedir organik kimya
Eliminasyon nedir organik kimya Alkolmetre sıcaklık düzeltmesi
Alkolmetre sıcaklık düzeltmesi R sabiti
R sabiti Pteridin halkası
Pteridin halkası Gksel
Gksel Anlamlı rakamlar kimya
Anlamlı rakamlar kimya Sabun molekülünün hidrokarbon zinciri
Sabun molekülünün hidrokarbon zinciri Kimya denklem çözücü
Kimya denklem çözücü Ersa kimya denizli
Ersa kimya denizli Kısa cevaplı yazılı yoklamalar
Kısa cevaplı yazılı yoklamalar Genel verici kan
Genel verici kan