ENLACE QUMICO 1 En esta presentacin se incluye













































- Slides: 68

ENLACE QUÍMICO 1

En esta presentación se incluye material didáctico elaborado por: Dra. Paola Gómez-Tagle Dra. Erika Martin Arrieta Dr. Laura Ma. Gasque Silva 2

Para entender el enlace químico es importante conocer y entender las propiedades de las sustancias primero… 3

¿Podemos clasificar a las sustancias? 4

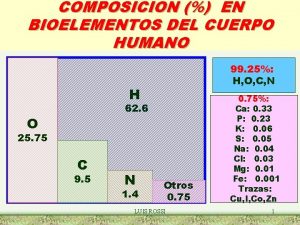
LAS SUSTANCIAS QUÍMICAS 5

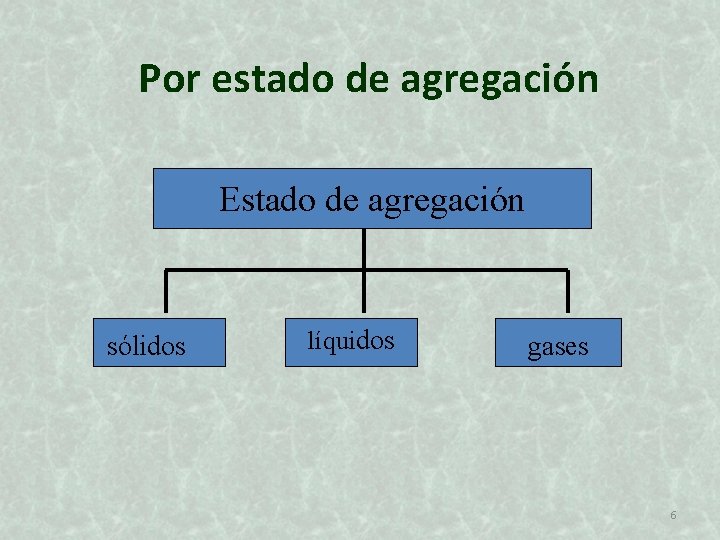
Por estado de agregación Estado de agregación sólidos líquidos gases 6

Problemas. . • ¿A qué temperatura? – Temperatura “ambiente” Ga 28. 5ºC, Cs 29. 8ºC, DMSO 18. 5ºC • ¿A qué presión? – 1 -penteno: líquido (excepto en el D. F. , en La Paz Bolivia, en Bogotá, en Toluca, en Guanajuato. . • ¿ En qué tiempo? – Puré de papas, mermelada, vidrio=mito 7

Mejor revisemos de nuevo 8

Sólidos de “alto” punto de fusión 9

Grafito. . Punto de fusión (P. f. ) 4000 °C. . . 10

Diamante. . . P. f 4000 °C (Cotton dice que es el mayor conocido) 11

Ca 5(PO 4)3(OH) P. f. = 1600 °C Hidroxiapatita 12

Hierro P. f. = 1528 °C 13

Sal común P. f. = 801 °C 14

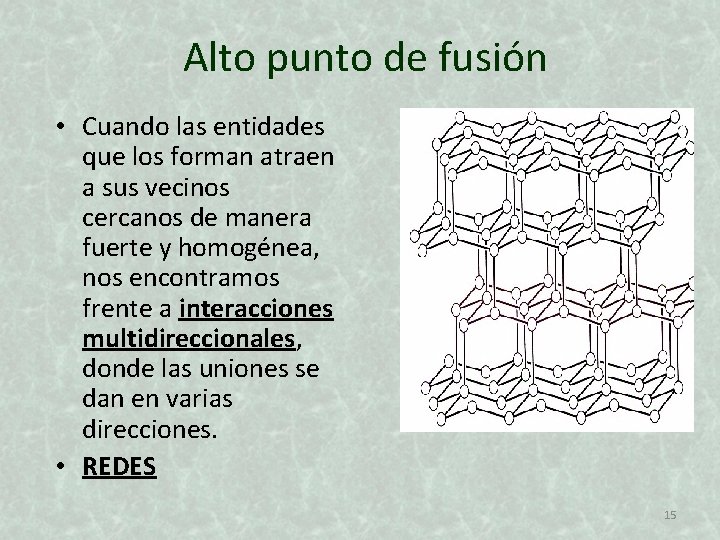
Alto punto de fusión • Cuando las entidades que los forman atraen a sus vecinos cercanos de manera fuerte y homogénea, nos encontramos frente a interacciones multidireccionales, donde las uniones se dan en varias direcciones. • REDES 15

Sólidos de bajo punto de fusión 16

Azufre P. f. 120 °C 17

Sólidos de bajo punto de fusión • Aquí las interacciones se dan con intensidad, pero sólo entre algunos átomos vecinos y son débiles con los otros. A esto se le llama interacciones de dirección selectiva, ya que sólo en algunas direcciones que se da una interacción fuerte. • MOLÉCULAS 18

Moléculas • En las interacciones de dirección selectiva, hay átomos fuertemente unidos a otros átomos vecinos (con lo que se forman moléculas), • pero la interacción entre moléculas es relativamente débil. • En este caso, para pasar al estado líquido lo que se requiere es romper las interacciones débiles entre moléculas, por lo que el punto de fusión es bajo. 19

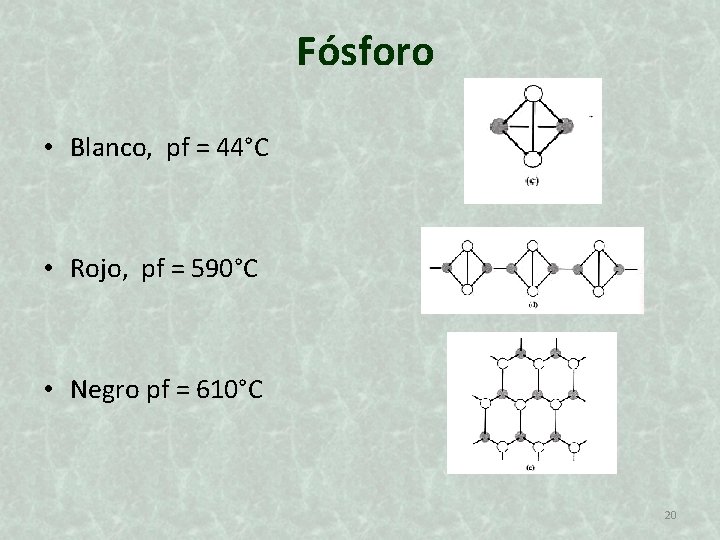
Fósforo • Blanco, pf = 44°C • Rojo, pf = 590°C • Negro pf = 610°C 20

Gases, líquidos o sólidos de bajo punto de fusión • Si una sustancia está formada por moléculas será explicable que exista como un gas, como un líquido o como un sólido con temperatura de fusión reducida. 21

En resumen • Sólidos de alto punto de fusión • Bajo punto de fusión (sólido, líquidos o gases) • Interacciones multidireccionales: • Interacciones de direccionalidad selectiva. REDES MOLÉCULAS 22

¿Conductividad? • En estado sólido • Fundidos • En disolución 23

Conductividad en disolución 24

¿Y la cristalinidad. . . ? 25

¿Y la solubilidad. . . ? 26

Clasificación de las sustancias Sólidos de bajo punto de fusión Sólidos de alto punto de fusión Conduce* en sólido Conduce* fundido No conducen* en sólido Conduce* fundido Conduce* en disolución * Conducción de la electricidad No conducen* fundido No conducen* en disolución 27

Redes metálicas Zinc Hierro Cobre 28

Redes covalentes C-trigonal en ambas estructuras C-tetraédrico arreglo cúbico en toda la red a-grafito ABAB d. C-C= 141. 5 pm vs 154 (C-C en moléculas) d entre capas= 335. 4 pm d. C-C= 154. 45 pm vs 141. 5 pm en grafito Diamante -grafito ABCABC 29

Redes covalentes El mejor diamante: arreglo hexagonal análogo a la wurzita (Zn. S) Diamante-Lonsdaleita 30

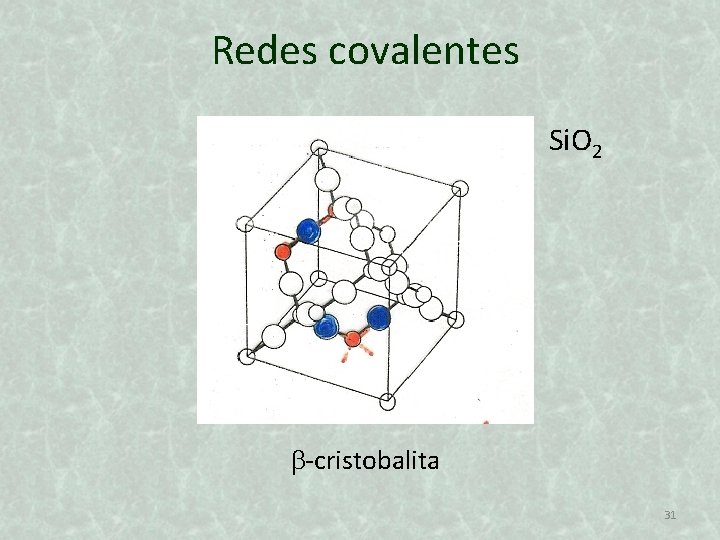
Redes covalentes Si. O 2 -cristobalita 31

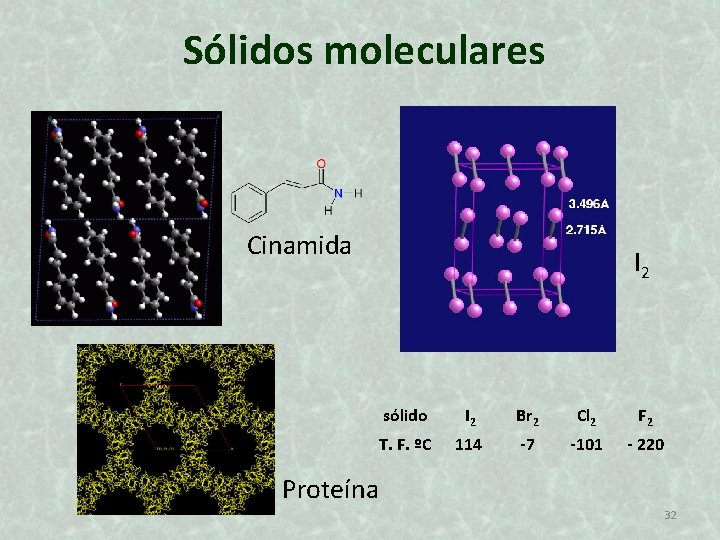
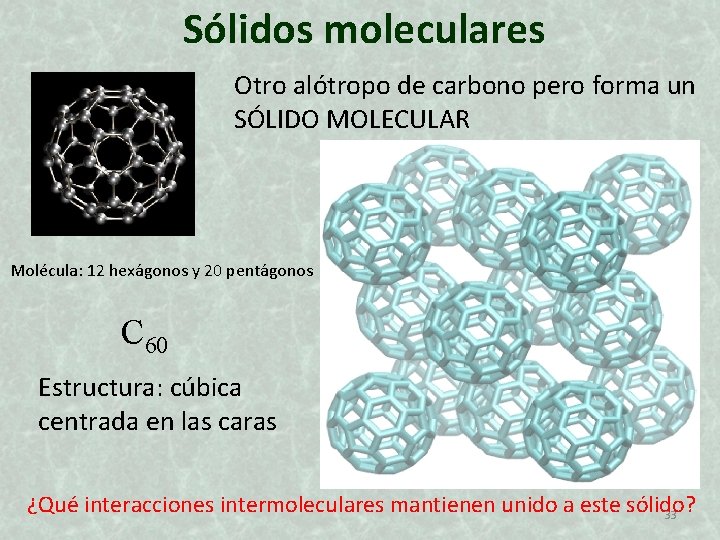
Sólidos moleculares Cinamida I 2 sólido I 2 Br 2 Cl 2 F 2 T. F. ºC 114 -7 -101 - 220 Proteína 32

Sólidos moleculares Otro alótropo de carbono pero forma un SÓLIDO MOLECULAR Molécula: 12 hexágonos y 20 pentágonos C 60 Estructura: cúbica centrada en las caras ¿Qué interacciones intermoleculares mantienen unido a este sólido? 33

ENLACE QUÍMICO 34

Enlace iónico • Un enlace iónico es el enlace químico que se forma por la atracción electrostática neta que existe entre un conjunto de aniones y cationes 35

Enlace metálico • Los metales pueden concebirse como un conjunto de iones positivos que se encuentran ordenadamente colocados dentro de un mar de electrones libres. 36

Enlace covalente • Cuando se comparten electrones entre un par de dos átomos se forma entre ellos un enlace covalente que da origen a una molécula, en este caso diatómica, como el H 2, el CO, el Cl 2, el HCl. (nótese que todos son gases) 37

Enlace covalente polar • En el cloruro de hidrógeno, HCl, el cloro atrae con más fuerza a los electrones que el hidrógeno, pero los electrones se comparten entre los dos átomos, no se han cedido de uno a otro como en el caso de un enlace iónico: Decimos que el cloro es más electronegativo 38

¿y eso. . cómo se sabe. . . ? 39

Electronegatividad • Definición de Pauling: Es la capacidad de un átomo en un enlace para atraer electrones hacia sí mismo 40

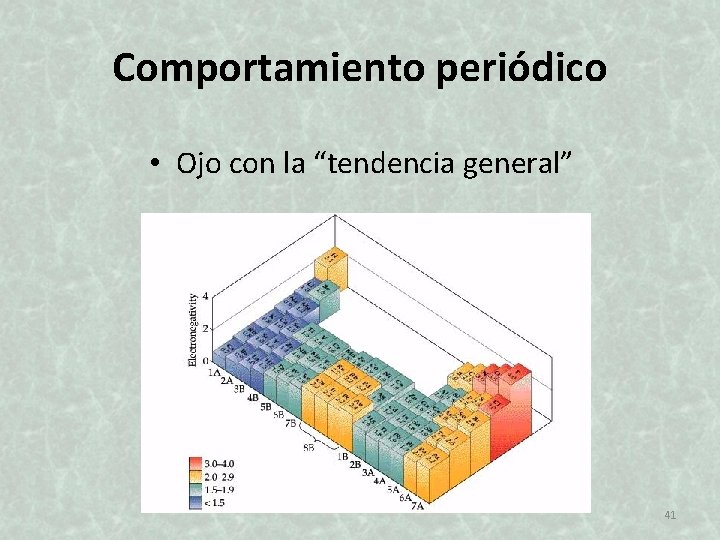
Comportamiento periódico • Ojo con la “tendencia general” 41

Predicción del tipo de enlace • = 0 enlace covalente no polar • ? < < 0 enlace covalente polar • > ? ? enlace iónico 42

¿Tipo de enlace. . . ? Cs. F Na. Cl Li. Br HF BF 3 = = = 4. 0 – 0. 7 = 3. 3 3. 0 – 0. 9 = 2. 1 2. 8 – 1. 0 = 1. 8 4. 0 – 2. 1 = 1. 9 4. 0 – 2. 0 = 2. 0 43

Óxidos • • Na 2 O = 2. 4 Ca. O = 2. 5 Fe. O = 1. 7 Al 2 O 3 = 2. 0 • CO 2 = 1. 0 • NO 2 = 0. 5 • SO 3 = 1. 0 44

Ejercicio #6 Falso (F) o verdadero (V) 1. Los compuestos covalentes pueden formar sólidos cristalinos. 2. Los compuestos gaseosos a temperatura ambiente, son covalentes 3. El gas BF 3 es iónico porque la diferencia de electronegatividades entre el B y el F es de 2. 4. Todo compuesto iónico se disuelve en agua y conduce la corriente 5. Si un compuesto forma cristales a T amb. , es iónico 45

Otra manera de saberlo es… 46

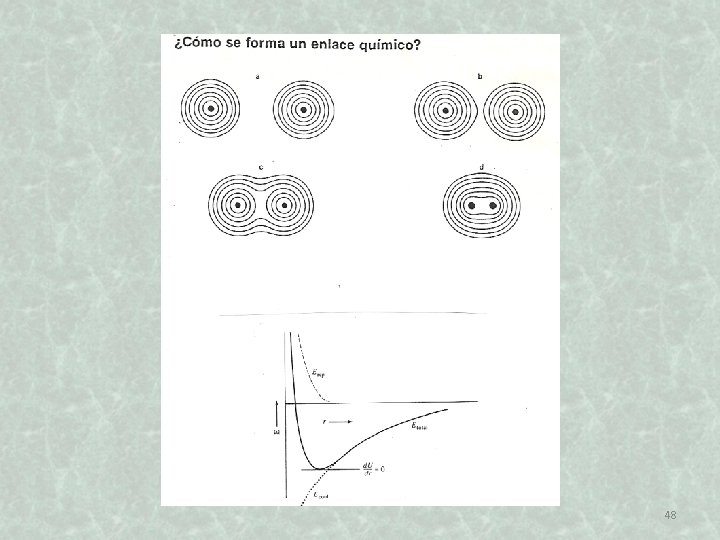
47

48

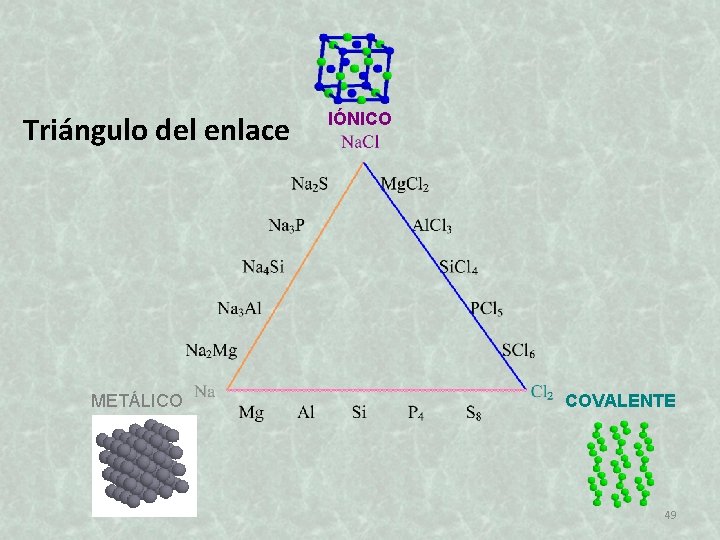
Triángulo del enlace METÁLICO IÓNICO COVALENTE 49

50

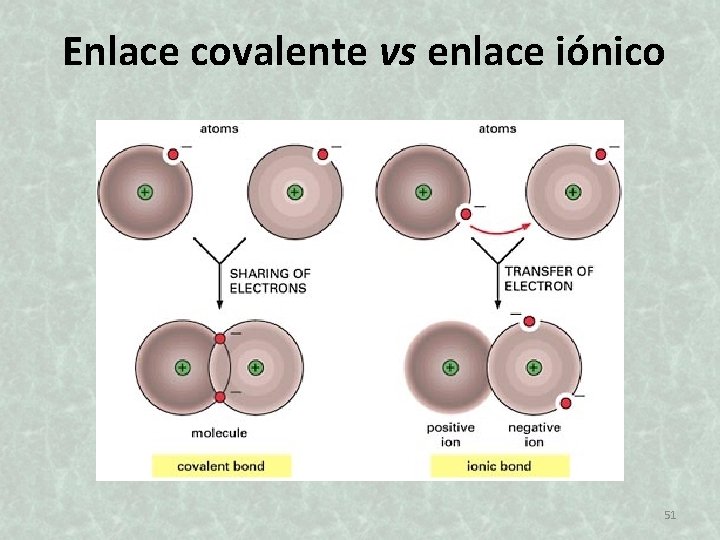
Enlace covalente vs enlace iónico 51

Enlace Los gases nobles presentan gran estabilidad química, y existen como moléculas mono-atómicas. Su configuración electrónica es muy estable y contiene 8 e- en la capa de valencia (excepto el He). e- de valencia He Ne Ar Kr Xe Rn 2 8 8 8 La idea de enlace covalente fue sugerida en 1916 por G. N. Lewis: G. N. Lewis Los átomos pueden adquirir estructura de gas noble compartiendo electrones para formar un enlace de pares de electrones. 52

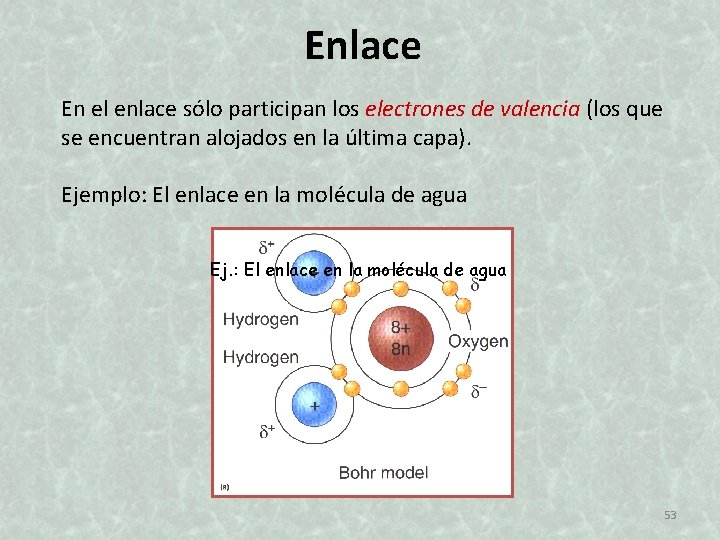
Enlace En el enlace sólo participan los electrones de valencia (los que se encuentran alojados en la última capa). Ejemplo: El enlace en la molécula de agua Ej. : El enlace en la molécula de agua 53

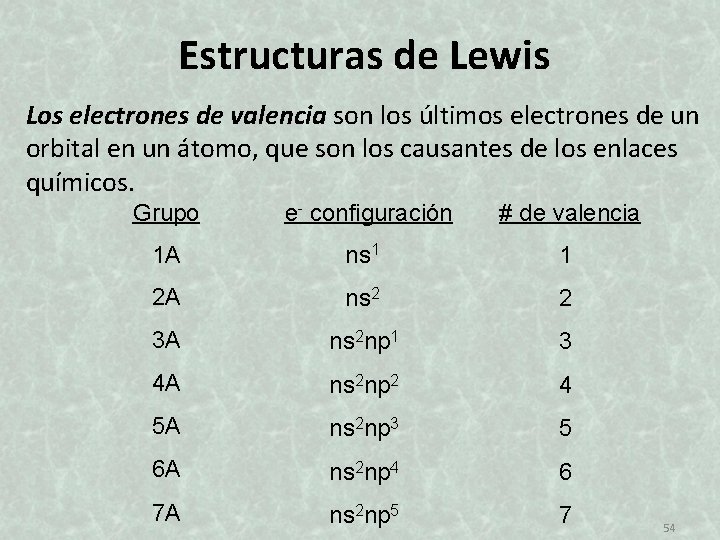
Estructuras de Lewis Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e- configuración # de valencia 1 A ns 1 1 2 A ns 2 2 3 A ns 2 np 1 3 4 A ns 2 np 2 4 5 A ns 2 np 3 5 6 A ns 2 np 4 6 7 A ns 2 np 5 7 54

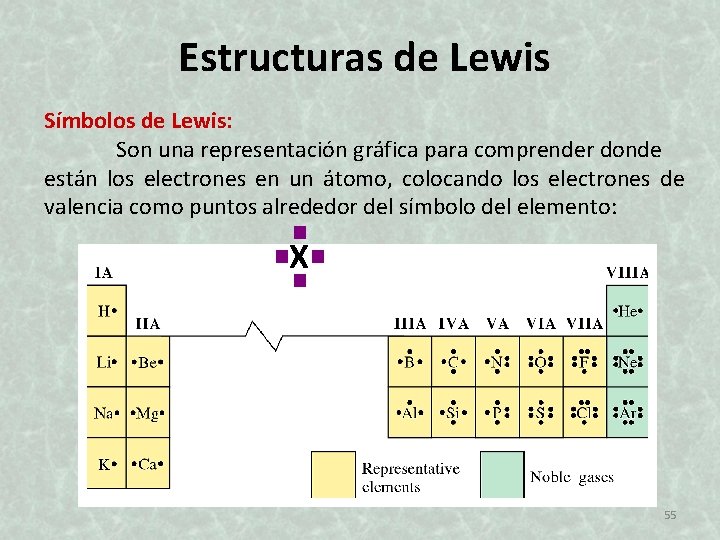
Estructuras de Lewis Símbolos de Lewis: Son una representación gráfica para comprender donde están los electrones en un átomo, colocando los electrones de valencia como puntos alrededor del símbolo del elemento: Xv v 55

Estructuras de Lewis Regla del octeto: Los átomos se unen compartiendo electrones hasta conseguir completar la última capa con 8 e- (4 pares de e-) es decir conseguir la configuración de gas noble: s 2 p 6 Tipos de pares de electrones: 1 - Pares de e- compartidos entre dos átomos (representado con una línea entre los at. unidos) · enlaces sencillos · enlaces dobles · enlaces triples 2 - Pares de e- no compartidos (ó par solitario) 56

Estructuras de Lewis ¿Como se dibujan las estructuras de Lewis? 1 - Se suman los e- de valencia de los átomos presentes en la molécula. Para un anión poliatómico se le añade un e- más por cada carga negativa y para un catión se restan tantos electrones como cargas positivas. 2 - Se dibuja una estructura esquemática con los símbolos atómicos unidos mediante enlaces sencillos. 3 - Se calcula el nº de e- de valencia quedan disponibles. 4 - Se distribuyen los e- de forma que se complete un octeto para cada átomo. Ejemplo 1: CH 4 1) C: 1 s 22 s 2 p 2 4 e. H: 2) 1 s 1 1 e- x 4= 4 e- 8 e- Ejemplo 2: H 2 CO 1) C: 1 s 22 s 2 p 2 4 e. H: 1 s 1 1 e- x 2= 2 e. O: 1 s 22 s 2 p 4 6 e 2) 12 e- 3) e- de v. libres: 12 -6= 6 4) 57

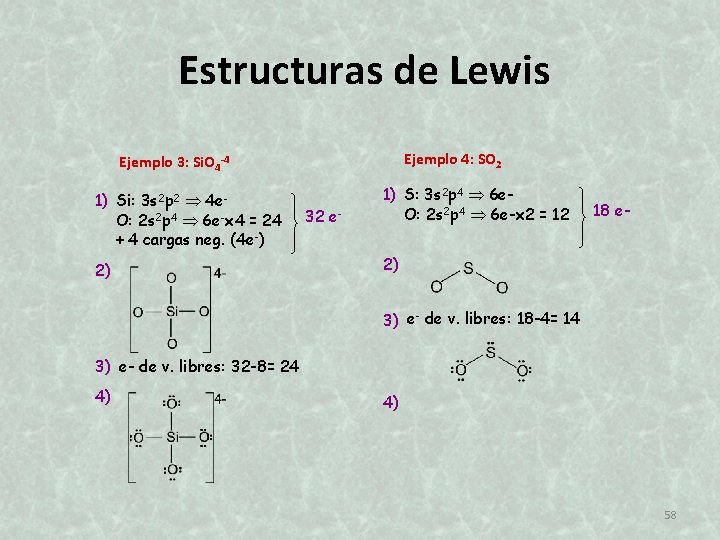
Estructuras de Lewis Ejemplo 4: SO 2 Ejemplo 3: Si. O 4 -4 1) Si: 3 s 2 p 2 4 e. O: 2 s 2 p 4 6 e-x 4 = 24 + 4 cargas neg. (4 e-) 2) 32 e- 1) S: 3 s 2 p 4 6 e. O: 2 s 2 p 4 6 e-x 2 = 12 18 e- 2) 3) e- de v. libres: 18 -4= 14 3) e- de v. libres: 32 -8= 24 4) 4) 58

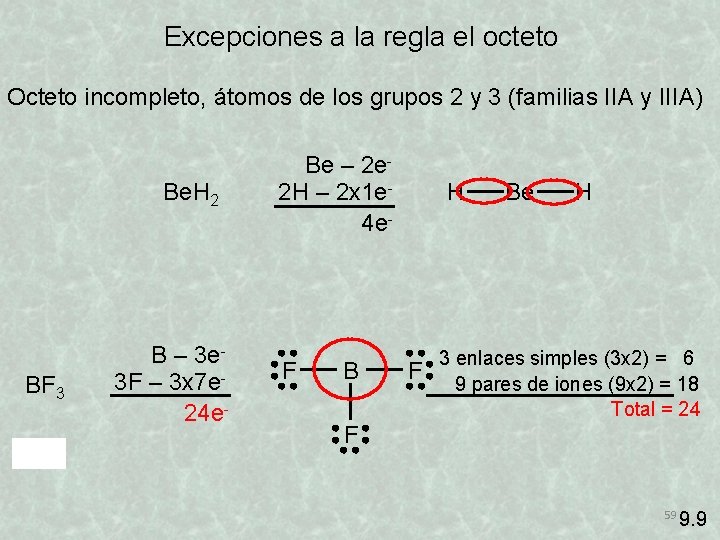
Excepciones a la regla el octeto Octeto incompleto, átomos de los grupos 2 y 3 (familias IIA y IIIA) Be. H 2 BF 3 B – 3 e 3 F – 3 x 7 e 24 e- Be – 2 e 2 H – 2 x 1 e 4 e- F B H F Be H 3 enlaces simples (3 x 2) = 6 9 pares de iones (9 x 2) = 18 Total = 24 F 59 9. 9

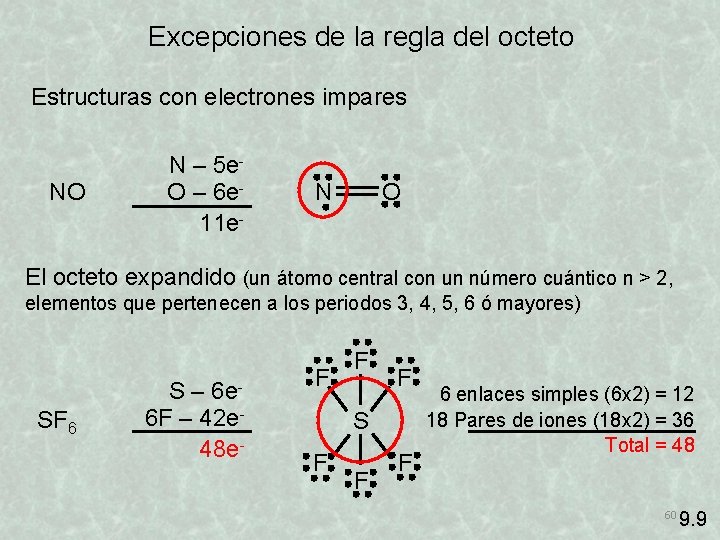
Excepciones de la regla del octeto Estructuras con electrones impares NO N – 5 e. O – 6 e 11 e- N O El octeto expandido (un átomo central con un número cuántico n > 2, elementos que pertenecen a los periodos 3, 4, 5, 6 ó mayores) SF 6 S – 6 e 6 F – 42 e 48 e- F F F S F F F 6 enlaces simples (6 x 2) = 12 18 Pares de iones (18 x 2) = 36 Total = 48 60 9. 9

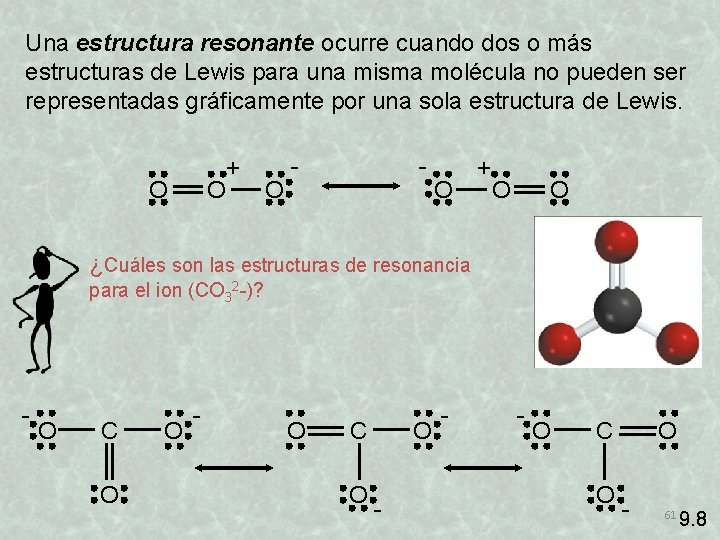
Una estructura resonante ocurre cuando dos o más estructuras de Lewis para una misma molécula no pueden ser representadas gráficamente por una sola estructura de Lewis. O O + O - - O + O O ¿Cuáles son las estructuras de resonancia para el ion (CO 32 -)? - O C O O - - - O C O O - 61 9. 8

Carga formal De las estructuras posibles, aquella cuya carga formal sea menor, es la más razonable. Carga formal= (# de e- de valencia) – ½(# de e- compartidos) – (# de e- no compartidos)

Ejercicios de estructuras de Lewis, carga formal y estructuras resonantes: http: //www. stolaf. edu/depts/chemistry/courses/toolkits/121/js/lewis/ Hacer 10 de las moléculas que se tienen en opciones http: //www. 100 ciaquimica. net/oq/cuestiones/coq 011. htm 63

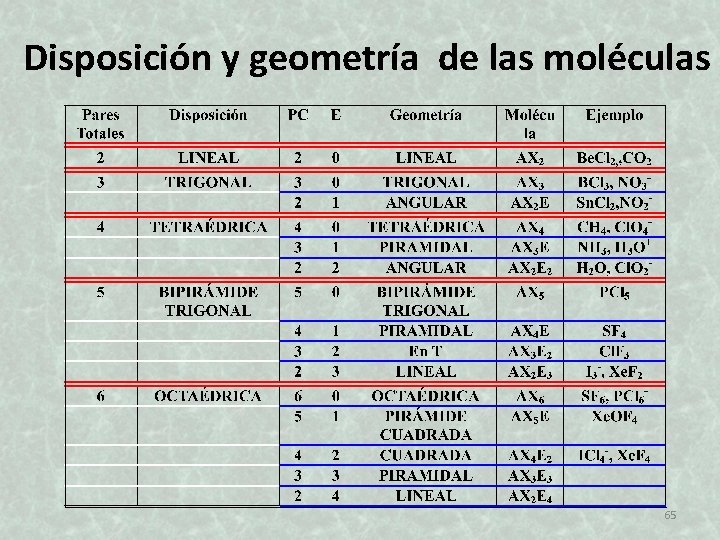
Teoría de repulsión de pares electrónicos de la capa de valencia (TRPECV) Gillespie R. J. y Nyholm R. S. AXn. Em A= átomo central X= substituyentes E= pares solitarios Pares electrónicos totales= pares electrónicos compartidos + pares solitarios PT=PC+E 64

Disposición y geometría de las moléculas 65

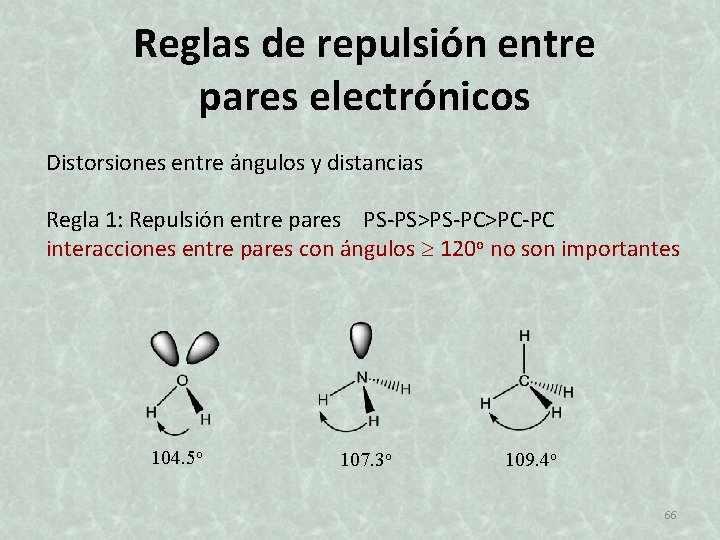
Reglas de repulsión entre pares electrónicos Distorsiones entre ángulos y distancias Regla 1: Repulsión entre pares PS-PS>PS-PC>PC-PC interacciones entre pares con ángulos 120 o no son importantes 104. 5 o 107. 3 o 109. 4 o 66

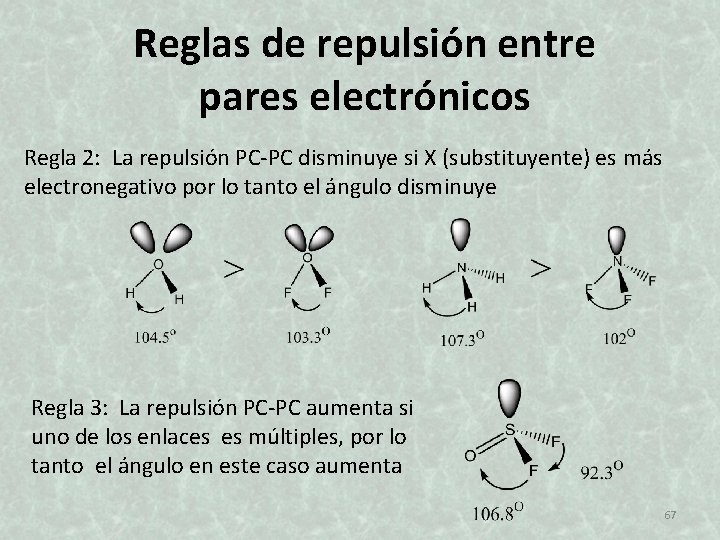
Reglas de repulsión entre pares electrónicos Regla 2: La repulsión PC-PC disminuye si X (substituyente) es más electronegativo por lo tanto el ángulo disminuye Regla 3: La repulsión PC-PC aumenta si uno de los enlaces es múltiples, por lo tanto el ángulo en este caso aumenta 67

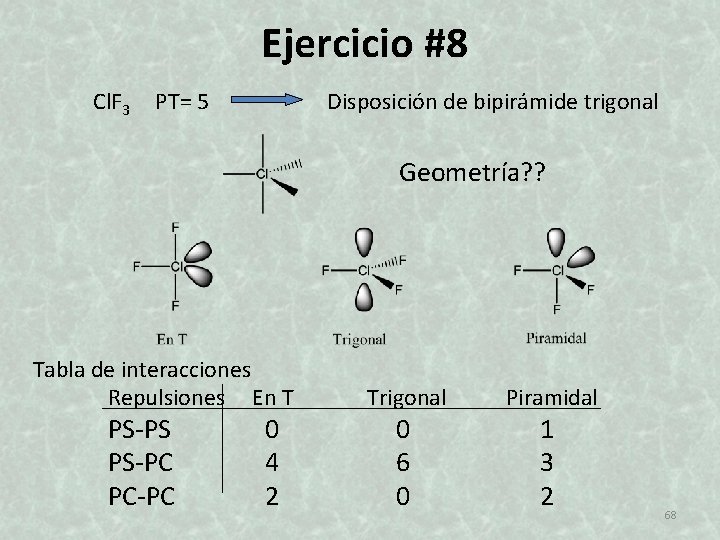
Ejercicio #8 Cl. F 3 PT= 5 Disposición de bipirámide trigonal Geometría? ? Tabla de interacciones Repulsiones En T PS-PS PS-PC PC-PC 0 4 2 Trigonal 0 6 0 Piramidal 1 3 2 68
 Tipo de enlace del oxígeno
Tipo de enlace del oxígeno Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Qumica
Qumica Intervalos automáticos o manuales
Intervalos automáticos o manuales Enlaces sigma y pi del carbono
Enlaces sigma y pi del carbono Una de las siguientes oraciones incluye un verbo reflexivo
Una de las siguientes oraciones incluye un verbo reflexivo Ejemplos de entrevistas indirectas
Ejemplos de entrevistas indirectas El reino vegetal incluye organismos
El reino vegetal incluye organismos éric está deprimido
éric está deprimido Carga formal
Carga formal Mgf2 estructura de lewis
Mgf2 estructura de lewis Cromoproteínas función
Cromoproteínas función Estructura de haworth de la ribulosa
Estructura de haworth de la ribulosa El grupo carbonilo
El grupo carbonilo Mutarrotación de la fructosa
Mutarrotación de la fructosa Modelo de watson y crick
Modelo de watson y crick Electrones de valencia
Electrones de valencia Pares
Pares Protenas
Protenas Enlace covalente
Enlace covalente Teoria de lewis
Teoria de lewis Enlace
Enlace Centro nacional de enlace
Centro nacional de enlace De acuerdo con la siguiente representación de lewis
De acuerdo con la siguiente representación de lewis Ejemplo de enlace covalente
Ejemplo de enlace covalente Mariana bianchi
Mariana bianchi La naturaleza del enlace quimico
La naturaleza del enlace quimico Azcares
Azcares Enlace n-n
Enlace n-n Hio4 lewis
Hio4 lewis Enlace glicosídico
Enlace glicosídico Enlace quimico metalico
Enlace quimico metalico Slidetodoc
Slidetodoc Hibridacion de orbitales
Hibridacion de orbitales Conectores de enlace
Conectores de enlace Enlace ionico
Enlace ionico Teoria de enlace de valencia
Teoria de enlace de valencia Tipos de enlaces quimicos
Tipos de enlaces quimicos Enlace glucosidico sacarosa
Enlace glucosidico sacarosa So enlace
So enlace Molecula polar y apolar
Molecula polar y apolar Caracter covalente tabla periodica
Caracter covalente tabla periodica Site:slidetodoc.com
Site:slidetodoc.com Enfermera de enlace
Enfermera de enlace Tipos de enlace interatomico
Tipos de enlace interatomico Enlace covalente simple doble y triple ejemplos
Enlace covalente simple doble y triple ejemplos Https://www.youtube.com/watch?v= oslgtjbtgpk
Https://www.youtube.com/watch?v= oslgtjbtgpk Que es un enlace polar
Que es un enlace polar Enlace covalente dativo
Enlace covalente dativo Objetivos de enlaces quimicos
Objetivos de enlaces quimicos Orbtale
Orbtale Enrutamiento por estado de enlace
Enrutamiento por estado de enlace Enlace covalente polar
Enlace covalente polar Tipo de enlace de los carbohidratos
Tipo de enlace de los carbohidratos Quimica polar
Quimica polar Enlace covalente heteronuclear
Enlace covalente heteronuclear Enlace
Enlace Enlace glucosidico
Enlace glucosidico Grupo funcional nitrogenado
Grupo funcional nitrogenado Lipidos animacion
Lipidos animacion Enlace
Enlace Enlace triple
Enlace triple Enlace covalente
Enlace covalente Angulo de enlace
Angulo de enlace Dicarbonílico
Dicarbonílico Simbolo de lewis
Simbolo de lewis Los monosacaridos tienen poder reductor
Los monosacaridos tienen poder reductor