ENLACE QUMICO 1 En esta presentacin se incluye











- Slides: 23

ENLACE QUÍMICO 1

En esta presentación se incluye material didáctico elaborado por: Dra. Paola Gómez-Tagle Dra. Erika Martin Arrieta Dr. Laura Ma. Gasque Silva 2

Teoría de repulsión de pares electrónicos de la capa de valencia (TRPECV) Gillespie R. J. y Nyholm R. S. AXn. Em A= átomo central X= substituyentes E= pares solitarios Pares electrónicos totales= pares electrónicos compartidos + pares solitarios PT=PC+E 3

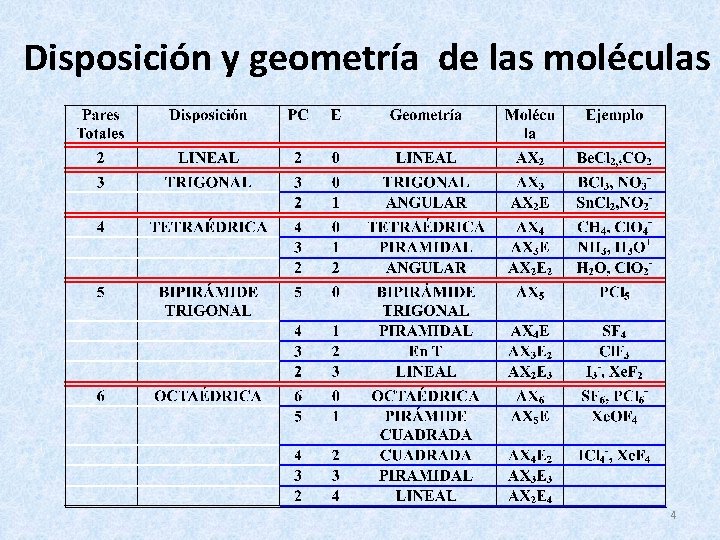
Disposición y geometría de las moléculas 4

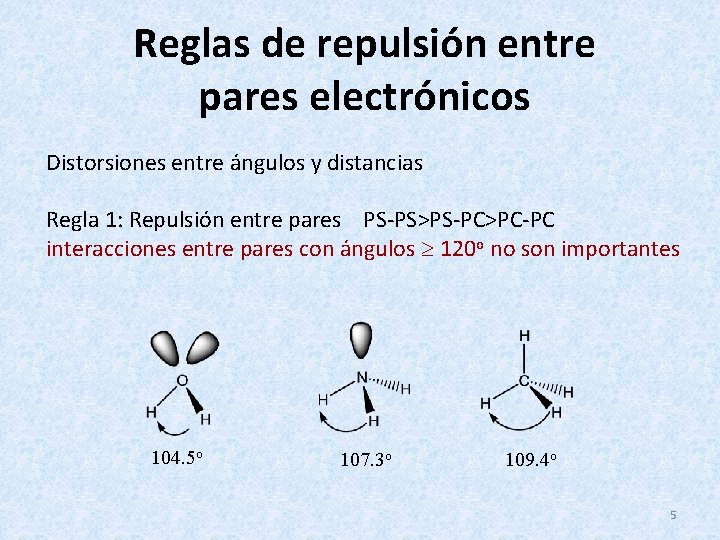
Reglas de repulsión entre pares electrónicos Distorsiones entre ángulos y distancias Regla 1: Repulsión entre pares PS-PS>PS-PC>PC-PC interacciones entre pares con ángulos 120 o no son importantes 104. 5 o 107. 3 o 109. 4 o 5

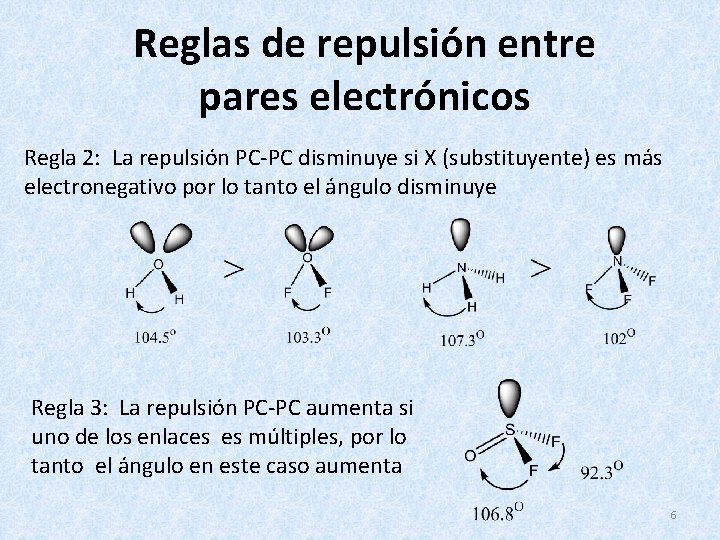
Reglas de repulsión entre pares electrónicos Regla 2: La repulsión PC-PC disminuye si X (substituyente) es más electronegativo por lo tanto el ángulo disminuye Regla 3: La repulsión PC-PC aumenta si uno de los enlaces es múltiples, por lo tanto el ángulo en este caso aumenta 6

Las estructuras y las geometrías de las moléculas 7

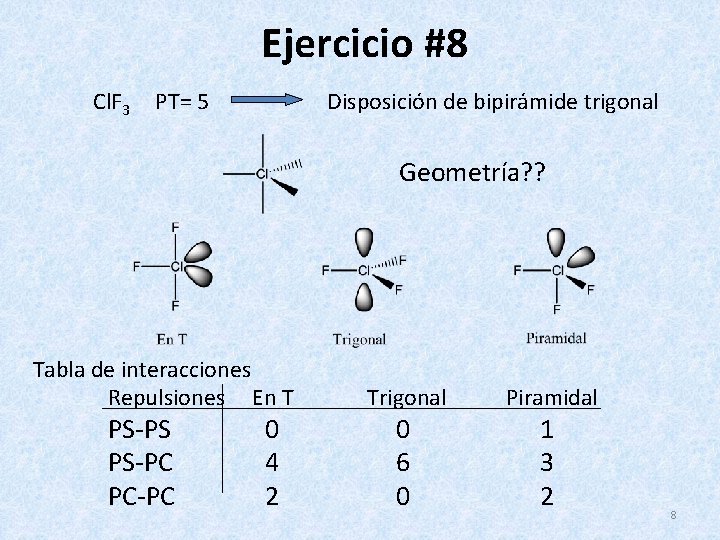
Ejercicio #8 Cl. F 3 PT= 5 Disposición de bipirámide trigonal Geometría? ? Tabla de interacciones Repulsiones En T PS-PS PS-PC PC-PC 0 4 2 Trigonal Piramidal 0 6 0 1 3 2 8

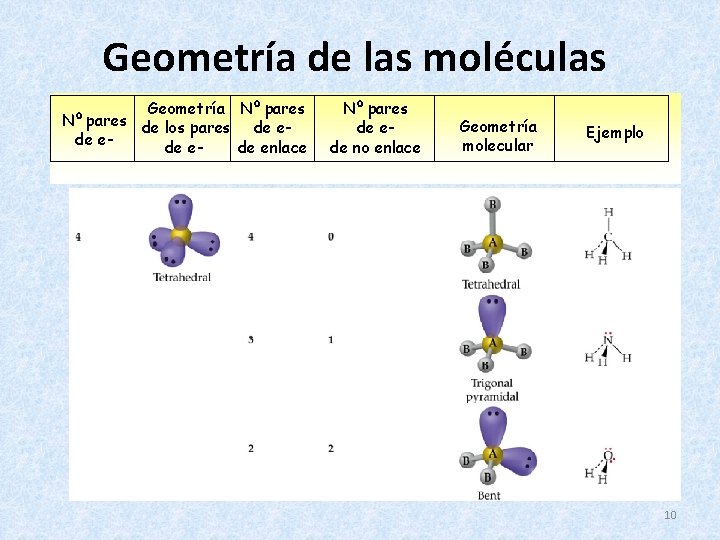
Geometría de las moléculas Geometría Nº pares de los pares de ede enlace Nº pares de ede no enlace Geometría molecular Ejemplo 9

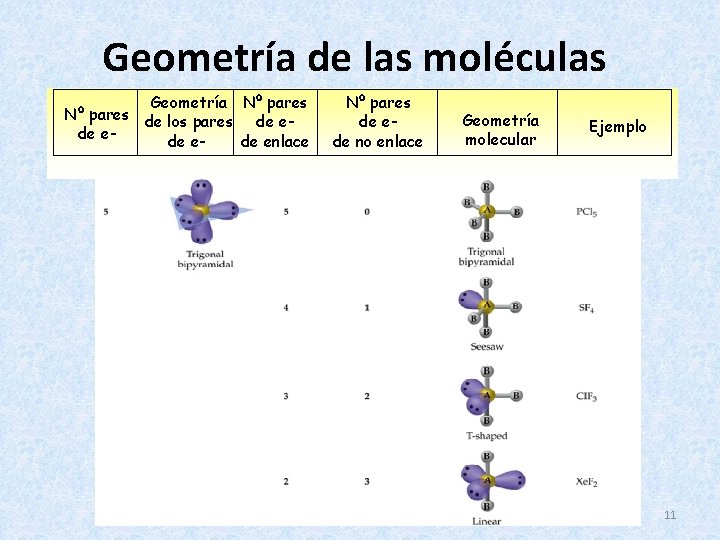
Geometría de las moléculas Geometría Nº pares de los pares de ede enlace Nº pares de ede no enlace Geometría molecular Ejemplo 10

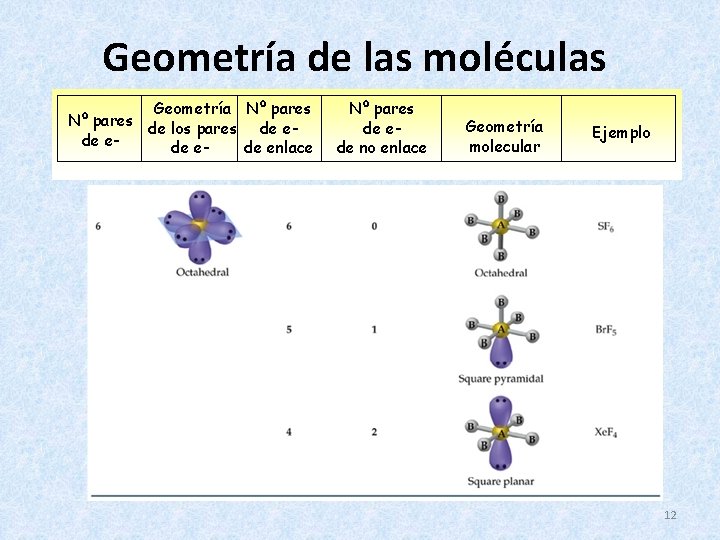
Geometría de las moléculas Geometría Nº pares de los pares de ede enlace Nº pares de ede no enlace Geometría molecular Ejemplo 11

Geometría de las moléculas Geometría Nº pares de los pares de ede enlace Nº pares de ede no enlace Geometría molecular Ejemplo 12

Ejercicio #9 Escribir la estructura de Lewis y determinar la disposición y la geometría de las siguientes especies: 01. - PCl 3 02. - PCl 5 03. - H 2 SO 3 04. - CN 05. - NH 4+ 06. - NH 3 07. - I 3 08. - SCl 6 09. - BF 3 10. - H 3 BO 3 13

Polaridad del enlace Los enlaces covalentes y las moléculas unidas por ellos pueden ser: Polares: Existe una distribución asimétrica de los electrones, el enlace o la molécula posee un polo + y uno -, o un dipolo No polares: Existe una distribución simétrica de los e-, produciendo un enlace o molécula sin dipolo. Enlaces covalentes polares Enlaces covalentes no polares H-H F-F El grado de polaridad de un enlace covalente está relacionado con la diferencia de electronegatividad de los átomos unidos. 14

Polaridad del enlace Polarity of bonds H Cl Carga postiva pequeña Menor electronegatividad Carga negativa pequeña Mayor electronegatividad 15

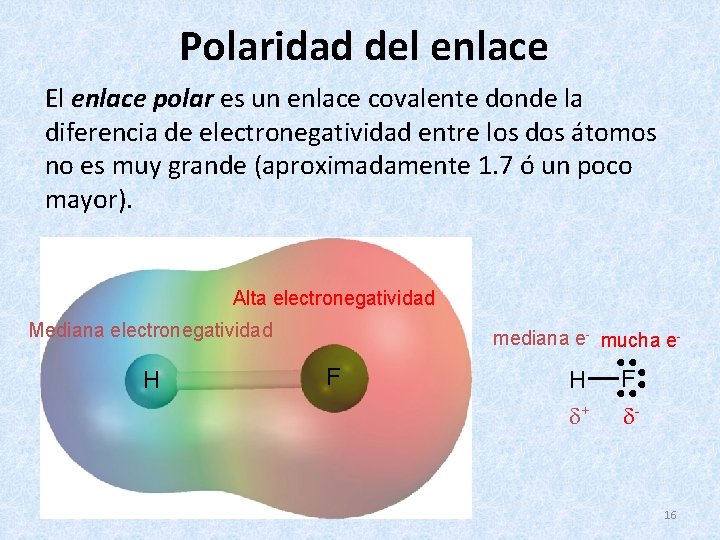
Polaridad del enlace El enlace polar es un enlace covalente donde la diferencia de electronegatividad entre los dos átomos no es muy grande (aproximadamente 1. 7 ó un poco mayor). Alta electronegatividad Mediana electronegatividad H mediana e- mucha e- F H + F - 16

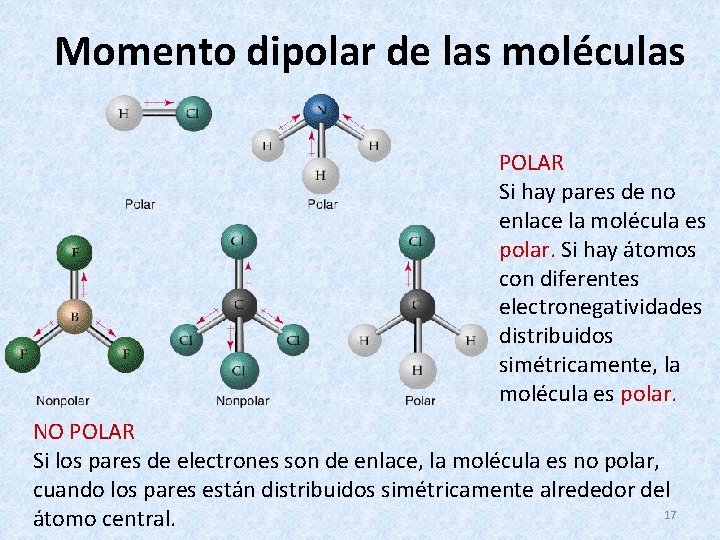
Momento dipolar de las moléculas POLAR Si hay pares de no enlace la molécula es polar. Si hay átomos con diferentes electronegatividades distribuidos simétricamente, la molécula es polar. NO POLAR Si los pares de electrones son de enlace, la molécula es no polar, cuando los pares están distribuidos simétricamente alrededor del 17 átomo central.

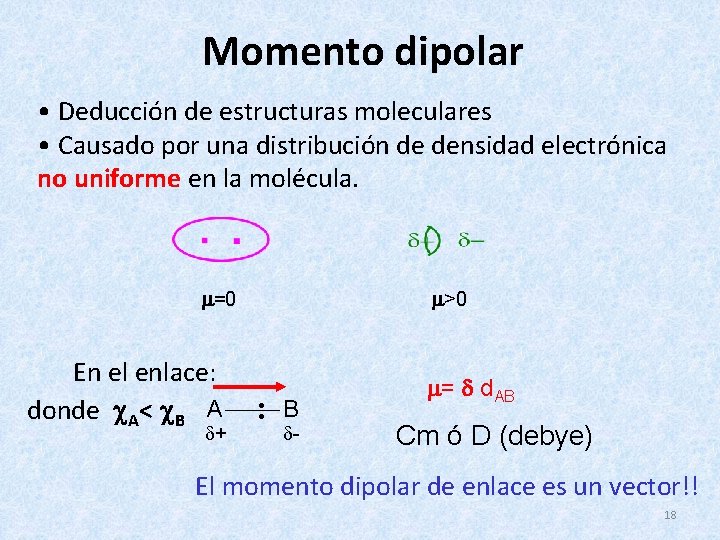
Momento dipolar • Deducción de estructuras moleculares • Causado por una distribución de densidad electrónica no uniforme en la molécula. =0 En el enlace: donde A< B A + >0 : B - = d. AB Cm ó D (debye) El momento dipolar de enlace es un vector!! 18

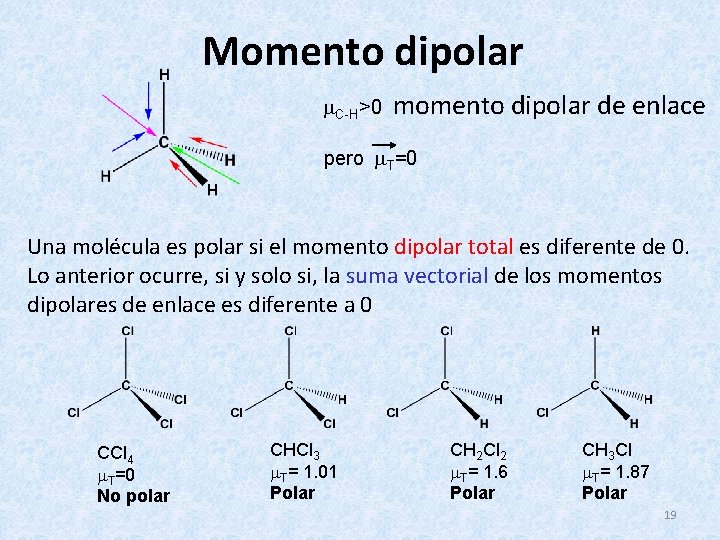
Momento dipolar C-H>0 momento dipolar de enlace pero T=0 Una molécula es polar si el momento dipolar total es diferente de 0. Lo anterior ocurre, si y solo si, la suma vectorial de los momentos dipolares de enlace es diferente a 0 CCl 4 T=0 No polar CHCl 3 T= 1. 01 Polar CH 2 Cl 2 T= 1. 6 Polar CH 3 Cl T= 1. 87 Polar 19

Momento dipolar Me. OH T=1. 7 Polar Acetona T=2. 88 Polar Agua T=1. 85 Polar Éter metílico T=1. 15 Polar Dimetilsulfóxido T=3. 93 Polar Ciclohexano T=0 No Polar hexano T=0. 012 Silla Bote 20

INTERACCIONES INTERMOLECULARES 21

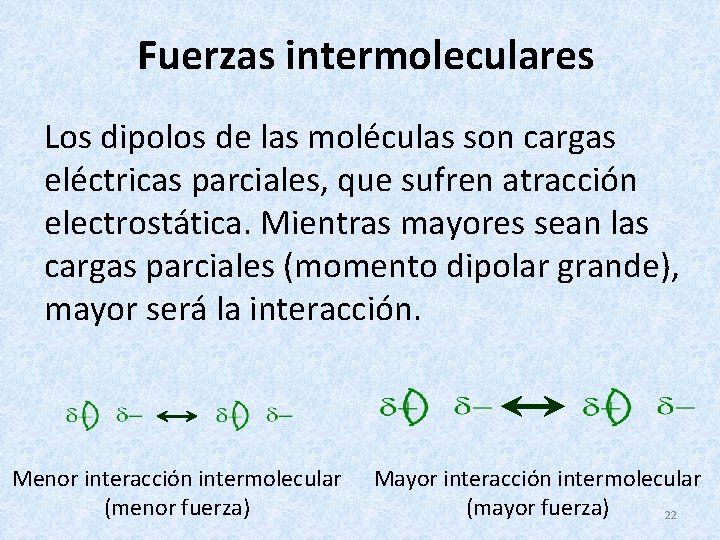
Fuerzas intermoleculares Los dipolos de las moléculas son cargas eléctricas parciales, que sufren atracción electrostática. Mientras mayores sean las cargas parciales (momento dipolar grande), mayor será la interacción. Menor interacción intermolecular (menor fuerza) Mayor interacción intermolecular (mayor fuerza) 22

Magnitud de la fuerza de las interacciones intermoleculares Tipo de interacción Fuerza relativa Función energía-distancia covalente Muy fuerte Compleja, pero de largo alcance Iónica Muy fuerte Relativamente de largo alcance 1/r Ión-Ión Muy fuerte Relativamente de largo alcance 1/r Ión-dipolo Fuerte 1/r 2, de corto alcance Dipolo-dipolo Moderadamente fuerte 1/r 3, de corto alcance Ión-dipolo inducido Débil 1/r 4, de muy corto alcance Dipolo-dipolo inducido Muy débil 1/r 5, de alcance extremadamente corto Dip. instantáneo-dip. inducido Extremadamente débil 1/r 5, de extremadamente corto alcance 23
 Polar y no polar
Polar y no polar Estructura de lewis de hf
Estructura de lewis de hf Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Intervalos automáticos o manuales de powerpoint
Intervalos automáticos o manuales de powerpoint Enlaces sigmas
Enlaces sigmas Habitat del reino plantae
Habitat del reino plantae Señala la alternativa que no presenta un verbo irregular.
Señala la alternativa que no presenta un verbo irregular. Que son las preguntas mixtas
Que son las preguntas mixtas Cara triste
Cara triste Enlace quimico metalico
Enlace quimico metalico Enlace covalente normal
Enlace covalente normal Planteamiento del problema de investigación
Planteamiento del problema de investigación Isomeros constitucionales
Isomeros constitucionales Palabras conectores
Palabras conectores Tipos de enlaces quimicos
Tipos de enlaces quimicos Enlace ionico
Enlace ionico Hibridacion quimica organica
Hibridacion quimica organica Enlace so
Enlace so Enlace polar
Enlace polar Es el enlace característico en los compuestos orgánicos.
Es el enlace característico en los compuestos orgánicos. Regla del dueto
Regla del dueto F2 estructura de lewis
F2 estructura de lewis