ENLACES QUIMICOS En la naturaleza todo tiende a








- Slides: 11

ENLACES QUIMICOS En la naturaleza, todo tiende a un equilibrio, a la estabilidad. Un cuerpo con relación al piso puede tener diferentes posiciones pero siempre buscara la mayor estabilidad

¿QUÉ MANTIENE UNIDO A LOS ATÓMOS? Un concepto básico en química es el estudio de cómo los átomos forman compuestos. La mayoría de los elementos que conocemos existen en la naturaleza formando agrupaciones de átomos iguales o de distintos tipos, enlazados entre sí.

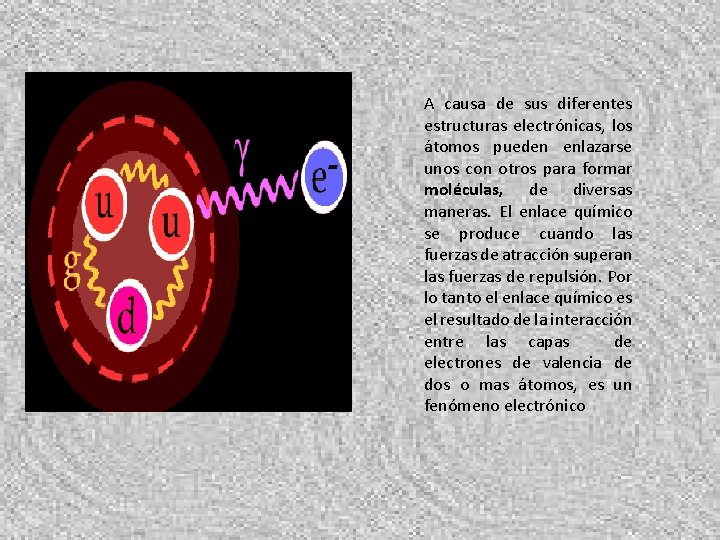
A causa de sus diferentes estructuras electrónicas, los átomos pueden enlazarse unos con otros para formar moléculas, de diversas maneras. El enlace químico se produce cuando las fuerzas de atracción superan las fuerzas de repulsión. Por lo tanto el enlace químico es el resultado de la interacción entre las capas de electrones de valencia de dos o mas átomos, es un fenómeno electrónico

TEORIAS SOBRE EL ENLACE QUIMICO 2 1 Hacia 1916 G. N. Lewis (2) y R. Kossel (1), propuesiron las siguientes teorias: • Un enlace iónico resulta de la transferencia de electrones de un átomo a otro • Un enlace covalente es el resultado de compartir un par de electrones entre dos átomos • Los átomos transfieren o comparten electrones para alcanzar una configuración electrónica que los hace estable energéticamente y que coincide con la configuración del gas noble

ENLACE IONICO Y COVALENTE El enlace iónico se forma por transferencia de electrones del nivel mas exterior, resulta por la atracción de iones cargas opuestas El enlace covalente resulta de la compartición de electrones Enlace iónico

TEORIA DEL ENLACE DE VALENCIA Esta teoría retiene el concepto de Lewis, considerando que el enlace se forma por superposición de orbitales atómico cuando los átomos se acercan uno al otro, sin perder su identidad Los electrones quedan localizados entre los dos núcleos de los átomos bajo su influencia. La fuerza de este enlace es proporcional a la superposición de los orbitales atómicos.

TEORIA DE LA ORBITA MOLECULAR Esta teoría, considera que al formarse la molécula desaparecen los orbitales atómicos de todos los átomos y se produce una nueva serie de orbitales moleculares que pertenecen a la molécula y son controlados por todos los núcleos que forman parte de esta. Cuando los electrones del enlace se localizan entre los núcleos se forma un orbital molecular enlazante, cuando los electrones se localizan fuera de esa región se forma un orbital molecular anti-enlazante

El enlace covalente es el resultado de compartir un par de electrones de enlace entre dos átomos. Los electrones compartidos resultan as u vez de la fusión de orbitales atómicos para orbitales moleculares

REPRESENTACION DE LOS ENLACES COVALENTES 1) Enlace simple: es la unión resultante de compartir un par de electrones. 2) Enlaces dobles o triples: Dos átomos pueden compartir también dos o tres pares de electrones

¿CUANDO SE FORMA ENLACES COVALENTES? Cuando la diferencia de electronegatividad entre dos átomos es elevada-mayor que 1. 7 - se forman enlaces iónicos. Por ejemplo, un átomo de sodio-electronegatividad 0. 9 -ejerce poca atracción sobre su electrón de enlace, transfiriéndolo con facilidad a un átomo de cloroelectronegatividad 3. 0 Mientras que la diferencia de electronegatividad entre dos átomos de carbono es cero, entre uno de carbono y uno de hidrogeno es 0. 4 y entre uno de carbono y uno de cloro es 0. 5. Cuando la diferencia de electronegatividad es baja-menor que 1. 7 -, se forman enlaces covalentes

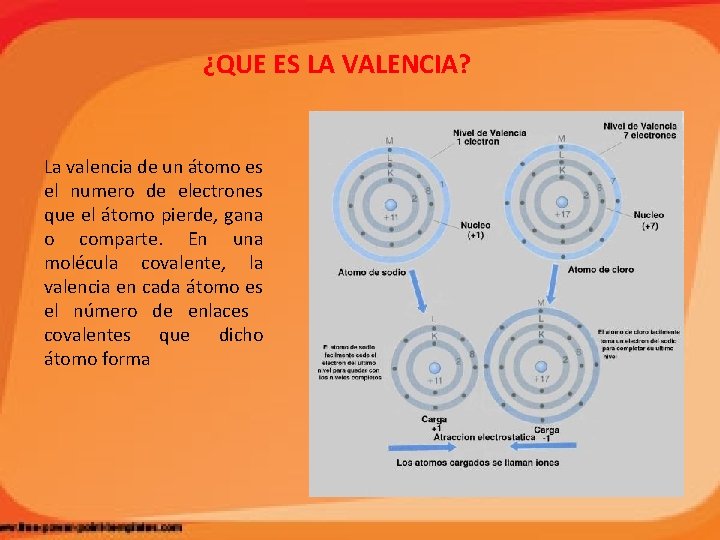
¿QUE ES LA VALENCIA? La valencia de un átomo es el numero de electrones que el átomo pierde, gana o comparte. En una molécula covalente, la valencia en cada átomo es el número de enlaces covalentes que dicho átomo forma
 Naturaleza del enlace
Naturaleza del enlace Diferencias entre enlace ionico y covalente
Diferencias entre enlace ionico y covalente Tipos de enlaces
Tipos de enlaces Objetivos de enlaces quimicos
Objetivos de enlaces quimicos Entalpia de reaccion
Entalpia de reaccion Eenheden tienden honderdsten
Eenheden tienden honderdsten Enlace sigma y pi del carbono
Enlace sigma y pi del carbono Todo tiene su tiempo
Todo tiene su tiempo Todo lo que pasa es relativo
Todo lo que pasa es relativo Dejando ciertamente lo que queda atras
Dejando ciertamente lo que queda atras Instituto americano de ingenieros químicos
Instituto americano de ingenieros químicos Fenômeno químico
Fenômeno químico