ENLACES QUIMICOS Lic Yeiner Jos Mojica Lin PROPIEDADES















- Slides: 30

ENLACES QUIMICOS Lic. Yeiner José Mojica Liñán

PROPIEDADES PERIÓDICAS Las propiedades químicas de un elemento dependen de la situación de los electrones en su corteza, es decir, de la situación de sus electrones en la corteza. Por tanto, todos los electrones que tengan configuración electrónica semejante en el nivel más externo tendrán propiedades químicas parecidas.

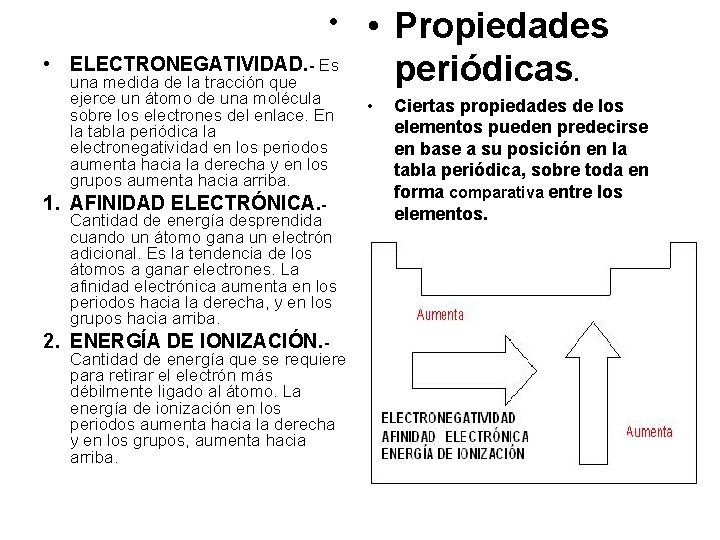
• • ELECTRONEGATIVIDAD. - Es 1. 2. una medida de la tracción que ejerce un átomo de una molécula sobre los electrones del enlace. En la tabla periódica la electronegatividad en los periodos aumenta hacia la derecha y en los grupos aumenta hacia arriba. AFINIDAD ELECTRÓNICA. Cantidad de energía desprendida cuando un átomo gana un electrón adicional. Es la tendencia de los átomos a ganar electrones. La afinidad electrónica aumenta en los periodos hacia la derecha, y en los grupos hacia arriba. ENERGÍA DE IONIZACIÓN. Cantidad de energía que se requiere para retirar el electrón más débilmente ligado al átomo. La energía de ionización en los periodos aumenta hacia la derecha y en los grupos, aumenta hacia arriba. • Propiedades periódicas. • Ciertas propiedades de los elementos pueden predecirse en base a su posición en la tabla periódica, sobre toda en forma comparativa entre los elementos.

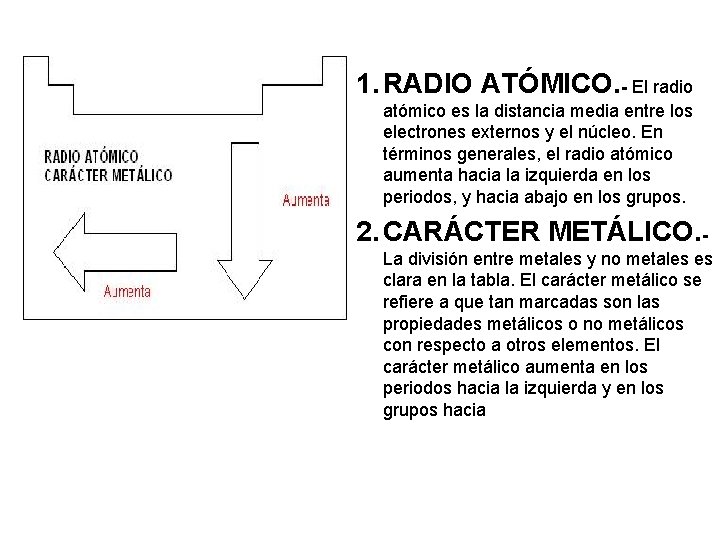
1. RADIO ATÓMICO. - El radio atómico es la distancia media entre los electrones externos y el núcleo. En términos generales, el radio atómico aumenta hacia la izquierda en los periodos, y hacia abajo en los grupos. 2. CARÁCTER METÁLICO. La división entre metales y no metales es clara en la tabla. El carácter metálico se refiere a que tan marcadas son las propiedades metálicos o no metálicos con respecto a otros elementos. El carácter metálico aumenta en los periodos hacia la izquierda y en los grupos hacia

ENLACE QUÍMICO 1. . Concepto de enlace químico 1. 1. Energía y estabilidad 1. 2. Estructura de gas noble 1. 3. Clases de químicos enlaces 2. . Enlace iónico 2. 1. Estructura de los compuestos iónicos 3. . Enlace covalente 3. 1. Modelo de Lewis 3. 2. Teoría del enlace de valencia 3. 3. Polarización del enlace covalente 4. . Enlace metálico 5. . Enlaces intermoleculares 6. . Tipos de sustancias según sus enlaces 10/30/2020 5

1. . Concepto de enlace químico De los 118 elementos que actualmente conocemos, 90 son pueden encontrar en la naturaleza pero nunca solos (excepto los gases nobles y a veces los metales nobles y algún otro) sino formando parte de un compuesto. Decimos que los átomos de esos elementos se unen, se combinan, formando enlaces químicos. Las fuerzas que mantienen unidas a los átomos, los iones o las moléculas que forman las sustancias químicas, tanto simples como compuestas, de manera estable, se llaman ENLACE QUÍMICO . 10/30/2020 Departamento de Física y Química - IPFA Cádiz 6

1. 2. Estructura de gas noble Decíamos al principio que todos los elementos se encuentran en la naturaleza combinados con otro(s) elementos , excepto los gases nobles. Estos tienen su última capa electrónica, la capa de valencia, completa con 8 electrones ( excepto el helio que la completa con 2) Configuración electrónica Esta estructura con 8 electrones de valencia recibe el nombre de octeto electrónico y tiene las siguientes características: • Es la responsable de la especial estabilidad de los gases nobles, que explica el hecho que estos no se combinen con otros elementos. • En los elementos existe la tendencia a combinarse para conseguir la estructura de gas noble, con lo que aumentan su estabilidad. Estos hechos experimentales han llevado a los químicos a enunciar una regla de gran interés: la regla del octeto Muchos elementos, al unirse con otros, manifiestan la tendencia a adquirir la estructura electrónica externa propia de los gas noble, esto es, tener 8 electrones en su última capa. La regla del octeto no tiene validez general, siendo especialmente aplicable a los elementos representativos 10/30/2020 7

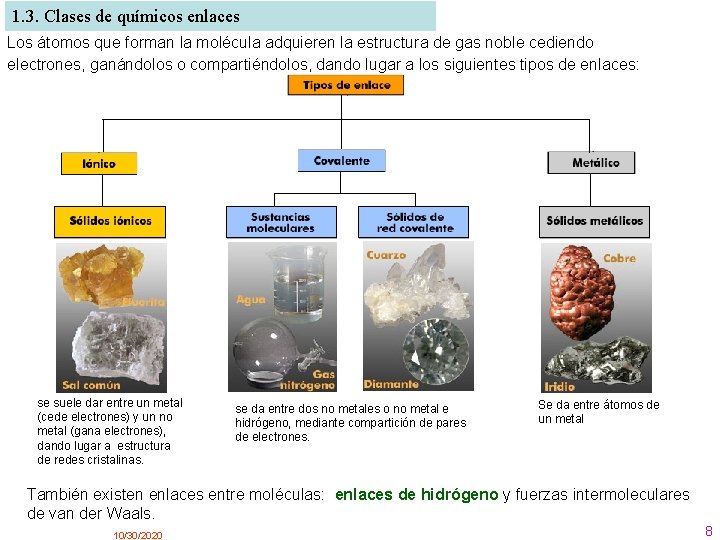
1. 3. Clases de químicos enlaces Los átomos que forman la molécula adquieren la estructura de gas noble cediendo electrones, ganándolos o compartiéndolos, dando lugar a los siguientes tipos de enlaces: se suele dar entre un metal (cede electrones) y un no metal (gana electrones), dando lugar a estructura de redes cristalinas. se da entre dos no metales o no metal e hidrógeno, mediante compartición de pares de electrones. Se da entre átomos de un metal También existen enlaces entre moléculas: enlaces de hidrógeno y fuerzas intermoleculares de van der Waals. 10/30/2020 8

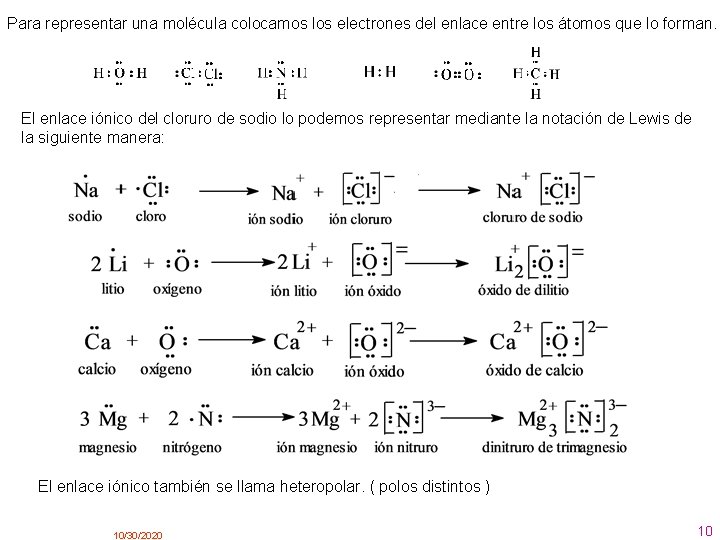
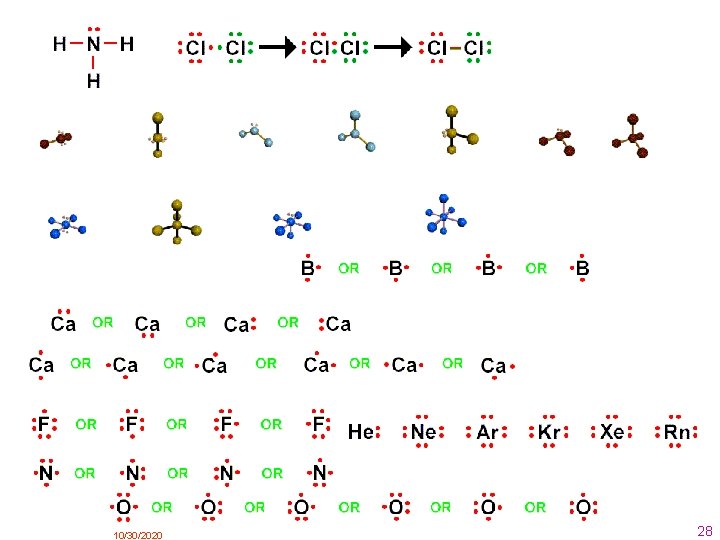
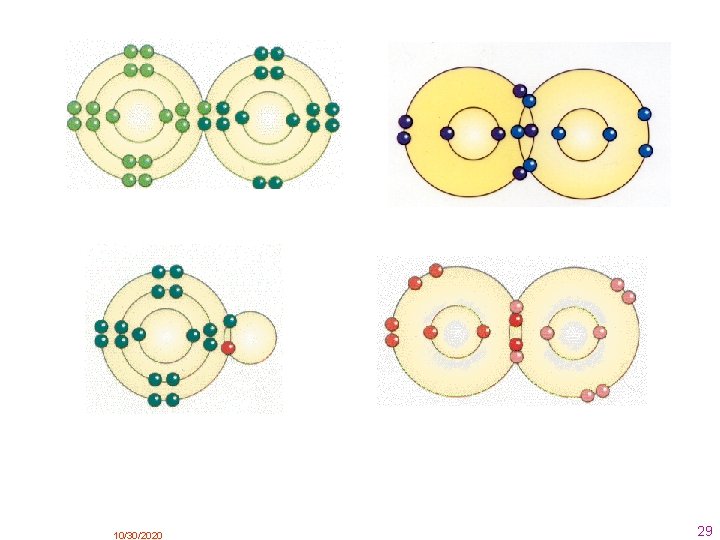
2. . Enlace iónico Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica ). En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos (cationes) y negativos (aniones, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas llamamos enlaces iónicos. Como ejemplo veamos el enlace iónico entre el cloro y el sodio: 1 Na (Z = 11) 1 s 2 2 s 2 p 6 3 s Na+ (Z = 11) 1 s 2 2 s 2 p 6 Cl (Z = 17) 1 s 2 2 s 2 p 6 3 s 2 p 5 + Cl– (Z = 17) 1 s 2 2 s 2 p 6 3 s 2 p 6 (anión cloruro) átomos Enlace iónico (catión sodio) Iones, que se unen mediante fuerza eléctrostática (Coulomb) También podemos representar este enlace mediante los diagramas o notación de Lewis. Es un modo de representar a los átomos y sus enlaces, propuesto por el químico G. N. Lewis Para representar un átomo, escribimos el símbolo del elemento y lo rodeamos de tantos puntos como electrones de valencia tenga. 10/30/2020 9

Para representar una molécula colocamos los electrones del enlace entre los átomos que lo forman. El enlace iónico del cloruro de sodio lo podemos representar mediante la notación de Lewis de la siguiente manera: El enlace iónico también se llama heteropolar. ( polos distintos ) 10/30/2020 10

2. 1. Estructura de los compuestos iónicos La atracción electrostática no se limita a un sólo ión, sino que cada uno de ellos se rodea del número máximo posible de iones de carga opuesta, formando una red cristalina iónica tridimensional. Los compuestos iónicos no forman moléculas independientes. Enlace iónico Llamamos índice de coordinación de un compuesto iónico al número de iones de un signo que rodean a un ión de signo contrario. Compuesto índice de coordinación Cloruro de sodio Na. Cl 6: 6 Cloruro de cesio Cs. Cl 8: 8 Fluoruro de calcio Ca. F 2 8: 4 El tipo de enlace de un compuesto determina la mayoría de sus propiedades. Propiedades de las sustancias iónicas: • Las sustancias iónicas se encuentran en la naturaleza formando redes cristalinas, por tanto son sólidas. • Son duros y frágiles y tienen puntos de fusión y ebullición altos. • Son solubles en disolventes polares como el agua. • Conducen la corriente eléctrica disueltos o fundidos. 10/30/2020 11

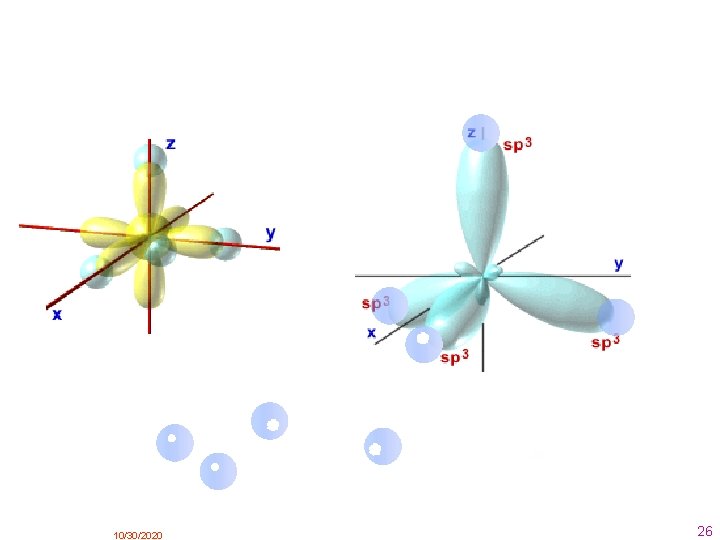
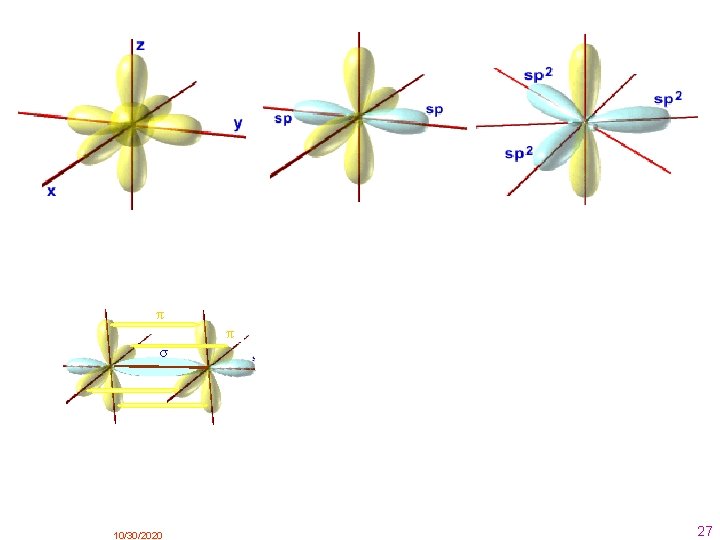
3. . Enlace covalente Cuando uno de los átomos tiene tendencia a ceder electrones y el otro a ganarlos, hemos visto que se unen mediante un enlace iónico. Pero ¿ qué ocurre cuando ambos tienen tendencia a ganarlos? En este caso, se unen COMPARTIENDO PARES DE ELECTRONES, que es lo que caracteriza al enlace covalente. • Si los átomos comparten un par de electrones el enlace es SIMPLE. • Si los átomos comparten dos pares de electrones el enlace es DOBLE. • Si los átomos comparten tres pares de electrones el enlace es TRIPLE. Hay varias teorias o modelos: 3. 1. Modelo de Lewis Se basa en la regla del octeto. Los electrones compartidos son aportados a partes iguales por cada uno de los átomos que forman el enlace, aunque existe la posibilidad de que los electrones sean aportados por uno sólo de los átomos ( enlace covalente coordinado o dativo) Ya dijimos al principio que la regla del octeto no tiene validez general. 10/30/2020 12

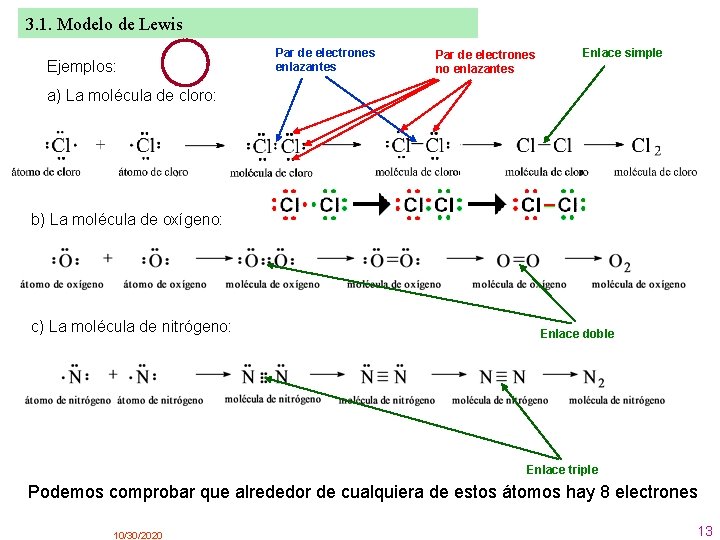
3. 1. Modelo de Lewis Ejemplos: Par de electrones enlazantes Par de electrones no enlazantes Enlace simple a) La molécula de cloro: b) La molécula de oxígeno: c) La molécula de nitrógeno: Enlace doble Enlace triple Podemos comprobar que alrededor de cualquiera de estos átomos hay 8 electrones 10/30/2020 13

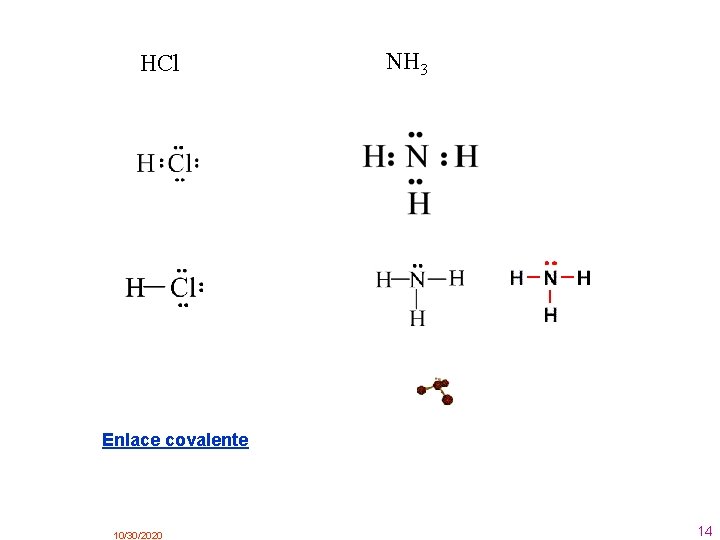
HCl NH 3 Enlace covalente 10/30/2020 14

Como vemos en los ejemplos anteriores tenemos que decidir cómo colocar los electrones en torno a los átomos enlazados, esto es, cuántos de los electrones de valencia disponibles son electrones enlazantes (compartidos) y cuántos son electrones no enlazantes (no compartidos) ( asociados a un solo átomo) Para dibujar las estructuras de Lewis se puede seguir el siguiente método: 1. Se colocan los átomos de la molécula ( o ión poliatómico) de la forma más simétrica posible. 2. Se determina el nº de electrones disponibles D en la capa externa de todos los átomos de la molécula o ión poliatómico ( en este caso hay que añadir un electrón por cada carga negativa que tenga el ión o restar un electrón por cada carga positiva que tenga). 3. Se calcula el número total de electrones N de las capas externas que necesitan todos los átomos de la molécula o ión poliatómico para tener configuración de gas noble. N = 8 · número de átomos sin incluir átomos de H + 2 · número de átomos de H 4. El nº total de electrones compartidos C es: C=N–D 5. Se colocan los electrones C como pares compartidos entre los átomos que forman enlaces. 6. El resto de los electrones hasta completar D se colocan como pares no compartidos para completar el octeto de todos los átomos. 10/30/2020 15

Seguiremos el método anterior para escribir el diagrama o estructura de Lewis para la molécula del agua, H 2 O 1. Se colocan los átomos de la molécula ( o ión poliatómico) de la forma más simétrica posible. H O H 2. Se determina el nº de electrones disponibles D en la capa externa de todos los átomos de la molécula o ión poliatómico ( en este caso hay que añadir un electrón por cada carga negativa que tenga el ión o restar un electrón por cada carga positiva que tenga). D = 1+ 6 + 1 = 8 3. Se calcula el número total de electrones N de las capas externas que necesitan todos los átomos de la molécula o ión poliatómico para tener configuración de gas noble. N = 8 · número de átomos sin incluir átomos de H + 2 · número de átomos de H N = 8 · 1 + 2 · 2 = 12 4. El nº total de electrones compartidos C es: C=N–D = 12 – 8 = 4 5. Se colocan los electrones C como pares compartidos entre los átomos que forman enlaces. Tenemos que colocar 4 electrones, es decir, 2 pares 6. El resto de los electrones hasta completar D se colocan como pares no compartidos para completar el octeto de todos los átomos. Tenemos que colocar otros 4 electrones para completar los 8 que teníamos al principio, mirando que se cumpla la regla del octeto. 10/30/2020 16

Seguiremos el método anterior para escribir el diagrama o estructura de Lewis para la molécula del dióxido de carbono, CO 2 1. Se colocan los átomos de la molécula ( o ión poliatómico) de la forma más simétrica posible. O C O 2. Se determina el nº de electrones disponibles D en la capa externa de todos los átomos de la molécula o ión poliatómico ( en este caso hay que añadir un electrón por cada carga negativa que tenga el ión o restar un electrón por cada carga positiva que tenga). D = 6+ 4 + 6 = 16 3. Se calcula el número total de electrones N de las capas externas que necesitan todos los átomos de la molécula o ión poliatómico para tener configuración de gas noble. N = 8 · número de átomos sin incluir átomos de H + 2 · número de átomos de H N = 8 · 3 = 24 4. El nº total de electrones compartidos C es: C=N–D = 24 – 16 = 8 5. Se colocan los electrones C como pares compartidos entre los átomos que forman enlaces. Tenemos que colocar 8 electrones, es decir, 4 pares 6. El resto de los electrones hasta completar D se colocan como pares no compartidos para completar el octeto de todos los átomos. Tenemos que colocar otros 8 electrones para completar los 16 que teníamos al principio, mirando que se cumpla la regla del octeto. 10/30/2020 17

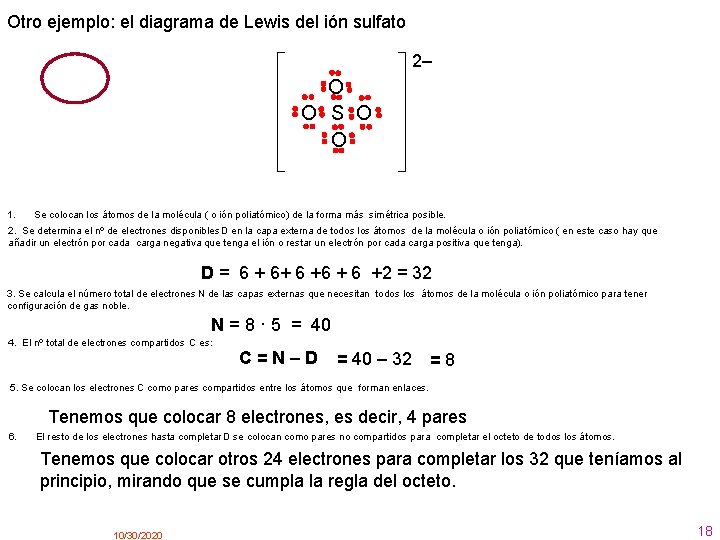
Otro ejemplo: el diagrama de Lewis del ión sulfato 2– O O S O O 1. Se colocan los átomos de la molécula ( o ión poliatómico) de la forma más simétrica posible. 2. Se determina el nº de electrones disponibles D en la capa externa de todos los átomos de la molécula o ión poliatómico ( en este caso hay que añadir un electrón por cada carga negativa que tenga el ión o restar un electrón por cada carga positiva que tenga). D = 6 + 6+ 6 +6 + 6 +2 = 32 3. Se calcula el número total de electrones N de las capas externas que necesitan todos los átomos de la molécula o ión poliatómico para tener configuración de gas noble. N = 8 · 5 = 40 4. El nº total de electrones compartidos C es: C=N–D = 40 – 32 = 8 5. Se colocan los electrones C como pares compartidos entre los átomos que forman enlaces. Tenemos que colocar 8 electrones, es decir, 4 pares 6. El resto de los electrones hasta completar D se colocan como pares no compartidos para completar el octeto de todos los átomos. Tenemos que colocar otros 24 electrones para completar los 32 que teníamos al principio, mirando que se cumpla la regla del octeto. 10/30/2020 18

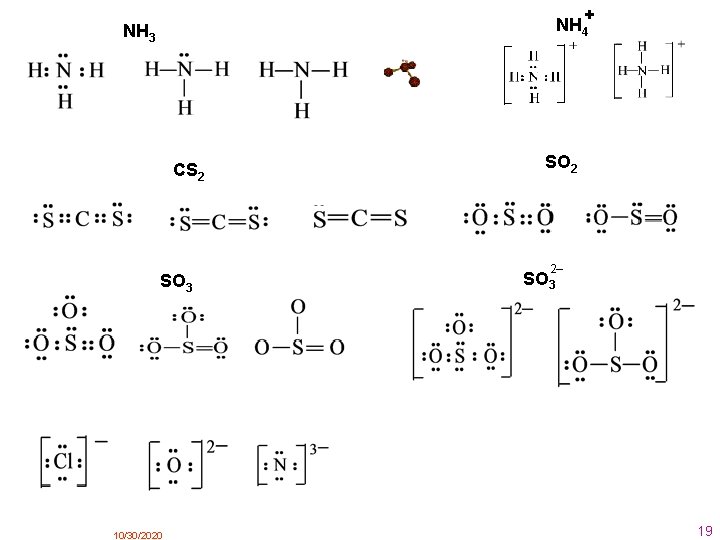
+ NH 4 NH 3 CS 2 SO 3 10/30/2020 SO 2 2– SO 3 19

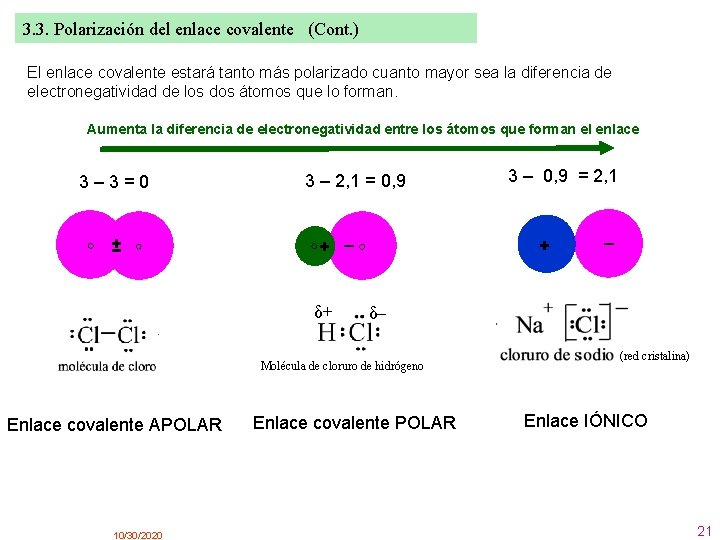
3. 3. Polarización del enlace covalente En un enlace covalente formado por dos átomos iguales, el par de electrones o los pares de electrones es compartido por igual por ambos átomos. Se dice que el enlace es apolar ya que ambos átomos “tiran” con la misma fuerza de los electrones compartidos. Pero si nos fijamos en enlaces covalentes formados por átomos distintos, como el cloruro de hidrógeno: el cloro es más electronegativo que el hidrógeno y tira con más fuerza del par de electrones que comparten, que estará más cerca de él que del hidrógeno. Esto hace que el cloro adquiera una carga parcial negativa δ – , mientras que el hidrógeno tiene una carga parcial positiva δ + , diciéndose que el enlace covalente es polar El enlace covalente polar se forma cuando se unen dos átomos de diferente electronegatividad. Esto produce la aparición de cargas parciales opuestas en los extremos del enlace 10/30/2020 20

3. 3. Polarización del enlace covalente (Cont. ) El enlace covalente estará tanto más polarizado cuanto mayor sea la diferencia de electronegatividad de los dos átomos que lo forman. Aumenta la diferencia de electronegatividad entre los átomos que forman el enlace ± 3 – 2, 1 = 0, 9 + – δ+ 10/30/2020 – δ– Molécula de cloruro de hidrógeno Enlace covalente APOLAR 3 – 0, 9 = 2, 1 + 3– 3=0 Enlace covalente POLAR (red cristalina) Enlace IÓNICO 21

Propiedades de los compuestos covalentes. • Los compuestos covalentes forman moléculas individuales. • Los compuestos covalentes suelen presentarse en estado líquido o gaseoso aunque también pueden ser sólidos. Por lo tanto sus puntos de fusión y ebullición no son elevados • Se disuelven bien en disolventes apolares (éter, gasolina, …. ) pero no en disolventes polares (agua), y es nula su capacidad conductora. • Los sólidos covalentes macromoleculares, tienen altos puntos de fusión y ebullición, son duros, malos conductores y en general insolubles (diamante , cuarzo, …) Compuestos macromoleculares 10/30/2020 22

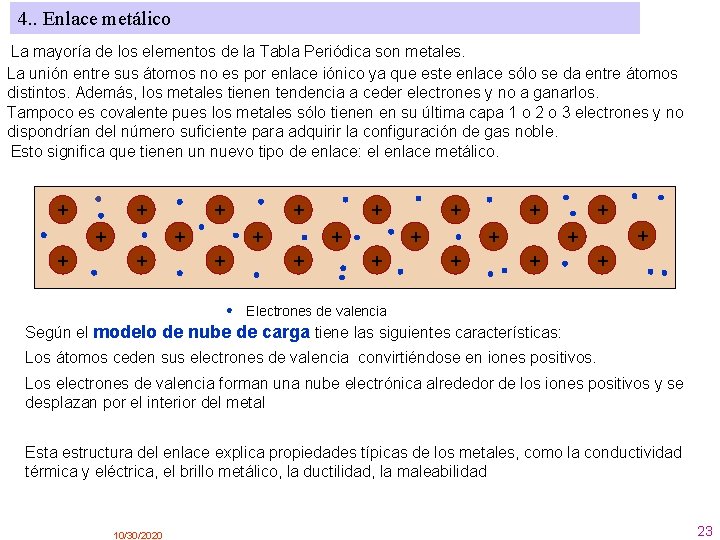
4. . Enlace metálico La mayoría de los elementos de la Tabla Periódica son metales. La unión entre sus átomos no es por enlace iónico ya que este enlace sólo se da entre átomos distintos. Además, los metales tienen tendencia a ceder electrones y no a ganarlos. Tampoco es covalente pues los metales sólo tienen en su última capa 1 o 2 o 3 electrones y no dispondrían del número suficiente para adquirir la configuración de gas noble. Esto significa que tienen un nuevo tipo de enlace: el enlace metálico. + + + + + + Electrones de valencia Según el modelo de nube de carga tiene las siguientes características: Los átomos ceden sus electrones de valencia convirtiéndose en iones positivos. Los electrones de valencia forman una nube electrónica alrededor de los iones positivos y se desplazan por el interior del metal Esta estructura del enlace explica propiedades típicas de los metales, como la conductividad térmica y eléctrica, el brillo metálico, la ductilidad, la maleabilidad 10/30/2020 23

Propiedades de los compuestos metálicos: . Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente. Las conductividades térmicas y eléctricas son muy elevadas. Presentan brillo metálico. Son dúctiles y maleables. Pueden emitir electrones cuando reciben energía en forma de calor o de oem. 10/30/2020 24

Los enlaces metálicos: Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente. Las conductividades térmicas y eléctricas son muy elevadas. Presentan brillo metálico. Son dúctiles y maleables. Pueden emitir electrones cuando reciben energía en forma de calor. 10/30/2020 25

10/30/2020 26

π π σ 10/30/2020 27

10/30/2020 28

10/30/2020 29

10/30/2020 30
 Gmail
Gmail Enlaces quimicos mapa mental
Enlaces quimicos mapa mental Tipos de enlaces quimicos
Tipos de enlaces quimicos Objetivos de enlaces quimicos
Objetivos de enlaces quimicos Como calcular la entalpía de una reacción
Como calcular la entalpía de una reacción Naturaleza del enlace quimico
Naturaleza del enlace quimico Enlaces triples sigma y pi
Enlaces triples sigma y pi Nomenclatura de los hidruros
Nomenclatura de los hidruros Fenômenos físicos e químicos
Fenômenos físicos e químicos Agentes quimicos
Agentes quimicos Fenomenos quimicos ejemplos
Fenomenos quimicos ejemplos Oxoacidos
Oxoacidos Busqueda por imagen
Busqueda por imagen Productos rotulados
Productos rotulados Armazenamento de produtos químicos
Armazenamento de produtos químicos Seudomorfismo
Seudomorfismo Instituto americano de ingenieros químicos
Instituto americano de ingenieros químicos Clasificacion de los elementos quimicos
Clasificacion de los elementos quimicos Elementos quimicos
Elementos quimicos Bacteriostático y bactericida
Bacteriostático y bactericida La materia se clasifica en
La materia se clasifica en Fenômenos químicos
Fenômenos químicos Riesgo quimico
Riesgo quimico Diversidad de la materia
Diversidad de la materia Anabel soto
Anabel soto Ejemplos de compuestos químicos
Ejemplos de compuestos químicos Processos quimicos da digestão
Processos quimicos da digestão Grupo funcional importancia
Grupo funcional importancia Reacción química
Reacción química Elementos quimicos que forman parte de los seres vivos
Elementos quimicos que forman parte de los seres vivos Mutagenos quimicos
Mutagenos quimicos