Mt 2 Enlaces Quimicos Pero primero vamos a

















- Slides: 31

Mt 2 Enlaces Quimicos

• Pero primero, vamos a revisar ¿Cómo se llama la forma más pequeña de un elemento? • ¿Qué significa el número atómico de un elemento nos dice? • ¿Cómo determinamos el número de electrones que se encuentra en la capa exterior? • ¿Que es el nombre de electrones que se encuentran en la capa exterior? • ¿Cómo determinamos el número de capas de electrones que tiene un elemento? •

• ¿Cómo es la estructura de un átomo relacionada con unión? Las clave para responder a esa pregunta está relacionada con el a) Número de electrones de valencia b) Número de capas de electrones

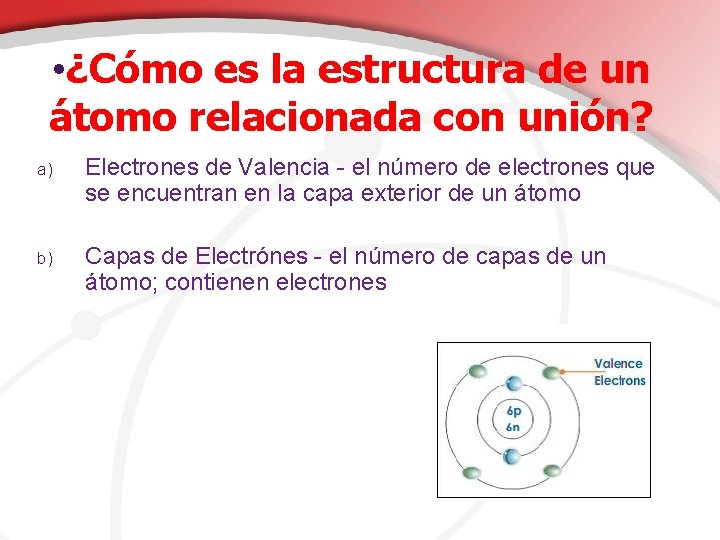
• ¿Cómo es la estructura de un átomo relacionada con unión? a) Electrones de Valencia - el número de electrones que se encuentran en la capa exterior de un átomo b) Capas de Electrónes - el número de capas de un átomo; contienen electrones

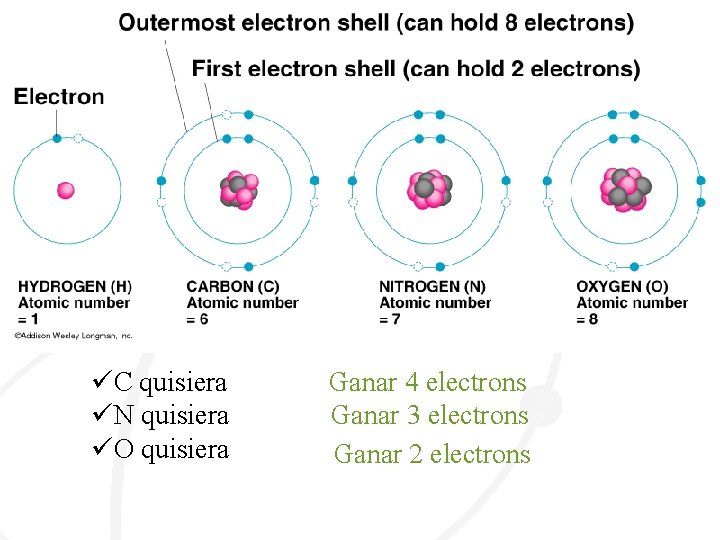
• ¿Por qué quieren los átomos formar un enlace químico? • • Quieren ser más estable • lo que significa que quieren estar en un estado de energía más bajo • Todos los átomos quieren tener una capa EXTERIOR COMPLETO • Los únicos elementos que tienen una capa exterior completa son los Gases Nobel Por lo tanto, todos los elementos quieren parecerse a gases nobles, lo que significa que quieren que sus capas de electrones sen llenados Atomo de Litio Atomo de Neon Gas Noble

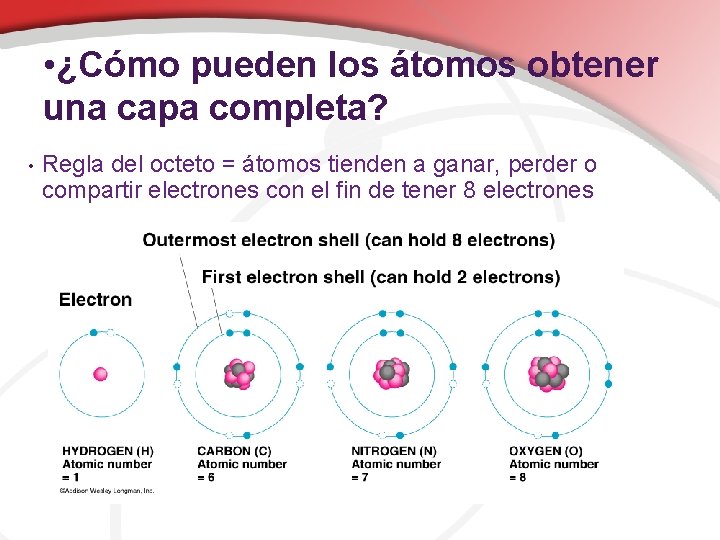
• ¿Cómo pueden los átomos obtener una capa completa? • Regla del octeto = átomos tienden a ganar, perder o compartir electrones con el fin de tener 8 electrones

üC quisiera üN quisiera üO quisiera Ganar 4 electrons Ganar 3 electrons Ganar 2 electrons

• ¿Cuáles son las reglas de capas de electrones? 1) La primera capa puede contener hasta 2 electrones, y cada capa a partir de entonces puede contener hasta 8 electrones. 2) Tenga en cuenta que existen subniveles que también pueden contener diferentes cantidades de electrones. – Pero eso vamos aprendir en la clase de Quimica


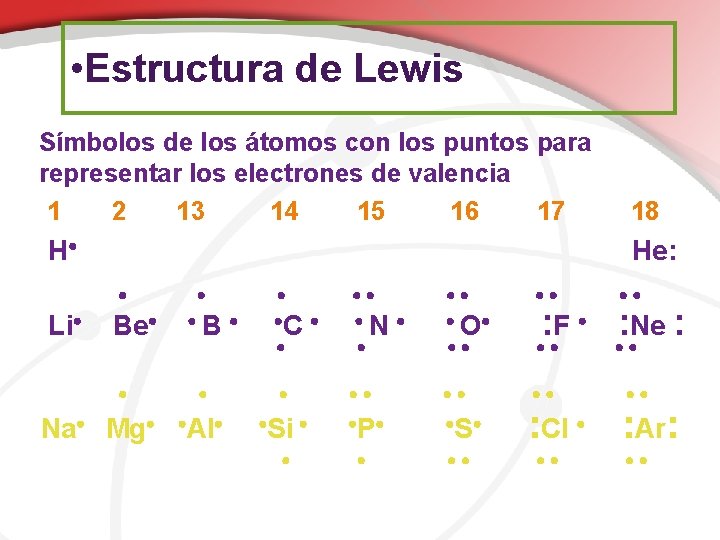
• Estructura de Lewis Símbolos de los átomos con los puntos para representar los electrones de valencia 1 2 13 14 15 16 17 H He: Li 18 Be Na Mg C N O Al Si P S B : F : Ne : : Cl : Ar:

• ¿Qué son los enlaces químicos? un intento de llenar las capas de electrónes Que es creado como resultado de un enlace químico? Una molécula o un compuesto

¿Cuáles son los tipos de enlaces químicos? 1. 2. 3. Los enlaces iónicos Los enlaces covalentes Los enlaces metálicos

Enlace iónico Enlace formado entre dos iones ( un negativo y un positivo) por la transferencia de electrones Estos enlaces conducen la electricidad Ejemplos de Formulas Quimicas: Na. Cl, Ca. Cl 2, K 2 O

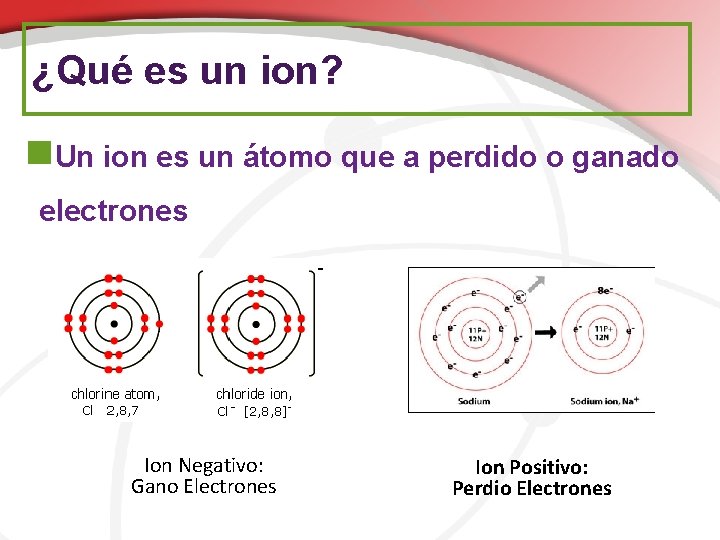
¿Qué es un ion? n. Un ion es un átomo que a perdido o ganado electrones Ion Negativo: Gano Electrones Ion Positivo: Perdio Electrones

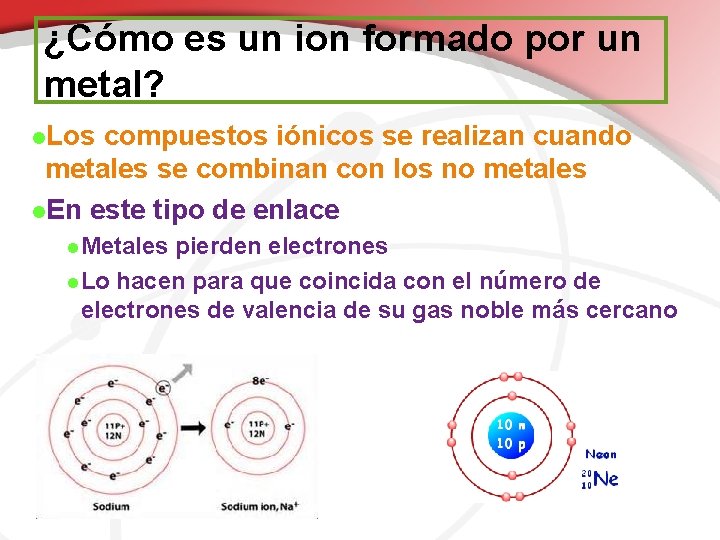
¿Cómo es un ion formado por un metal? l. Los compuestos iónicos se realizan cuando metales se combinan con los no metales l. En este tipo de enlace l. Metales pierden electrones l. Lo hacen para que coincida con el número de electrones de valencia de su gas noble más cercano

¿Cómo es un ion formado por un metal? l. Metales formarán iones positivos l. El número de electrones son menos que el número de protones l. Grupo 1 metales iones 1+ l. Grupo 2 metales iones 2+ l. Grupo 13 metales iones 3+

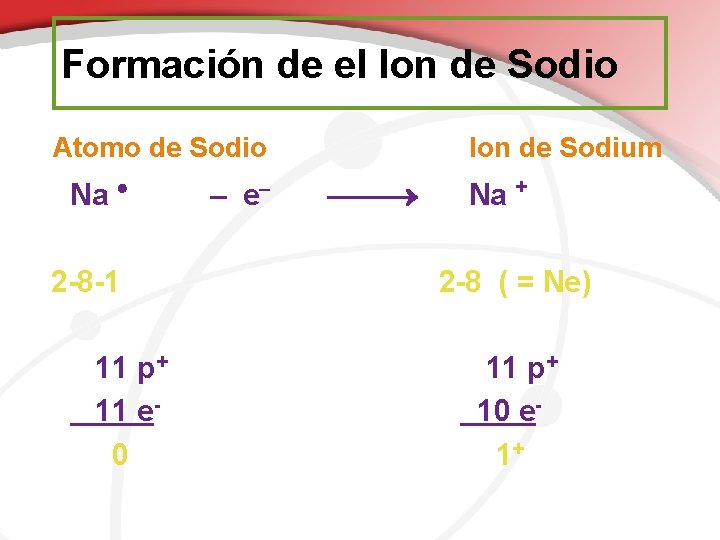
Formación de el Ion de Sodio Atomo de Sodio Na 2 -8 -1 11 p+ 11 e 0 – e Ion de Sodium Na + 2 -8 ( = Ne) 11 p+ 10 e 1+

Algunos iones típicos con cargas positivas (cationes) Grupo 1 Grupo 2 Grupo 13 H+ Mg 2+ Al 3+ Li+ Ca 2+ Na+ Sr 2+ K+ Ba 2+

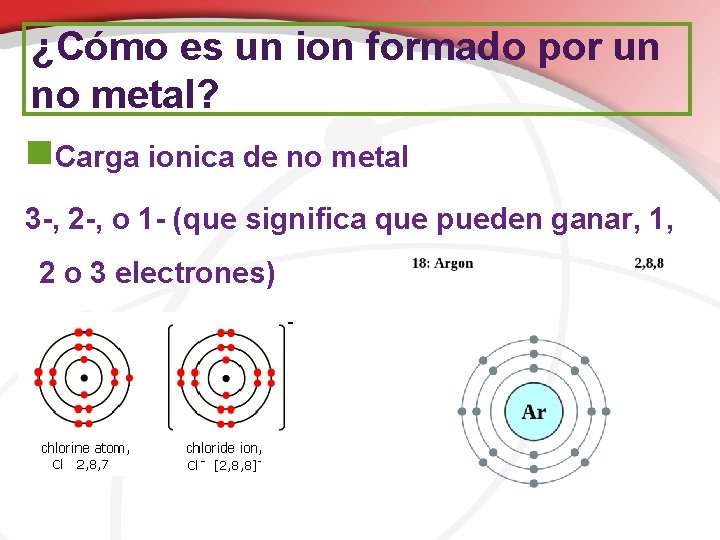
¿Cómo es un ion formado por un no metal? n. En los compuestos iónicos, los no metales del grupo 15, 16, y 17 ganan electrones de los metales n. No metales añaden electrones para lograr la disposición octeto n. Al hacer esto, ellos crean un ion negativo (anión)

¿Cómo es un ion formado por un no metal? n. Carga ionica de no metal 3 -, 2 -, o 1 - (que significa que pueden ganar, 1, 2 o 3 electrones)

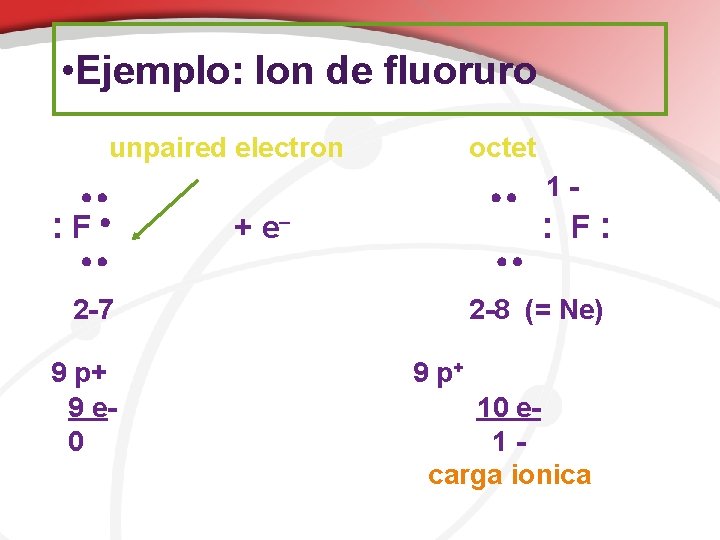
• Ejemplo: Ion de fluoruro unpaired electron : F octet + e : F: 2 -7 9 p+ 9 e 0 1 - 2 -8 (= Ne) 9 p+ 10 e 1 carga ionica


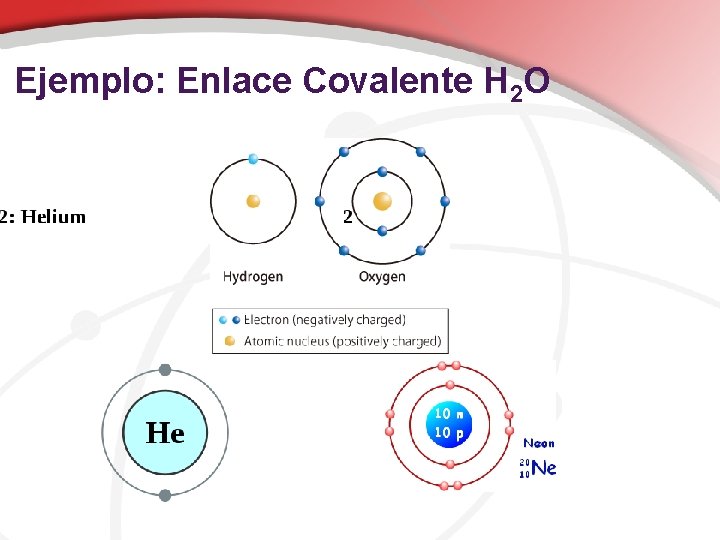
Enlace Covalente enlace formado por el intercambio de electrones Ejemplos: O 2, C 2 H 6, H 2 O, Si. C

• Enlace Covalente • Entre los elementos no metálicos de electronegatividad similar. • Formado por compartir pares de electrones • No son conductores en cualquier estado

Ejemplo: Enlace Covalente H 2 O


Enlace Metalico enlace que se encuentra en metales; mantiene átomos de metales juntos muy fuertemente

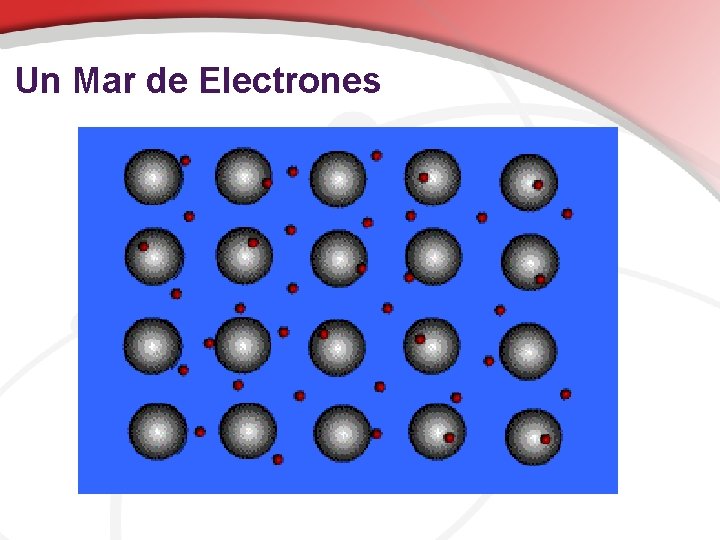
Enlace Metalico • Formado entre átomos de elementos metálicos • Tiene nube de Electrones alrededor de átomos conocidos como "mar de electrones" • Son buenos conductores en todos los estados, puntos de fusión muy altos, son brillantes • Ejemplos: Na, Fe, Al, Au, Co

Un Mar de Electrones

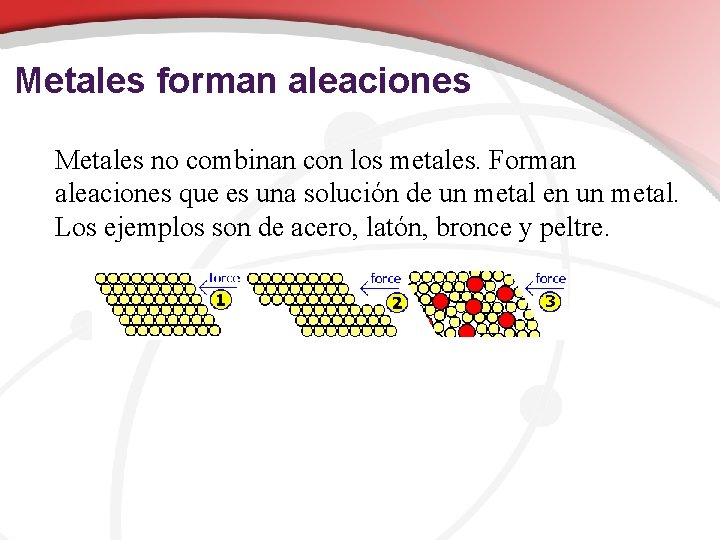
Metales forman aleaciones Metales no combinan con los metales. Forman aleaciones que es una solución de un metal en un metal. Los ejemplos son de acero, latón, bronce y peltre.

• Review • ¿Qué elementos forman un enlace iónico? • ¿Qué elementos forman un enlace covalente? • ¿Qué elementos forman un enlace metálico? • ¿Cuál es la actividad de electrones (lo que están haciendo los electrones) en cada bono? • ¿Qué vínculo conduce la electricidad?
 Tipos de enlaces
Tipos de enlaces Objetivos de enlaces quimicos
Objetivos de enlaces quimicos Ley de lavoisier
Ley de lavoisier La naturaleza del enlace quimico
La naturaleza del enlace quimico Union covalente e ionica
Union covalente e ionica Cuales son los enlaces sigma
Cuales son los enlaces sigma En un pesebre humilde viniste tu al mundo
En un pesebre humilde viniste tu al mundo Tema hombres que fueron sinceros con dios
Tema hombres que fueron sinceros con dios Tercer hábito establezca primero lo primero
Tercer hábito establezca primero lo primero Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Toca no toca pero pero si toca adivinanza
Toca no toca pero pero si toca adivinanza Consecuencias del uso de productos quimicos
Consecuencias del uso de productos quimicos Qumica
Qumica Elementos quimicos que forman parte de los seres vivos
Elementos quimicos que forman parte de los seres vivos Organizacion funcional del cuerpo
Organizacion funcional del cuerpo Suco entérico
Suco entérico Meclofen
Meclofen Cromosoma
Cromosoma Niveles de organizacion de los seres vivos
Niveles de organizacion de los seres vivos Dtr formula
Dtr formula Clasificacion de los elementos quimicos
Clasificacion de los elementos quimicos Fenomenos fisicos
Fenomenos fisicos Agua y miel
Agua y miel Agentes quimicos
Agentes quimicos Fenomenos quimicos ejemplos
Fenomenos quimicos ejemplos Thor group limited
Thor group limited Formulacin
Formulacin Rotulado de productos quimicos
Rotulado de productos quimicos Armazenamento de produtos químicos
Armazenamento de produtos químicos Isomorfismo en minerales
Isomorfismo en minerales Cetonas terminacion
Cetonas terminacion Propriedades de um elemento quimico
Propriedades de um elemento quimico






















































