SEMANA 2 2020 ELCTRONEGATIVIDAD UNIONES Y ENLACES QUIMICOS
























- Slides: 30

SEMANA 2 2020 ELCTRONEGATIVIDAD, UNIONES Y ENLACES QUIMICOS LICDA. CORINA MARROQUIN

ENLACE QUIMICO Son las fuerzas de atracción que mantienen unidos a los átomos para formar moléculas, iones y cristales en una porción de materia. Son de tipo eléctrico.

ELECTRONEGATIVIDAD. n n n Es una medida de la tendencia que muestra un átomo en un enlace covalente de atraer los electrones compartidos. La electronegatividad aumenta de izquierda a derecha, es decir conforme aumenta el no. Atómico. Dentro de un grupo la electronegatividad disminuye a medida que el no. Atómico aumenta.


ENLACE QUIMICO n n n Es la atracción que se da entre dos o más átomos para formar compuestos. El tipo de enlace en una sustancia determina sus propiedades físicas y químicas así como la atracción que una sustancia ejerce sobre otra. Ej. solubilidad

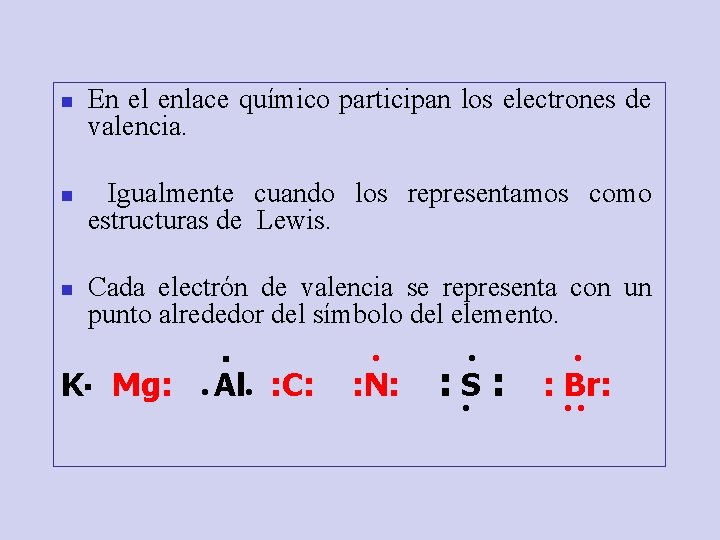
n n n En el enlace químico participan los electrones de valencia. Igualmente cuando los representamos como estructuras de Lewis. Cada electrón de valencia se representa con un punto alrededor del símbolo del elemento. . K▪ Mg: ● Al● : C: ● : N: ● : S: ● ● : Br: ●●

PEQUEÑAS CANTIDADES DE METALES CAUSAN LOS DIFERENTES COLORES DE LAS GEMAS.

n n n Los metales Pierden electrones. Se convierten en cationes (+) Na+ Se oxidan n n Los no metales Ganan electrones. Se convierten en aniones (-) Cl. Se reducen.

REGLA DEL OCTETO n n Tendencia de los átomos no metálicos a ganar electrones para completar ocho electrones de valencia similares a los gases nobles. El hecho que los átomos transfieran o compartan electrones, depende de la electronegatividad que posean.


LOS ENLACES QUIMICOS PUEDEN SER: n n n COVALENTE: Se comparten electrones. (Unión entre dos no metales). IONICO: Se trasfieren electrones. (Unión metal y un no metal) METALICO: Unión dos átomos metálicos

Como saber que tipo de enlace es: n La diferencia de electronegatividades es el criterio para la clasificación de los enlaces interatómicos. n < covalente 1. 8 n > 1. 8 iónico


Enlace covalente puede ser: n n Según la diferencia de electronegatividad: Polar (0. 4 a < 1. 8) Apolar (< 0. 4) Según los electrones compartidos (sencillo, doble, triple).

ENLACE COVALENTE POLAR 0. 4 - 1. 8 n n Los electrones se comparten de manera desigual entre dos átomos no metálicos diferentes. El átomo más electronegativo tendrá mayor atracción por el par de electrones compartidos.

ENLACE COVALENTE POLAR DOS NO METALES DISTINTOS.

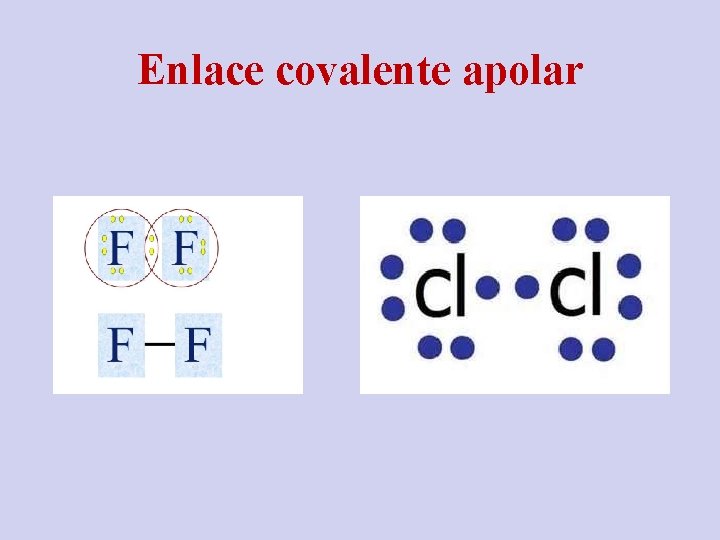
ENLACE COVALENTE NO POLAR 0. 4 – 0 n Los electrones se comparten de manera equitativa entre dos átomos del mismo elemento. Ocurre entre átomos no metálicos iguales. n Ej. Diatómicos. n

Enlace covalente apolar


ENLACE COVALENTE SEGÚN SUS ELECTRONES COMPARTIDOS: n Este puede formar un: n Enlace sencillo: cuando se comparte un par de electrones. Ej. I 2, Cl 2, Br 2

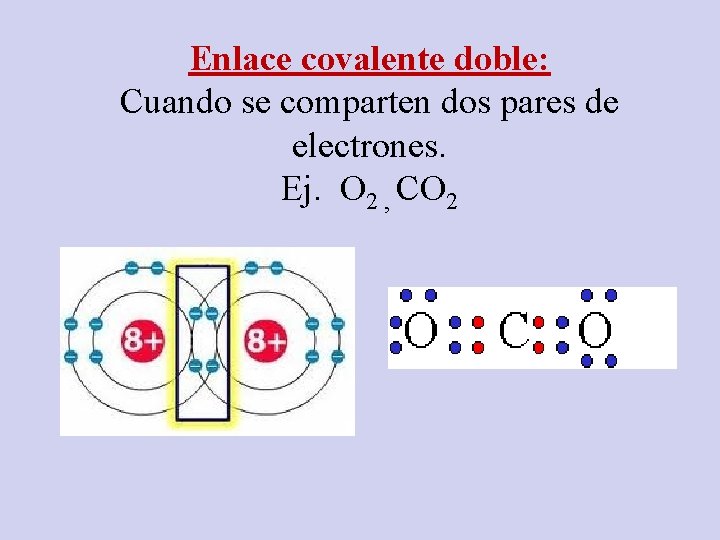
Enlace covalente doble: Cuando se comparten dos pares de electrones. Ej. O 2 , CO 2

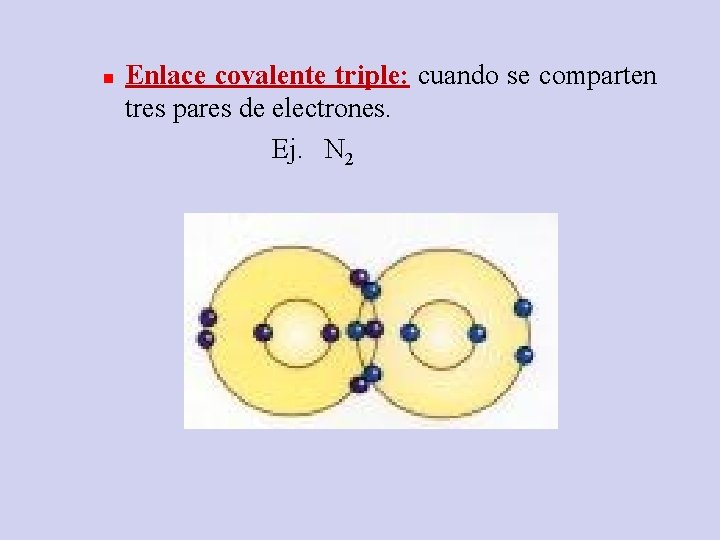
n Enlace covalente triple: cuando se comparten tres pares de electrones. Ej. N 2


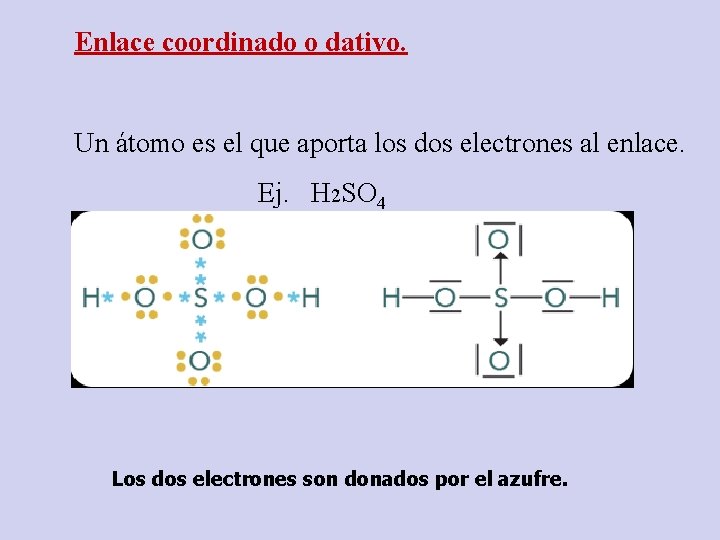
Enlace coordinado o dativo. Un átomo es el que aporta los dos electrones al enlace. Ej. H 2 SO 4 Los dos electrones son donados por el azufre.

UN ENLACE IONICO (>1. 8) n Fuerza de atracción entre iones de carga opuesta. n Hay transferencia completa de electrones. n Se da entre un metal y un no metal.


ENLACES COVALENTES FORMA COMPUESTOS COVALENTES ENLACES IÓNICOS FORMA COMPUESTOS IÓNICOS.

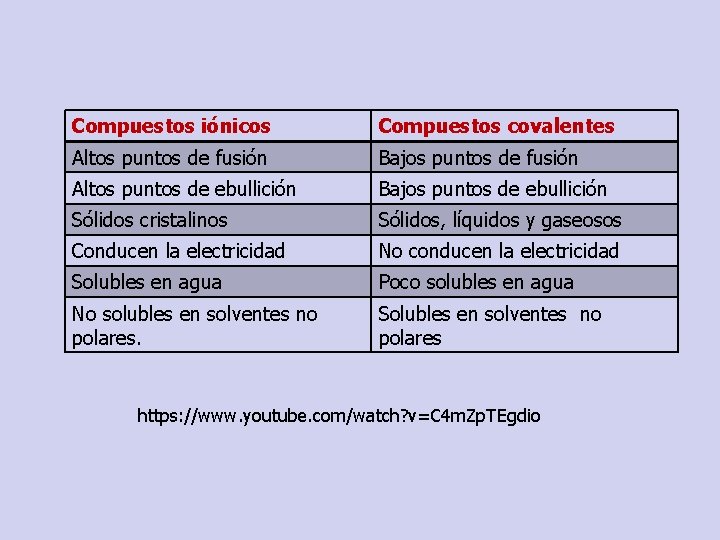
Compuestos iónicos Compuestos covalentes Altos puntos de fusión Bajos puntos de fusión Altos puntos de ebullición Bajos puntos de ebullición Sólidos cristalinos Sólidos, líquidos y gaseosos Conducen la electricidad No conducen la electricidad Solubles en agua Poco solubles en agua No solubles en solventes no polares. Solubles en solventes no polares https: //www. youtube. com/watch? v=C 4 m. Zp. TEgdio

ENLACE METALICO n Consiste en iones metálicos con carga positiva que están fijos en una red cristalina mientras que los electrones se desplazan por todo el cristal.

 Naturaleza del enlace
Naturaleza del enlace Molecula polar y apolar
Molecula polar y apolar Tipos de enlaces quimicos
Tipos de enlaces quimicos H-o-h tipo de enlace
H-o-h tipo de enlace Ley de lavoisier
Ley de lavoisier Ejemplos de enlace sigma
Ejemplos de enlace sigma Integrinas
Integrinas Uniones sinoviales
Uniones sinoviales Uniones y conexiones wan
Uniones y conexiones wan Nivel de organismo
Nivel de organismo Uniones soldadas a tope y de filete
Uniones soldadas a tope y de filete Union ocluyente
Union ocluyente Uniones de holliday
Uniones de holliday Modelo de holliday
Modelo de holliday Soldadura en zig zag
Soldadura en zig zag Enlace covalente heteronuclear
Enlace covalente heteronuclear Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Uniones quimicas entre atomos
Uniones quimicas entre atomos Uniones heterofilicas
Uniones heterofilicas Catetos de soldadura
Catetos de soldadura Uniones traslapadas
Uniones traslapadas Desmosoma en banda
Desmosoma en banda Spray fijador es solución coloide o suspension
Spray fijador es solución coloide o suspension Uniones fijas
Uniones fijas Proteinas de membrana funcion
Proteinas de membrana funcion Molecula polar y apolar
Molecula polar y apolar Uniones estrechas
Uniones estrechas Compuestos quimicos inorganicos
Compuestos quimicos inorganicos Elementos quimicos que forman parte de los seres vivos
Elementos quimicos que forman parte de los seres vivos Nucleolo
Nucleolo Suco entérico
Suco entérico