Longitud y energa de enlace ENLACES QUIMICOS Los
















- Slides: 24

Longitud y energía de enlace

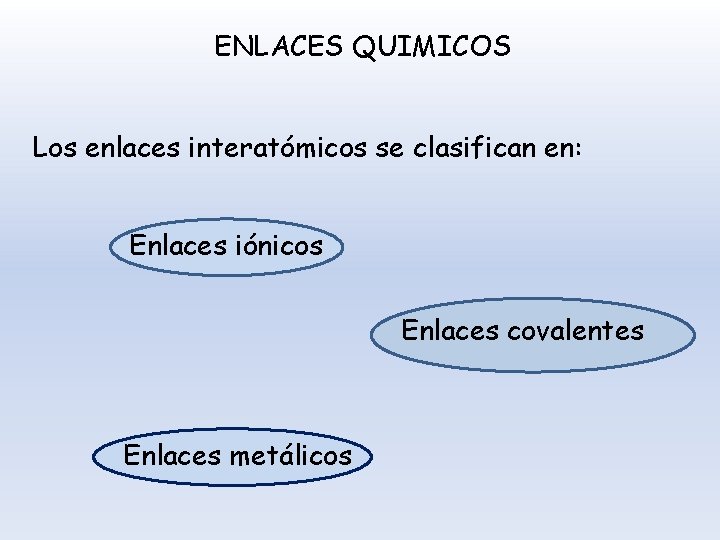
ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos

ENLACE IÓNICO: Transferencia de electrones Li F El litio le regala al flúor su electrón de valencia


¿Qué elementos forman compuestos iónicos? METAL Y UN NO METAL Recordemos: Son metales cuando electrones de valencia <4 Son no metales cuando electrones de valencia > 4 Si EN entre 2 átomos es mayor a 2 unidades

ENLACE COVALENTE: Comparte los electrones En el HCl, el hidrógeno y el cloro comparten un par de electrones

Enlace covalente : Se comparten electrones de valencia y no existe transferencia de éstos. Unión entre un No Metal y un No Metal

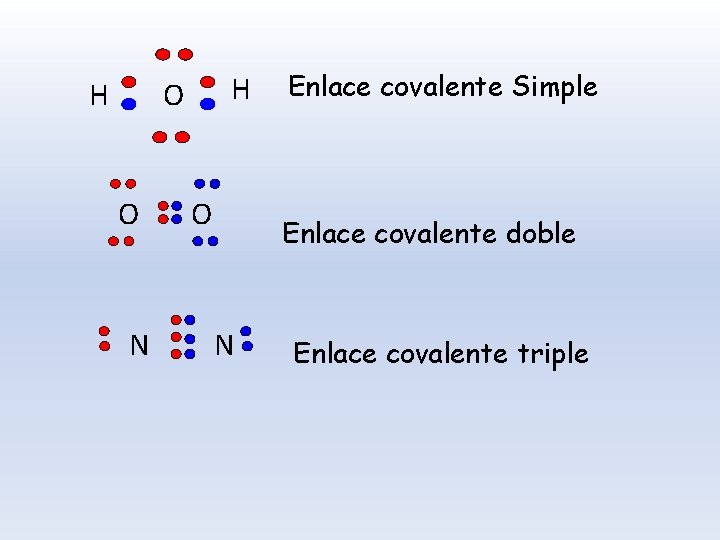
Dependiendo del número de pares de electrones que se comparten entre dos átomos, el enlace covalente puede ser simple (H 2), doble (O 2) o triple (N 2)

H H O O N O Enlace covalente Simple Enlace covalente doble N Enlace covalente triple

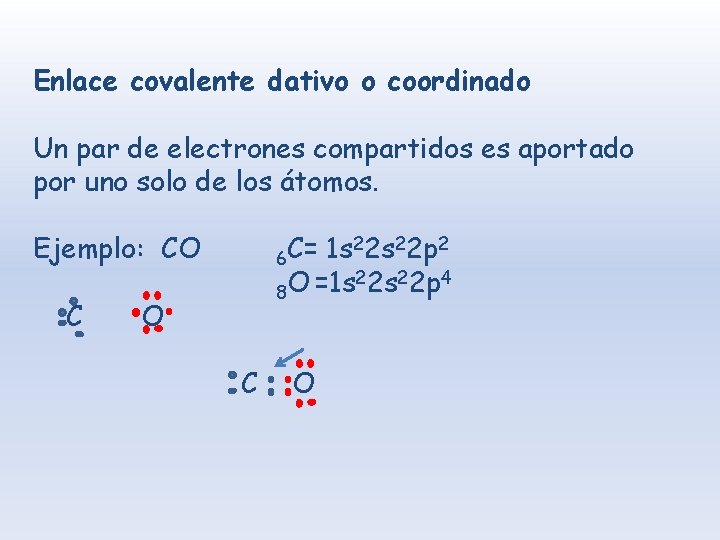
Enlace covalente dativo o coordinado Un par de electrones compartidos es aportado por uno solo de los átomos. Ejemplo: CO C 22 s 22 p 2 C= 1 s 6 22 s 22 p 4 O =1 s 8 O C O

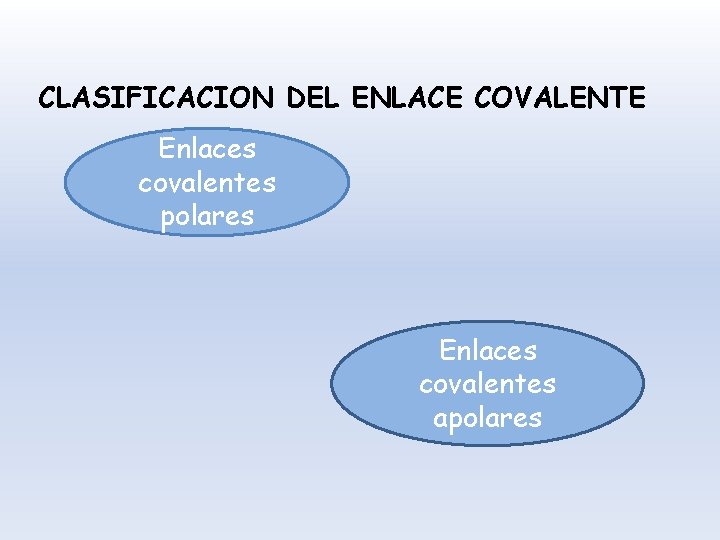
CLASIFICACION DEL ENLACE COVALENTE Enlaces covalentes polares Enlaces covalentes apolares

Enlace covalente apolar: Se produce entre 2 átomos que presentan igual electronegatividad o levemente diferente. Los electrones compartidos son atraídos por los núcleos de similar intensidad, los è se distribuyen de manera simétrica entre los núcleos de los átomos y no generan polos o cargas parciales Ej: H 2, CH 4, CO 2

Enlace covalente polar Se produce entre átomos que tienen distinta electronegatividad. Los è no son atraídos por la misma fuerza por cada núcleo, lo cual origina cargas parciales positivas y negativas en los extremos del enlace

Enlace metálico: Es la fuerza de atracción que se establece entre un gran número de iones positivos que se mantienen unidos por una nube de electrones

Propiedades de los metales a)Tienden a oxidarse, porque ceden electrones, convirtiéndose en iones positivos b)Buenos conductores de calor y electricidad, por el movimiento de los electrones externos. c) Son dúctiles y maleables, ya que los iones de la red se desplazan sin que haya repulsión de las cargas de igual signo. d) Presentan brillo metálico debido a que la luz recibida es reflejada por los electrones libres e)Son densos, duros y alto puntos de fusión y ebullición, debido a su modelo de empaquetamiento.

Geometría molecular Ordenamiento tridimensional de los átomos o iones en una molécula o red cristalina.



Enlaces intermoleculares: uniones entre moléculas Son las fuerzas de atracción entre moléculas. Los enlaces entre moléculas son más débiles que los enlaces interatómicos.

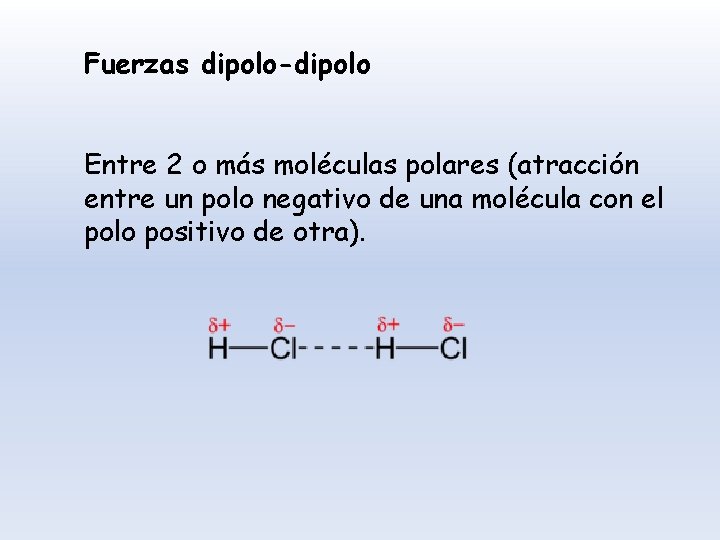
Fuerzas dipolo-dipolo Entre 2 o más moléculas polares (atracción entre un polo negativo de una molécula con el polo positivo de otra).

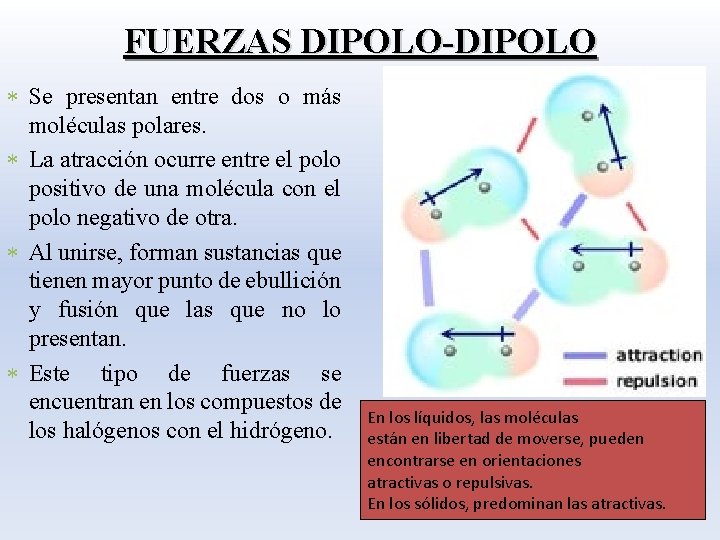
FUERZAS DIPOLO-DIPOLO * Se presentan entre dos o más moléculas polares. * La atracción ocurre entre el polo positivo de una molécula con el polo negativo de otra. * Al unirse, forman sustancias que tienen mayor punto de ebullición y fusión que las que no lo presentan. * Este tipo de fuerzas se encuentran en los compuestos de los halógenos con el hidrógeno. En los líquidos, las moléculas están en libertad de moverse, pueden encontrarse en orientaciones atractivas o repulsivas. En los sólidos, predominan las atractivas.

FUERZAS IÓN-DIPOLO * Se presenta entre los iones de una sustancia que interactúan con los polos de las moléculas covalentes polares. * Así, el polo negativo de una molécula atrae el ión positivo y el polo positivo interactúa con el ión negativo; es decir, las partes de cada molécula se unen por fuerzas de atracción de cargas opuestas.

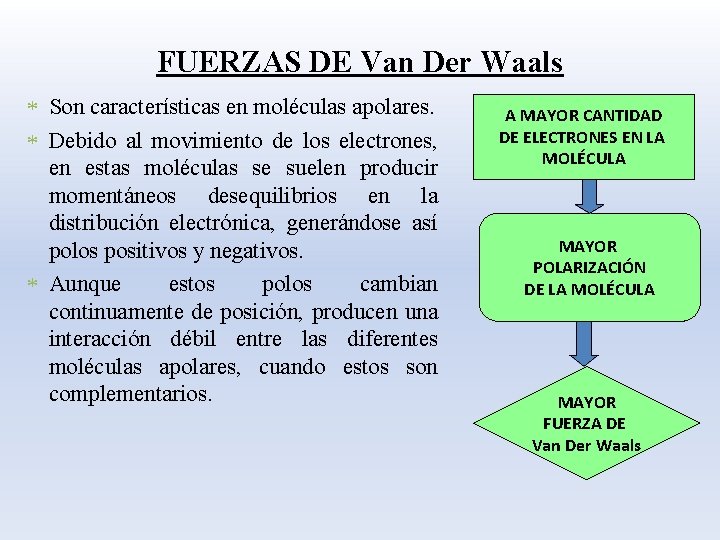
FUERZAS DE Van Der Waals * Son características en moléculas apolares. * Debido al movimiento de los electrones, en estas moléculas se suelen producir momentáneos desequilibrios en la distribución electrónica, generándose así polos positivos y negativos. * Aunque estos polos cambian continuamente de posición, producen una interacción débil entre las diferentes moléculas apolares, cuando estos son complementarios. A MAYOR CANTIDAD DE ELECTRONES EN LA MOLÉCULA MAYOR POLARIZACIÓN DE LA MOLÉCULA MAYOR FUERZA DE Van Der Waals

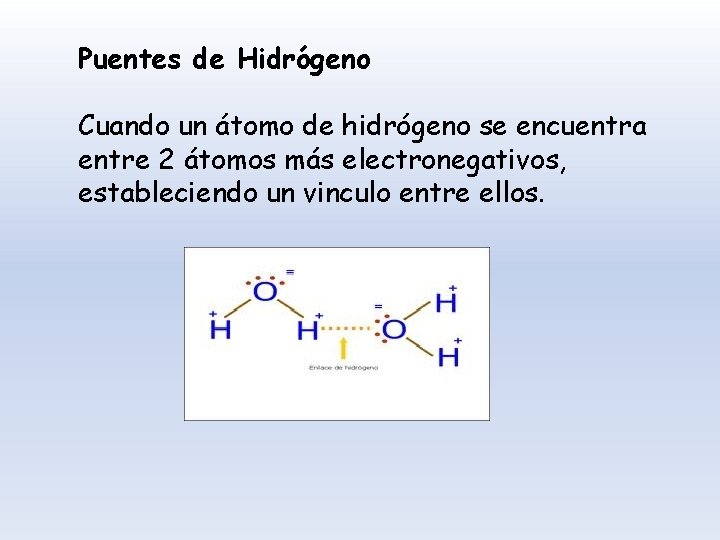
Puentes de Hidrógeno Cuando un átomo de hidrógeno se encuentra entre 2 átomos más electronegativos, estableciendo un vinculo entre ellos.
 Naturaleza de los enlaces quimicos
Naturaleza de los enlaces quimicos Ley de lavoisier
Ley de lavoisier Tipos de enlaces quimicos
Tipos de enlaces quimicos H-o-h tipo de enlace
H-o-h tipo de enlace Diferencias entre enlace ionico y covalente
Diferencias entre enlace ionico y covalente Enlace sigma pi
Enlace sigma pi Energa potencial
Energa potencial Energa solar
Energa solar Exergonico y exotermico
Exergonico y exotermico Clasificacion de los elementos quimicos
Clasificacion de los elementos quimicos Elementos quimicos que forman parte de los seres vivos
Elementos quimicos que forman parte de los seres vivos Los 4 reinos de la naturaleza
Los 4 reinos de la naturaleza Formulacin
Formulacin Fqcolindres
Fqcolindres Clasificación del enlace covalente
Clasificación del enlace covalente Longitud de intervalos
Longitud de intervalos Isomeria de carbohidratos
Isomeria de carbohidratos Site:slidetodoc.com
Site:slidetodoc.com Mutagenos quimicos
Mutagenos quimicos Mutagenos quimicos
Mutagenos quimicos Productos quimicos rotulados
Productos quimicos rotulados Icasus3
Icasus3 Pupinel materiales que se esterilizan
Pupinel materiales que se esterilizan Compuestos binarios ternarios y cuaternarios
Compuestos binarios ternarios y cuaternarios Grupos funcionales importancia
Grupos funcionales importancia