SEMANA 2 UNIONES Y ENLACES QUMICOS QUMICA 2021
















- Slides: 23

SEMANA 2 UNIONES Y ENLACES QUÍMICOS QUÍMICA 2021 1

SEMANA 02 UNIONES Y ENLACES QUÍMICOS Uniones y enlaces químicos. -Definición de electronegatividad. -Ejercicio sobre su variación en los grupos y periodos y diferencias de electronegatividad en compuestos binarios. Regla del Octeto. Estructura de Lewis: elementos, iones y compuestos binarios -Clasificación de enlaces: Enlace iónico Enlace covalente: Polar y No polar. Simple, doble, triple y coordinado -Comparación de propiedades físicas de compuestos iónicos y covalentes. -Aplicación de los conceptos en la salud y el ambiente: Lecturas en libro de texto - La Química en la Salud: “Algunos Iones importantes en el cuerpo” Laboratorio: Equipo básico de laboratorio de química 2

¿PORQUÉ SE ENLAZAN LOS ÁTOMOS? • Los átomos libres (como se encuentran escritos en la tabla periódica) son poco estables. • Para lograr la estabilidad, deben de cumplir la REGLA DEL OCTETO que consiste en lo siguiente: Es la tendencia de los átomos a tener 8 electrones en su último nivel para ganar estabilidad y que sus configuraciones electrónicas se parezcan a la de los gases nobles que son muy estables porque tienen octetos en su último nivel. ¿Cómo lo logran? Formando enlaces químicos con otros átomos cuando forman compuestos. 3

OCTETOS DE LOS GASES NOBLES 4


ENLACE QUÍMICO Es la unión de dos o más átomos para formar un compuesto ya sea, ganando, perdiendo o compartiendo electrones. TIPOS DE ENLACES: Iónico y Covalente • Lo que determina el tipo de enlace que se formara entre dos átomos será la diferencia entre sus ELECTRONEGATIVIDADES. 6

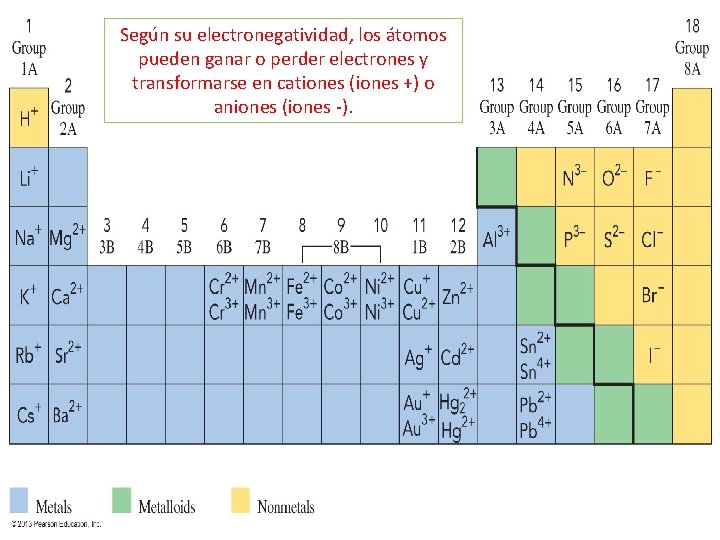
ELECTRONEGATIVIDAD Es capacidad que tiene un átomo de atraer y acercar los electrones que forman el enlace. (este valor se encuentra en la tabla periódica). • El átomo menos electronegativo es el Francio y el más electronegativo el Flúor. • En los períodos aumenta de izquierda a derecha En las columnas disminuye de arriba hacia abajo. • Los METALES por ser menos electronegativos tienden a perder sus electrones de valencia cuando forman enlaces. • Los NO METALES por ser más electronegativos tienden a ganar electrones cuando forman enlaces. 7


Según su electronegatividad, los átomos pueden ganar o perder electrones y transformarse en cationes (iones +) o aniones (iones -).

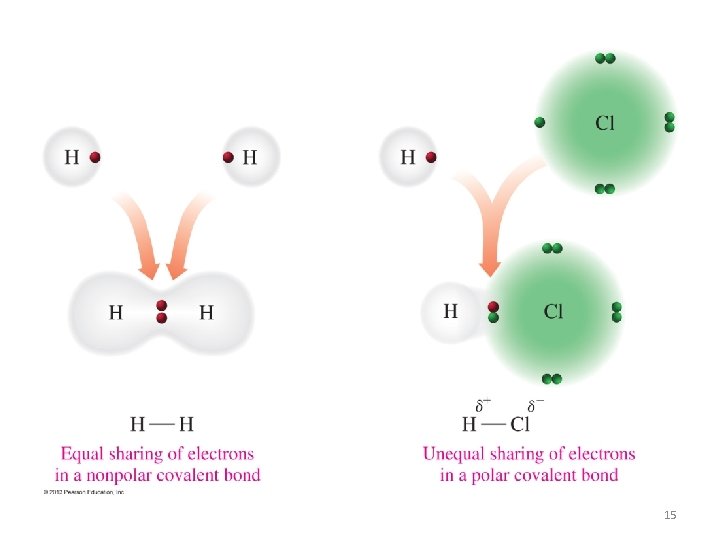
CLASIFICACIÓN DE LOS ENLACES Según la diferencia (resta) de las electronegatividades de los 2átomos que se enlazan se clasifican en: • • ENLACE COVALENTE PURO: diferencia de 0 ENLACE COVALENTE APOLAR: de 0 a 0. 4 ENLACE COVALENTE POLAR: mayor de 0. 4 a menor de 1. 8 ENLACE IÓNICO: de 1. 8 en adelante 0 0. 4 ELECTRONEGATIVIDAD 1. 8 en adelante 10

ENLACE IÓNICO Ejemplo: Na. Cl al restar sus electronegatividades Na: 0. 93 – Cl: 3. 16 = 2. 23 (mayor de 1. 8). • En el enlace iónico hay transferencia de electrones del átomo menos electronegativo hacia el más electronegativo. • Lo que provoca la formación de iones +(cationes) de Na+ y de iones - (aniones) de Cl. Como las cargas eléctricas opuestas se atraen, esto formará el enlace iónico. Na+ Cl- = Na. Cl • Generalmente se forma entre átomos de un Metal y un Nometal. Los compuestos que contienen enlaces iónicos se llaman COMPUESTOS IÓNICOS. 11



ENLACE COVALENTE Ejemplo: HCl al restar sus electronegatividades H: 2. 10 – Cl: 3. 16 = 1. 06 (menor de 1. 8) • En el enlace covalente se comparten electrones entre los dos átomos (no se forman iones). Se forman MOLÉCULAS. H-Cl = HCl • Generalmente se forma entre dos átomos de Nometales ó entre Hidrógeno y Nometal. Los compuestos que contienen enlaces covalentes e llaman COMPUESTOS COVALENTES. 14

15

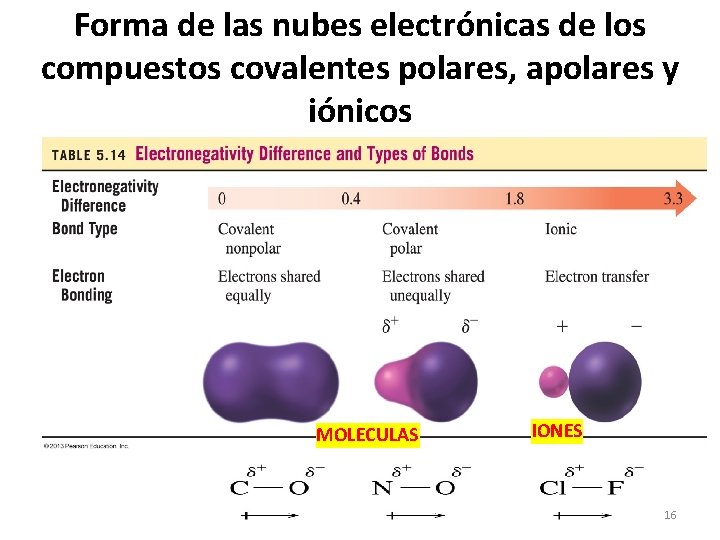
Forma de las nubes electrónicas de los compuestos covalentes polares, apolares y iónicos MOLECULAS IONES 16

Ejercicios ¿Qué tipo de enlaces forma el Mg cuando se enlaza con O, S o As ? Compuesto Ba. F 2 PCl 5 Si. H 4 Al 2 O 3 NH 3 Electronegatividades Ba: P: Si: Al: N: Diferencia Enlace Iónico, de covalente polar Electrone- o covalente gatividad apolar F: Cl: H: O: H: 17

CLASIFICACIÓN DEL ENLACE COVALENTE Por la diferencia de electronegatividad: • COVALENTE PURO: Diferencia de 0 • COVALENTE APOLAR: de 0 a 0. 4 • COVALENTE POLAR: de mayor de 0. 4 a menor de 1. 8 • • Por los pares de electrones que se comparten en el enlace: COVALENTE SIMPLE COVALENTE DOBLE COVALENTE TRIPLE COVALENTE DATIVO o COORDINADO 18

ESTRUCTURAS DE LEWIS o electrón punto • Diagrama utilizado para representa los electrones de valencia de los átomos. • Se escribe el símbolo del átomo con sus electrones de valencia con figuras ( *, +, x, . ) • Permite representar el tipo de enlace que une los átomos en los compuestos. (SE UTILIZAN PARA DETERMINAR SI LOS ENLACES COVALENTES DE UN COMPUESTO SON SIMPLES, DOBLES, TRIPLES O COORDINADOS). 19

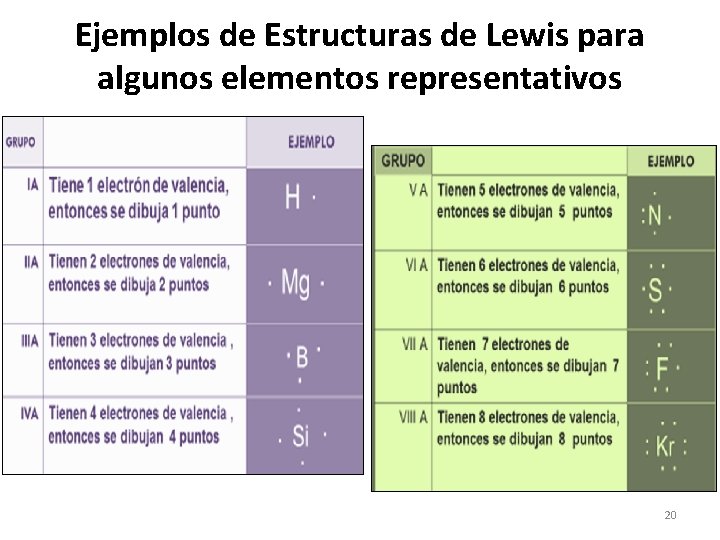
Ejemplos de Estructuras de Lewis para algunos elementos representativos 20

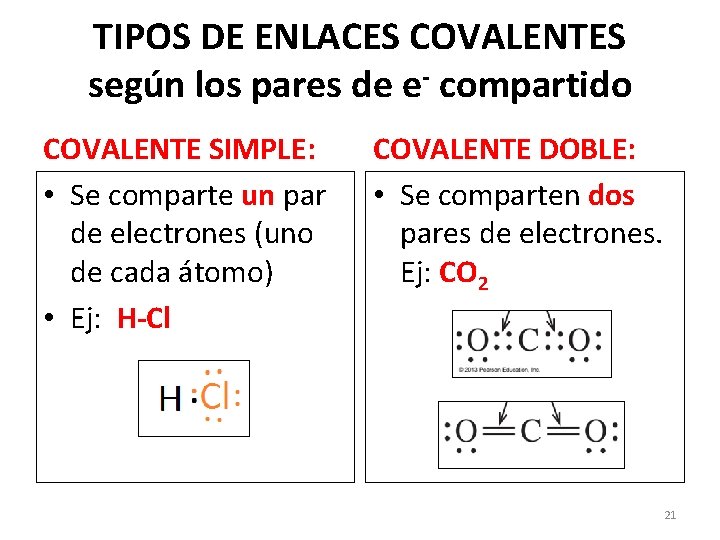
TIPOS DE ENLACES COVALENTES según los pares de e- compartido COVALENTE SIMPLE: • Se comparte un par de electrones (uno de cada átomo) • Ej: H-Cl COVALENTE DOBLE: • Se comparten dos pares de electrones. Ej: CO 2 21

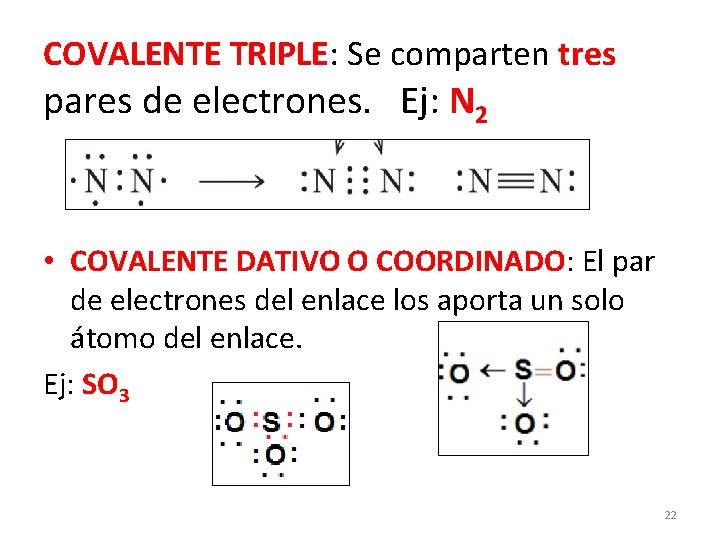
COVALENTE TRIPLE: Se comparten tres pares de electrones. Ej: N 2 • COVALENTE DATIVO O COORDINADO: El par de electrones del enlace los aporta un solo átomo del enlace. Ej: SO 3 22

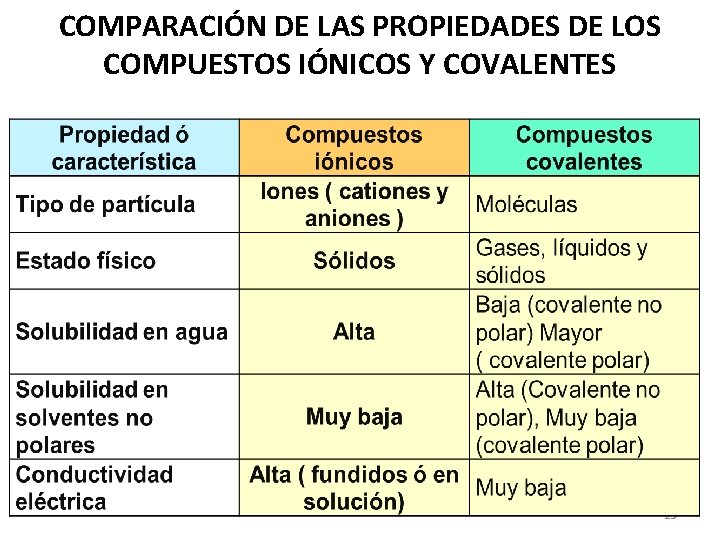
COMPARACIÓN DE LAS PROPIEDADES DE LOS COMPUESTOS IÓNICOS Y COVALENTES 23
 Enlace doble sigma y pi
Enlace doble sigma y pi 70 semanas daniel
70 semanas daniel Depurinacion
Depurinacion Plano de soldadura
Plano de soldadura Uniones traslapadas
Uniones traslapadas Nefrona
Nefrona El agua mineral es disoluciones coloides o suspensiones
El agua mineral es disoluciones coloides o suspensiones Uniones fijas
Uniones fijas Moleculas de adhesion
Moleculas de adhesion Como saber si un elemento es polar o apolar
Como saber si un elemento es polar o apolar Uniones estrechas
Uniones estrechas Tejido cartilaginoso
Tejido cartilaginoso Uniones y conexiones wan
Uniones y conexiones wan Uniones intercelulares
Uniones intercelulares Simbolo de espesor de chapa
Simbolo de espesor de chapa Uniones en hendidura
Uniones en hendidura Union adherente celular
Union adherente celular Depurinacion
Depurinacion Heterofilicas
Heterofilicas Soldadura en zig zag
Soldadura en zig zag Que es un enlace polar
Que es un enlace polar Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Uniones quimicas entre atomos
Uniones quimicas entre atomos Qumica
Qumica