UNIONES Y ENLACE QUMICO SEMANA 2 2021 Licda






























- Slides: 40

UNIONES Y ENLACE QUÍMICO SEMANA 2 - 2021 Licda: Isabel Fratti de Del Cid 2021

ENLACE QUÍMICO Son uniones, atracciones, interacciones, fuerzas , que mantienen unidas a las partículas (átomos , iones ó moléculas) en las sustancias. Estas partículas al unirse, tienden a formar estructuras más estables. El enlace químico puede ser: § Covalente § Iónico Se da entre átomos y § Metálico Iones §Intermolecular moléculas : se da entre 2

REGLA DEL OCTETO Se aplica a la unión entre átomos, ya sea que generen moléculas ó iones: Regla del octeto Cuando dos o más átomos se combinan para formar compuestos tienden a ganar, perder ó compartir electrones, en número suficiente para llegar a tener capas externas con 8 electrones ( octeto) similares a las de los gases nobles ó inertes. 3

Las configuraciones de los gases nobles( VIIIA) terminan en ns 2 np 6 ( n=2, 3, 4, 5, 6) (poseen 8 e- en el nivel mas externo es decir muestran un octeto). Ejemplo: 2 2 s 2 2 p 6 ( 8 e- en su último nivel Ne = 1 s 10 «octeto» ) 2 2 s 2 2 p 6 3 s 2 3 p 6 ( 8 e- en su último Ar = 1 s 18 nivel = «octeto» ) 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 ( 8 e- en Kr = 1 s 36 su último nivel «octeto» ) (Estructura escrita usando regla diagonal) 4

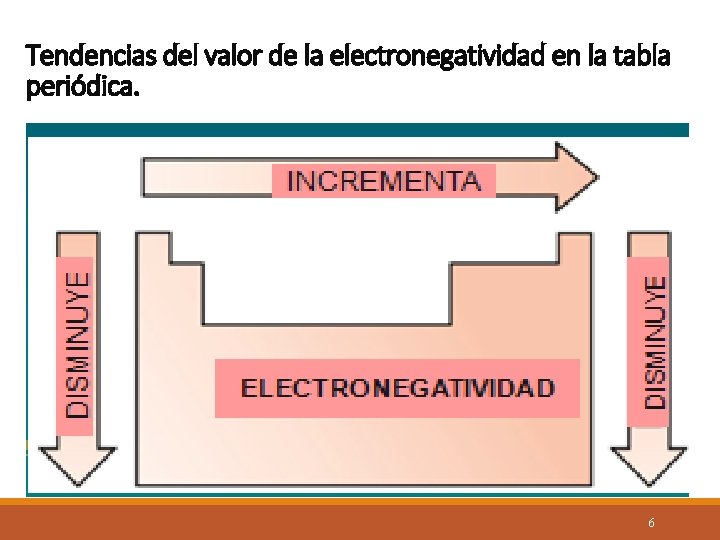
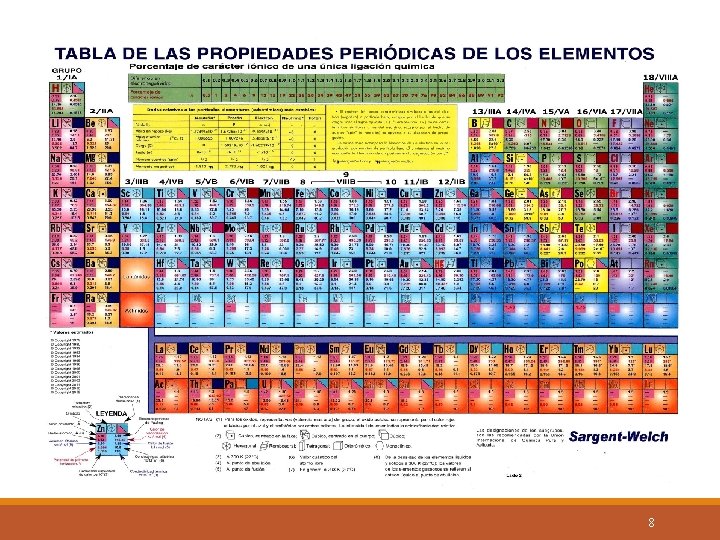
Electronegatividad. Capacidad relativa de un átomo para atraer los electrones de otro ú otros átomos al formar un enlace. Esta posee un valor numérico dado en la tabla periódica. ( Busque este dato en el reverso de la tabla como «Electronegatividad de Pauling» ) Los valores numéricos , presentan las siguientes tendencias: En un período aumenta de izquierda a derecha. En un grupo disminuye de arriba hacia abajo. 5

Tendencias del valor de la electronegatividad en la tabla periódica. 6

Con esto concluimos que los elementos : más electronegativos se hallan en la parte superior derecha de la tabla periódica : Ejemplo: F= 3. 98 , O= 3. 44 ( se excluyen de ésta regla, los gases nobles columna 18 / VIIIA) Los menos electronegativos se hallan en la parte inferior izquierda: Ejemplo: Cs = 0. 79 y Fr = 0. 7). 7

8

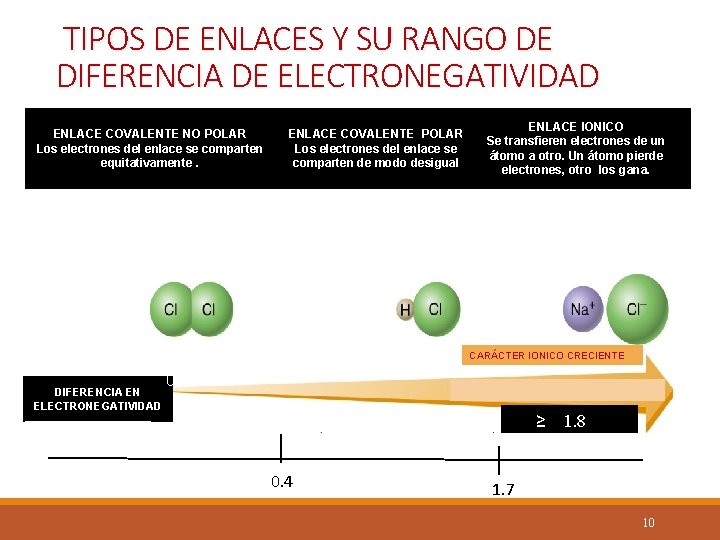
Criterio usando la electronegatividad para definir si un enlace es iónico ó covalente. A-Reste le electronegatividad mayor de la menor, sin importar el orden en que los átomos aparecen en la fórmula del compuesto. B- No debe multiplicar la electronegatividad por el número de veces que aparece el elemento en el compuesto. Solo se toma en cuenta una vez. Diferencia de electronegatividad Tipo de enlace 0. 0 a 0. 4 Covalente no polar ( apolar) mayor 0. 4 y menor 1. 8 en adelante Covalente polar Iónico. 9

TIPOS DE ENLACES Y SU RANGO DE DIFERENCIA DE ELECTRONEGATIVIDAD ENLACE COVALENTE NO POLAR Los electrones del enlace se comparten equitativamente. ENLACE COVALENTE POLAR Los electrones del enlace se comparten de modo desigual ENLACE IONICO Se transfieren electrones de un átomo a otro. Un átomo pierde electrones, otro los gana. CARÁCTER IONICO CRECIENTE DIFERENCIA EN ELECTRONEGATIVIDAD 0 ≥ 0. 4 1. 8 1. 7 10

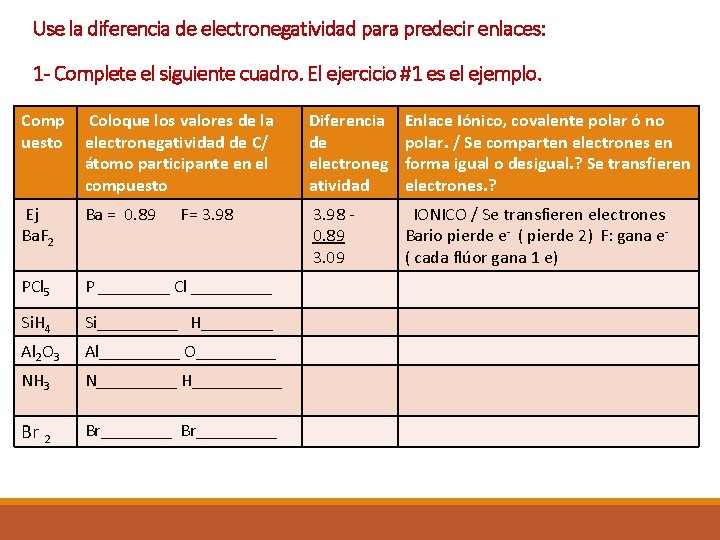
Use la diferencia de electronegatividad para predecir enlaces: 1 - Complete el siguiente cuadro. El ejercicio #1 es el ejemplo. Comp uesto Coloque los valores de la electronegatividad de C/ átomo participante en el compuesto Diferencia de electroneg atividad Enlace Iónico, covalente polar ó no polar. / Se comparten electrones en forma igual o desigual. ? Se transfieren electrones. ? Ej Ba. F 2 Ba = 0. 89 3. 98 0. 89 3. 09 IONICO / Se transfieren electrones Bario pierde e- ( pierde 2) F: gana e( cada flúor gana 1 e) PCl 5 P ____ Cl _____ Si. H 4 Si_____ H____ Al 2 O 3 Al_____ O_____ NH 3 N_____ H_____ Br 2 Br_________ F= 3. 98

Use la diferencia de electronegatividad para predecir enlaces: 2 - Con cual(es) de los siguientes átomos ( O, S, As, Cl) el Sr, formará un enlace iónico? _____ Un enlace covalente polar? _______.

Enlace iónico Al unirse átomos muy electronegativos con átomos de poca electronegatividad ; el más electronegativo «gana» electrones y se convierte en un ión con carga negativa ( anión) y el menos electronegativo «pierde» electrones y se convierte en un ión con carga positiva (catión). Recordar que esto sucede generalmente si la diferencia de electronegatividad es de 1. 8 en adelante. Hay transferencia de electrones ( uno gana otro pierde). Lo que mantiene unidos a cationes (+) y aniones (-) es la fuerza de atracción electrostática entre cargas opuestas. ( Ley de Coulomb : cargas opuestas se atraen) 13

Esquema de la formación de un enlace iónico entre un metal (M) y un no metal ( Nm) Perdida y ganancia de electrones El metal pierde electrones convirtiéndose en un catión ( carga +). El no metal gana electrones generando un anión (. Carga -) Note: aquí el metal pierde electrones y se convierte en catión (M+), y el no metal gana e- y se convierte en anión ( Nm- ). En el no metal, se observa la formación del octeto. El metal también alcanza el octeto, pero queda en el nivel interno, por eso no se observa en éste tipo de estructuras (Lewis). ENLACE IONICO 14

Ejemplo de ENLACE IONICO Ca + F 2 Ca F 2 (formado de Ca+2 y 2 F - ) 2 2 s 2 2 p 6 3 s 23 p 64 s 2 ( átomo neutro) Ca = 1 s 20 +2 = 1 s 22 p 63 s 23 p 6 ( Catión: perdió 2 e- ) Ca 20 El Ca perdió 2 e- que son sus electrones de valencia los del último nivel y logra, su «octeto» : 3 s 2 3 p 6. El calcio logra la configuración de un gas noble: Ca+2 = [ Ar] 15

Cada flúor gana 1 e- logra su octeto en el último nivel ( 2 s 2 2 p 6 ) y alcanza la configuración de un gas noble: * 2 2 s 2 2 p 5 (átomo neutro) F = 1 s 9 - =1 s 22 p 6 (anión ganó un e F 9 * - : = [ Ne] Configuración de un gas noble F 9 16

+2 - La formación de éstos iones Ca y F se pueden predecir por la diferencia de electronegatividad : Ca = 1. 0 y F = 3. 98 Diferencia 2. 98, por lo tanto es iónico el Ca, pierde 2 electrones por ser menos electronegativo y el F, gana 1 electrón por ser mas electronegativo. Se requieren 2 F- ya que el Ca +2 perdió 2 e - y cada Flúor necesita solo 1 e- para completar octeto su fórmula queda: Ca. F 2 17

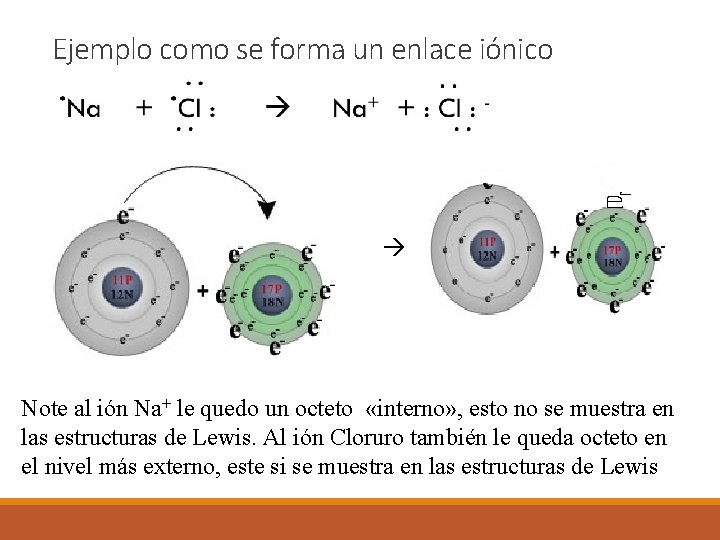
Ejemplo como se forma un enlace iónico Note al ión Na+ le quedo un octeto «interno» , esto no se muestra en las estructuras de Lewis. Al ión Cloruro también le queda octeto en el nivel más externo, este si se muestra en las estructuras de Lewis

ENLACE COVALENTE Si los átomos poseen electronegatividades similares, éstos no ganan ni pierden electrones entonces se comparten los e- del enlace á esto se le conoce como enlace covalente. Por eso no se generan iones ( partículas con carga). Se forman moléculas Para efectos prácticos se considera que un enlace covalente se forma cuando la diferencia de electronegatividades es< de 1. 8 Estos enlaces se representan con líneas H-H ó puntos H: H 19

Tipos de enlace covalente I-De acuerdo al numero de parejas de electrones que comparten: A-Covalente simple se comparte una pareja de electrones. Cada átomo pone un electrón. B-Covalente doble: se comparten dos parejas de electrones. Cada átomo pone dos electrones. C-Covalente triple: se comparten tres parejas de electrones. C / átomo pone tres electrones. D-Covalente coordinado ó dativo: Se comparte una pareja de electrones, pero éstos provienen de uno solo de los átomos.

Cont. Tipos de enlace covalente II- De acuerdo a diferencia de electronegatividad: A- Covalente no polar( apolar) : Diferencia de 0. 0 -0. 4. B-Covalente polar diferencia >0. 4 y < 1. 8. Nota: Todo enlace covalente: simple, doble, triple, coordinado puede a la vez ser No polar ó polar.

Enlaces Covalentes simple Un Enlace covalente simple es cuando se comparte un par de electrones, donde cada átomo aporta un electrón. El enlace simple se puede representar con dos puntos ó con un guión entre los átomos que lo forman. Ejemplo: H-Cl Note el octeto de electrones alrededor del cloro 22

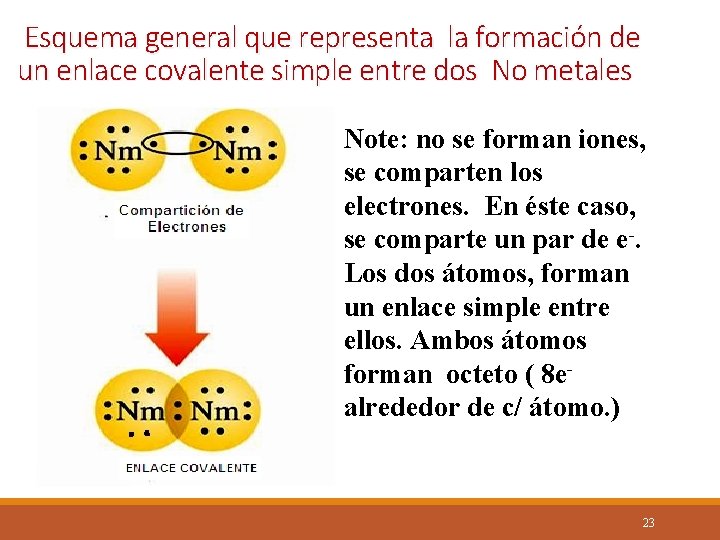
Esquema general que representa la formación de un enlace covalente simple entre dos No metales Note: no se forman iones, se comparten los electrones. En éste caso, se comparte un par de e-. Los dos átomos, forman un enlace simple entre ellos. Ambos átomos forman octeto ( 8 ealrededor de c/ átomo. ) 23

Enlaces covalentes múltiples: Dobles ó triples A-Dobles CH 2=CH 2 C/átomo pone un par de e- : se comparten dos parejas de e- ( 4 e-) Note los octetos completos en cada Carbono 24

Enlaces covalentes múltiples: Dobles ó triples B- Triples N N Se comparten 3 parejas de ec/ átomo pone generalmente 3 e. Note los octetos completos en los átomos de Nitrógeno. N 2 N N 25

Enlace Covalente coordinado: También llamado DATIVO. Los átomos comparten un par de electrones, pero estos han sido aportados por un solo átomo. Ej. SO 3 presenta 1 enlace doble (cada átomo puso 2 e-) y 2 coordinados ó dativos. El Azufre ( S) es el que pone las parejas de electrones, en los dos enlaces covalentes coordinados. El oxigeno no pone electrones, solo usa los del azufre para completar octeto. 26

Enlace covalente polar Los electrones de enlace se comparten de manera desigual. Se forman dipolos. Los enlaces covalentes polares pueden ser: simples, coordinados, dobles ó triples. Para efectos prácticos un enlace es covalente polar si la diferencia de electronegatividad es de ( >0. 4 y < 1. 8). Ejemplo: HCl SO 2 CO 2 27

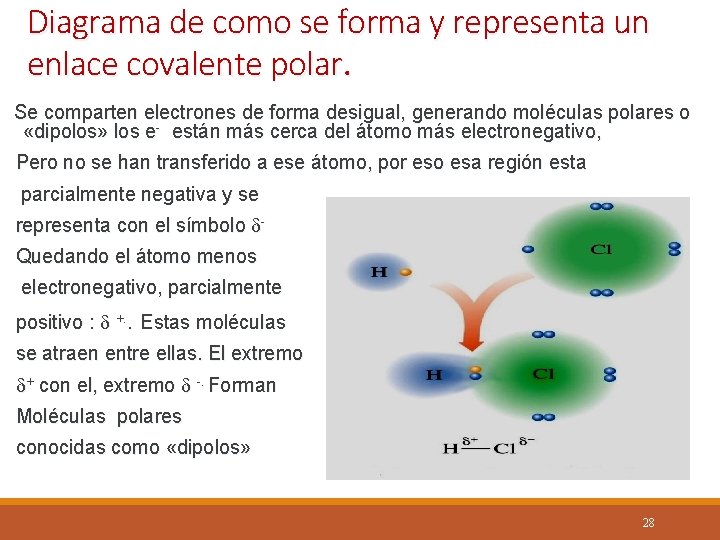
Diagrama de como se forma y representa un enlace covalente polar. Se comparten electrones de forma desigual, generando moléculas polares o «dipolos» los e- están más cerca del átomo más electronegativo, Pero no se han transferido a ese átomo, por eso esa región esta parcialmente negativa y se representa con el símbolo Quedando el átomo menos electronegativo, parcialmente positivo : +. . Estas moléculas se atraen entre ellas. El extremo + con el, extremo -. Forman Moléculas polares conocidas como «dipolos» 28

Enlace covalente no polar (apolar) Se dan cuando los pares de electrones se comparten de manera equitativa ó muy pareja. No forman dipolos. Para efectos prácticos es no polar si la diferencia de electronegatividad está en el rango : (0. 0 a 0. 4). Ejemplo : Cl 2 , Si. H 4 , Sb. H 3 29

Enlace covalente puro Enlace covalente “puro”, También es un enlace No polar donde la diferencia de electronegatividad es 0. 0 debido a que el enlace se da entre átomos idénticos: Ejemplo todos los elementos diatómicos: N 2, O 2, F 2, H 2 , Cl 2 , I 2 , Br 2 30

Los enlaces covalentes simples, dobles ó triples, a su vez pueden ser polares ó NO polares. Ejemplos H 2 * y Si. H 4 : Covalente simple NO polar HCl ; NH 3 : Covalente simple polar. O 2 * : Covalente doble NO polar SO 2 : Posee un covalente doble polar y un coordinado polar. N 2 *: covalente triple NO polar. * : en éstos casos los enlaces covalente apolares son conocidos como covalentes puros, debido a que la diferencia de electronegatividad es 0. 0 pues son átomos idénticos

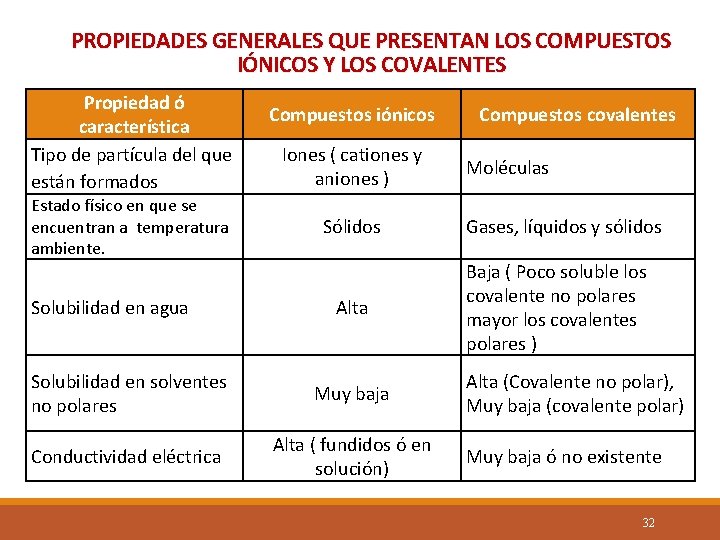
PROPIEDADES GENERALES QUE PRESENTAN LOS COMPUESTOS IÓNICOS Y LOS COVALENTES Propiedad ó característica Tipo de partícula del que están formados Estado físico en que se encuentran a temperatura ambiente. Solubilidad en agua Compuestos iónicos Iones ( cationes y aniones ) Sólidos Alta Solubilidad en solventes no polares Muy baja Conductividad eléctrica Alta ( fundidos ó en solución) Compuestos covalentes Moléculas Gases, líquidos y sólidos Baja ( Poco soluble los covalente no polares mayor los covalentes polares ) Alta (Covalente no polar), Muy baja (covalente polar) Muy baja ó no existente 32

ESTRUCTURAS DE LEWIS de átomos Es la representación de un elemento y sus electrones de valencia. El símbolo de cada elemento se utiliza para representar el núcleo y todos los electrones internos. Los electrones de valencia ( los que se hallan en el último nivel de energía) se representan como puntos alrededor del símbolo. Ejemplos: º º Al º Cl Na ∧ . . 33 º

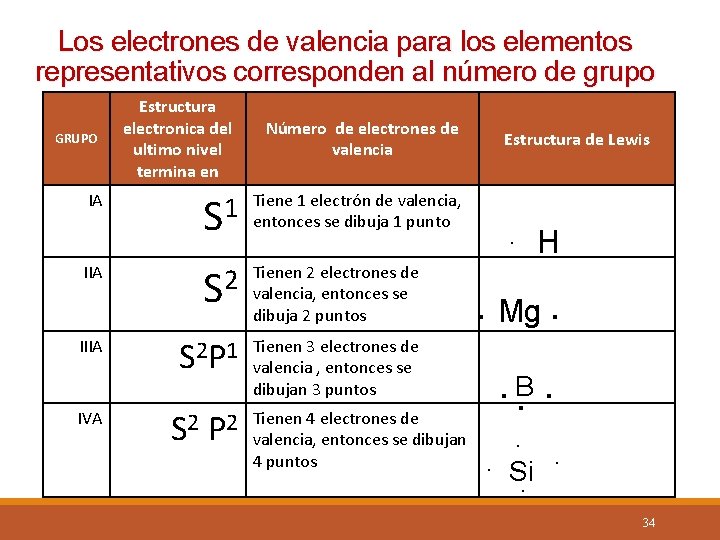
Los electrones de valencia para los elementos representativos corresponden al número de grupo GRUPO Estructura electronica del ultimo nivel termina en S 1 Tiene 1 electrón de valencia, entonces se dibuja 1 punto S 2 Tienen 2 electrones de valencia, entonces se dibuja 2 puntos S 2 P 1 Tienen 3 electrones de valencia , entonces se dibujan 3 puntos IA IIIA IVA Número de electrones de valencia S 2 P 2 Tienen 4 electrones de valencia, entonces se dibujan 4 puntos Estructura de Lewis . H . Mg. . B. . Si. . 34

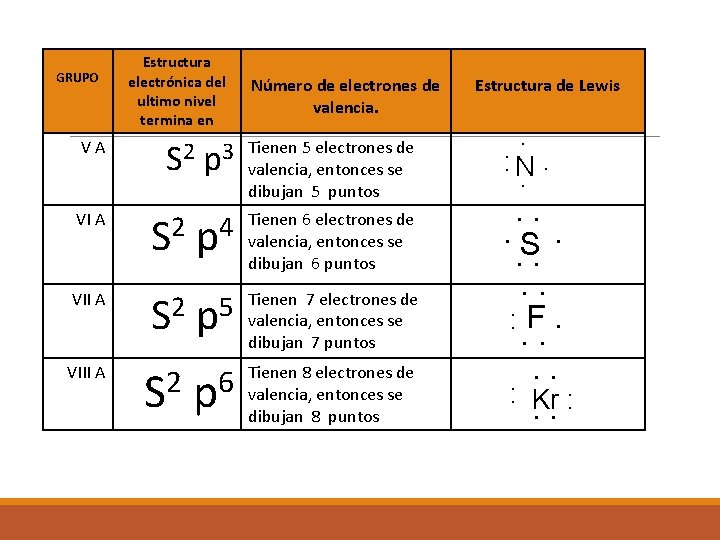
GRUPO Estructura electrónica del ultimo nivel termina en p 3 Tienen 5 electrones de valencia, entonces se dibujan 5 puntos VI A S 2 p 4 Tienen 6 electrones de valencia, entonces se dibujan 6 puntos VII A 2 S 5 p Tienen 7 electrones de valencia, entonces se dibujan 7 puntos S 2 p 6 Tienen 8 electrones de valencia, entonces se dibujan 8 puntos VA VIII A S 2 Número de electrones de valencia. Estructura de Lewis . : N. . . S. . . : F. . . : Kr : . .

Realice los siguientes ejercicios Haga la estructura de Lewis del Si H 4 ( represente cada átomo y sus electrones de valencia de color diferente use puntos para representar los electrones. . Es covalente polar no polar o iónico. ? 36

El Ga. F 3, Es iónico o covalente. ? Haga la estructura de Lewis. 37

Ejercicios del libro recomendados: ( 5. 9, 5. 11: pag 166 ) Respuestas paginas 202 y 203. 38

Ejercicios del libro recomendados: 5. 53, 5. 59. pag 188), (5. 75, 5. 79. pag 196). respuestas paginas 202 -203. 39

Ejercicios del libro recomendados: (5. 75, 5. 79. pag 196). Respuestas paginas 202 -203 40
 Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace dativo
Enlace dativo Que es enlace coordinado
Que es enlace coordinado Enlace covalente sigma
Enlace covalente sigma Semana 70 de daniel 2021
Semana 70 de daniel 2021 Aparato de golgi
Aparato de golgi 10 ejemplos fuerzas de van der waals ejemplos
10 ejemplos fuerzas de van der waals ejemplos Uniones estrechas
Uniones estrechas Uniones homofilicas
Uniones homofilicas Uniones celulares del tejido epitelial
Uniones celulares del tejido epitelial Uniones y conexiones wan
Uniones y conexiones wan Simbolo de espesor de chapa
Simbolo de espesor de chapa Uniones gap junction
Uniones gap junction Uniones de holliday
Uniones de holliday Uniones de holliday
Uniones de holliday Nch 305
Nch 305 Redes covalentes
Redes covalentes Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Transitria
Transitria Union celula celula
Union celula celula Soldadura de filete intermitente
Soldadura de filete intermitente Uniones traslapadas
Uniones traslapadas Uniones sinoviales
Uniones sinoviales Diferenciaciones de membrana
Diferenciaciones de membrana Espuma para rasurar es solución coloide o suspension
Espuma para rasurar es solución coloide o suspension Uniones fijas y desmontables
Uniones fijas y desmontables Clasificacion de heteroproteinas
Clasificacion de heteroproteinas Na y cl
Na y cl Regla del dueto
Regla del dueto Estructura de lewis hcl
Estructura de lewis hcl Centro nacional de enlace
Centro nacional de enlace Https: //www.youtube.com/watch? v = ikrdcad47yw
Https: //www.youtube.com/watch? v = ikrdcad47yw Ejemplos de enlace dativo
Ejemplos de enlace dativo Enlace del potasio
Enlace del potasio Diferencia de electronegatividad
Diferencia de electronegatividad H-o-h tipo de enlace
H-o-h tipo de enlace Enlace glicosídico
Enlace glicosídico Unidad de formación
Unidad de formación Palabras de enlace
Palabras de enlace