ENLACES QUMICOS Qumica Orgnica D Ph Perla L







- Slides: 20

ENLACES QUÍMICOS Química Orgánica D. Ph. Perla L. Ordóñez B.

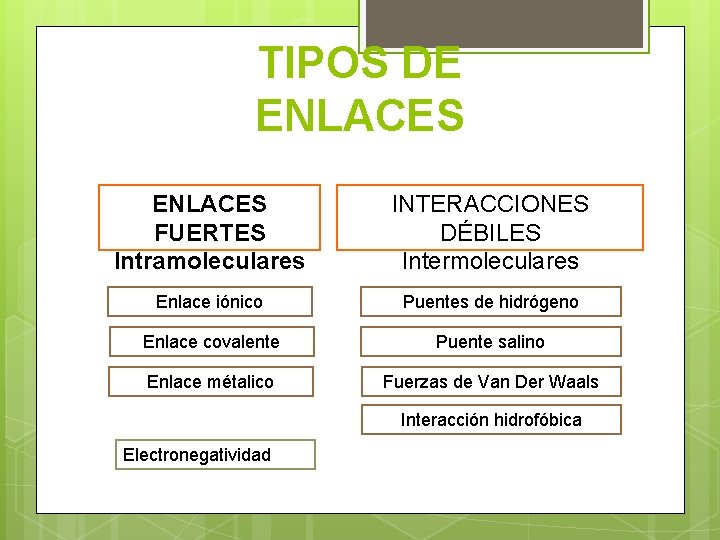
TIPOS DE ENLACES FUERTES Intramoleculares INTERACCIONES DÉBILES Intermoleculares Enlace iónico Puentes de hidrógeno Enlace covalente Puente salino Enlace métalico Fuerzas de Van Der Waals Interacción hidrofóbica Electronegatividad

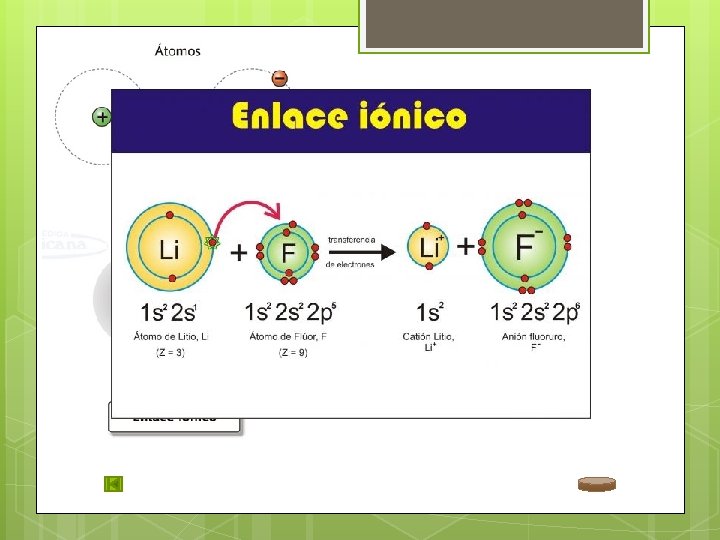
ENLACE IÓNICO Sucede entre metal y no metal. Los electrones se transfieren del metal al no metal. Se forman iones: Catión (+) Anión (-).

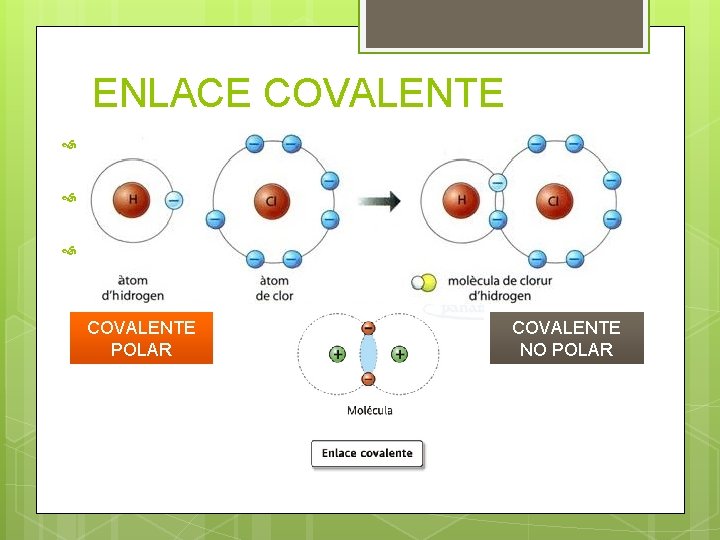
ENLACE COVALENTE Ocurre con dos o más átomos comparten electrones. Los elementos que participan son “no metales”. Tipo de enlace presente en las moléculas biológicas. COVALENTE POLAR COVALENTE NO POLAR

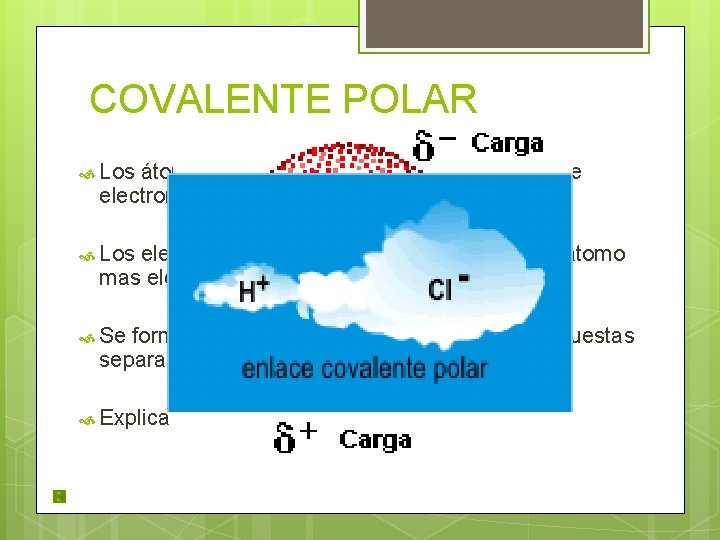
COVALENTE POLAR Los átomos que forman el enlace tienen diferente electronegatividad. Los electrones son atraídos hacia el núcleo del átomo mas electronegativo. Se forma un dipolo: Molécula con dos cargas opuestas separadas por una pequeña distancia. Explica la solubilidad del agua ¿Por qué. . ?

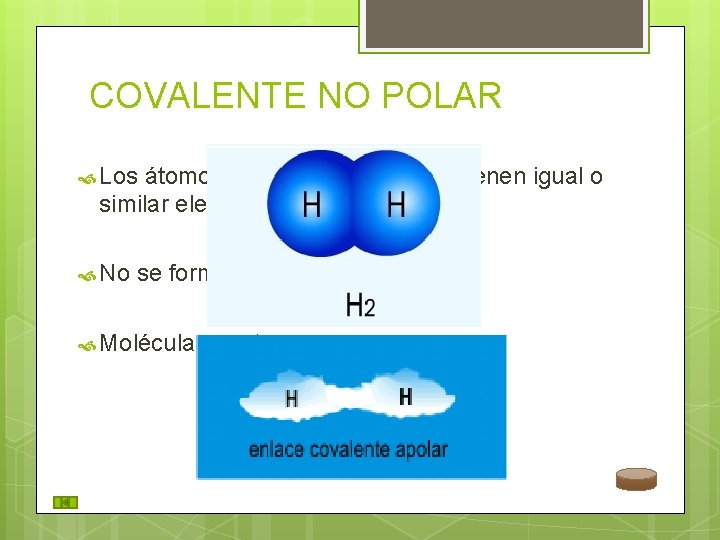
COVALENTE NO POLAR Los átomos que forman el enlace tienen igual o similar electronegatividad. No se forman dipolos. Moléculas neutras.

ENLACE METÁLICO Tipo de enlace que mantiene unidos los átomos de los metales. Los electrones son liberados hacia un “mar” de electrones que rodea a los núcleos de los átomos. Responsable de la maleabilidad, ductilidad y conductividad de los metales.

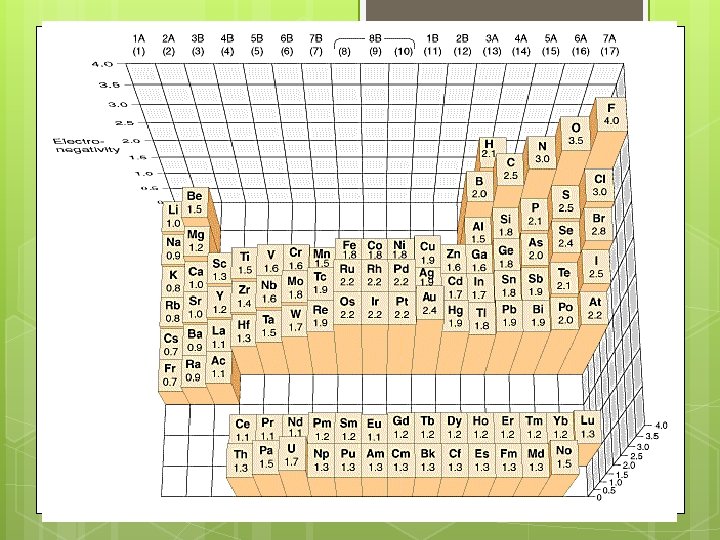
ELECTRONEGATIVIDAD La electronegatidad (EN) de un elemento es una medida de la tendencia relativa de un átomo a atraer electrones hacia sí mismo cuando está combinado químicamente con otro átomo.


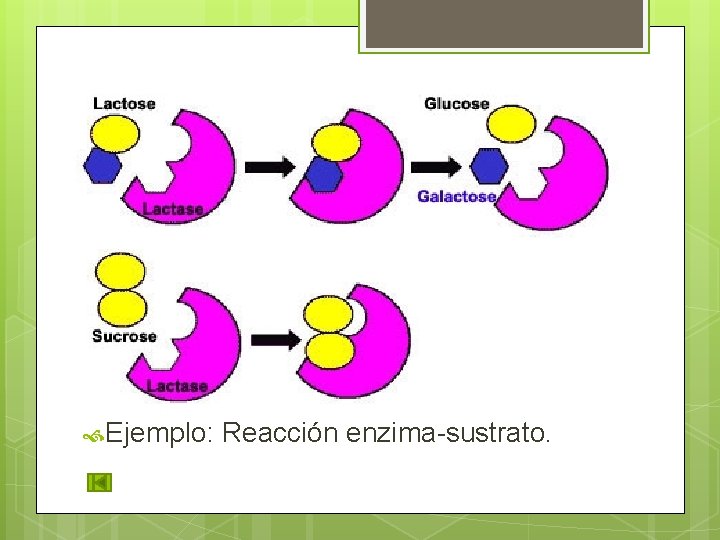
INTERACCIONES DÉBILES Esenciales para la vida. Las moléculas interaccionan para llevar a cabo una reacción y ser capaces de separarse. Ejemplo: Reacción enzima-sustrato.

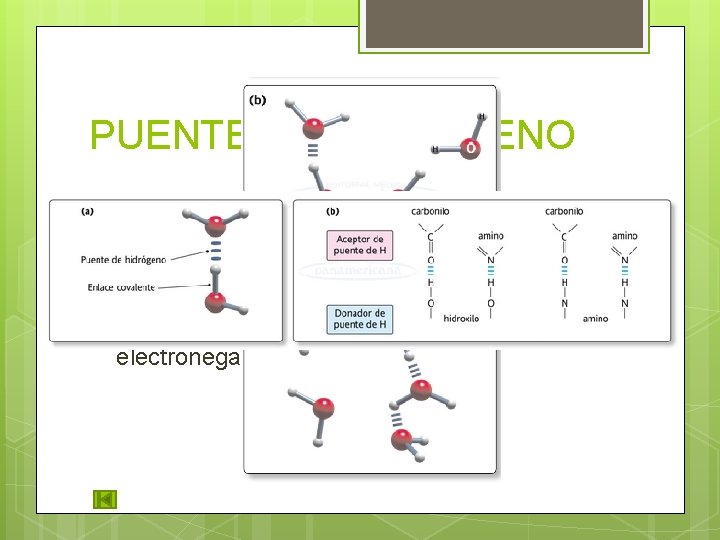
PUENTE DE HIDRÓGENO Relativamente fuerte. Involucra moléculas polares en un medio acuoso. Para su formación es necesario 1 átomo de H con unión covalente a un átomo muy electronegativo (O, N).

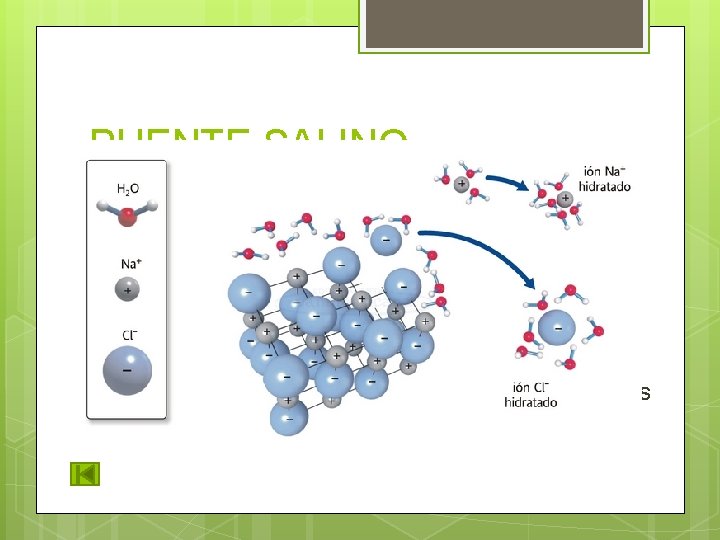
PUENTE SALINO Enlace iónico en agua: los iones (K+, Na+, Cl +) interactúan entre cargas opuestas. Los iones se atraen o se repelen de acuerdo a su carga. Es débil ya que al estar en agua (solvatados), se reduce la fuerza de sus enlaces. Grupos funcionales que se comportan como iones en p. H fisiológico: Carboxilo y amino.

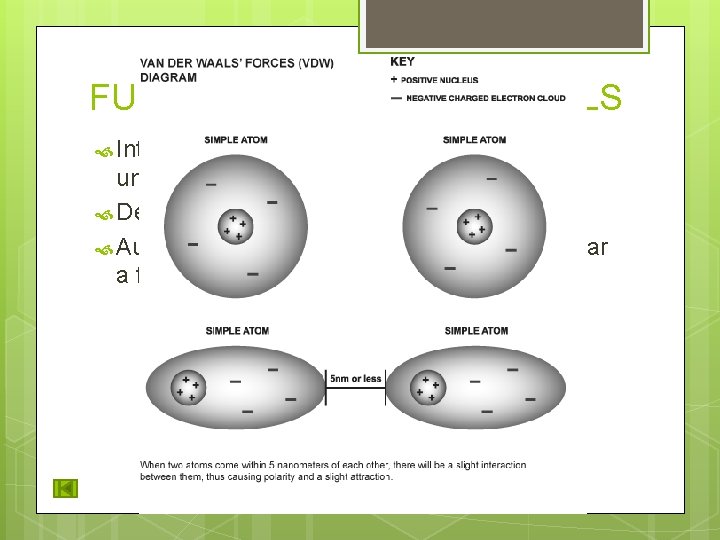
FUERZAS DE VAN DER WAALS Interacciones muy débiles que mantienen unidos átomos o moléculas no polares. Depende de la distancia de los átomos. Aunque son moléculas sin carga, puede llegar a formar un dipolo temporal.

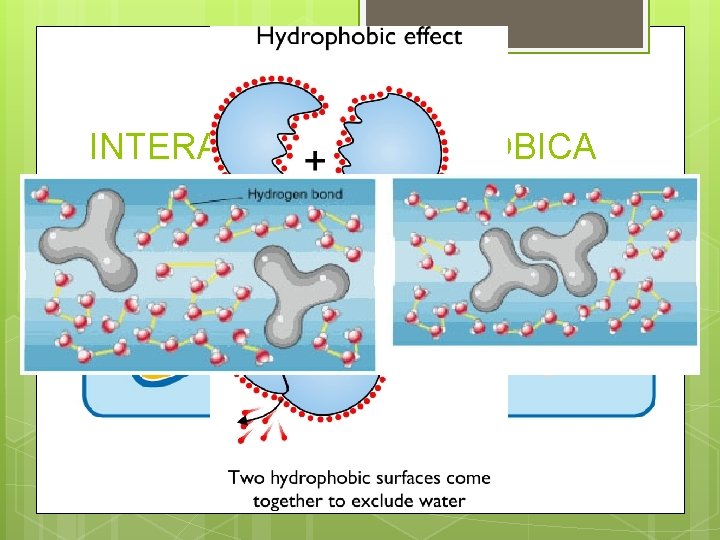
INTERACCIÓN HIDROFÓBICA No son electrostáticas. Entre moléculas y grupos funcionales no polares. No hay interacción. La unión se basa en la imposibilidad de las moléculas de interactuar con el agua. La fuerza que mantiene unidas las moléculas apolares se debe a la tendencia de expulsar el agua de su entorno por la insolubilidad. Presente en las membranas celulares.

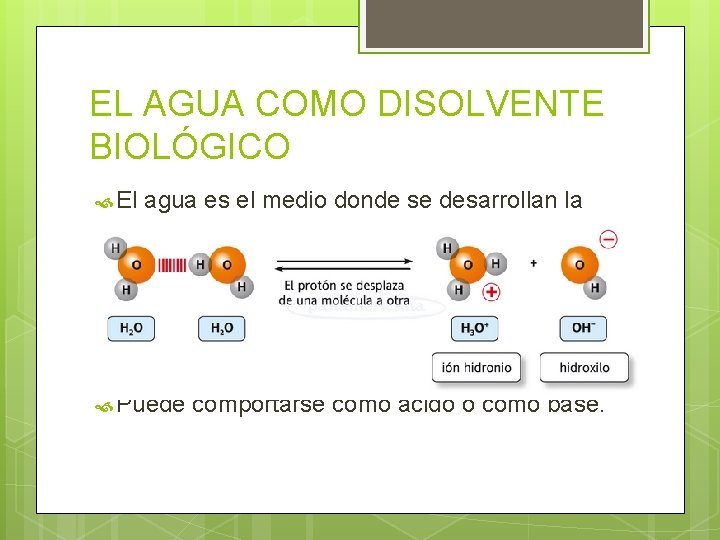
EL AGUA COMO DISOLVENTE BIOLÓGICO El agua es el medio donde se desarrollan la mayoría de las reacciones químicas en la célula. Es un dipolo. Por medio de los puentes de hidrógeno se pueden disolver muchos compuestos. Puede ionizarse. Puede comportarse como ácido o como base.

ÁCIDOS Y BASES ÁCIDO: Molécula con un átomo capaz de aceptar electrones (carga +). Cede protones. BASE: Tiene electrones para llevar a cabo un enlace (carga ). Acepta protones. Anfótera: Puede comportarse como ácido o como base El agua se comporta como ácido en presencia de una base y como base en presencia de un ácido

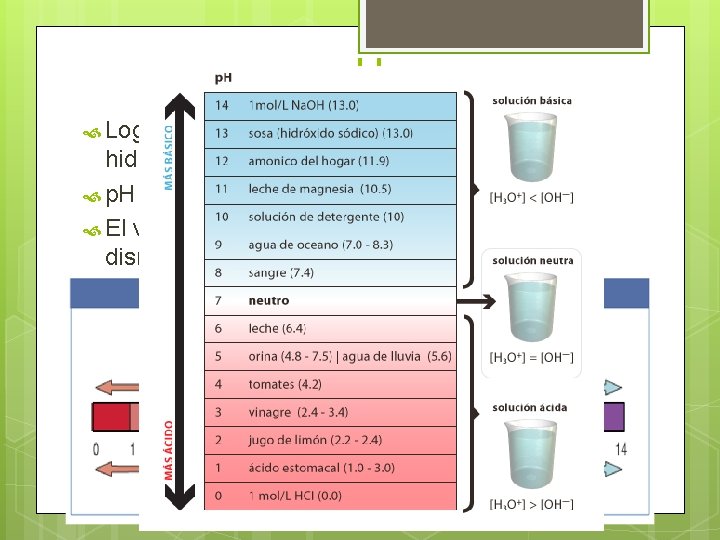
p. H Logaritmo negativo de la concentración del ión hidrógeno (H+). p. H = -log [H+]. El valor de p. H aumenta a medida que [H+] disminuye.

TAREA Definición, Alcanos Alquenos Alquinos similitudes y diferencias de:

GRUPOS FUNCIONALE S

 Enlace sigma ejemplo
Enlace sigma ejemplo El reino de dios es como una perla
El reino de dios es como una perla Jorge jesus calcach gutierrez
Jorge jesus calcach gutierrez Pascoli chiu
Pascoli chiu Perla barocco
Perla barocco Lorena perla alta
Lorena perla alta Pupille perla
Pupille perla Ubicacion geografica
Ubicacion geografica Rozpad kolonializmu
Rozpad kolonializmu Con perlas
Con perlas Perla irregular
Perla irregular La perla de cuba
La perla de cuba Baroko perla
Baroko perla La ostra que perdio su perla
La ostra que perdio su perla Barocco perla
Barocco perla Perla nepravidelného tvaru
Perla nepravidelného tvaru Qual a sentença verdadeira
Qual a sentença verdadeira Qumica
Qumica Qumica
Qumica Homogneo
Homogneo Qumica
Qumica