LOS COMPONENTES QUMICOS DE LA CLULA ENLACES QUMICOS










![p. H (II) En una disolución neutra: [H 3 O+] = [OH-] = 10 p. H (II) En una disolución neutra: [H 3 O+] = [OH-] = 10](https://slidetodoc.com/presentation_image/051f032636728429ae9f59c66e08dc0c/image-29.jpg)



- Slides: 37

LOS COMPONENTES QUÍMICOS DE LA CÉLULA

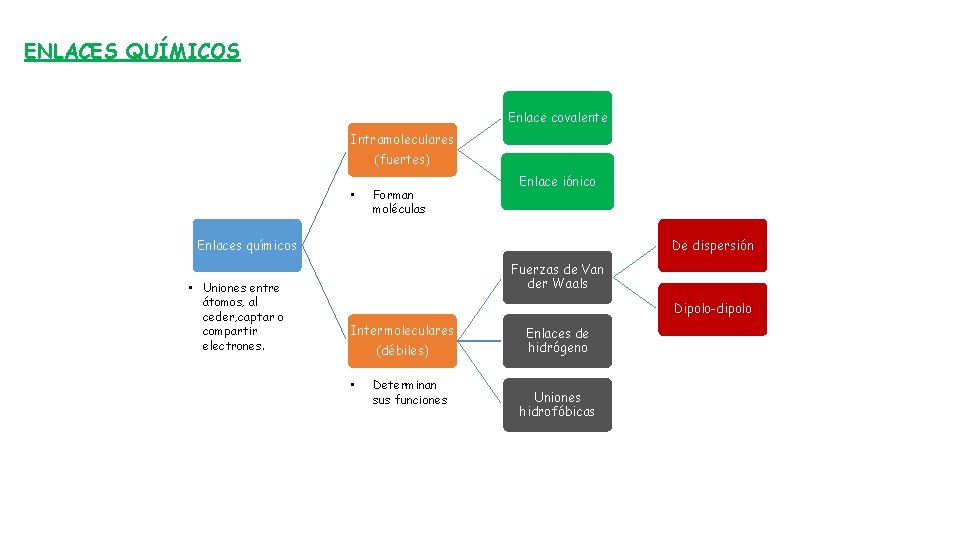
ENLACES QUÍMICOS Enlace covalente Intramoleculares (fuertes) • Forman moléculas Enlace iónico Enlaces químicos • Uniones entre átomos, al ceder, captar o compartir electrones. De dispersión Fuerzas de Van der Waals Dipolo-dipolo Intermoleculares (débiles) • Determinan sus funciones Enlaces de hidrógeno Uniones hidrofóbicas

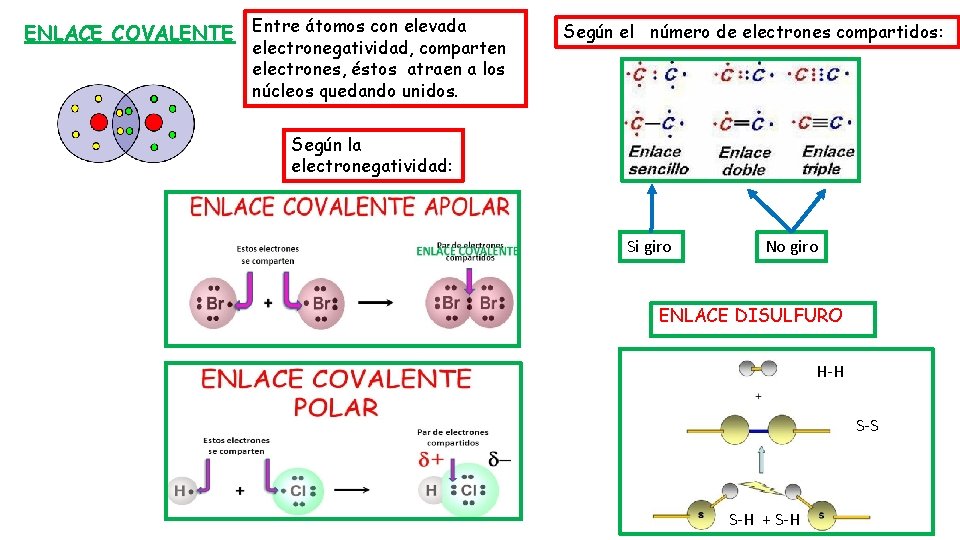
ENLACE COVALENTE Entre átomos con elevada electronegatividad, comparten electrones, éstos atraen a los núcleos quedando unidos. Según el número de electrones compartidos: Según la electronegatividad: Si giro No giro ENLACE DISULFURO H-H S-S S-H + S-H

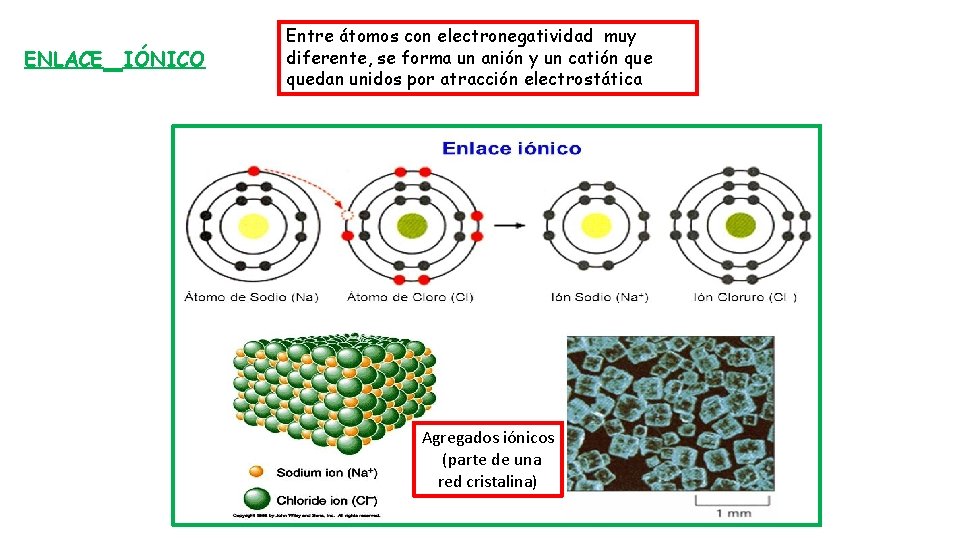
ENLACE IÓNICO Entre átomos con electronegatividad muy diferente, se forma un anión y un catión quedan unidos por atracción electrostática Agregados iónicos (parte de una red cristalina)

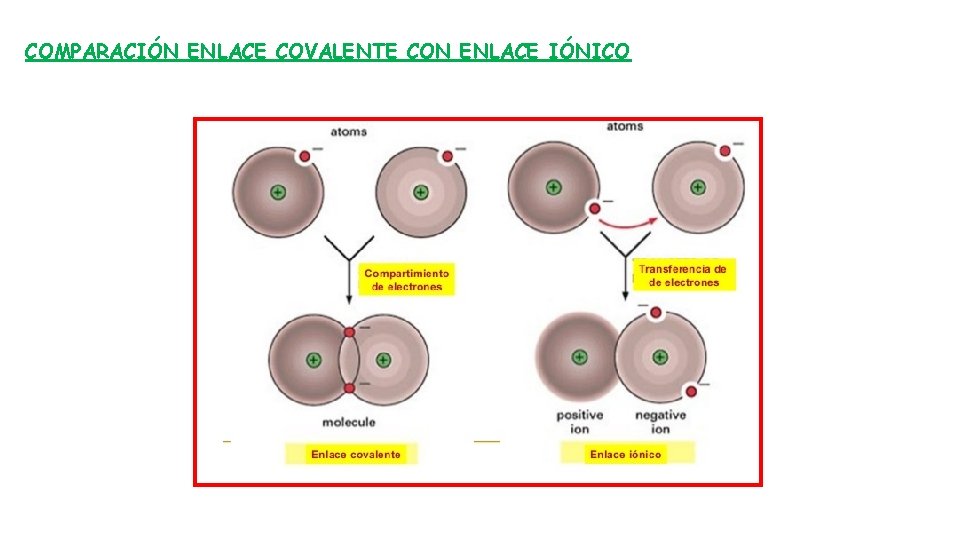
COMPARACIÓN ENLACE COVALENTE CON ENLACE IÓNICO

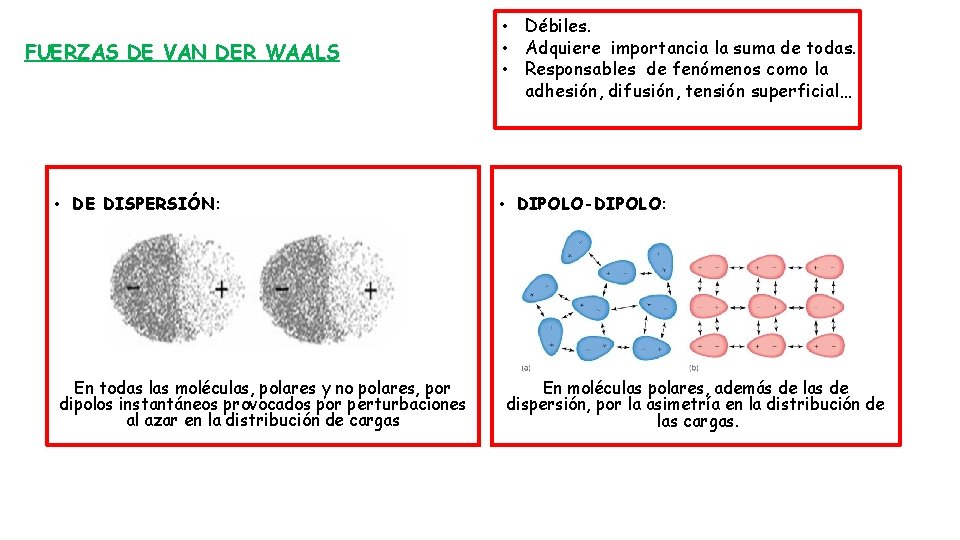
FUERZAS DE VAN DER WAALS • DE DISPERSIÓN: En todas las moléculas, polares y no polares, por dipolos instantáneos provocados por perturbaciones al azar en la distribución de cargas • Débiles. • Adquiere importancia la suma de todas. • Responsables de fenómenos como la adhesión, difusión, tensión superficial… • DIPOLO-DIPOLO: En moléculas polares, además de las de dispersión, por la asimetría en la distribución de las cargas.

ENLACES DE HIDRÓGENO Enlace de hidrógeno, atracción electrostática. 1. H unido a F, O, N → 2. Elevada electronegatividad y pequeño tamaño del F, O y N→ 3. Cercanía de los electrones compartidos → 4. Exceso de carga negativa δ- sobre ellos y positiva δ+ sobre el H → 5. Enlace de hidrógeno por atracción eléctrica entre las cargas parciales.

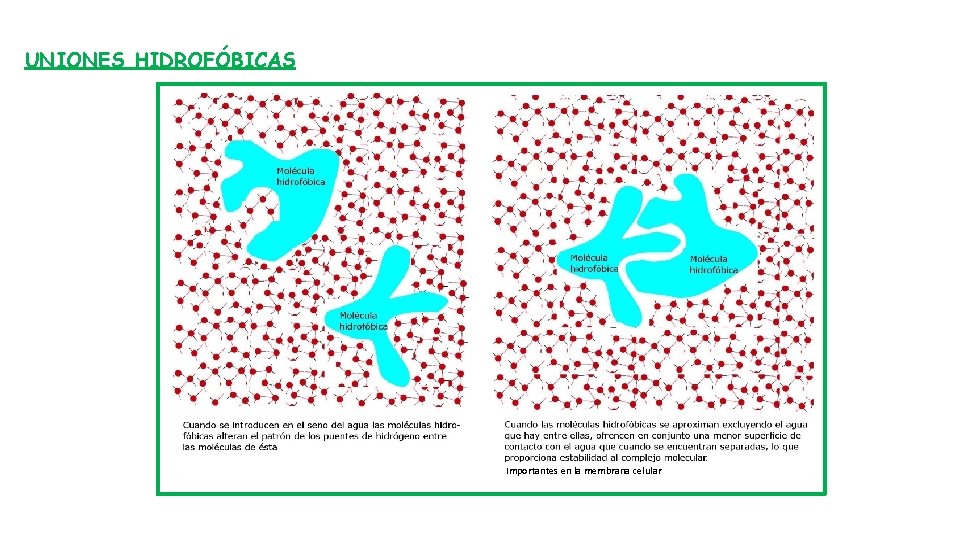
UNIONES HIDROFÓBICAS Importantes en la membrana celular

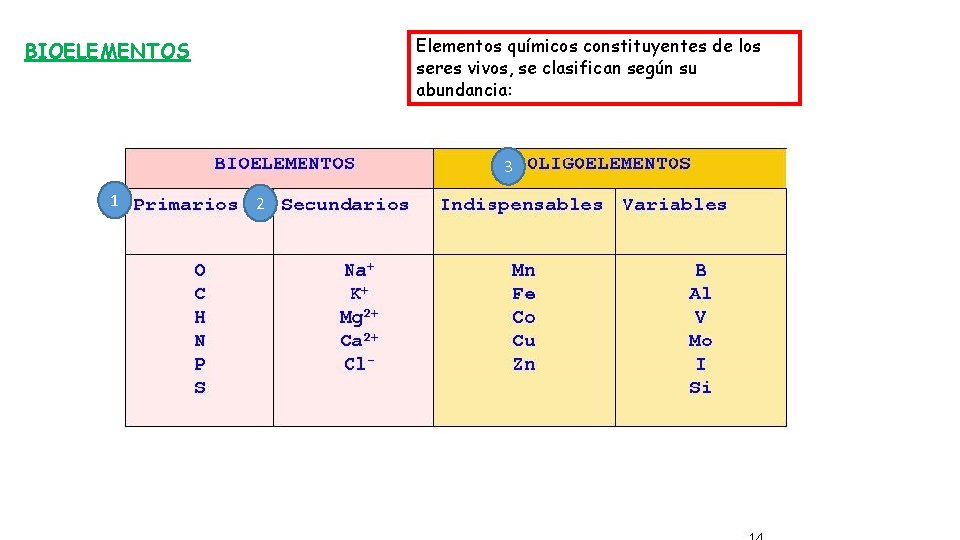
Elementos químicos constituyentes de los seres vivos, se clasifican según su abundancia: BIOELEMENTOS 3 1 2

BIOELEMENTOS PRIMARIOS 99 % de la masa celular: C, H, O, N, P, S. Forman parte de todas las biomoléculas orgánicas Fundamental en proteínas, ácidos nucleicos, clorofila, muchos glúcidos y lípidos

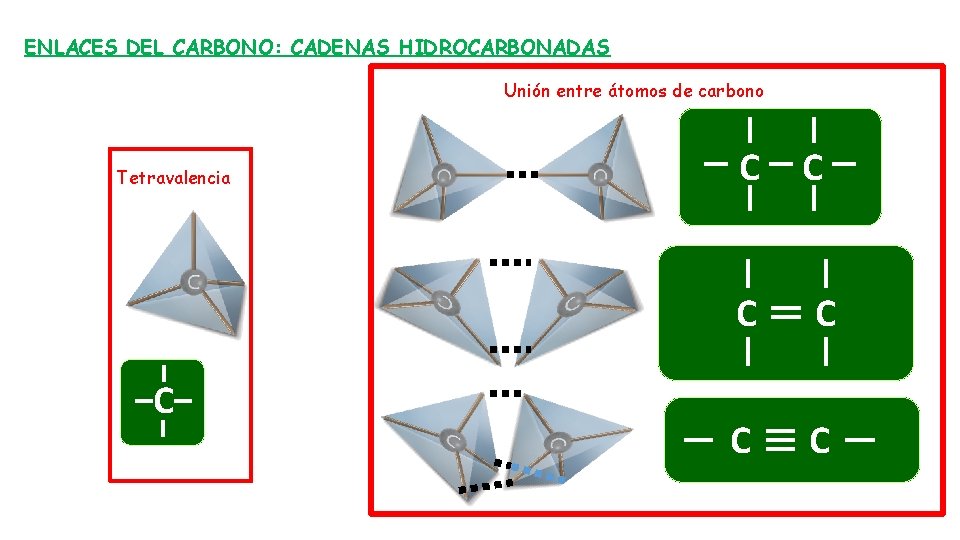
CARACTERÍSTICAS DE LOS BIOELEMENTOS PRIMARIOS 1. Por su configuración electrónica para completar su capa de valencia necesitan electrones, el H 1 e- , el O 2 e-, el N 3 e- y el C 4 e- , establecen enlaces covalentes. H → Z = 1 → ↑ O → Z = 8 → ↑↓ ↑↓ ↑↓ ↑ ↑ N → Z = 7 → ↑↓ ↑↓ ↑ ↑ ↑ C → Z = 6 → ↑↓ ↑ ↑ 1 s 2 s 2 p 2. Masa atómica baja, enlaces fuertes, moléculas estables. 3. En el caso concreto del C: 3. 1. Tetravalencia: Al poseer 4 e- de valencia, pudiendo unirse hasta con 4 átomos o grupos funcionales diferentes mediante enlaces covalentes que dan estabilidad a la molécula y se disponen formando un tetraedro regular que forma moléculas tridimensionales. 3. 2. Los C pueden unirse entre sí mediante enlaces sencillos, dobles y triples, formando cadenas hidrocarbonadas lineales, ramificadas o cíclicas, muy variadas y complejas al poder unirse con el O y el N. 4. La electronegatividad del O, N, P y S les permite formar grupos polares y al unirse a las cadenas hidrocarbonadas les confieren polaridad suficiente para ser solubles en agua facilitando su incorporación y eliminación.

ENLACES DEL CARBONO: CADENAS HIDROCARBONADAS Unión entre átomos de carbono Tetravalencia C C C C

BIOELEMENTOS SECUNDARIOS En pequeñas cantidades, incluso menor de 0, 1 %, generalmente en forma iónica: Na+, Ca 2+, K+, Mg 2+, Cl-

OLIGOEMENTOS (Oligos: escaso), presentes de forma vestigial, pero fundamentales por sus funciones catalíticas. Ausencia: enfermedades carenciales, Exceso: intoxicaciones. Entre otros: Fe, Mn, Cu, Zn, I, F…

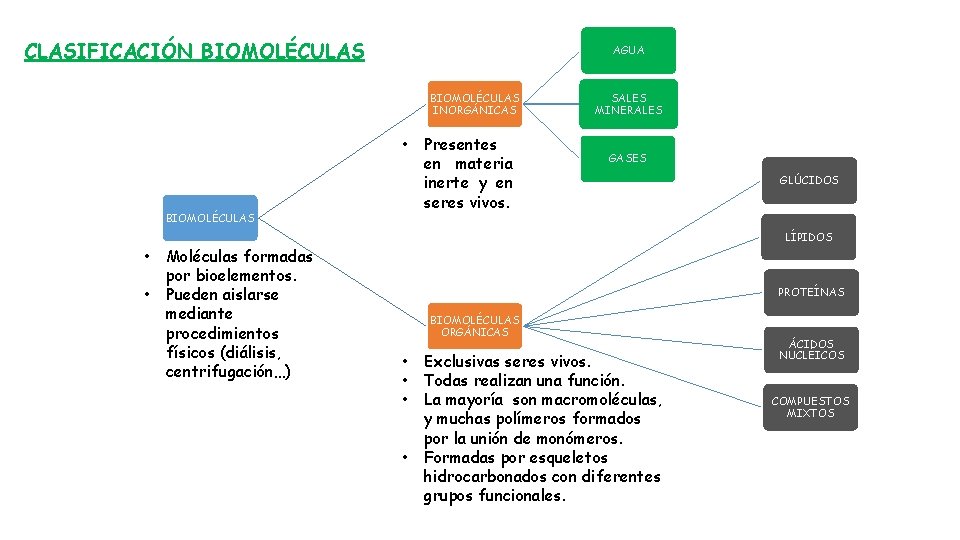
CLASIFICACIÓN BIOMOLÉCULAS AGUA BIOMOLÉCULAS INORGÁNICAS • BIOMOLÉCULAS Presentes en materia inerte y en seres vivos. SALES MINERALES GASES GLÚCIDOS LÍPIDOS • • Moléculas formadas por bioelementos. Pueden aislarse mediante procedimientos físicos (diálisis, centrifugación…) PROTEÍNAS BIOMOLÉCULAS ORGÁNICAS • • Exclusivas seres vivos. Todas realizan una función. La mayoría son macromoléculas, y muchas polímeros formados por la unión de monómeros. Formadas por esqueletos hidrocarbonados con diferentes grupos funcionales. ÁCIDOS NUCLÉICOS COMPUESTOS MIXTOS

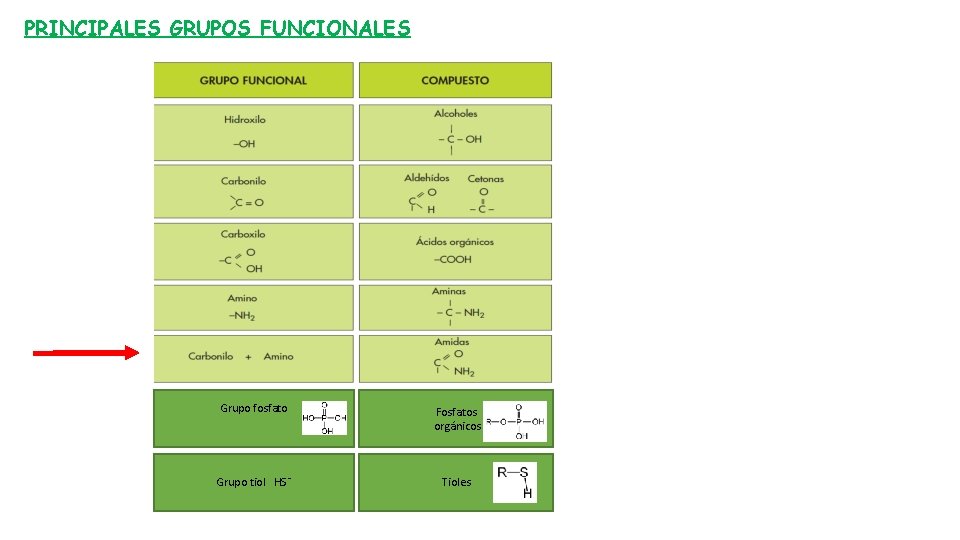
PRINCIPALES GRUPOS FUNCIONALES Grupo fosfato Fosfatos orgánicos Grupo tiol HS¯ Tioles

MOLÉCULA DE AGUA • Biomolécula inorgánica. • Componente más abundante de los seres vivos dependiendo de: 1. % partes esqueléticas: ↑%, ↓H 2 O 2. Edad: ↑edad, ↓H 2 O 3. Actividad biológica tejido: ↑actividad, ↑ H 2 O • Componente fundamental de las células: 2/3 intracelular, 1/3 extracelular. • Hábitat de un gran número de especies de seres vivos. • Estructura →propiedades →funciones.

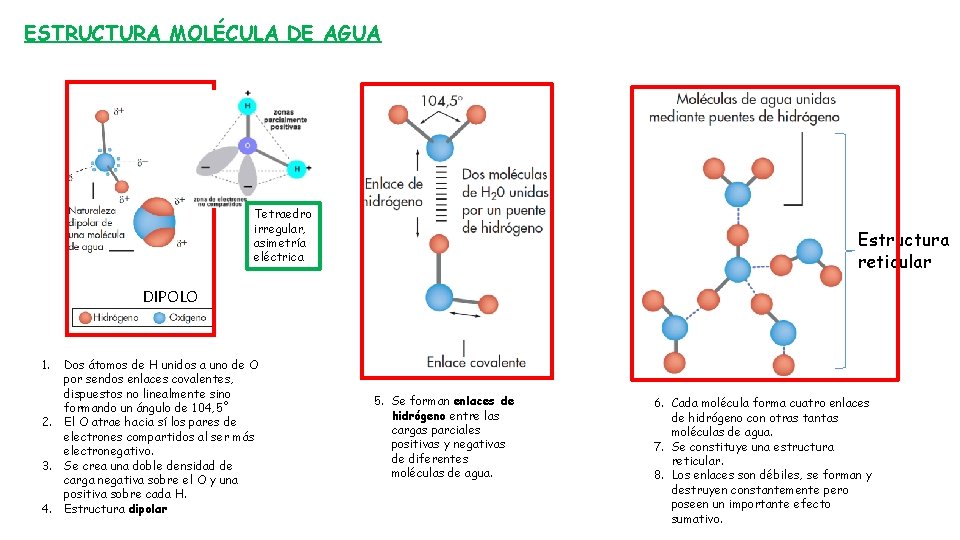
ESTRUCTURA MOLÉCULA DE AGUA Tetraedro irregular, asimetría eléctrica Estructura reticular DIPOLO 1. Dos átomos de H unidos a uno de O por sendos enlaces covalentes, dispuestos no linealmente sino formando un ángulo de 104, 5˚ 2. El O atrae hacia sí los pares de electrones compartidos al ser más electronegativo. 3. Se crea una doble densidad de carga negativa sobre el O y una positiva sobre cada H. 4. Estructura dipolar 5. Se forman enlaces de hidrógeno entre las cargas parciales positivas y negativas de diferentes moléculas de agua. 6. Cada molécula forma cuatro enlaces de hidrógeno con otras tantas moléculas de agua. 7. Se constituye una estructura reticular. 8. Los enlaces son débiles, se forman y destruyen constantemente pero poseen un importante efecto sumativo.

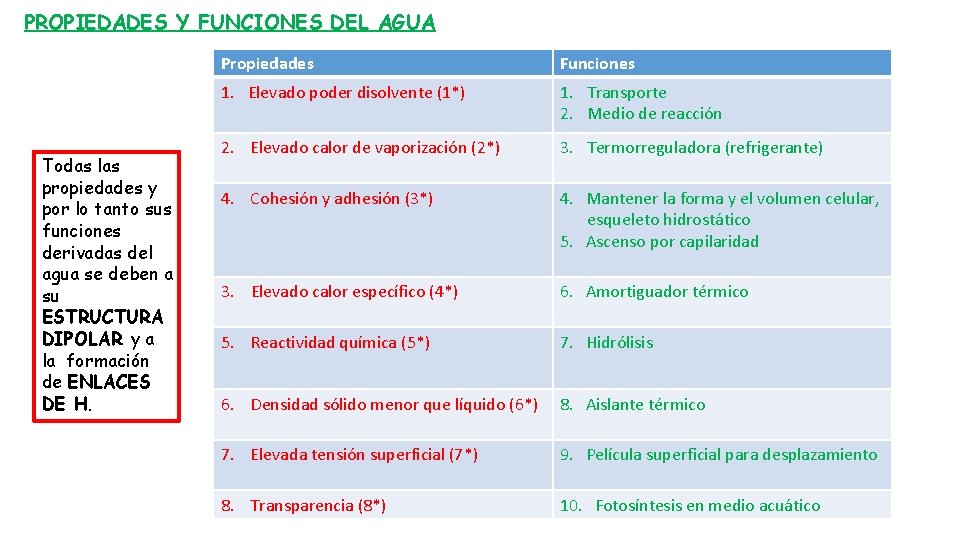
PROPIEDADES Y FUNCIONES DEL AGUA Todas las propiedades y por lo tanto sus funciones derivadas del agua se deben a su ESTRUCTURA DIPOLAR y a la formación de ENLACES DE H. Propiedades Funciones 1. Elevado poder disolvente (1*) 1. Transporte 2. Medio de reacción 2. Elevado calor de vaporización (2*) 3. Termorreguladora (refrigerante) 4. Cohesión y adhesión (3*) 4. Mantener la forma y el volumen celular, esqueleto hidrostático 5. Ascenso por capilaridad 3. Elevado calor específico (4*) 6. Amortiguador térmico 5. Reactividad química (5*) 7. Hidrólisis 6. Densidad sólido menor que líquido (6*) 8. Aislante térmico 7. Elevada tensión superficial (7*) 9. Película superficial para desplazamiento 8. Transparencia (8*) 10. Fotosíntesis en medio acuático

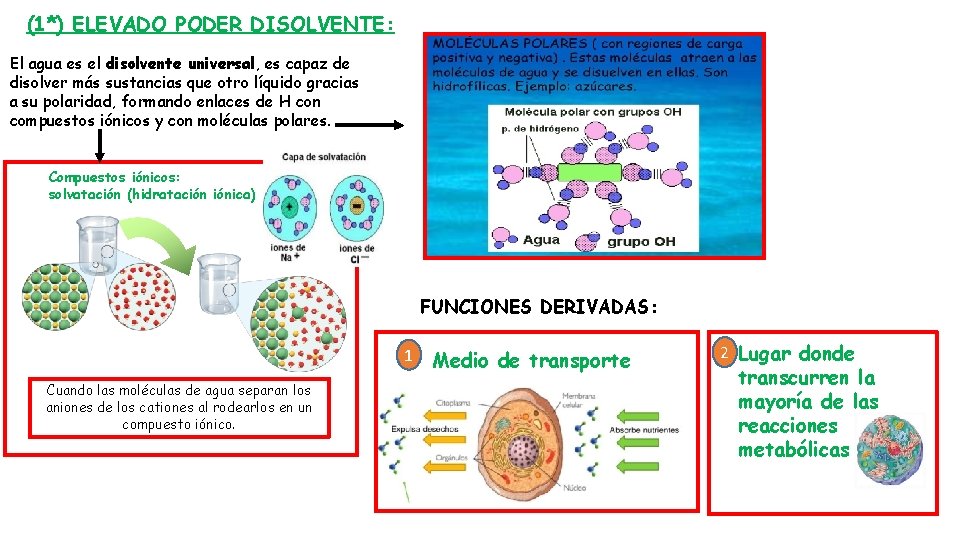
(1*) ELEVADO PODER DISOLVENTE: El agua es el disolvente universal, es capaz de disolver más sustancias que otro líquido gracias a su polaridad, formando enlaces de H con compuestos iónicos y con moléculas polares. Compuestos iónicos: solvatación (hidratación iónica) FUNCIONES DERIVADAS: 1 Cuando las moléculas de agua separan los aniones de los cationes al rodearlos en un compuesto iónico. Medio de transporte 2 Lugar donde transcurren la mayoría de las reacciones metabólicas

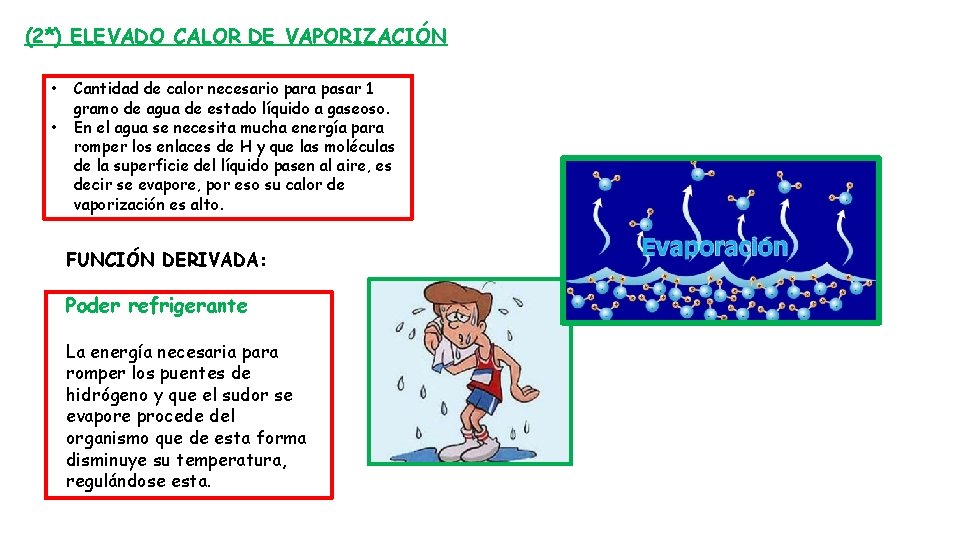
(2*) ELEVADO CALOR DE VAPORIZACIÓN • • Cantidad de calor necesario para pasar 1 gramo de agua de estado líquido a gaseoso. En el agua se necesita mucha energía para romper los enlaces de H y que las moléculas de la superficie del líquido pasen al aire, es decir se evapore, por eso su calor de vaporización es alto. FUNCIÓN DERIVADA: Poder refrigerante La energía necesaria para romper los puentes de hidrógeno y que el sudor se evapore procede del organismo que de esta forma disminuye su temperatura, regulándose esta.

(3*) COHESIÓN Y ADHESIÓN ELEVADAS Cohesión: Unión con otras moléculas de agua. Adhesión: Unión con cualquier otra molécula con cargas positivas y negativas. FUNCIONES DERIVADAS: 1 2 Esqueleto hidrostático Capilaridad Anélidos Celentéreos vegetales

(4*) CALOR ESPECÍFICO ELEVADO • Cantidad de calor que hay que suministrar a 1 g de agua para elevar su temperatura 1°C. FUNCIÓN DERIVADA: Amortiguador térmico La temperatura sube al aumentar la energía cinética de sus moléculas, es decir al aumentar su movimiento → Los enlaces de H dificultan el movimiento → Parte de la energía se emplea en romper los enlaces de hidrógenos y solo una parte en subir su temperatura → En el agua la temperatura asciende y desciende más lentamente → Amortiguador térmico VERANO Energía térmica INVIERNO Energía térmica

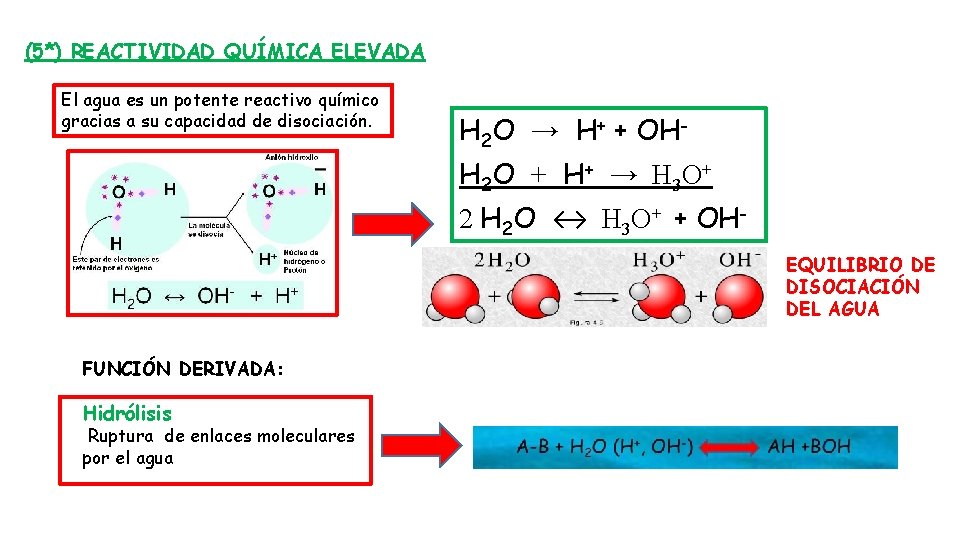
(5*) REACTIVIDAD QUÍMICA ELEVADA El agua es un potente reactivo químico gracias a su capacidad de disociación. H 2 O → H+ + OHH 2 O + H + → H 3 O + 2 H 2 O ↔ H 3 O+ + OHEQUILIBRIO DE DISOCIACIÓN DEL AGUA FUNCIÓN DERIVADA: Hidrólisis Ruptura de enlaces moleculares por el agua

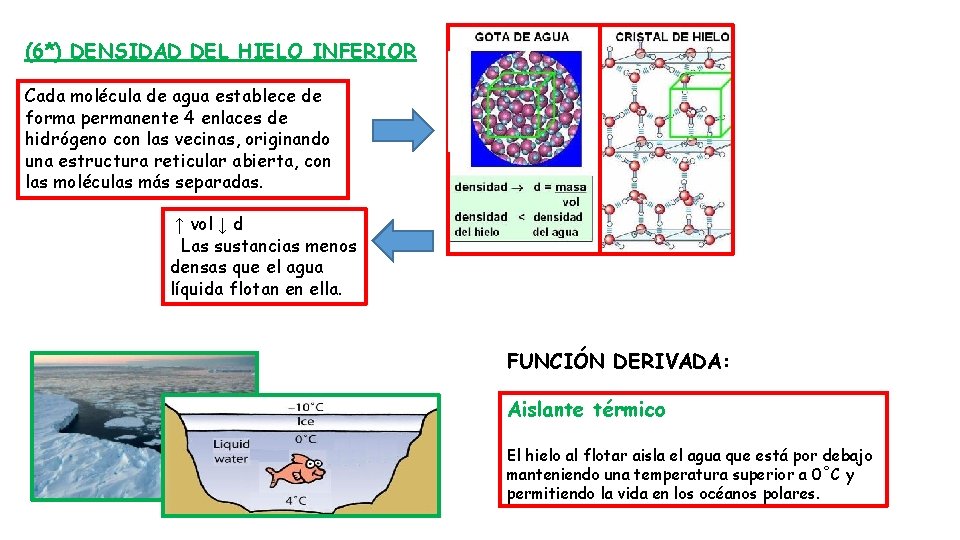
(6*) DENSIDAD DEL HIELO INFERIOR Cada molécula de agua establece de forma permanente 4 enlaces de hidrógeno con las vecinas, originando una estructura reticular abierta, con las moléculas más separadas. ↑ vol ↓ d Las sustancias menos densas que el agua líquida flotan en ella. FUNCIÓN DERIVADA: Aislante térmico El hielo al flotar aisla el agua que está por debajo manteniendo una temperatura superior a 0˚C y permitiendo la vida en los océanos polares.

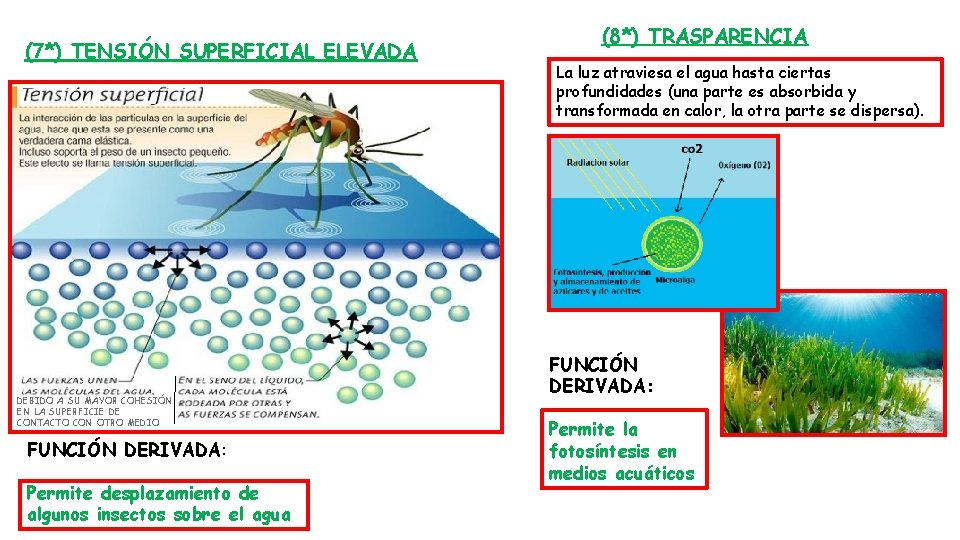
(7*) TENSIÓN SUPERFICIAL ELEVADA DEBIDO A SU MAYOR COHESIÓN EN LA SUPERFICIE DE CONTACTO CON OTRO MEDIO FUNCIÓN DERIVADA: Permite desplazamiento de algunos insectos sobre el agua (8*) TRASPARENCIA La luz atraviesa el agua hasta ciertas profundidades (una parte es absorbida y transformada en calor, la otra parte se dispersa). FUNCIÓN DERIVADA: Permite la fotosíntesis en medios acuáticos

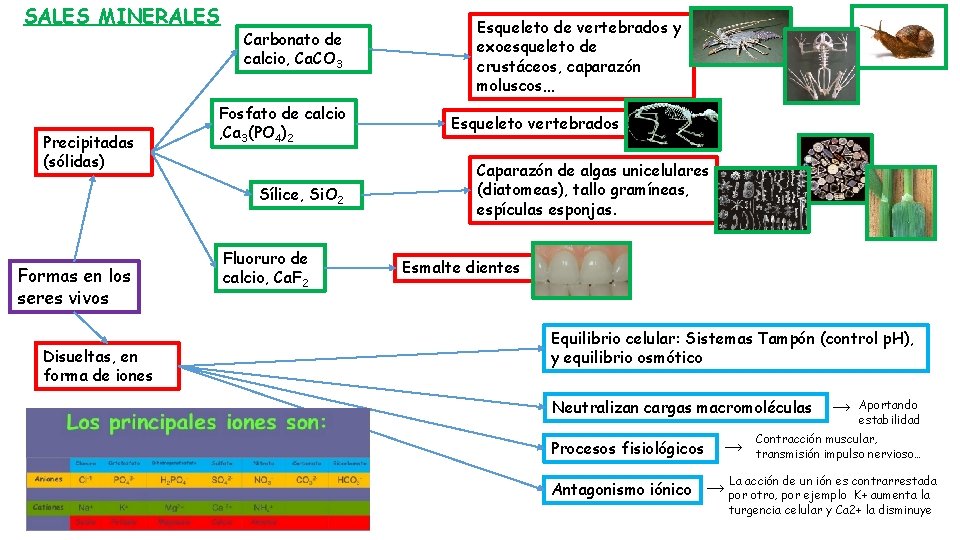
SALES MINERALES Precipitadas (sólidas) Carbonato de calcio, Ca. CO 3 Fosfato de calcio , Ca 3(PO 4)2 Sílice, Si. O 2 Formas en los seres vivos Disueltas, en forma de iones Fluoruro de calcio, Ca. F 2 Esqueleto de vertebrados y exoesqueleto de crustáceos, caparazón moluscos… Esqueleto vertebrados Caparazón de algas unicelulares (diatomeas), tallo gramíneas, espículas esponjas. Esmalte dientes Equilibrio celular: Sistemas Tampón (control p. H), y equilibrio osmótico Neutralizan cargas macromoléculas Procesos fisiológicos Antagonismo iónico → → → Aportando estabilidad Contracción muscular, transmisión impulso nervioso… La acción de un ión es contrarrestada por otro, por ejemplo K+ aumenta la turgencia celular y Ca 2+ la disminuye

EQUILIBRIO CELULAR: p. H (I) Equilibrio de disociación del agua: El p. H es el logaritmo decimal con signo negativo de [H 3 O+] 2 H 2 O ↔ H 3 O+ + OHCuya constante de equilibrio es: K = [H 3 O+] [OH-] / [H 2 O]2 Como: Lleguemos a esa expresión……. [H 2 O] = gramos de H 2 O en 1 L / PM = 1000 / 18 = 55, 5 Quedaría: K · 55, 5 = [H 3 O+] [OH-] A lo que se llama producto iónico del agua, Kw, que a 25 °C es de 10 -14: Kw = [H 3 O+] [OH-] = 10 -14
![p H II En una disolución neutra H 3 O OH 10 p. H (II) En una disolución neutra: [H 3 O+] = [OH-] = 10](https://slidetodoc.com/presentation_image/051f032636728429ae9f59c66e08dc0c/image-29.jpg)
p. H (II) En una disolución neutra: [H 3 O+] = [OH-] = 10 -7 Si nos centramos en los hidronios [H 3 O+]: [H 3 O+] = 10 -7 Si tomamos logaritmos a ambos lados de la igualdad Log [H 3 O+] = Log 10 -7 Aplicando la definición de logaritmo: Log [H 3 O+] = -7 Multiplicamos por (-1) ambos lados de la igualdad: -Log [H 3 O+] = 7 Aplicando la definición de p. H, logaritmo decimal con signo negativo de [H 3 O+]: p. H = 7

p. H (III) En una disolución ácida, el ácido al disolverse produce H+ que se unen al H 2 O y origina [H 3 O+] que por lo tanto aumentará: [H 3 O+] > 10 -7 Si tomamos logaritmos a ambos lados de la igualdad: Log [H 3 O+] > Log 10 -7 Aplicando la definición de logaritmo: Log [H 3 O+] > -7 Multiplicamos por (-1) ambos lados de la igualdad, > cambia a <: -Log [H 3 O+] < 7 Aplicando la definición de p. H, logaritmo decimal con signo negativo de [H 3 O+]: p. H < 7

p. H (IV) En una disolución básica, la base al disolverse produce OH- que se unen al H 3 O+ por lo que disminuirá su concentración: [H 3 O+] < 10 -7 Si tomamos logaritmos a ambos lados de la igualdad: Log [H 3 O+] < Log 10 -7 Aplicando la definición de logaritmo: Log [H 3 O+] < -7 Multiplicamos por (-1) ambos lados de la igualdad, > cambia a <: -Log [H 3 O+] > 7 Aplicando la definición de p. H, logaritmo decimal con signo negativo de [H 3 O+]: p. H > 7

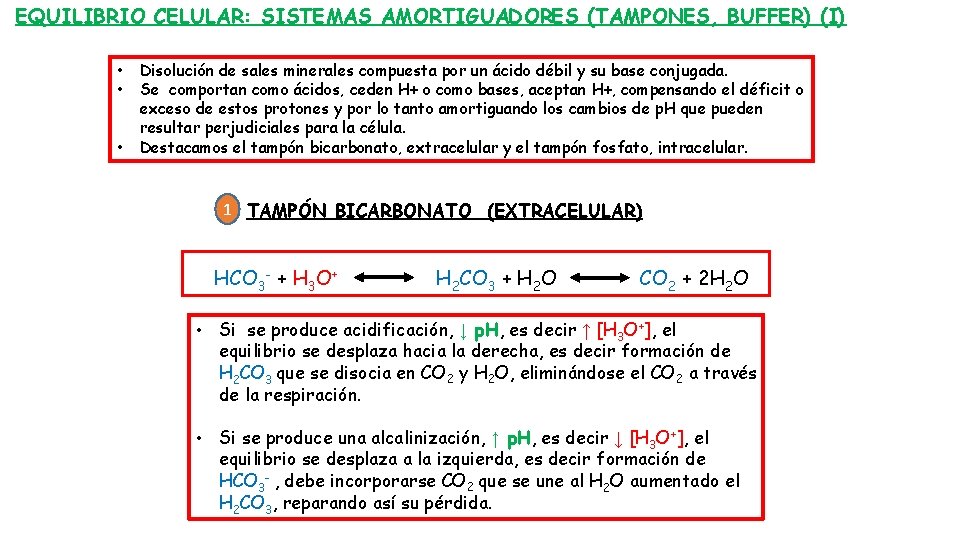
EQUILIBRIO CELULAR: SISTEMAS AMORTIGUADORES (TAMPONES, BUFFER) (I) • • • Disolución de sales minerales compuesta por un ácido débil y su base conjugada. Se comportan como ácidos, ceden H+ o como bases, aceptan H+, compensando el déficit o exceso de estos protones y por lo tanto amortiguando los cambios de p. H que pueden resultar perjudiciales para la célula. Destacamos el tampón bicarbonato, extracelular y el tampón fosfato, intracelular. 1 TAMPÓN BICARBONATO (EXTRACELULAR) HCO 3 - + H 3 O+ H 2 CO 3 + H 2 O CO 2 + 2 H 2 O • Si se produce acidificación, ↓ p. H, es decir ↑ [H 3 O+], el equilibrio se desplaza hacia la derecha, es decir formación de H 2 CO 3 que se disocia en CO 2 y H 2 O, eliminándose el CO 2 a través de la respiración. • Si se produce una alcalinización, ↑ p. H, es decir ↓ [H 3 O+], el equilibrio se desplaza a la izquierda, es decir formación de HCO 3 - , debe incorporarse CO 2 que se une al H 2 O aumentado el H 2 CO 3, reparando así su pérdida.

SISTEMAS AMORTIGUADORES (TAMPONES, BUFFER) (II) 2 TAMPÓN FOSFATO (INTRACELULAR) (HPO 4) 2 - + H 3 O+ (H 2 PO 4)- + H 2 O • Si se produce acidificación, ↓ p. H, es decir ↑ [H 3 O+], el equilibrio se desplaza hacia la derecha es decir formación de H 2 PO 4 • Si se produce alcalinización, ↑ p. H, es decir s ↓ [H 3 O+], el equilibrio se desplaza hacia la izquierda, es decir hacia la formación de HPO 42 -

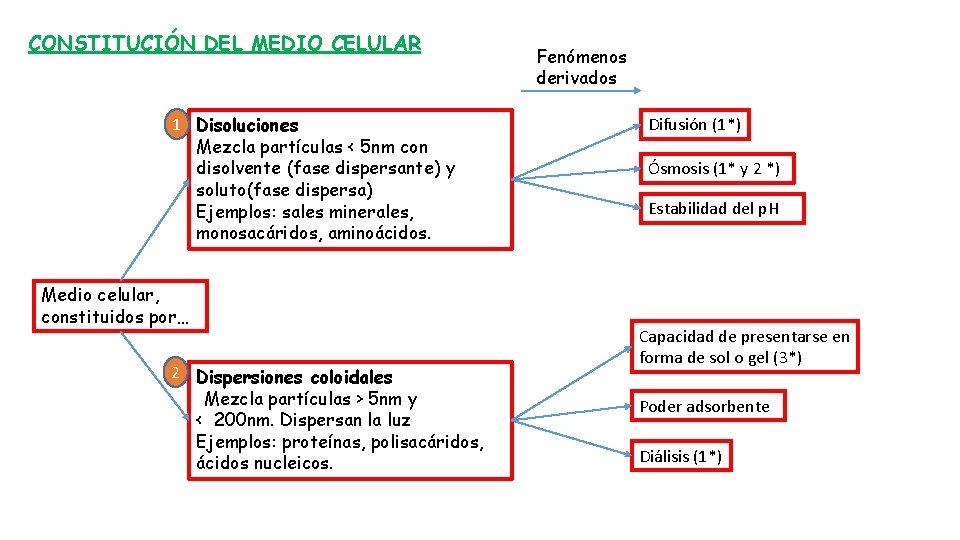
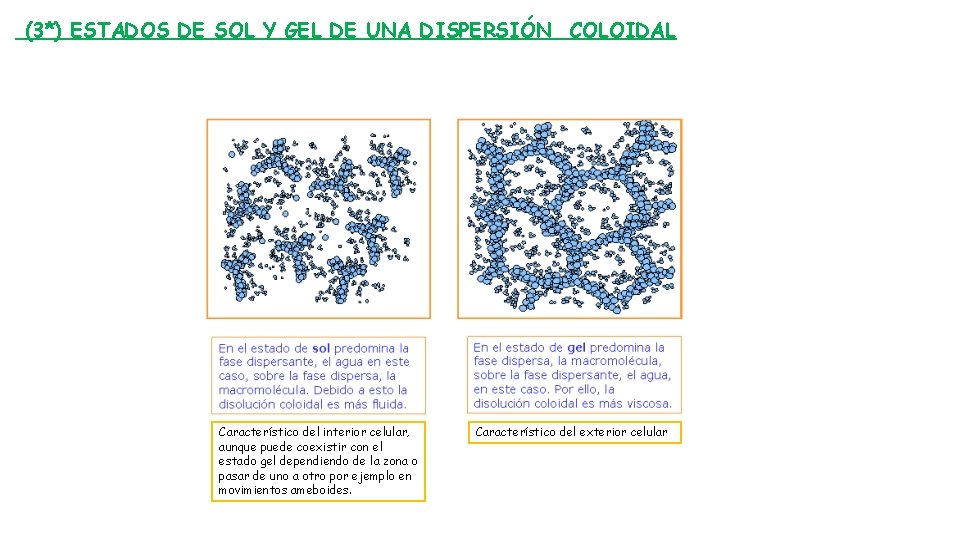
CONSTITUCIÓN DEL MEDIO CELULAR 1 Disoluciones Mezcla partículas < 5 nm con disolvente (fase dispersante) y soluto(fase dispersa) Ejemplos: sales minerales, monosacáridos, aminoácidos. Medio celular, constituidos por… 2 Dispersiones coloidales Mezcla partículas > 5 nm y < 200 nm. Dispersan la luz Ejemplos: proteínas, polisacáridos, ácidos nucleicos. Fenómenos derivados Difusión (1*) Ósmosis (1* y 2 *) Estabilidad del p. H Capacidad de presentarse en forma de sol o gel (3*) Poder adsorbente Diálisis (1*)

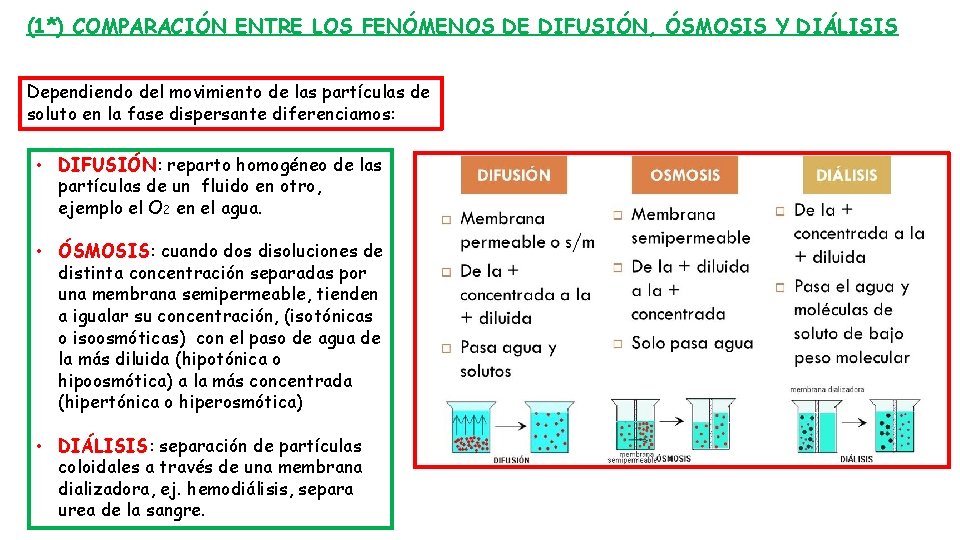
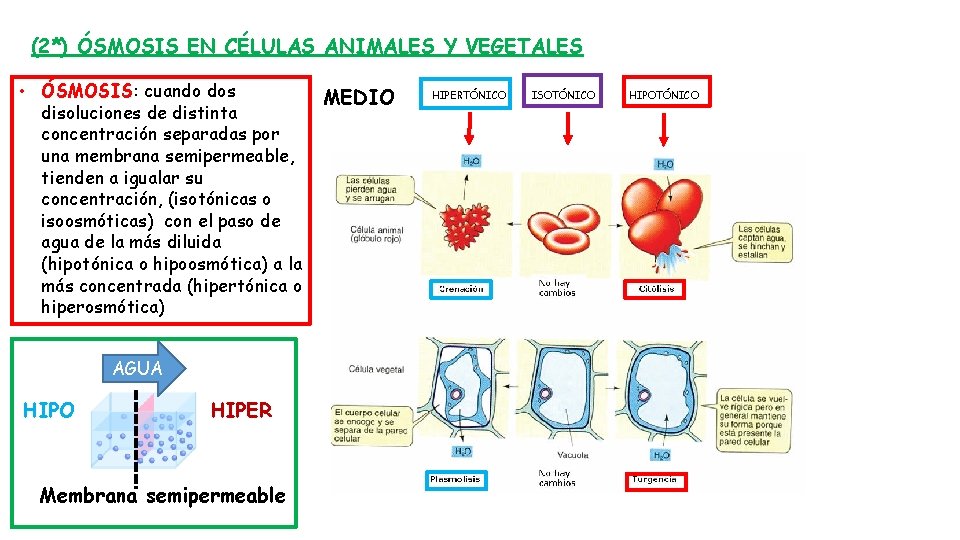
(1*) COMPARACIÓN ENTRE LOS FENÓMENOS DE DIFUSIÓN, ÓSMOSIS Y DIÁLISIS Dependiendo del movimiento de las partículas de soluto en la fase dispersante diferenciamos: • DIFUSIÓN: reparto homogéneo de las partículas de un fluido en otro, ejemplo el O 2 en el agua. • ÓSMOSIS: cuando dos disoluciones de distinta concentración separadas por una membrana semipermeable, tienden a igualar su concentración, (isotónicas o isoosmóticas) con el paso de agua de la más diluida (hipotónica o hipoosmótica) a la más concentrada (hipertónica o hiperosmótica) • DIÁLISIS: separación de partículas coloidales a través de una membrana dializadora, ej. hemodiálisis, separa urea de la sangre.

(2*) ÓSMOSIS EN CÉLULAS ANIMALES Y VEGETALES • ÓSMOSIS: cuando dos disoluciones de distinta concentración separadas por una membrana semipermeable, tienden a igualar su concentración, (isotónicas o isoosmóticas) con el paso de agua de la más diluida (hipotónica o hipoosmótica) a la más concentrada (hipertónica o hiperosmótica) AGUA HIPO HIPER Membrana semipermeable MEDIO HIPERTÓNICO ISOTÓNICO HIPOTÓNICO

(3*) ESTADOS DE SOL Y GEL DE UNA DISPERSIÓN COLOIDAL Característico del interior celular, aunque puede coexistir con el estado gel dependiendo de la zona o pasar de uno a otro por ejemplo en movimientos ameboides. Característico del exterior celular
 Enlaces sigma y pi carbono
Enlaces sigma y pi carbono Chapter 7 the nervous system
Chapter 7 the nervous system Bolo alimenticio
Bolo alimenticio Componentes componentes
Componentes componentes Aminoacidos
Aminoacidos Red cristalina que forman los compuestos iónicos
Red cristalina que forman los compuestos iónicos La naturaleza del enlace quimico
La naturaleza del enlace quimico Clasificación del enlace covalente
Clasificación del enlace covalente Ley de lavoisier laplace
Ley de lavoisier laplace Clula
Clula O que são células eucariontes
O que são células eucariontes Clula
Clula Clula
Clula Vacuolo central
Vacuolo central Cloroplasto
Cloroplasto Retículo nucleoplasmático
Retículo nucleoplasmático Qu es una celula
Qu es una celula Parte del núcleo celular
Parte del núcleo celular Clula
Clula Bioeletrogênese
Bioeletrogênese Clula
Clula Clula
Clula Carioplasma dibujo
Carioplasma dibujo Clula
Clula Clula
Clula Mitose
Mitose Citoplasma
Citoplasma Clula
Clula Clula
Clula Que hay dentro de una celula
Que hay dentro de una celula Partes importantes del nucleo
Partes importantes del nucleo Clula
Clula Clula
Clula Clula
Clula Slidetodoc
Slidetodoc Clula
Clula Glicocálix
Glicocálix Clula
Clula