Uniones Qumicas Uniones Qumicas La actividad qumica de

















- Slides: 24

Uniones Químicas

Uniones Químicas • La actividad química de los metales y no metales se debe a que los átomos tratan de completar su último nivel con ocho electrones cumpliendo con la clásica teoría del octeto de Lewis. • Los átomos tienen la necesidad de adquirir una configuración electrónica similar a la del gas inerte más próximo, para alcanzar así estabilidad. • A estos efectos los átomos ganan, ceden o comparten e-. • Así, los átomos de Na, que tienen un e- en su última órbita tratan de perderlo para asemejarse al Ne, mientras que el Cl procura ganar un e- para parecerse al Ar.

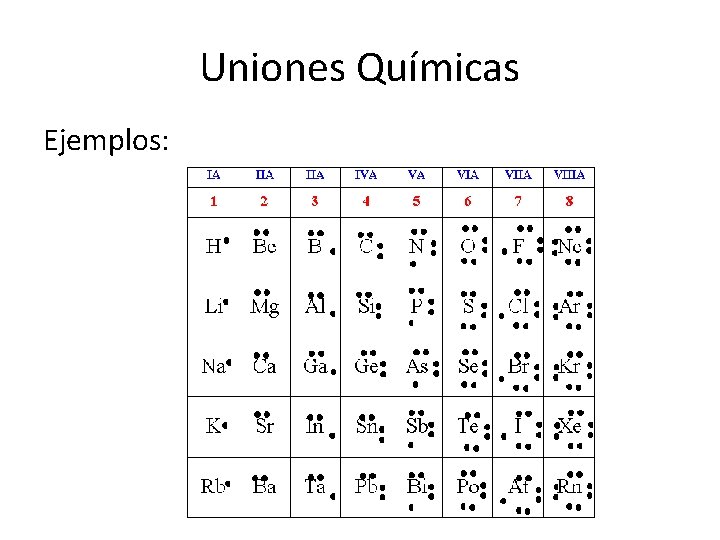
Uniones Químicas Notación de Lewis Para simplificar la representación de los átomos, Lewis propuso una forma sencilla de representación: Cada átomo se representa con su símbolo y a su alrededor puntos en igual cantidad a los e- que tiene en su último nivel.

Uniones Químicas Ejemplos:

Uniones Químicas Tipos de uniones químicas Los átomos al unirse entre sí para formar moléculas, lo hacen de diferentes formas. Los principales tipos de uniones que pueden presentarse son: a) Unión Iónica b) Unión Covalente c) Unión Metálica

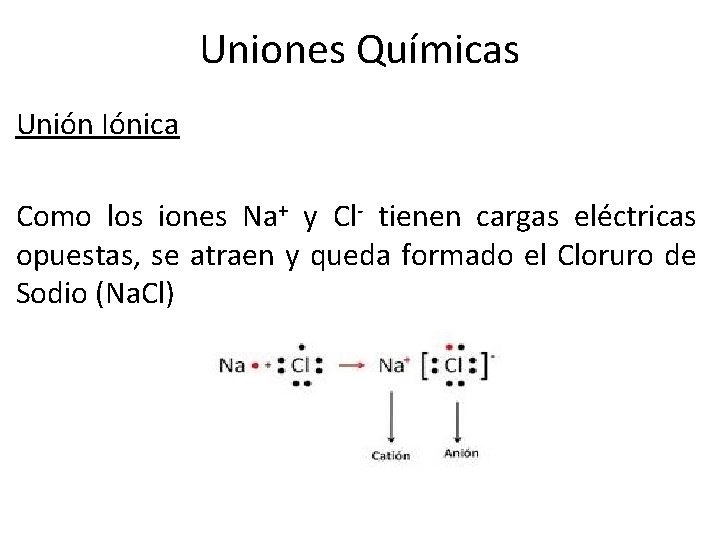
Uniones Químicas Unión Iónica • Este tipo de unión es característico de los compuestos formados por un metal y un no metal; es el caso del cloruro de sodio, sal de mesa. Na (bajo potencial de ionización) tanto se transforma en catión pierde 1 e-, por lo Cl (alto potencial de ionización) transforma un anión gana 1 e-, y se

Uniones Químicas Unión Iónica Como los iones Na+ y Cl- tienen cargas eléctricas opuestas, se atraen y queda formado el Cloruro de Sodio (Na. Cl)

Uniones Químicas Unión Iónica Otro ejemplo: En el caso del Óxido de Calcio, que se conoce comercialmente como cal viva, sucede los siguiente: Ca pierde 2 e-, por lo tanto se transforma en catión O gana 2 e-, y se transforma un anión

Uniones Químicas Unión Iónica Como los iones Ca 2+ y O 2 - tienen cargas eléctricas opuestas, se atraen y queda formado el Óxido de Calcio (Ca. O) . . Ca + . . . O. . . Ca 2+ [ . . O. . ]2. .

Uniones Químicas Unión Iónica En la formación de estos compuestos es necesario que haya igualdad entre los electrones ganados y los perdidos. En los casos anteriores esto se logra con un átomo de cada elemento, pero en otras ocasiones es algo más complicado

Uniones Químicas Unión Iónica En el Cloruro de Magnesio ( Mg. Cl 2) cada átomo de Mg pierde 2 e- y son necesarios 2 átomos de cloro para que cada uno de ellos gane 1 e- del Mg, originando 2 aniones cloro.

Uniones Químicas Propiedades de los compuestos iónicos: • Tienen puntos de fusión y ebullición altos (más de 700 °C), por lo cual a temperatura ambiente se encuentra en estado sólido. • Son solubles en agua. • En solución conducen la corriente eléctrica. • Son duros y frágiles.

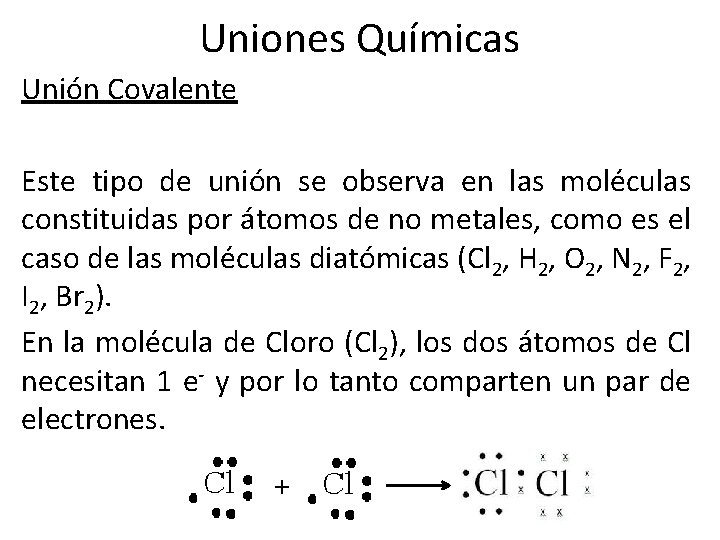
Uniones Químicas Unión Covalente Este tipo de unión se observa en las moléculas constituidas por átomos de no metales, como es el caso de las moléculas diatómicas (Cl 2, H 2, O 2, N 2, F 2, I 2, Br 2). En la molécula de Cloro (Cl 2), los dos átomos de Cl necesitan 1 e- y por lo tanto comparten un par de electrones. +

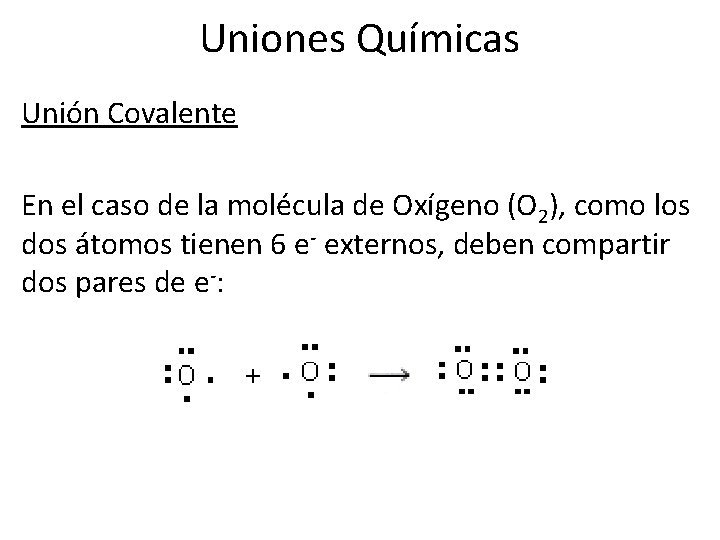
Uniones Químicas Unión Covalente En el caso de la molécula de Oxígeno (O 2), como los dos átomos tienen 6 e- externos, deben compartir dos pares de e-:

Uniones Químicas Unión Covalente En el caso de la molécula de Nitrógeno (N 2), como los dos átomos tienen 5 e- externos, deben compartir tres pares de e-: +

Uniones Químicas Unión Covalente La unión covalente, no solo se observa en las moléculas simples, sino también en muchas otras que forman las sustancias compuestas, como el Agua (a) y Cloruro de Hidrógeno (b): a) + + b)

Uniones Químicas Con relación a la mayor o menor capacidad que presentan los átomos para atraer los e- que comparten en una unión covalente, se ha propuesto el concepto de electronegatividad. La electronegatividad es la capacidad que tiene un átomo para atraer a los e- que comparte en una unión covalente. Los átomos que atraen con mayor intensidad a los e- que comparten son los más electronegativos y corresponden a los no metales, como F, Cl, O, S, etc.

Uniones Químicas Unión covalente dativa o coordinada En algunos compuestos se observa otra forma de unión covalente, en la cual los e- son aportados por uno de los átomos. Ejemplo: dióxido de azufre (SO 2)

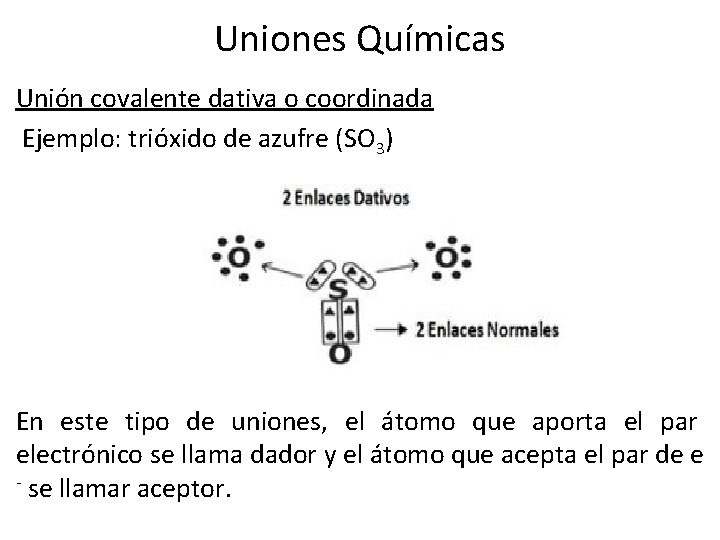
Uniones Químicas Unión covalente dativa o coordinada Ejemplo: trióxido de azufre (SO 3) En este tipo de uniones, el átomo que aporta el par electrónico se llama dador y el átomo que acepta el par de e - se llamar aceptor.

Uniones Químicas Propiedades de los compuestos covalentes: • Los puntos de fusión y ebullición son bajos (menos de 300 °C), por lo que las fuerzas que mantienen unidas entre sí a las moléculas son débiles. • Son solubles en solventes orgánicos (cloroformo, nafta, etc. ) y generalmente insolubles en agua. • No conducen la corriente eléctrica, pues carecen de iones.

Uniones Químicas Unión metálica Esta forma de unión se encuentra entre los átomos de los metales. Ya se ha señalado que los átomos metálicos pueden convertirse en iones positivos y, por este motivo, se considera que una porción de metal esta constituida por un conjunto de cationes entre los que se mueven libremente los e-, formando una nube o mar de e-.

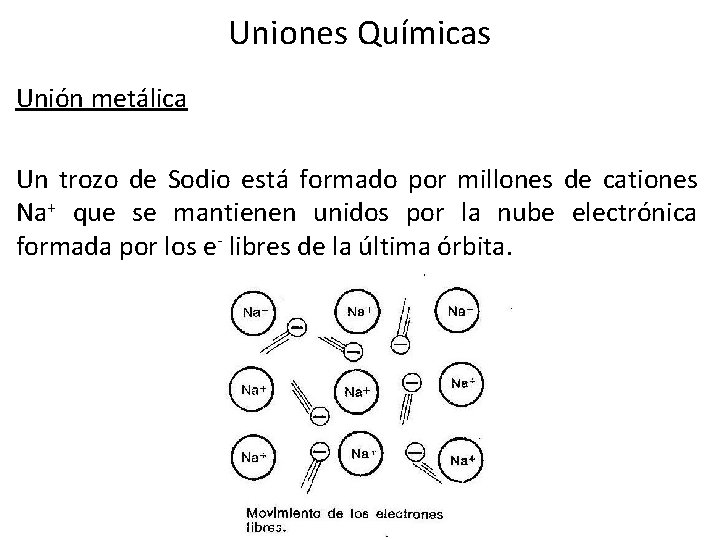
Uniones Químicas Unión metálica Un trozo de Sodio está formado por millones de cationes Na+ que se mantienen unidos por la nube electrónica formada por los e- libres de la última órbita.

Uniones Químicas Propiedades de los metales: El brillo característico se debe a la movilidad de los e-. La luz que incide sobre un metal es absorbida por los e- libres emitiendo energía radiante que se aprecia como brillo. La corriente eléctrica se genera por el desplazamiento de los e-, los cuales al llegar al metal repelen a los e- externos del mismo por tener cargas iguales y así permiten el paso de la electricidad.

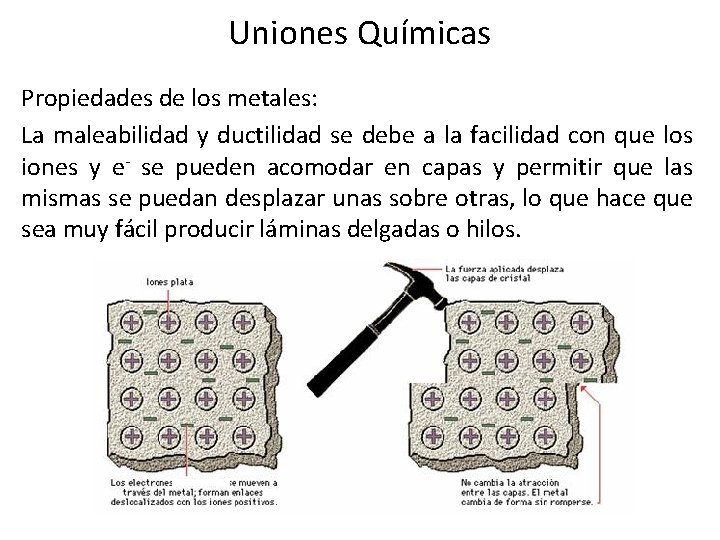
Uniones Químicas Propiedades de los metales: La maleabilidad y ductilidad se debe a la facilidad con que los iones y e- se pueden acomodar en capas y permitir que las mismas se puedan desplazar unas sobre otras, lo que hace que sea muy fácil producir láminas delgadas o hilos.
 Qumicas
Qumicas Que se entiende por actividad moderada y actividad vigorosa
Que se entiende por actividad moderada y actividad vigorosa Uniones fijas
Uniones fijas Clasificación del enlace covalente
Clasificación del enlace covalente Union celula celula
Union celula celula Tipos de redes cristalinas
Tipos de redes cristalinas Uniones quimicas entre atomos
Uniones quimicas entre atomos Uniones sinoviales
Uniones sinoviales Uniones celulares del tejido epitelial
Uniones celulares del tejido epitelial Uniones traslapadas
Uniones traslapadas Uniones en hendidura
Uniones en hendidura Matriz extracelular
Matriz extracelular El agua mineral es disoluciones coloides o suspensiones
El agua mineral es disoluciones coloides o suspensiones Uniones homofilicas
Uniones homofilicas Tipos de soldadura
Tipos de soldadura Desmosomas
Desmosomas Dipolos instantaneos
Dipolos instantaneos Uniones y conexiones wan
Uniones y conexiones wan Uniones de filete
Uniones de filete Reparacion por mal apareamiento de bases
Reparacion por mal apareamiento de bases Simbologia de soldadura
Simbologia de soldadura Uniones de holliday
Uniones de holliday Desmosoma puntual
Desmosoma puntual Reação exergônica
Reação exergônica Truta
Truta