QUMICA 10 1 QUMICA 10 2 QUMICA 10


























- Slides: 29

QUÍMICA 10 1

QUÍMICA 10 2

QUÍMICA 10 SUMÁRIO: Ordens de grandeza e escalas de comprimento. Dimensões à escala atómica e nanotecnologia. Constituição do átomo. Massa isotópica e massa atómica relativa média. Resolução de exercícios e problemas consolidação dos conteúdos lecionados. para 3

QUÍMICA 10 O ÁTOMO ORDEM DE GRANDEZA Potência de base dez mais próxima de um número escrito em notação científica. Escalas de comprimento e ordens de grandeza. 4

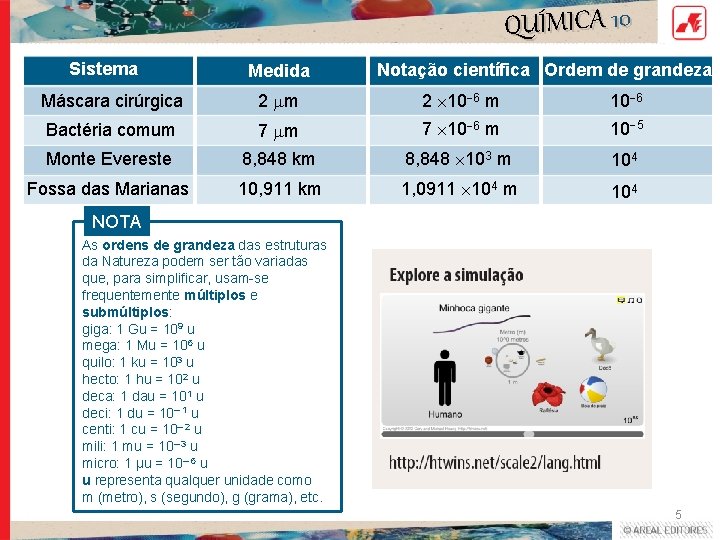
QUÍMICA 10 Sistema Medida Notação científica Ordem de grandeza Máscara cirúrgica 2 m 2 10 6 m 10 6 Bactéria comum 7 10 6 m 10 5 Monte Evereste 8, 848 km 8, 848 103 m 104 Fossa das Marianas 10, 911 km 1, 0911 104 m 104 NOTA As ordens de grandeza das estruturas da Natureza podem ser tão variadas que, para simplificar, usam-se frequentemente múltiplos e submúltiplos: giga: 1 Gu = 109 u mega: 1 Mu = 106 u quilo: 1 ku = 103 u hecto: 1 hu = 102 u deca: 1 dau = 101 u deci: 1 du = 10– 1 u centi: 1 cu = 10– 2 u mili: 1 mu = 10– 3 u micro: 1 μu = 10– 6 u u representa qualquer unidade como m (metro), s (segundo), g (grama), etc. 5

QUÍMICA 10 Exercício resolvido As estruturas que podem ser objeto de estudo da Química têm dimensões muito variadas. Por exemplo: A. Diâmetro da célula eucariótica: 40 m. B. Altura média de um ser humano: 1, 7 m. C. Raio médio da Terra: 6371 km. D. Diâmetro do Sol: 1, 39 Gm. Escreva cada um dos valores em notação científica na unidade do SI e indique a sua ordem de grandeza. Proposta de resolução A. 40 m = 40 10 6 m = 4, 0 10 5 m, logo é da ordem de grandeza 10 5. B. 1, 7 m = 1, 7 100 m, logo é da ordem de grandeza 100. C. 6371 km = 6371 103 m = 6, 371 106 m, logo é da ordem de grandeza 107. D. 1, 39 Gm = 1, 39 109 m, logo é da ordem de grandeza 109. 6

QUÍMICA 10 Exercício proposto Indique a ordem de grandeza e apresente cada um dos seguintes valores, em notação científica, na unidade do SI. A. Diâmetro médio do cabelo humano: 80 m. B. Comprimento de uma baleia azul: 30 m. C. Diâmetro da Lua: 3480 km. D. Distância da órbita da Lua à Terra: 384 Mm. Proposta de resolução A. 80 μm = 80 10– 6 m = 8, 0 10– 5 m, logo e da ordem de grandeza 10– 4; B. 30 m = 3, 0 101 m, logo e da ordem de grandeza 101; C. 3480 km = 3480 103 m = 3, 480 106 m, logo e da ordem de grandeza 106; D. 384 Mm = 384 106 m = 3, 84 108 m, logo e da ordem de grandeza 108. 7

QUÍMICA 10 DIMENSÕES À ESCALA ATÓMICA Numa laranja do tamanho da Terra, os átomos teriam o tamanho de cerejas e o núcleo atómico continuaria invisível; num átomo com a dimensão da maior cúpula do mundo, a da catedral de São Pedro, em Roma, o núcleo teria o tamanho de um grão de sal. NOTA As dimensões à escala atómica são tão reduzidas que é usual a utilização de outros submúltiplos como: nanómetro: 1 nm = 1 10 -9 m angstrom: 1 Å = 1 10 -10 m picómetro: 1 pm = 1 10 -12 m Ordem de grandeza dos raios das partículas – escala atómica. 8

QUÍMICA 10 Exercício resolvido Na figura ao lado observa-se uma camada de grafeno, obtida com microscópio de efeito de túnel, onde os pontos azuis desenhados representam os átomos de carbono. Qual é a ordem de grandeza da distância média entre os átomos de carbono, em unidade do SI? Proposta de resolução Como 1, 42 Å = 1, 42 10– 10 m e a ordem de grandeza é a potência de base 10 mais próxima do número, neste caso, a distância média entre os átomos de carbono é da ordem dos 10– 10 m. 9

QUÍMICA 10 Exercício proposto Com base na figura do exercício resolvido, qual seria a ordem de grandeza da distância média entre os átomos de carbono no grafeno se esse número fosse expresso em nanómetro? Proposta de resolução Como 1, 42 Å = 0, 142 nm = 1, 42 10 1 nm, a distância média entre os átomos de carbono é da ordem dos 10 1 nm. 10

QUÍMICA 10 NANOTECNOLOGIA A nanotecnologia dedica-se ao estudo da manipulação da matéria à escala atómica e molecular e permite o desenvolvimento de aplicações “alucinantes”. Dimensão do nanómetro 11

QUÍMICA 10 Exercício resolvido Transcreva, do texto Aplicar a Química: “Nanotecnologia”, das páginas 11 e 12 do manual, a afirmação que melhor define o conceito de nanotecnologia e identifique dois exemplos de aplicação desta tecnologia. Proposta de resolução A frase que melhor define o conceito de nanotecnologia é “A nanotecnologia dedica-se ao estudo da manipulação da matéria à escala atómica e molecular e permite aos engenheiros desenvolver aplicações “alucinantes” ”. São vários os exemplos de aplicação, podendo destacar-se a área da eletrónica e da computação, onde já foi possível criar um ecrã flexível, ou a área de engenharia dos materiais, com criação de materiais com propriedades extraordinárias como tecidos que regulam a temperatura e eliminam fungos e bactérias. 12

QUÍMICA 10 Exercício proposto Procure outros dois exemplos de notícias que surgiram recentemente sobre futuras aplicações da nanotecnologia. 13

QUÍMICA 10 CONSTITUIÇÃO DO ÁTOMO • A A existência primeira ideia de átomo na antiga Dalton, em 1808, retomou a surgiu teoria ado modelo de átomos continuava dividir os Grécia com Leucipo e Demócrito. atómico. cientistas ainda no início do séc. XX, até que, em 1905, Einstein provou a sua existência a partir da explicação do movimento browniano. Demócrito (460 a. C. -370 a. C. ) John Dalton (1766 -1844) Químico, físico e meteorologista inglês que impulsionou a teoria atómica. Albert Einstein (1879 -1955) Prémio Nobel da Física em 1921 pela sua contribuição na Física Teórica. 14

QUÍMICA 10 CONSTITUIÇÃO DO ÁTOMO • Uns anos antes, em 1897, Thomson descobriu o eletrão, partícula com carga negativa, com o tubo de raios catódicos e propôs o modelo do “pudim de passas”. Joseph Thomson (1856 -1940) Prémio Nobel da Física em 1906 pelas investigações sobre a condutividade elétrica em gases. Modelo atómico proposto por Thomson: modelo do “pudim de passas”. 15

QUÍMICA 10 CONSTITUIÇÃO DO ÁTOMO • Utilizando Em 1932, um Chadwick feixe decomprovou partículas alfa, que Rutherford no núcleo também percebeu existem que a maior partesem partículas do volume carga edocom átomo massa era, semelhante na realidade, aoespaço protão vazio, – os propondo o modelo planetário. neutrões. Ernest Rutherford James Chadwick (1871 -1937) Prémio Nobel da Química em 1908 pelas investigações sobre desintegração de elementos químicos. (1891 -1974) Prémio Nobel da Física em 1935 pela descoberta do neutrão. Modelo atómico proposto por Rutherford: “modelo planetário”. 16

QUÍMICA 10 O ÁTOMO TABELA I – PROPRIEDADES DAS PARTÍCULAS SUBATÓMICAS Nome (símbolo) Carga Massa / u Localização Protão (p+) +1 1, 00728 Núcleo Neutrão (n 0) 0 1, 00866 Núcleo Eletrão (e ) 1 0, 00054858 Em torno do núcleo CARGA NUCLEAR Carga do núcleo do átomo, positiva e igual à soma das cargas dos protões. 17

QUÍMICA 10 O átomo é eletricamente neutro porque tem um número igual de protões e de eletrões. Átomos de árgon e carbono: em cada átomo, o número de protões e de eletrões é igual. 18

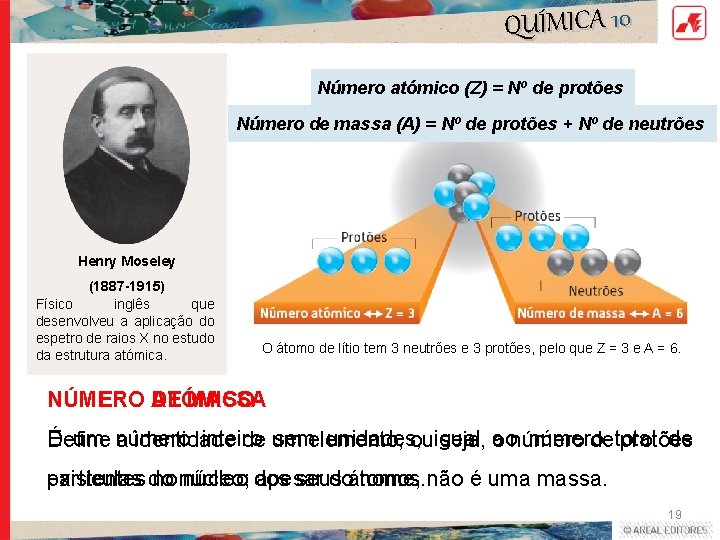
QUÍMICA 10 Número atómico (Z) = Nº de protões Número de massa (A) = Nº de protões + Nº de neutrões • Moseley, em 1913, determinou o número de cargas Henry Moseley (1887 -1915) Físico inglês que desenvolveu a aplicação do espetro de raios X no estudo da estrutura atómica. positivas no núcleo atómico, atualmente designado de número atómico (Z). O átomo de lítio tem 3 neutrões e 3 protões, pelo que Z = 3 e A = 6. NÚMERO DE MASSA ATÓMICO É um número inteiro semelemento, unidades, aonúmero de Define a identidade de um ouigual seja, o de total protões partículas apesar doátomos. nome, não é uma massa. existentes do no núcleo; núcleo dos seus 19

QUÍMICA 10 Representação de um átomo de um elemento químico. 20

QUÍMICA 10 ISÓTOPOS Átomos do mesmo elemento (têm, portanto, o mesmo número atómico) com diferentes números de neutrões, apresentando, por isso, números de massa distintos. Francis William Aston (1877 -1945) Prémio Nobel da Química em 1922 pela descoberta dos isótopos de um grande número de elementos químicos. O hidrogénio tem três isótopos com números de massa 1, 2 e 3 (contendo 0, 1 e 2 neutrões, respetivamente) designados prótio, deutério e trítio. 21

QUÍMICA 10 Exercício resolvido Considere os átomos a seguir representados: Nota: as letras X, Y, R, W não representam os símbolos verdadeiros dos elementos químicos. 1. Indique o número de protões, o número de neutrões, o número de eletrões e a carga nuclear do átomo R. 2. Quantos elementos químicos estão representados? Proposta de resolução 1. O número de protões é igual ao número atómico, logo, é 6; Para o átomo ser eletricamente neutro, o número de eletrões deverá ser igual, ou seja, 6; O número de neutrões (n) pode ser obtido pela expressão: n = A - Z = 8; A carga nuclear é determinada pelo número de protões, logo, é + 6. 22

QUÍMICA 10 Exercício resolvido Considere os átomos a seguir representados: Nota: as letras X, Y, R, W não representam os símbolos verdadeiros dos elementos químicos. 1. Indique o número de protões, o número de neutrões, o número de eletrões e a carga nuclear do átomo R. 2. Quantos elementos químicos estão representados? Proposta de resolução 2. Cada elemento químico tem um único número atómico que o identifica. Por isso, os 4 átomos apresentados referem-se apenas a 3 elementos diferentes, uma vez que os átomos Y e W pertencem ao mesmo elemento (Z = 17), sendo isótopos entre si. 23

QUÍMICA 10 Exercício proposto Considere os átomos. Atendendo à constituição destes átomos, indique o que têm em comum entre si. Proposta de resolução O átomo de carbono-14 é constituído por 6 protões, 6 eletrões e 8 neutrões enquanto o átomo de oxigénio-16 é constituído por 8 protões, 8 eletrões e 8 neutrões, logo, têm igual número de neutrões. Átomo de oxigénio-14 tem 8 protões, 8 eletrões e 6 neutrões, logo, tem igual número de protões e eletrões que o átomo de oxigénio-16 uma vez que possuem o mesmo número atómico e são isótopos. Em relação ao carbono-14, o oxigénio-14 tem apenas em comum o número de massa, ou seja, o número de nucleões. 24

QUÍMICA 10 MASSA ATÓMICA RELATIVA É o número de vezes que a massa de um átomo é maior do que 1/12 da massa do átomo do isótopo carbono-12. A massa atómica relativa é uma grandeza adimensional. MASSA ISOTÓPICA RELATIVA É a massa atómica relativa de um isótopo de um dado elemento que se define como o número de vezes que a massa atómica do isótopo desse elemento é maior do que 1/12 da massa atómica do isótopo carbono-12. 25

QUÍMICA 10 MASSA ATÓMICA RELATIVA MÉDIA DE UM ELEMENTO É a massa atómica relativa de um elemento e corresponde à média ponderada das massas isotópicas dos vários isótopos de um elemento químico que se encontram na Natureza. TABELA II – MASSAS ATÓMICAS RELATIVAS E ABUND NCIA DOS ISÓTOPOS DO CLORO Isótopo Massa isotópica relativa Abundância natural / % 35 Cℓ 34, 97 75, 8 37 Cℓ 36, 97 24, 2 Ar (Cℓ) = 34, 97 0, 758 + 36, 97 0, 242 = 35, 45 26

QUÍMICA 10 A massa atómica relativa média de um elemento pode ser consultada na Tabela Periódica. • O valor obtido não é um número inteiro, pois resulta de uma média ponderada; • O resultado é mais próximo da massa atómica relativa do isótopo mais abundante, pois tem maior peso na média do que a do isótopo menos abundante. 27

QUÍMICA 10 Exercício resolvido O cobre (29 Cu) é formado pelos isótopos cobre-63 e cobre-65, representando o primeiro 69, 09% da massa total de cobre. Sabendo que a massa atómica relativa média do cobre é 63, 55 e que a massa isotópica relativa do 63 Cu é 62, 93, calcule para o outro isótopo: a) a abundância relativa; b) a massa isotópica relativa. Proposta de resolução a) A abundância natural do isótopo é: 65 Cu = 100% 69, 09% = 30, 91% b) 28

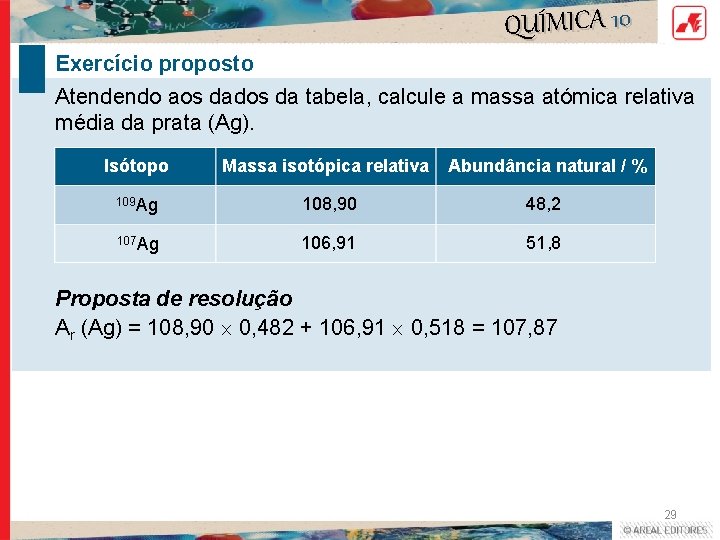
QUÍMICA 10 Exercício proposto Atendendo aos dados da tabela, calcule a massa atómica relativa média da prata (Ag). Isótopo Massa isotópica relativa Abundância natural / % 109 Ag 108, 90 48, 2 107 Ag 106, 91 51, 8 Proposta de resolução Ar (Ag) = 108, 90 0, 482 + 106, 91 0, 518 = 107, 87 29
 Lei de proust
Lei de proust Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Unip engenharia de produção
Unip engenharia de produção Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Lista de atomos
Lista de atomos Oxissais
Oxissais Biologia
Biologia Penumbra
Penumbra Qumica
Qumica Celdas
Celdas Carbono hibridacion
Carbono hibridacion Poluição das águas
Poluição das águas Qumica
Qumica Acidos organicos
Acidos organicos Qumica
Qumica Qumica
Qumica Enxofre rombico e monoclinico diferença
Enxofre rombico e monoclinico diferença Qumica
Qumica Qumica
Qumica Pilha de daniell
Pilha de daniell Qumica
Qumica


















































