Soluciones Qumica Unidad 1 Qumica Soluciones qumicas Conocer




- Slides: 24

Soluciones Química Unidad 1 - Química: Soluciones químicas Conocer las características generales de las soluciones químicas. Cálculo de la concentración en algunas de ellas. Las relaciones estequiométricas de las reacciones químicas en solución.

Objetivos de aprendizaje OA 15 Explicar, por medio de modelos y la experimentación, las propiedades de las soluciones en ejemplos cercanos, considerando: -El estado físico (sólido, líquido y gaseoso). -Sus componentes (soluto y solvente). -La cantidad de soluto disuelto (concentración). CONTENIDOS A ESTUDIAR • Definir el concepto de mezcla y los diferentes tipos de mezclas. • Tipos de soluciones • Solubilidad y factores que afectan a la solubilidad CLASE 5 DE ABRIL Y 12 DE ABRIL

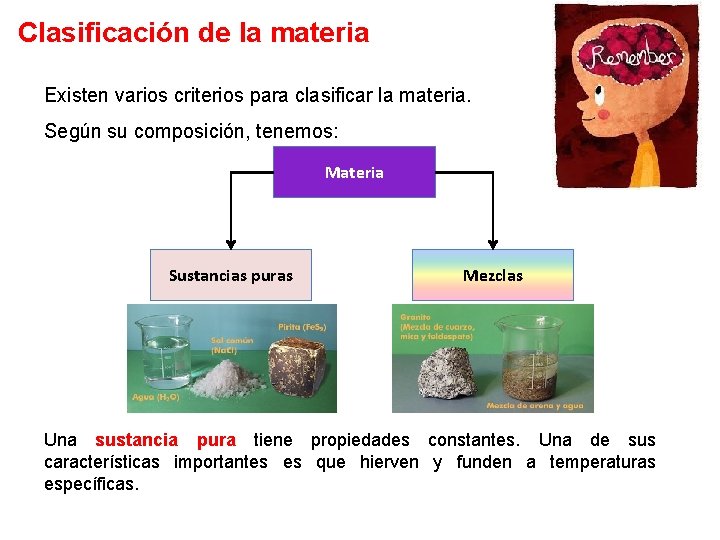
Clasificación de la materia Existen varios criterios para clasificar la materia. Según su composición, tenemos: Materia Sustancias puras Mezclas Una sustancia pura tiene propiedades constantes. Una de sus características importantes es que hierven y funden a temperaturas específicas.

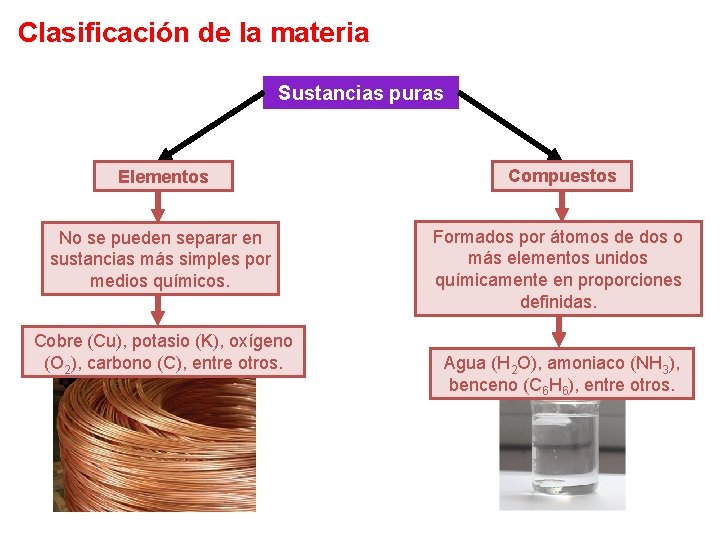
Clasificación de la materia Sustancias puras Elementos Compuestos No se pueden separar en sustancias más simples por medios químicos. Formados por átomos de dos o más elementos unidos químicamente en proporciones definidas. Cobre (Cu), potasio (K), oxígeno (O 2), carbono (C), entre otros. Agua (H 2 O), amoniaco (NH 3), benceno (C 6 H 6), entre otros.

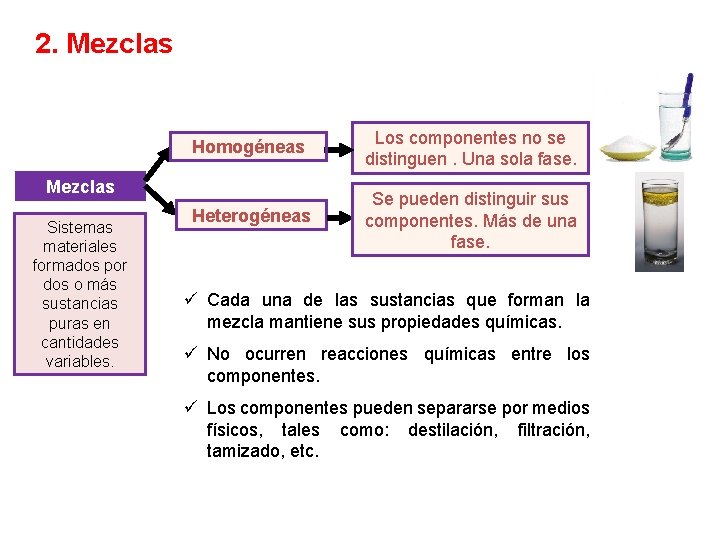
2. Mezclas Homogéneas Los componentes no se distinguen. Una sola fase. Heterogéneas Se pueden distinguir sus componentes. Más de una fase. Mezclas Sistemas materiales formados por dos o más sustancias puras en cantidades variables. ü Cada una de las sustancias que forman la mezcla mantiene sus propiedades químicas. ü No ocurren reacciones químicas entre los componentes. ü Los componentes pueden separarse por medios físicos, tales como: destilación, filtración, tamizado, etc.

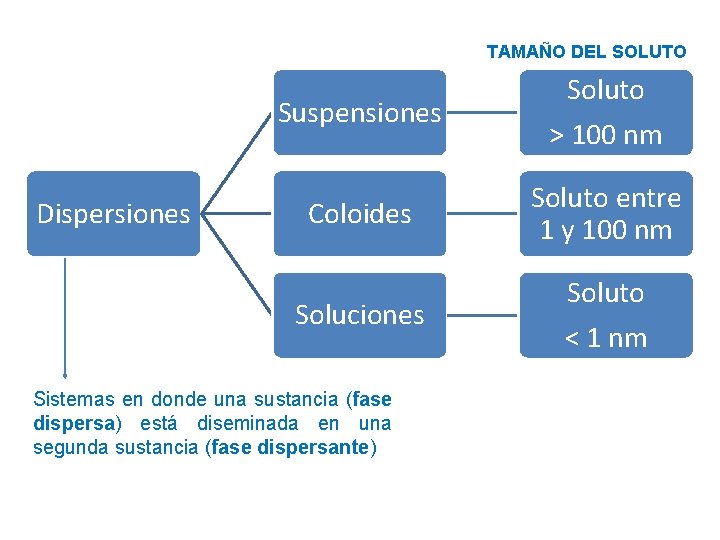
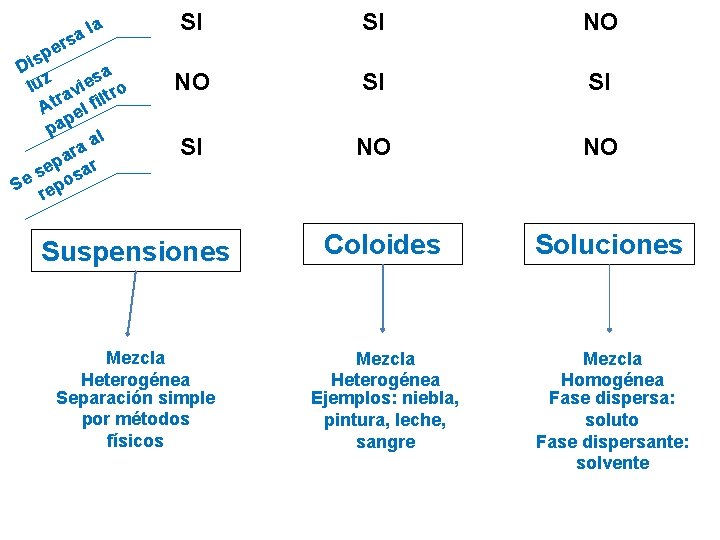
TAMAÑO DEL SOLUTO Dispersiones Suspensiones Soluto > 100 nm Coloides Soluto entre 1 y 100 nm Soluciones Soluto < 1 nm Sistemas en donde una sustancia (fase dispersa) está diseminada en una segunda sustancia (fase dispersante)

a l a s r pe s i D a s z e u i l v ltro a r At el fi p pa al a ar r p se osa e S rep SI SI NO NO SI SI SI NO NO Suspensiones Coloides Soluciones Mezcla Heterogénea Separación simple por métodos físicos Mezcla Heterogénea Ejemplos: niebla, pintura, leche, sangre Mezcla Homogénea Fase dispersa: soluto Fase dispersante: solvente

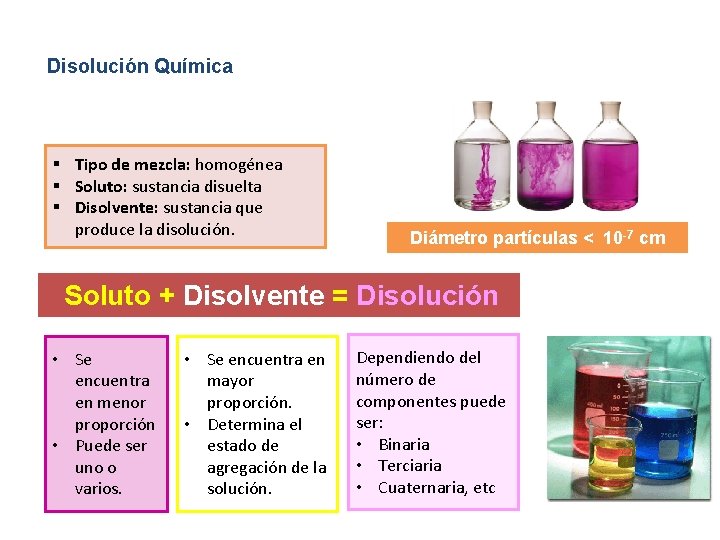
Disolución Química § Tipo de mezcla: homogénea § Soluto: sustancia disuelta § Disolvente: sustancia que produce la disolución. Diámetro partículas < 10 -7 cm Soluto + Disolvente = Disolución • Se encuentra en menor proporción • Puede ser uno o varios. • Se encuentra en mayor proporción. • Determina el estado de agregación de la solución. Dependiendo del número de componentes puede ser: • Binaria • Terciaria • Cuaternaria, etc

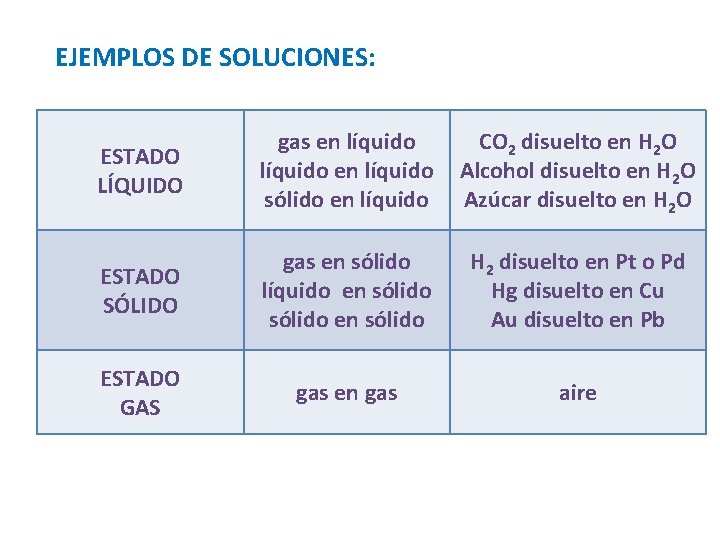
EJEMPLOS DE SOLUCIONES: ESTADO LÍQUIDO gas en líquido sólido en líquido CO 2 disuelto en H 2 O Alcohol disuelto en H 2 O Azúcar disuelto en H 2 O ESTADO SÓLIDO gas en sólido líquido en sólido H 2 disuelto en Pt o Pd Hg disuelto en Cu Au disuelto en Pb ESTADO GAS gas en gas aire

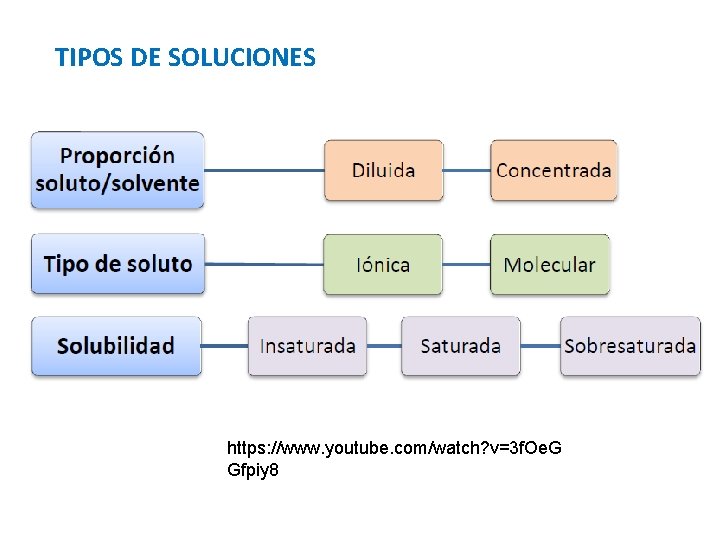
TIPOS DE SOLUCIONES https: //www. youtube. com/watch? v=3 f. Oe. G Gfpiy 8

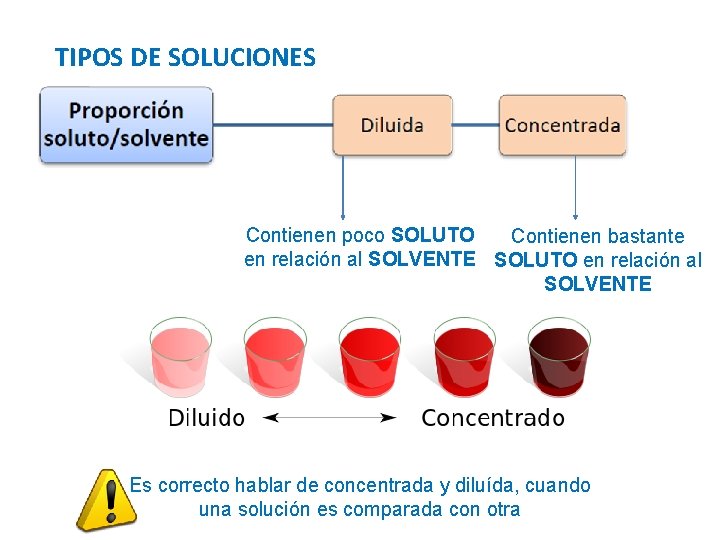
TIPOS DE SOLUCIONES Contienen poco SOLUTO Contienen bastante en relación al SOLVENTE SOLUTO en relación al SOLVENTE Es correcto hablar de concentrada y diluída, cuando una solución es comparada con otra

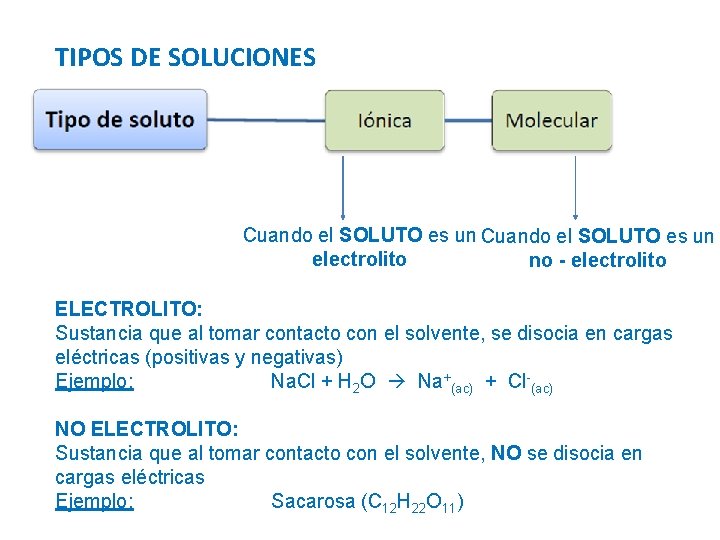
TIPOS DE SOLUCIONES Cuando el SOLUTO es un electrolito no - electrolito ELECTROLITO: Sustancia que al tomar contacto con el solvente, se disocia en cargas eléctricas (positivas y negativas) Ejemplo: Na. Cl + H 2 O Na+(ac) + Cl-(ac) NO ELECTROLITO: Sustancia que al tomar contacto con el solvente, NO se disocia en cargas eléctricas Ejemplo: Sacarosa (C 12 H 22 O 11)

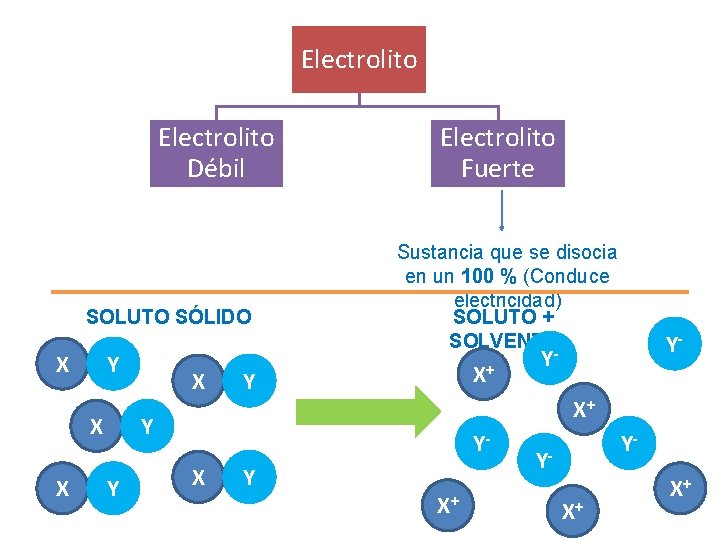
Electrolito Débil SOLUTO SÓLIDO X Y X X X Electrolito Fuerte Sustancia que se disocia en un 100 % (Conduce electricidad) SOLUTO + SOLVENTE X+ Y Y YX Y Y- Y- X+ Y- YX+ X+

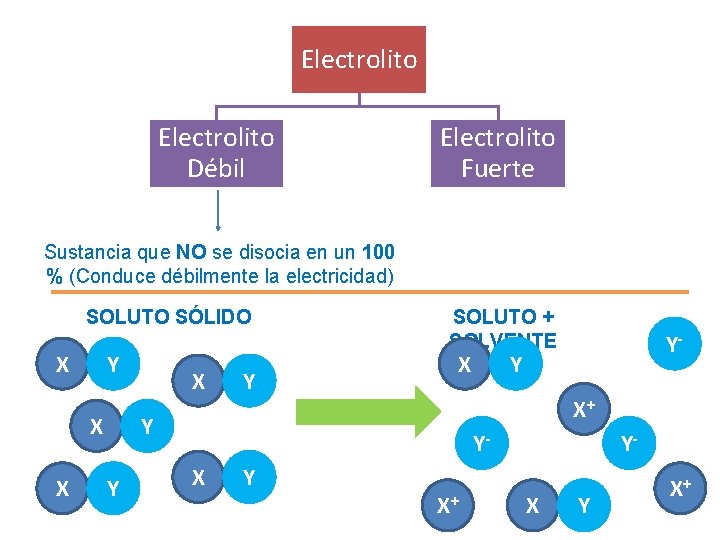
Electrolito Débil Electrolito Fuerte Sustancia que NO se disocia en un 100 % (Conduce débilmente la electricidad) SOLUTO SÓLIDO X Y X X X Y SOLUTO + SOLVENTE X Y X+ Y Y Y- YX Y X+

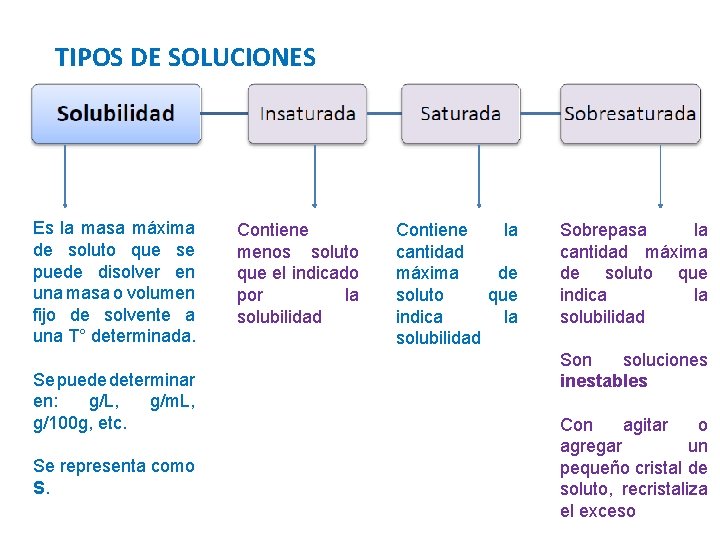
TIPOS DE SOLUCIONES Es la masa máxima de soluto que se puede disolver en una masa o volumen fijo de solvente a una T° determinada. Se puede determinar en: g/L, g/m. L, g/100 g, etc. Se representa como S. Contiene menos soluto que el indicado por la solubilidad Contiene la cantidad máxima de soluto que indica la solubilidad Sobrepasa la cantidad máxima de soluto que indica la solubilidad Son soluciones inestables Con agitar o agregar un pequeño cristal de soluto, recristaliza el exceso

TIPOS DE SOLUCIONES ¿Cómo se logra una solución sobresaturada? Una vez alcanzado el punto de saturación, se deben disolver pequeñas cantidades (pizcas) de soluto en la solución

PRACTIQUEMOS LO APRENDIDO Si una sustancia X tiene una S = 30 g / 100 g H 2 O a) Se agregan 10 g de X en 100 g de H 2 O, tenemos una… Solución Insaturada b) Se agregan 30 g de X en 100 g de H 2 O, tenemos una… Solución Saturada a) Se agregan 35 g de X en 100 g de H 2 O, tenemos una… Solución Sobresaturada …entonces que es? ? ? Mezcla Heterogénea

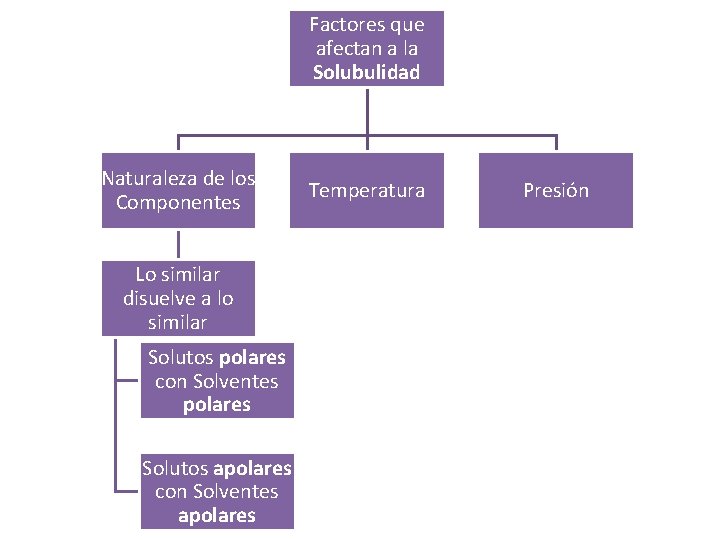
Factores que afectan a la Solubulidad Naturaleza de los Componentes Lo similar disuelve a lo similar Solutos polares con Solventes polares Solutos apolares con Solventes apolares Temperatura Presión

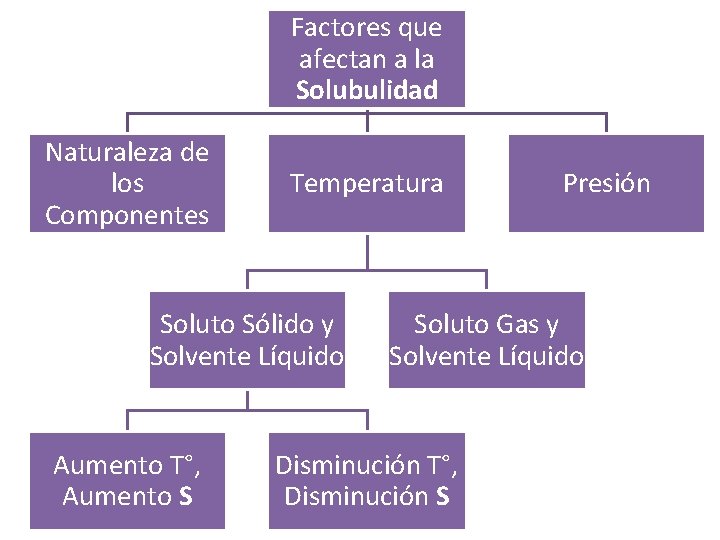
Factores que afectan a la Solubulidad Naturaleza de los Componentes Temperatura Soluto Sólido y Solvente Líquido Aumento T°, Aumento S Presión Soluto Gas y Solvente Líquido Disminución T°, Disminución S

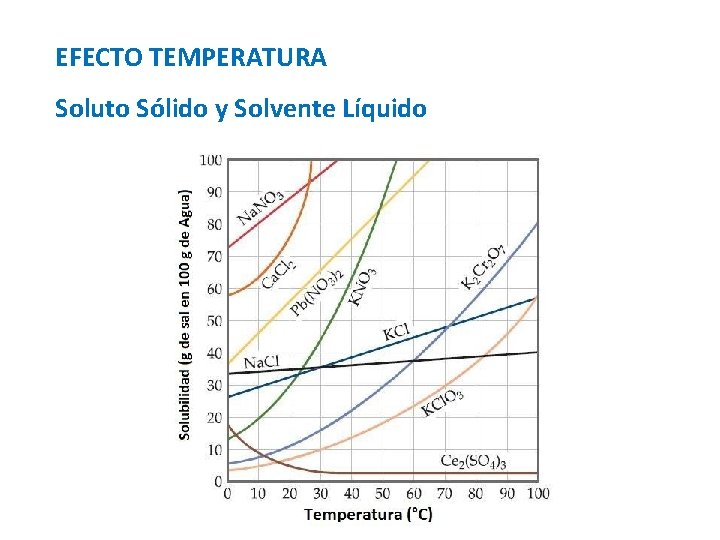
EFECTO TEMPERATURA Soluto Sólido y Solvente Líquido

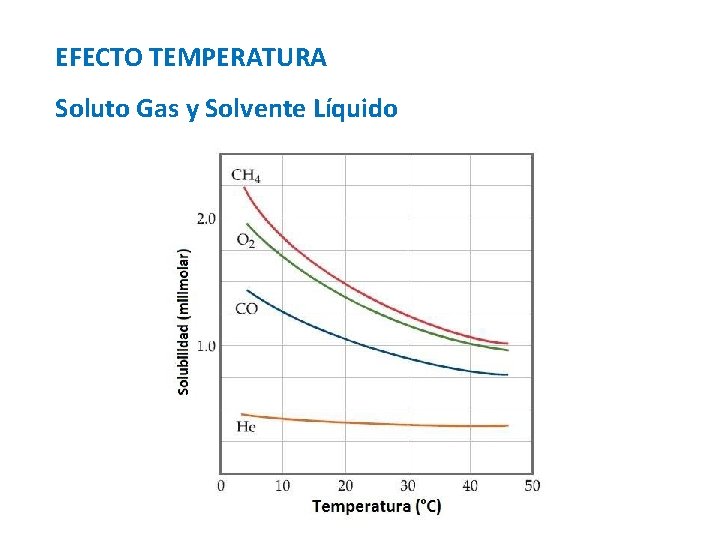
Factores que afectan a la Solubulidad Naturaleza de los Componentes Temperatura Soluto Sólido y Solvente Líquido Presión Soluto Gas y Solvente Líquido Disminución T°, Aumento S Aumento T°, Disminuye S

EFECTO TEMPERATURA Soluto Gas y Solvente Líquido

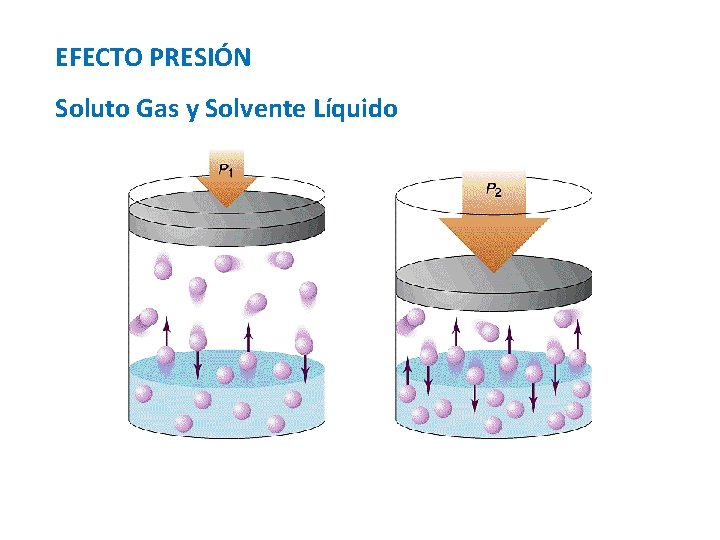
Factores que afectan a la Solubulidad Naturaleza de los Componentes Temperatura Mayor Presión, Mayor S Presión (Sólo solutos gases) Menor Presión, Menor S

EFECTO PRESIÓN Soluto Gas y Solvente Líquido
 Qumicas
Qumicas Unidad decena centena
Unidad decena centena Saber y conocer
Saber y conocer Conocer reciprocal reflexive
Conocer reciprocal reflexive Los verbos saber y conocer worksheet
Los verbos saber y conocer worksheet Spanish sentances
Spanish sentances Diagrama de la biblia
Diagrama de la biblia ¡inténtalo! elige la respuesta más lógica.
¡inténtalo! elige la respuesta más lógica. Conjugate conocer
Conjugate conocer Conocer verbo infinitivo
Conocer verbo infinitivo Si pudieras conocer a alguien famoso a quién sería
Si pudieras conocer a alguien famoso a quién sería Why is it spicy
Why is it spicy I verb
I verb Realidades 2 capitulo 1b the verbs saber and conocer
Realidades 2 capitulo 1b the verbs saber and conocer Competencias saber ser saber hacer
Competencias saber ser saber hacer La ayuda a po a conocer su pasado
La ayuda a po a conocer su pasado Con el tiempo aprendes
Con el tiempo aprendes Conoce
Conoce Preparando el viaje y equipaje para conocer el mundo vivo
Preparando el viaje y equipaje para conocer el mundo vivo Habilidades conceptuales ejemplos
Habilidades conceptuales ejemplos Podemos conocer a dios
Podemos conocer a dios Importancia de conocer las propiedades logarítmicas
Importancia de conocer las propiedades logarítmicas El ser hacer y saber
El ser hacer y saber Que es conocer
Que es conocer 2 pinzas tengo hacia atrás camino
2 pinzas tengo hacia atrás camino















































