REACCIONES QUMICAS Clculos en Qumica Fsica y Qumica















![19 ¿Cuál es la concentración en masa de una disolución de ácido clorhídrico [HCl(aq)] 19 ¿Cuál es la concentración en masa de una disolución de ácido clorhídrico [HCl(aq)]](https://slidetodoc.com/presentation_image_h/a8b872eac6d0704d352ac07739be9082/image-20.jpg)











- Slides: 33

REACCIONES QUÍMICAS Cálculos en Química Física y Química 1º Bach guía para la resolución de ejercicios

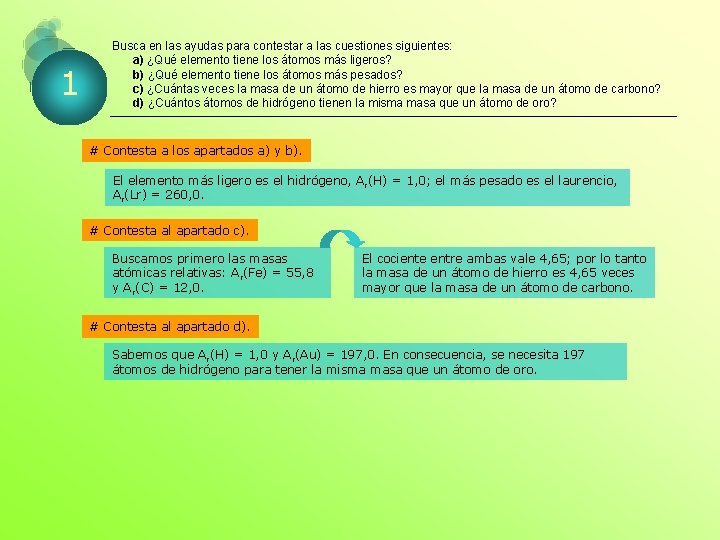
1 Busca en las ayudas para contestar a las cuestiones siguientes: a) ¿Qué elemento tiene los átomos más ligeros? b) ¿Qué elemento tiene los átomos más pesados? c) ¿Cuántas veces la masa de un átomo de hierro es mayor que la masa de un átomo de carbono? d) ¿Cuántos átomos de hidrógeno tienen la misma masa que un átomo de oro? # Contesta a los apartados a) y b). El elemento más ligero es el hidrógeno, Ar(H) = 1, 0; el más pesado es el laurencio, Ar(Lr) = 260, 0. # Contesta al apartado c). Buscamos primero las masas atómicas relativas: Ar(Fe) = 55, 8 y Ar(C) = 12, 0. El cociente entre ambas vale 4, 65; por lo tanto la masa de un átomo de hierro es 4, 65 veces mayor que la masa de un átomo de carbono. # Contesta al apartado d). Sabemos que Ar(H) = 1, 0 y A r(Au) = 197, 0. En consecuencia, se necesita 197 átomos de hidrógeno para tener la misma masa que un átomo de oro.

2 a) Calcula la masa molecular relativa de las siguientes sustancias: Br 2, CO 2; P 4, SO 3 y C 6 H 12 O 6 (glucosa). b) Halla la masa fórmula relativa de las siguientes sustancias: Ca. CO 3, HNO 3 y KI. # Contesta al apartado a). Mr(Br 2) = 2 Ar(Br) = 2· 79, 9 = 159, 8 Mr(CO 2) = Ar(C) + 2 Ar(O) = 12, 0 + 2· 16, 0 = 44, 0 Mr(P 4) = 4 Ar(P) = 4· 31, 0 = 124, 0 Mr(SO 3) = Ar(S) + 3 A r(O) = 32, 1 + 3· 16, 0 = 80, 1 Mr(C 6 H 12 O 6) = 6 Ar(C) + 12 Ar(H) + 6 Ar(O) = 6· 12, 0 + 12· 1, 0 + 6· 16, 0 = 180, 0 # Contesta al apartado b). Mr(Ca. CO 3) = Ar(Ca) + Ar(C) + 3 A r(O) = 40, 1 + 12, 0 + 3· 16, 0 = 100, 1 Mr(HNO 3) = Ar(H) + Ar(N) + 3 A r(O) = 1, 0 + 14, 0 + 3· 16, 0 = 63, 0 Mr(KI) = Ar(K) + A r(I) = 39, 1 + 126, 9 = 166, 0

3 Imagina que dispones de enormes cantidades de tornillos y de tuercas. Sabes, además, que la masa de un tornillo es el doble de la masa de una tuerca, aunque desconoces los valores de la masa, en g, de un tornillo o de una tuerca. Con esta información tienes que razonar si las siguientes afirmaciones son verdaderas o falsas. Si peso 100 g de tornillos y 100 g de tuercas dispongo del mismo número de tornillos que de tuercas. No puede haber el mismo número de unos y otras porque la masa de un tornillo es mayor (el doble) que la masa de una tuerca. Si peso 200 g de tornillos y 100 g de tuercas tengo el mismo número de tornillos que de tuercas. Al tomar las masas en la misma proporción (doble de tornillos que de tuercas) que tienen las masas individuales, ha de haber el mismo número de unos que de otras, aunque no sepamos cuál es ese número. Si peso 100 g de tornillos y 100 g de tuercas, el número de tornillos es la mitad del número de tuercas. Al ser la masa de un tornillo el doble de la masa de una tuerca, habrá menos tornillos (la mitad en número) que tuercas. Tampoco sabemos cuáles son esos números. Si peso 2000 kg de tornillos y 1000 kg de tuercas tengo el mismo número de tornillos que de tuercas. La justificación es la misma que la dada en la segunda afirmación. El siguiente paso va a consistir en trabajar con átomos y moléculas, de los cuales conocemos sus masas relativas, esto es, el número de veces que la masa de un átomo o de una molécula es mayor que la masa de otro que se toma como referencia.

4 La masa de un átomo de helio es cuatro veces mayor que la masa de un átomo de hidrógeno. Con esta información tienes que razonar si las siguientes afirmaciones son verdaderas o falsas. En 1 g de helio hay el mismo número de átomos de helio que átomos de hidrógeno hay en 4 g de hidrógeno. Si peso 4 g de helio y 1 g de hidrógeno tengo el mismo número de átomos de helio que de átomos de hidrógeno. No puede haber el mismo número de unos y otros porque la masa de un átomo de helio es mayor (cuatro veces) que la masa de un átomo de hidrógeno. Además, hemos tomado menos masa del más pesado. Al tomar las masas en la misma proporción (cuatro a uno) que tienen las masas atómicas relativas, ha de haber el mismo número de de átomos de helio y de hidrógeno, aunque no sepamos cuál es ese número. Si peso 80 g de helio y 20 g de hidrógeno tengo el mismo número de átomos de helio que de átomos de hidrógeno. La justificación es la misma que la dada en la afirmación anterior. En 50 g de helio hay el mismo número de átomos de helio que átomos de hidrógeno hay en 50 g de hidrógeno. Al ser la masa de un átomo de helio mayor que la masa de un átomo de hidrógeno, habrá menos átomos de helio que de hidrógeno. Tampoco sabemos cuáles son esos números.

5 La masa de una molécula de agua es 18 veces mayor que la masa de un átomo de hidrógeno y 1, 5 veces mayor que la masa de un átomo de carbono. Con esta información tienes que razonar si las siguientes afirmaciones son verdaderas o falsas. En 18 g de agua hay el mismo número de moléculas (H 2 O) que átomos de carbono (C) hay en 12 g de carbono. En 18 g de agua hay el mismo número de moléculas (H 2 O) que átomos de hidrógeno (H) hay en 12 g de hidrógeno. Al tomar las masas en la misma proporción (vez y media a uno) que tienen las masas relativas, ha de haber el mismo número de de moléculas de agua y de átomos de hidrógeno, aunque no sepamos cuál es ese número. No puede haber el mismo número de unas y otros porque la masa de una molécula de agua es mayor (dieciocho veces) que la masa de un átomo de hidrógeno y las masas que hemos tomado no guardan esa proporción. Si peso 180 g de agua y 10 g de hidrógeno tengo el mismo número de moléculas de agua que de átomos de hidrógeno. Al tomar las masas en la misma proporción (dieciocho a uno) que tienen las masas relativas, ha de haber el mismo número de de moléculas de agua y de átomos de hidrógeno, aunque no sepamos cuál es ese número. En 100 g de agua hay el mismo número de moléculas (H 2 O) que átomos de carbono hay en 100 g de carbono y que átomos de hidrógeno hay en 100 g de hidrógeno. No puede haber el mismo número de partículas (moléculas o átomos) porque hemos tomado masas iguales (100 g) y las masas relativas del agua, del carbono y del hidrógeno son diferentes.

6 La constante de Avogadro ( L = 6, 02· 1023 partículas/mol) es un número inmensamente grande. Para que te hagas una idea de su magnitud, realiza los siguientes cálculos: a) Si ese número fuesen cubitos de 1 cm 3 de volumen y los repartiésemos de forma compacta por la superficie de la Península Ibérica (595000 km 2), ¿qué altura alcanzarían los cubitos? b) La Tierra tiene unos 6· 109 habitantes. Si tuviéramos que repartir 1 mol de céntimos de € entre ellos, ¿cuántos euros recibiría cada uno? # Contesta al apartado a). Al repartir los cubitos por la península se forma un prisma de base irregular. El volumen de dicho prisma es: V = 6, 02· 10 23 cm 3 = 6, 02· 1017 m 3. Por otro lado, la superficie de la base es: S = 5, 95· 105 km 2 = 5, 95· 1011 m 2. En consecuencia, la altura que alcanzarían los cubitos, dado que V = S·h, será: h = V/S = 6, 02· 10 17 m 3/5, 95· 1011 m 2 = 1, 01· 106 m. ¡Más de 1000 km! # Contesta al apartado b). El capital que habría que distribuir es de 6, 02· 10 23 céntimos de € o 6, 02· 1021 €. A cada habitante le correspondería: 6, 02· 10 21 €/6· 109 habitantes = 1· 10 12 €/habitante. ¡Sólo un billón de € por habitante!

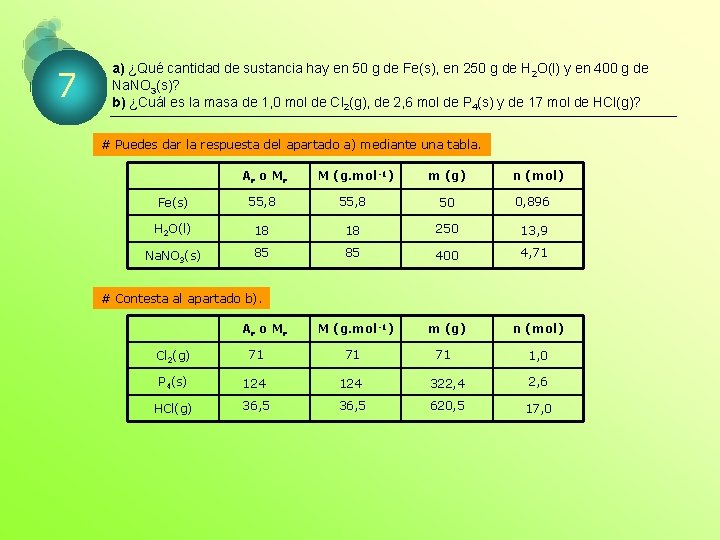
7 a) ¿Qué cantidad de sustancia hay en 50 g de Fe(s), en 250 g de H 2 O(l) y en 400 g de Na. NO 3(s)? b) ¿Cuál es la masa de 1, 0 mol de Cl 2(g), de 2, 6 mol de P 4(s) y de 17 mol de HCl(g)? # Puedes dar la respuesta del apartado a) mediante una tabla. Ar o M r M (g. mol-1) m (g) n (mol) Fe(s) 55, 8 50 0, 896 H 2 O(l) 18 18 250 13, 9 Na. NO 3(s) 85 85 400 4, 71 M (g. mol-1) m (g) # Contesta al apartado b). Ar o M r 71 n (mol) Cl 2(g) 71 71 P 4(s) 124 322, 4 2, 6 HCl(g) 36, 5 620, 5 17, 0 1, 0

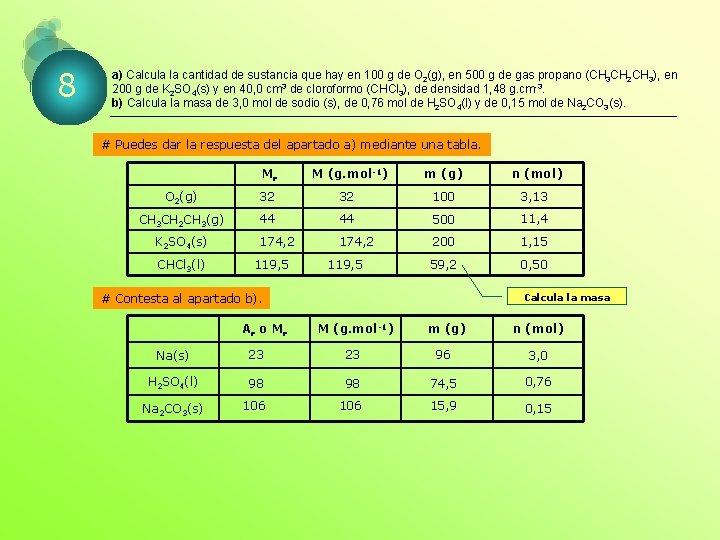
8 a) Calcula la cantidad de sustancia que hay en 100 g de O 2(g), en 500 g de gas propano (CH 3 CH 2 CH 3), en 200 g de K 2 SO 4(s) y en 40, 0 cm 3 de cloroformo (CHCl 3), de densidad 1, 48 g. cm-3. b) Calcula la masa de 3, 0 mol de sodio (s), de 0, 76 mol de H 2 SO 4(l) y de 0, 15 mol de Na 2 CO 3(s). # Puedes dar la respuesta del apartado a) mediante una tabla. Mr M (g. mol-1) m (g) n (mol) O 2(g) 32 32 100 3, 13 CH 3 CH 2 CH 3(g) 44 44 500 11, 4 174, 2 200 1, 15 59, 2 0, 50 K 2 SO 4(s) CHCl 3(l) 119, 5 # Contesta al apartado b). Ar o M r Calcula la masa M (g. mol-1) m (g) n (mol) Na(s) 23 23 96 3, 0 H 2 SO 4(l) 98 98 74, 5 0, 76 Na 2 CO 3(s) 106 15, 9 0, 15

9 a) El volumen molar del bromo líquido (Br 2) es 5, 5 cm 3/mol. Calcula el volumen que ocuparán 4, 0 mol de Br 2(l) a esa temperatura. b) ¿Qué volumen ocupan 12, 3 mol de oxígeno gaseoso a 0 ºC y 1 atm? c) ¿Qué cantidad de etano hay en 1200 cm 3 de etano gas, medidos en C. N. ? # Contesta al apartado a). De acuerdo con el concepto de volumen molar, se cumple que V = V mn, es decir, V = 5, 5 cm 3. mol-1 · 4 mol = 22 cm 3. # Contesta al apartado b). De acuerdo con el concepto de volumen molar, se cumple que V = V mn, es decir, V = 22, 4 dm 3. mol-1 · 12, 3 mol = 275, 5 dm 3, ya que, a 0 ºC y 1 atm, un mol de cualquier gas ideal ocupa 22, 4 dm 3. # Contesta al apartado c). De acuerdo con el concepto de volumen molar, se cumple que n = V/V m, es decir,

10 a) Halla la cantidad de oxígeno gaseoso que hay en 0, 25 L de oxígeno en C. N. b) ¿Qué volumen ocupan 12, 0 mol de dióxido de carbono gas en C. N. ? c) Calcula la masa de 300 cm 3 de O 2(g), medidos en C. N. # Contesta al apartado a). De acuerdo con el concepto de volumen molar, se cumple que n = V/V m, es decir, # Contesta al apartado b). De acuerdo con el concepto de volumen molar, se cumple que V = V mn, es decir, V = 22, 4 dm 3. mol-1 · 12 mol = 268, 8 dm 3, ya que, a 0 ºC y 1 atm, un mol de cualquier gas ideal ocupa 22, 4 dm 3. # Contesta al apartado c). De acuerdo con el concepto de volumen molar, se cumple que n = V/V m, es decir, La masa molar del O 2(g) es 32 g/mol; por lo tanto, m = n. M = 0, 0134 mol· 32 g. mol -1 = = 0, 43 g.

11 a) Calcula el número de átomos que hay en 40 g de sodio, Na(s). b) Halla el número de moléculas que hay en 0, 10 g de amoniaco, NH 3(g). c) ¿Cuántas unidades fórmula hay en 37, 4 g de cloruro de sodio, Na. Cl(s)? ¿Cuántos iones (Na+, Cl-) hay presentes en ese caso? # Antes de contestar al apartado a) diseña el procedimiento que vas a emplear. En primer lugar, se calcula la cantidad de sustancia de sodio: n = m/M, es decir, n = 40 g/23 g. mol-1 = 1, 74 mol. A continuación se calcula el número de partículas (átomos, en este caso): N = n·L = 1, 74 mol. 6, 02. 10 23 átomos. mol-1 = 1, 05. 1024 átomos. # Contesta al apartado b). En primer lugar, se calcula la cantidad de sustancia de amoniaco: n = m/M, es decir, n = 0, 10 g/17 g. mol-1 = 0, 0059 mol. A continuación se calcula el número de partículas (moléculas, en este caso): N = n·L = 5, 9. 10 -3 mol. 6, 02. 1023 moléculas. mol-1 = = 3, 6. 1021 moléculas. # Contesta al apartado c). En primer lugar, se calcula la cantidad de sustancia de cloruro de sodio: n = m/M, es decir, n = 37, 4 g/58, 5 g. mol-1 = 0, 64 mol. A continuación se calcula el número de partículas (unidades fórmula, en este caso): N = n·L = 0, 64 mol. 6, 02. 10 23 unidades fórmula. mol-1 = = 3, 85. 1023 unidades fórmula (Na. Cl). Cada unidad fórmula tiene dos iones (Na+, Cl-), por lo que habrá el doble de iones: 7, 70. 1023 iones.

12 a) ¿Cuántas moléculas hay en 7, 0 g de nitrógeno? b) ¿Cuántas moléculas de agua hay en 250 cm 3 de agua? Densidad del agua = 1 g. cm-3. c) ¿Cuántas moléculas hay en 98, 4 cm 3 de metano [CH 4(g)], medidos en C. N. ? ¿Cuántos átomos de carbono y de hidrógeno contiene dicha muestra? # Contesta al apartado a). En primer lugar, se calcula la cantidad de sustancia de nitrógeno, teniendo en cuenta que está formado por moléculas diatómicas (N 2): n = m/M, es decir, n = 7, 0 g/28 g. mol -1 = 0, 25 mol. A continuación se calcula el número de partículas (moléculas, en este caso): N = n·L = 0, 25 mol. 6, 02. 10 23 moléculas. mol-1 = 1, 51. 1023 moléculas (N 2). # Contesta al apartado b). En primer lugar, se calcula la cantidad de sustancia de agua, teniendo en cuenta que la masa de agua es 250 g (250 cm 3. 1 g. cm-3 ): n = m/M, es decir, n = 250 g/18 g. mol -1 = 13, 9 mol. A continuación se calcula el número de partículas (moléculas, en este caso): N = n·L = 13, 9 mol. 6, 02. 10 23 moléculas. mol-1 = 8, 37. 1024 moléculas (H 2 O). # Contesta al apartado c). En primer lugar, se calcula la cantidad de sustancia de metano: n = V/V m, es decir, n = 0, 0984 dm 3/22, 4 dm 3. mol-1 = 4, 39. 10 -3 mol. A continuación se calcula el número de partículas (moléculas, en este caso): N = n·L = 4, 39. 10 -3 mol. 6, 02. 1023 moléculas. mol-1 = 2, 64. 1021 moléculas (CH 4). Una molécula de metano contiene un átomo de carbono y cuatro átomos de hidrógeno; por lo tanto, N(C) = 2, 64. 10 21 átomos y N(H) = 4. 2, 64. 10 21 = 1, 06. 1022 átomos.

13 Calcula la masa de: a) un átomo de oro b) una molécula de dióxido de carbono c) una unidad fórmula de bromuro de potasio. # Contesta al apartado a). La masa molar del oro es de 197 g. mol-1; dicha masa contiene 6, 02. 10 23 átomos de oro. Por lo tanto, la masa de un átomo de oro es: # Contesta al apartado b). La masa molar del dióxido de carbono es de 44 g. mol -1; dicha masa contiene 6, 02. 10 23 moléculas de dióxido de carbono (CO 2). Por lo tanto, la masa de una molécula de CO 2 es: # Contesta al apartado b). La masa molar del bromuro de potasio es de 119 g. mol -1; dicha masa contiene 6, 02. 10 23 unidades fórmula de KBr. Por lo tanto, la masa de una unidad fórmula de KBr es:

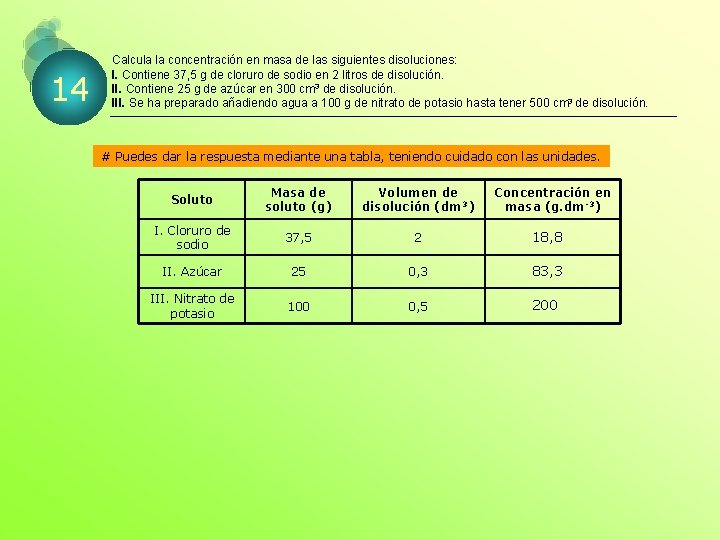
14 Calcula la concentración en masa de las siguientes disoluciones: I. Contiene 37, 5 g de cloruro de sodio en 2 litros de disolución. II. Contiene 25 g de azúcar en 300 cm 3 de disolución. III. Se ha preparado añadiendo agua a 100 g de nitrato de potasio hasta tener 500 cm 3 de disolución. # Puedes dar la respuesta mediante una tabla, teniendo cuidado con las unidades. Soluto Masa de soluto (g) Volumen de disolución (dm 3) Concentración en masa (g. dm-3) I. Cloruro de sodio 37, 5 2 18, 8 II. Azúcar 25 0, 3 83, 3 III. Nitrato de potasio 100 0, 5 200

15 a) ¿Cuál es la concentración de una disolución que contiene 37, 9 g de nitrato de potasio (KNO 3) en agua hasta completar 100 cm 3 de disolución? b) Calcula la cantidad de soluto que hay en 2 dm 3 de una disolución acuosa de hidróxido de sodio (Na. OH) de concentración 0, 4 mol. dm-3. c) ¿Qué masa de soluto hay en 50 cm 3 de una disolución acuosa de cloruro de sodio (Na. Cl) de concentración 0, 1 mol. dm-3? # Contesta al apartado a). En primer lugar, hay que calcular la cantidad de soluto, para lo que se requiere conocer la masa molar del soluto: M = 101 g. mol-1; la cantidad de soluto es, entonces, n = m/M = = 37, 9 g/101 g. mol-1 = 0, 375 mol. La concentración será: c = n soluto/Vdisolución = 0, 375 mol/0, 1 dm 3 = 3, 75 mol. dm-3. # Contesta al apartado b). De la expresión matemática de la concentración, deducimos que: n soluto = c·Vdisolución = = 0, 4 mol. dm-3· 2 dm 3 = 0, 8 mol de Na. OH. # Contesta al apartado c). Calculamos primero la cantidad de soluto: n soluto = c·Vdisolución = 0, 1 mol. dm-3· 0, 05 dm 3 = 0, 005 mol. La masa de soluto es, entonces, m = n. M = 0, 005 mol· 58, 5 g. mol -1 = 0, 29 g de Na. Cl.

16 Se quiere preparar 250 cm 3 de una disolución acuosa de hidróxido de sodio de concentración 0, 20 mol. dm-3. ¿Cuál es la masa de hidróxido de sodio que se ha de pesar? ¿Cómo se prepara la disolución en el laboratorio? # Contesta a la primera cuestión. En primer lugar, hay que calcular la cantidad de soluto: n soluto = c·Vdisolución = 0, 20 mol. dm-3· 0, 25 dm-3 = 0, 05 mol. En segundo lugar, conocida la masa molar del soluto (M = 40 g. mol-1), hallamos la masa de hidróxido de sodio requerida: m = n·M = 0, 05 mol· 40 g. mol-1 = 2 g. # Contesta a la segunda cuestión. Se pesaría 2 g de hidróxido de sodio y se colocaría en un vaso. Se añadiría agua, poco a poco, hasta su disolución. A continuación, se pasaría la disolución a un matraz aforado de 250 cm 3. Se agregaría agua y se agitaría el matraz para facilitar la dilución. Finalmente, se añadiría agua con mucho cuidado hasta enrasar.

17 Una disolución contiene 2 g de yodo en 100 g de etanol. La densidad del etanol es de 0, 79 g. cm-3. ¿Cuál es la concentración de la disolución? . Fíjate en que el dato que se conoce es la densidad del disolvente, no la densidad de la disolución. Tendrás que hacer alguna aproximación. # Calcula la cantidad de soluto y el volumen de disolución. El yodo está formado por moléculas diatómicas (I 2), por lo que su masa molar es: M = 254 g. mol-1. La cantidad de soluto es, entonces, n = m/M = 2 g / 254 g. mol -1 = 7, 87. 10 -3 mol. El volumen del disolvente es fácil de calcular: V disolvente = m/d = 100 g / 0, 79 g. cm -3 = 127 cm 3. El volumen de la disolución será algo mayor que el volumen del disolvente, ya que se ha añadido el soluto; sin embargo, vistas las magnitudes implicadas, vamos a considerar que el volumen de la disolución es prácticamente igual que el volumen del disolvente. # Calcula la concentración. La concentración de la disolución será: c = n soluto/Vdisolución = 7, 87. 10 -3 mol / 0, 127 dm 3 = 0, 062 mol. dm-3.

18 a) Tenemos una disolución acuosa de ácido sulfúrico de concentración 0, 25 mol. dm-3. Si tomamos 50 cm 3 de esta disolución, ¿qué masa de ácido sulfúrico habremos tomado? b) A los 50 cm 3 de la disolución citada en el apartado anterior se añade 150 cm 3 de agua. ¿Cuál es la concentración de la nueva disolución? # Contesta al apartado a). En primer lugar, se calcula la cantidad de ácido sulfúrico (H 2 SO 4): n = c·V disolución = 0, 25 mol. dm-3. 0, 05 dm 3 = 1, 25. 10 -2 mol. Como la masa molar del soluto es: M = 98 g. mol -1, la masa de ácido sulfúrico será: m = n·M = 1, 25. 10 -2 mol. 98 g. mol-1 = 1, 225 g. # Contesta al apartado b). La cantidad de ácido sulfúrico (H 2 SO 4) de la nueva disolución es, obviamente: n = 1, 25. 10 -2 mol. Como su volumen es de 0, 2 dm 3, la concentración será: c = n soluto/Vdisolución = = 1, 25. 10 -2 mol / 0, 2 dm 3 = 6, 25. 10 -2 mol. dm-3.
![19 Cuál es la concentración en masa de una disolución de ácido clorhídrico HClaq 19 ¿Cuál es la concentración en masa de una disolución de ácido clorhídrico [HCl(aq)]](https://slidetodoc.com/presentation_image_h/a8b872eac6d0704d352ac07739be9082/image-20.jpg)
19 ¿Cuál es la concentración en masa de una disolución de ácido clorhídrico [HCl(aq)] cuya concentración es de 0, 3 mol. dm-3? # Resuelve el ejercicio suponiendo que dispones de un litro de disolución. La cantidad de soluto es, entonces: n = c·V disolución = 0, 3 mol. dm-3. 1 dm 3 = 0, 3 mol. La masa de soluto se calcula mediante: m = n·M = 0, 3 mol. 36, 5 g. mol -1 = 10, 95 g. La concentración en masa será, pues: r = msoluto/Vdisolución = 10, 95 g/ 1 dm 3 = 10, 95 g. dm-3. # Resuelve ahora el ejercicio trabajando con las expresiones matemáticas de la concentración en masa y de la concentración. En consecuencia, r = 0, 3 mol. dm-3. 36, 5 g. mol-1 = 10, 95 g. dm-3.

20 Escribe, igualadas, las ecuaciones químicas asociadas a las siguientes reacciones. Explica el significado de cada una de ellas. La primera puede servir de ejemplo. I. cloro (g) + sodio (s) cloruro de sodio (s) Cl 2(g) + 2 Na(s) 2 Na. Cl(s) {1 mol de moléculas de cloro} reacciona con {2 mol de átomos de sodio} para dar {2 mol de unidades fórmula de cloruro de sodio} II. carbono (s) + oxígeno (g) dióxido de carbono (g) C(s) + O 2(g) CO 2(g) {1 mol de átomos de carbono} reacciona con {1 mol de moléculas de oxígeno} para dar {1 mol de moléculas de dióxido de carbono} III. cinc (s) + ácido clorhídrico (aq) cloruro de cinc (aq) + hidrógeno (g) Zn(s) + 2 HCl(aq) Zn. Cl 2(aq) + H 2(g) {1 mol de átomos de cinc} reacciona con {2 mol de moléculas de ácido clorhídrico} para dar {1 mol de unidades fórmula de cloruro de cinc} y {1 mol de moléculas de hidrógeno}

21 El óxido de calcio o cal viva se obtiene por calentamiento del carbonato de calcio, produciéndose, además, dióxido de carbono. a) Escribe, igualada, la ecuación química asociada al proceso descrito. b) Calcula la cantidad de óxido de calcio que se obtendrá por calentamiento de 10 toneladas de carbonato de calcio. c) Halla el volumen de dióxido de carbono, medido en C. N. , que se desprenderá a la atmósfera. # Contesta al apartado a). Ca. CO 3(s) Ca. O(s) + CO 2(g) {1 mol de carbonato de calcio} se descompone en {1 mol de óxido de calcio} y {1 mol de dióxido de carbono} # Contesta al apartado b). La ecuación química nos informa de las cantidades de sustancia que reaccionan o se forman. Por lo tanto, calculamos, en primer lugar, la cantidad de carbonato de calcio que se va a descomponer: n(Ca. CO 3) = 107 g/100 g. mol-1 = 105 mol. Como la relación estequiométrica entre el carbonato de calcio y el óxido de calcio es mol a mol, se obtendrá la misma cantidad de óxido de calcio: n(Ca. O) = 10 5 mol. # Contesta al apartado c). Por la razón ya apuntada, también se obtienen 10 5 mol de dióxido de carbono. El volumen de dióxido de carbono, en C. N. , será: V = n·V m = 105 mol. 22, 4 dm 3. mol-1 = = 2, 24. 106 dm 3 = 2240 m 3 de CO 2.

22 El etanol o alcohol etílico (CH 3 CH 2 OH) es un líquido que arde si se calienta en presencia de oxígeno para dar dióxido de carbono y vapor de agua. a) Escribe, igualada, la ecuación química asociada al proceso descrito. b) ¿Qué masa de oxígeno es necesaria para quemar 25 cm 3 de etanol? La densidad del etanol es de 0, 78 g. cm-3. # Contesta al apartado a). C 2 H 6 O(l) + 3 O 2 (g) 2 CO 2(g) + 3 H 2 O(l) {1 mol de etanol} reacciona con {3 mol de oxígeno} para dar {2 mol de dióxido de carbono} y {3 mol de agua} # Contesta al apartado b). La ecuación química nos informa de las cantidades de sustancia que reaccionan o se forman. Por lo tanto, calculamos, en primer lugar, la masa y la cantidad de etanol que va a reaccionar: m(C 2 H 6 O) = 25 cm 3. 0, 78 g. cm-3 = 19, 5 g; n(C 2 H 6 O) = 19, 5 g/46 g. mol -1 = 0, 424 mol. La relación estequiométrica entre el etanol y el oxígeno es de 1 mol a 3 mol; por lo tanto, la cantidad de oxígeno necesaria es: n(O 2) = (3 mol O 2/1 mol etanol). 0, 424 mol etanol = 1, 272 mol. La masa de oxígeno será, entonces: m(O 2) = 1, 272 mol. 32 g. mol-1 = 40, 7 g

23 El amoniaco se obtiene mediante el proceso de Haber, que se basa en la reacción del nitrógeno con el oxígeno. a) Escribe, igualada, la ecuación química asociada al proceso de Haber. b) ¿Qué volumen de amoniaco se obtendrá si se parte de 30 litros de nitrógeno y se supone que reacciona completamente con hidrógeno en exceso? Todos los volúmenes se miden en C. N. # Contesta al apartado a). N 2(g) + 3 H 2(g) 2 NH 3(g) {1 mol de nitrógeno} reacciona con {3 mol de hidrógeno} para dar {2 mol de amoniaco} # Para contestar al apartado b) escribe el esquema de cálculo que emplearás. Calculamos, en primer lugar, la cantidad de nitrógeno que va a reaccionar; para ello, debemos conocer el valor del volumen molar en C. N. : n(N 2)= 30 dm 3/22, 4 dm 3. mol-1 = 1, 34 mol. La relación estequiométrica entre el amoniaco y el nitrógeno es de 2 mol a 1 mol; por lo tanto, la cantidad de amoniaco obtenido es: n(NH 3) = (2 mol NH 3/1 mol N 2). 1, 34 mol N 2 = 2, 68 mol. La volumen de amoniaco será, entonces: V(NH 3 = 2, 68 mol. 22, 4 dm 3. mol-1 = 60 dm 3. V(N 2) 1/Vm n(N 2) 2 mol NH 3/1 mol N 2 n(NH 3) Vm V(NH 3)

24 Cuando el azufre reacciona con el oxígeno del aire se produce dióxido de azufre, que es una de las sustancias responsables de la lluvia ácida. Calcula la masa de dióxido de azufre que se forma cuando se quema 1 kg de azufre. # Escribe, igualada, la correspondiente ecuación química. S(s) + O 2(g) SO 2(g) {1 mol de azufre} reacciona con {1 mol de oxígeno} para dar {1 mol de dióxido de azufre} # Escribe el esquema de cálculo que emplearás. Calculamos, en primer lugar, la cantidad de azufre que va a reaccionar; para ello, debemos conocer el valor de su masa molar: n(S)= 1000 g/32 g. mol -1 = 31, 25 mol. La relación estequiométrica entre el dióxido de azufre y el azufre es mol a mol; por lo tanto, la cantidad de dióxido de azufre obtenido es: n(SO 2) = 31, 25 mol. La masa de dióxido de azufre será, entonces: m(SO 2) = 31, 25 mol. 64 g. mol-1 = 2000 g. m(S) 1/M n(S) 1 mol SO 2/1 mol S n(SO 2) M m(SO 2)

25 El gas propano (C 3 H 8) arde con el oxígeno del aire para dar dióxido de carbono y vapor de agua. Calcula el volumen de oxígeno, medido en C. N. , necesario para quemar 100 cm 3 de propano. # Escribe, igualada, la correspondiente ecuación química. C 3 H 8(g) + 5 O 2(g) 3 CO 2(g) + 4 H 2 O(g) {1 mol de propano} reacciona con {5 mol de oxígeno} para dar {3 mol de dióxido de carbono} y {4 mol de agua} # Escribe el esquema de cálculo que emplearás. Calculamos, en primer lugar, la cantidad de propano que va a reaccionar sabiendo el valor del volumen molar: n(C 3 H 8)= 0, 1 dm 3/22, 4 dm 3. mol-1 = 4, 46. 10 -3 mol. La relación estequiométrica entre el oxígeno y el propano es de 5 mol de oxígeno por 1 mol de propano; por lo tanto, la cantidad de oxígeno necesario es: n(O 2) = (5 mol O 2/1 mol C 3 H 8). 4, 46. 10 -3 mol C 3 H 8 = 2, 23. 10 -2 mol. El volumen de oxígeno será, entonces: V(O 2) = 2, 23. 10 -2 mol. 22, 4 dm 3. mol-1 = 500 dm 3. V(C 3 H 8) 1/Vm n(C 3 H 8) 5 mol O 2/1 mol C 3 H 8 n(O 2) Vm V(O 2)

26 El hierro se obtiene por reducción del óxido de hierro (III) en un alto horno. El agente reductor es el monóxido de carbono, que se oxida a dióxido de carbono. Calcula la masa de hierro que puede obtenerse a partir de 12 toneladas de óxido de hierro (III). # Escribe, igualada, la correspondiente ecuación química. Fe 2 O 3(s) + 3 CO(g) 2 Fe(s) + 3 CO 2(g) {1 mol de óxido de hierro (III)} reacciona con {3 mol de monóxido de carbono} para dar {2 mol de hierro} y {3 mol de dióxido de carbono} # Escribe el esquema de cálculo que emplearás. Calculamos, en primer lugar, la cantidad de óxido de hierro (III) que va a reaccionar; para ello, debemos conocer el valor de su masa molar: n(Fe 2 O 3)= 1, 2. 107 g/159, 6 g. mol-1 = 7, 52. 104 mol. La relación estequiométrica entre el hierro y el óxido de hierro (III) es de 2 mol a 1 mol; por lo tanto, la cantidad de hierro obtenido es: n(Fe) = (2 mol Fe/1 mol Fe 2 O 3). 7, 52. 104 mol = 1, 50. 105 mol. La masa de hierro será, entonces: m(Fe) = 1, 50. 10 5 mol. 55, 8 g. mol-1 = 8, 37. 106 g = 8, 37 toneladas. m(Fe 2 O 3) 1/M 2 mol Fe/1 mol Fe 2 O 3 n(Fe 2 O 3) n(Fe) M m(Fe)

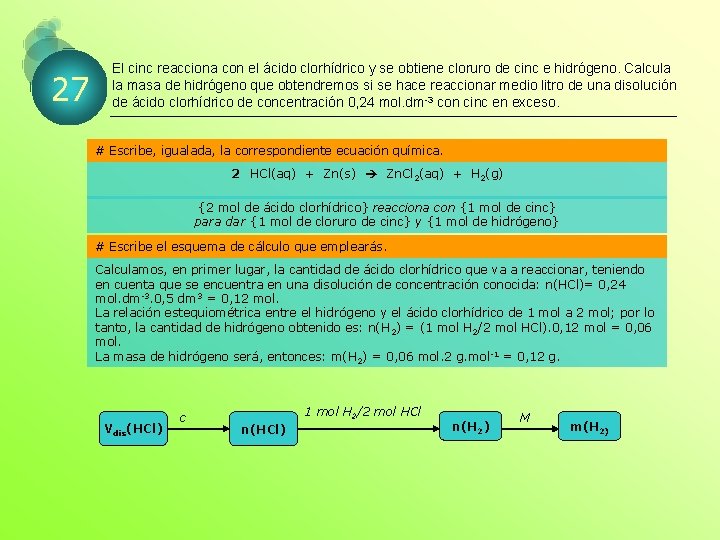
27 El cinc reacciona con el ácido clorhídrico y se obtiene cloruro de cinc e hidrógeno. Calcula la masa de hidrógeno que obtendremos si se hace reaccionar medio litro de una disolución de ácido clorhídrico de concentración 0, 24 mol. dm-3 con cinc en exceso. # Escribe, igualada, la correspondiente ecuación química. 2 HCl(aq) + Zn(s) Zn. Cl 2(aq) + H 2(g) {2 mol de ácido clorhídrico} reacciona con {1 mol de cinc} para dar {1 mol de cloruro de cinc} y {1 mol de hidrógeno} # Escribe el esquema de cálculo que emplearás. Calculamos, en primer lugar, la cantidad de ácido clorhídrico que va a reaccionar, teniendo en cuenta que se encuentra en una disolución de concentración conocida: n(HCl)= 0, 24 mol. dm-3. 0, 5 dm 3 = 0, 12 mol. La relación estequiométrica entre el hidrógeno y el ácido clorhídrico de 1 mol a 2 mol; por lo tanto, la cantidad de hidrógeno obtenido es: n(H 2) = (1 mol H 2/2 mol HCl). 0, 12 mol = 0, 06 mol. La masa de hidrógeno será, entonces: m(H 2) = 0, 06 mol. 2 g. mol-1 = 0, 12 g. Vdis(HCl) c 1 mol H 2/2 mol HCl n(HCl) n(H 2) M m(H 2)

Ayuda (*) Radiactivo

Ayuda (*) Radiactivo

Ayuda La masa atómica relativa (Ar) es el número de veces que la masa de un átomo es mayor que la doceava parte de la masa de un átomo de carbono-12. Ejemplo: A r(O) = 16 significa que la masa de un átomo de oxígeno es 16 veces mayor que la doceava parte de la masa de un átomo de carbono-12. La masa molecular relativa (Mr) es el número de veces que la masa de una molécula es mayor que la doceava parte de la masa de un átomo de carbono-12. Ejemplo: M r(H 2 O) = 18 significa que la masa de una molécula de agua es 18 veces mayor que la doceava parte de la masa de un átomo de carbono-12. La masa molecular relativa se calcula sumando las masas atómicas relativas de los átomos que forman la molécula. En el caso de estructuras gigantes (como la de Na. Cl), es más propio hablar de masa fórmula relativa, aunque su cálculo se hace de manera similar a la indicada para los compuestos moleculares. Un mol es la cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas, iones, etc) como átomos hay en 12 g de carbono-12. ¿Cuántos átomos hay en 12 g de carbono? La respuesta constituye la llamada constante de Avogadro, cuyo valor es 6, 02· 10 23 partículas/mol. Así pues, un mol es la cantidad de sustancia que contiene 6, 02· 10 23 entidades elementales (átomos, moléculas, iones, unidades fórmula, …). La cantidad de sustancia se refiere al número de partículas o moles de la sustancia considerada. El símbolo de la cantidad de sustancia es n. La masa de un mol se denomina masa molar. Su símbolo es M. El valor numérico de la masa molar de una sustancia, expresada en g/mol, coincide con el de la masa atómica relativa, la masa molecular relativa o la masa fórmula relativa de esta sustancia. Si se conoce la masa m de una sustancia, se puede calcular la cantidad de sustancia n dividiendo su masa por la masa molar M, esto es,

Ayuda El volumen molar (Vm) es el volumen de un mol de una sustancia. Se calcula mediante: La aplicación de esta fórmula no es tan general como la anterior (M = m/n), porque el volumen molar de una sustancia varía con la temperatura y, en el caso de los gases, también con la presión. El volumen molar de un gas ideal en C. N. (condiciones normales: 0 ºC de temperatura y 1 atm de presión) es de 22, 4 dm 3/mol. Para calcular el número de partículas (átomos o moléculas) N que hay en una determinada cantidad de sustancia n podemos utilizar la expresión: N = n. L, siendo L la constante de Avogadro. La masa de una partícula m se puede calcular a partir de la masa molar M y la constante de Avogadro L: La concentración en masa (r) de una disolución es la masa de soluto por unidad de volumen de disolución. Se expresa en g. dm -3 y se calcula mediante: La concentración (c) de una disolución es la cantidad de soluto por unidad de volumen de disolución. Se mide en mol. dm -3 y se calcula mediante:

Ayuda Pasos para escribir una ecuación química • Escribe la reacción química con palabras. Ejemplo: hidrógeno + oxígeno agua • Escribe las fórmulas de cada sustancia. H 2 + O 2 H 2 O • Fíjate bien en los átomos de cada tipo que hay en cada miembro de la ecuación química. • Introduce coeficientes delante de las fórmulas, de modo que el número de átomos de cada tipo contenido en cada miembro sea el mismo (conservación de la masa). 2 H 2 + O 2 2 H 2 O • Añade los símbolos de los estados de agregación de cada sustancia. 2 H 2(g) + O 2(g) 2 H 2 O(l) Algoritmo propuesto para el estudio cuantitativo de las reacciones químicas 1. Escribe la ecuación química igualada. 2. Determina la cantidad de sustancia a partir de los datos. 3. Establece las relaciones estequiométricas correspondientes. 4. Halla la cantidad de sustancia de los resultados. 5. Expresa el resultado en las unidades que interese.
 Clculos
Clculos Clculos
Clculos Qumicas
Qumicas Identicos
Identicos Fsica
Fsica Fsica
Fsica Vector unitario
Vector unitario Movimento retilíneo uniformemente variado
Movimento retilíneo uniformemente variado Fsica
Fsica Fsica
Fsica Fsica
Fsica Aceleracion relativa
Aceleracion relativa Lógica
Lógica Fsica
Fsica Fsica
Fsica I y j fisica
I y j fisica Dois vetores a e b
Dois vetores a e b Fsica
Fsica Definición de trayectoria en física
Definición de trayectoria en física Aceleración normal y aceleración tangencial
Aceleración normal y aceleración tangencial Fsica
Fsica Unidades de medida
Unidades de medida Leis de newton
Leis de newton Eficiencia de carnot
Eficiencia de carnot Fsica
Fsica Movimento
Movimento Ramas de la física moderna
Ramas de la física moderna Reacciones quimicas
Reacciones quimicas Redox os
Redox os Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Reacciones de hipersensibilidad
Reacciones de hipersensibilidad Calculos con reacciones quimicas
Calculos con reacciones quimicas Reacciones de orden cero
Reacciones de orden cero Representacion del fluor
Representacion del fluor
























































