UTP FIMAAS Fsica Curso Fsica General Sesin N






































- Slides: 60

UTP FIMAAS Física Curso: Física General. Sesión Nº 20 : Termodinámica. Profesor: Carlos Alvarado de la Portilla

Bibliografía. • Física Universitaria; Sears, Zemansky, Young, Freedman XI Edición. • Física General; Carel W. , Daniel Schaum Profesor: Carlos Alvarado de la Portilla

Termodinámica. 1. - Parámetros de un sistema termodinámico. 2. - Ecuación de estado de un gas ideal. 3. - Energía interna. 4. - Procesos termodinámicos. 5. - Trabajo efectuado por un gas ideal. 6. - Primera ley de la termodinámica. 7. - Máquinas térmicas. 8. - Rendimiento. 9. . - Máquina de Carnot. 10. - Segunda ley de la termodinámica. 11. - Entropía Ejercicios.

Termodinámica.

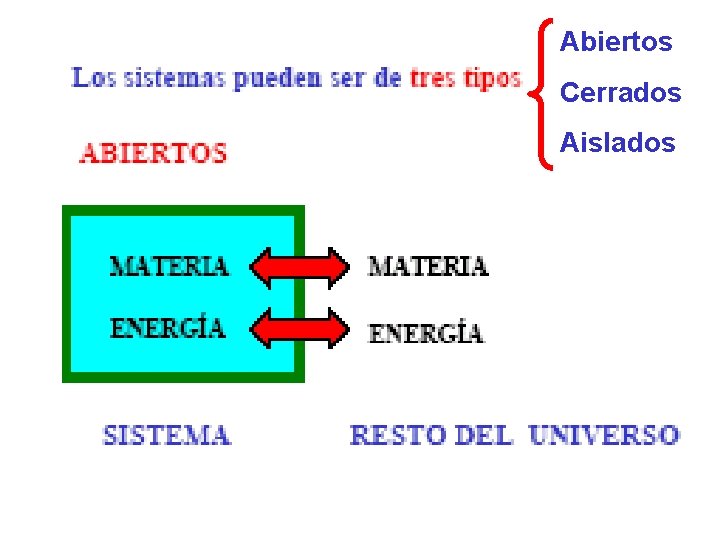
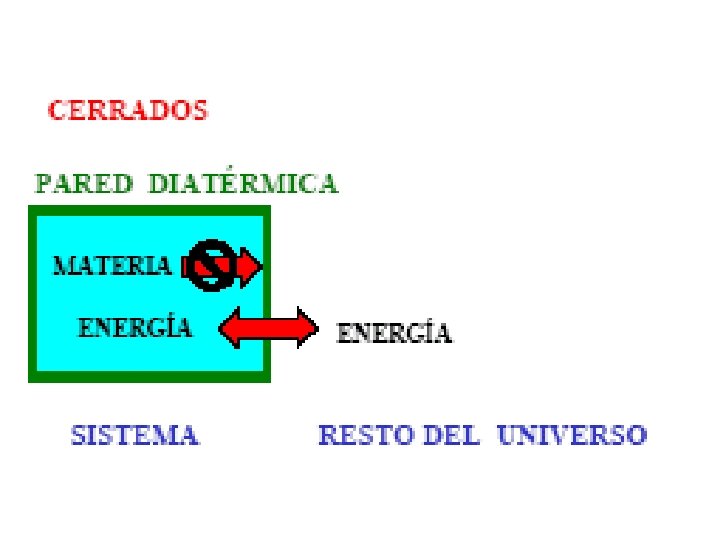
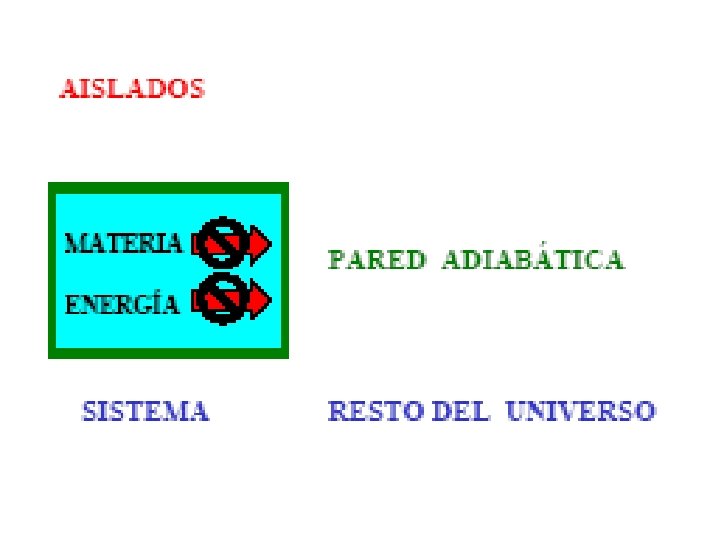
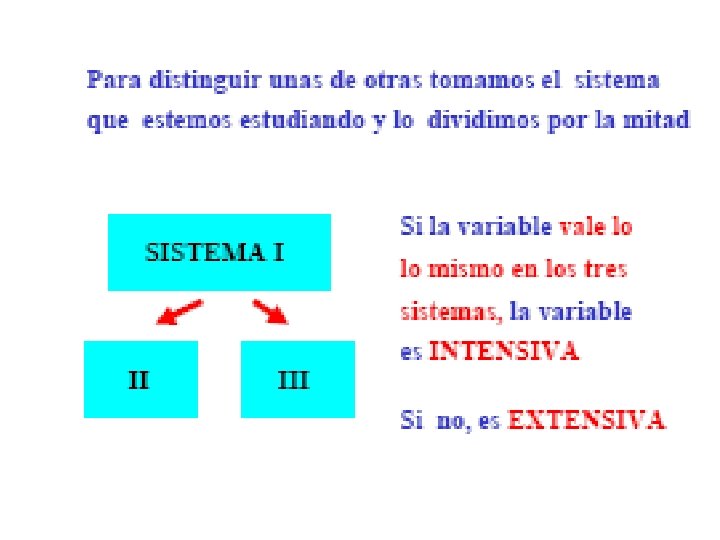
1. - Parámetros de un sistema termodinámico. • Sistema termodinámico. Es una parte del universo que se aisla para su estudio. Esta aislamiento se puede llevar a cabo de un a manera real en el campo experimental ; o de una manera ideal cuando se trata de un estudio teórico. • Parámetros de un sistema termodinámico. • Los sistemas que se estudian son generalmente aquellos cuyo estado queda perfectamente determinado por una terna de variables de estado: la Presión, el Volumen y la Temperatura.


Abiertos Cerrados Aislados







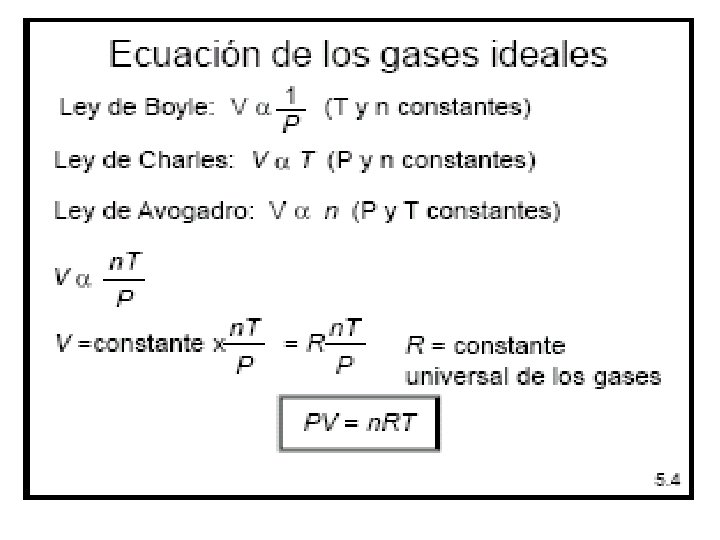
2. - Ecuación de estado de un gas ideal. • La ecuación que describe normalmente la relación entre presión, volumen, temperatura y número de moles de un gas ideal es: PV=n. RT Donde : P = presión V= volumen n = número de moles R = Constante universal de los gases ideales T = temperatura en grados Kelvin

• Valores de la constante universal de los gases ideales R. • R = 8. 314471 J /°K (molg) • R = 1. 987 cal /°K (molg) • R = 0. 082 litro-atm /°K (molg)

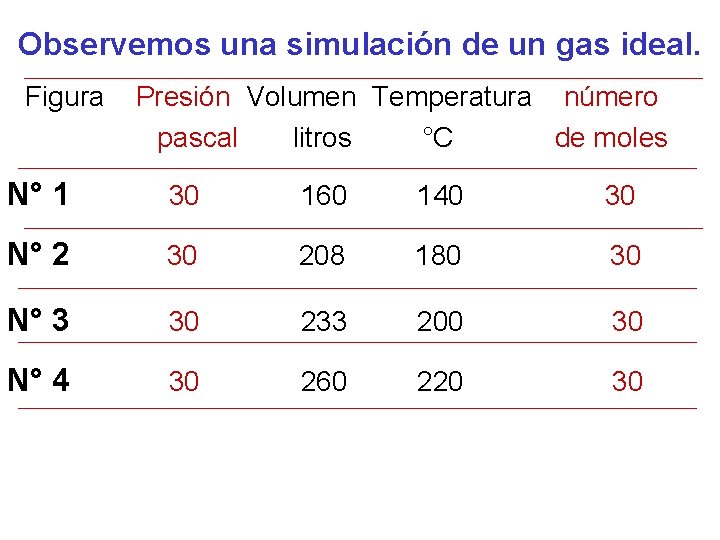
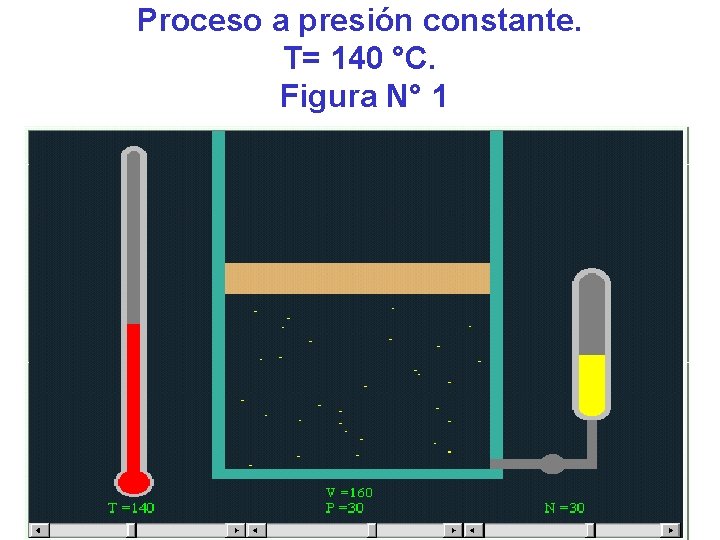
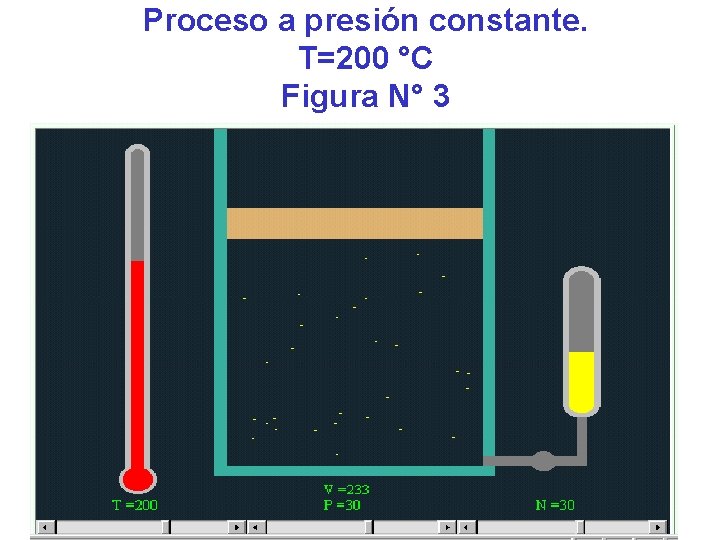
Observemos una simulación de un gas ideal. Figura Presión Volumen Temperatura número pascal litros °C de moles N° 1 30 160 140 30 N° 2 30 208 180 30 N° 3 30 233 200 30 N° 4 30 260 220 30

Proceso a presión constante. T= 140 °C. Figura N° 1

Proceso a presión constante. T=160 °C Figura N° 2

Proceso a presión constante. T=200 °C Figura N° 3

Proceso a presión constante. T=220 °C Figura N° 4


Variables de Estado de gases ideales.


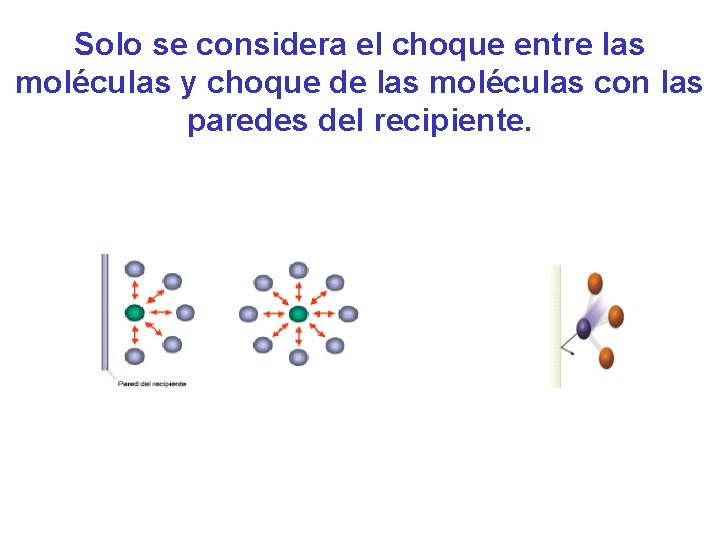
Solo se considera el choque entre las moléculas y choque de las moléculas con las paredes del recipiente.

3. - Energía interna “ΔU”. • La energía interna de un gas ideal es aquella que esta vinculada al movimiento interno de las moléculas del gas, es decir esta vinculada a la teoría cinética molecular desarrollada por Boltzmann y Maxwell: • Todo gas ideal esta compuesto por pequeñas partículas esféricas llamadas moléculas.

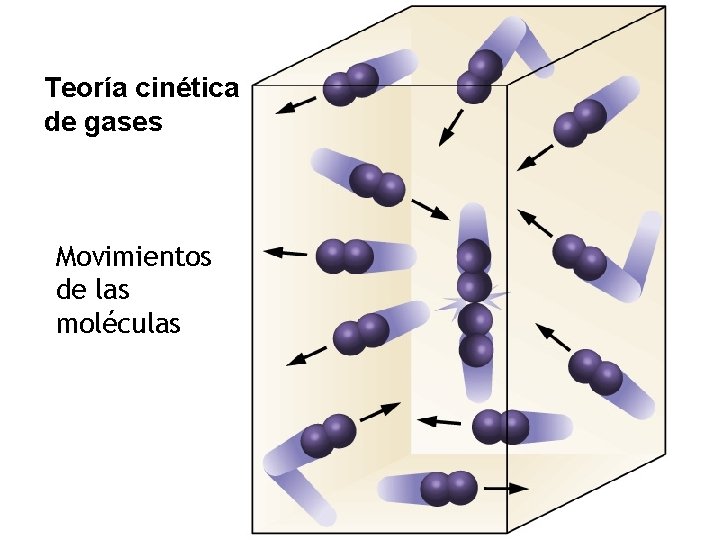
• Las moléculas se mueven en forma recta y desordenada. • Los choques de las moléculas con las paredes del recipiente ejercen una presión continua sobre él. • Los choques moleculares son perfectamente elásticos. • No se considera la atracción molecular. • La energía cinética media es proporcional a la temperatura absoluta del gas.

Energía interna “ΔU”. Teoría Cinética Presión sobre las paredes

Teoría cinética de gases Movimientos de las moléculas

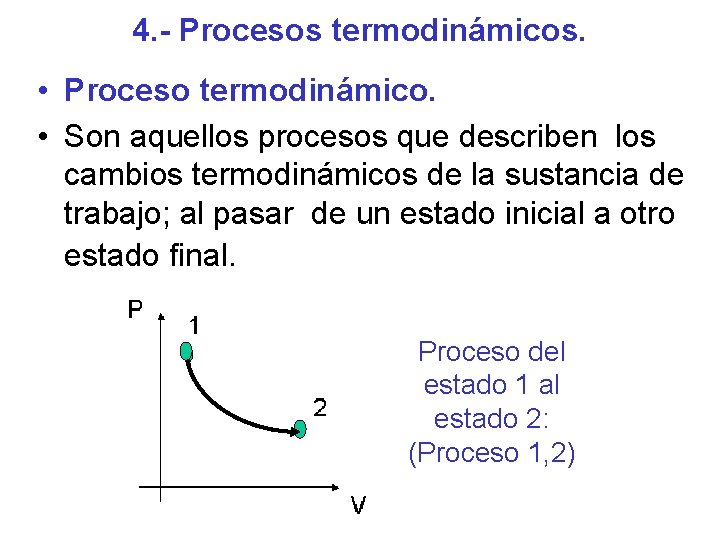
4. - Procesos termodinámicos. • Proceso termodinámico. • Son aquellos procesos que describen los cambios termodinámicos de la sustancia de trabajo; al pasar de un estado inicial a otro estado final. Proceso del estado 1 al estado 2: (Proceso 1, 2)

Los procesos termodinámicos pueden ser: • Proceso Isotérmico: A temperatura constante. • Proceso Isobárico: A presión constante. • Proceso Isométrico (Isocórico): A volumen constante. • Proceso Adiabático: No hay intercambio de calor con su entorno.


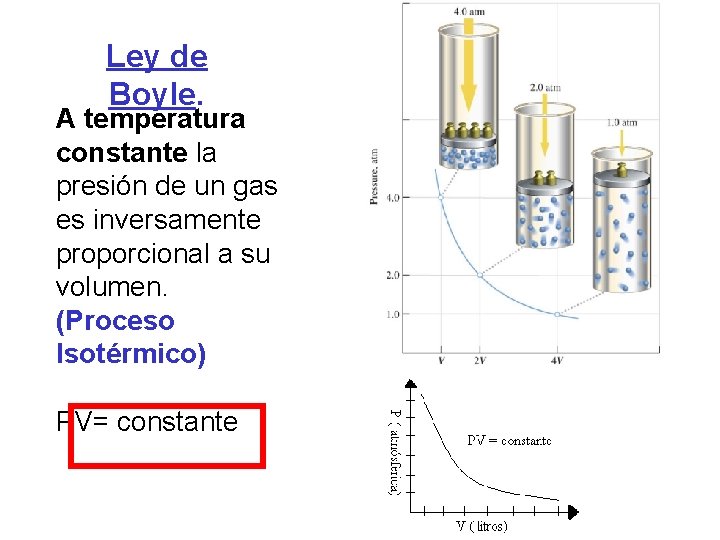
Ley de Boyle. A temperatura constante la presión de un gas es inversamente proporcional a su volumen. (Proceso Isotérmico) PV= constante

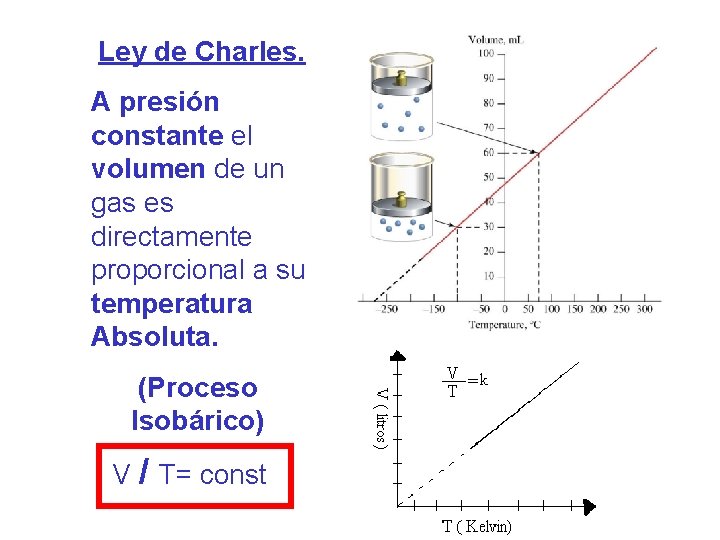
Ley de Charles. A presión constante el volumen de un gas es directamente proporcional a su temperatura Absoluta. (Proceso Isobárico) V / T= const

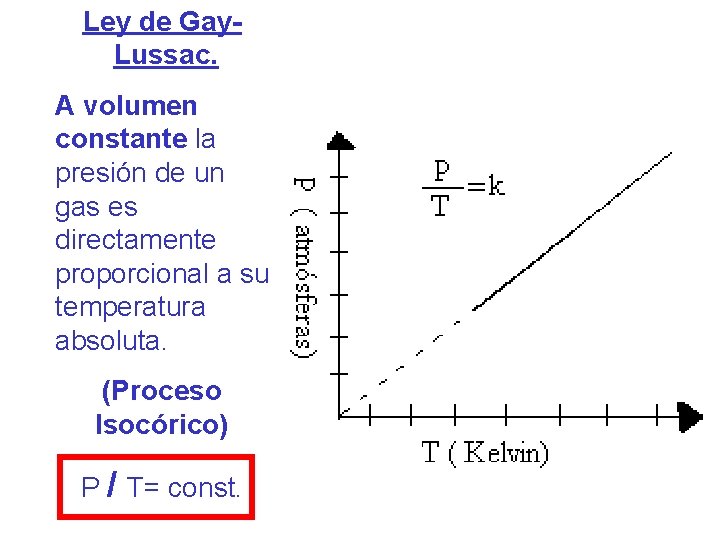
Ley de Gay. Lussac. A volumen constante la presión de un gas es directamente proporcional a su temperatura absoluta. (Proceso Isocórico) P / T= const.

Sustancia de trabajo. • Es aquella sustancia que recorre el sistema y en el cual podemos almacenar y/o extraer energía.

Ciclo termodinámico. • Es aquel fenómeno que experimenta un sistema termodinámico mediante el cual la sustancia de trabajo, luego de varios procesos, retorna a su estado original. P. e. estado 4. P. e. Ciclo 3, 4, 1. Ciclo 1, 2, 3, 4, 1.

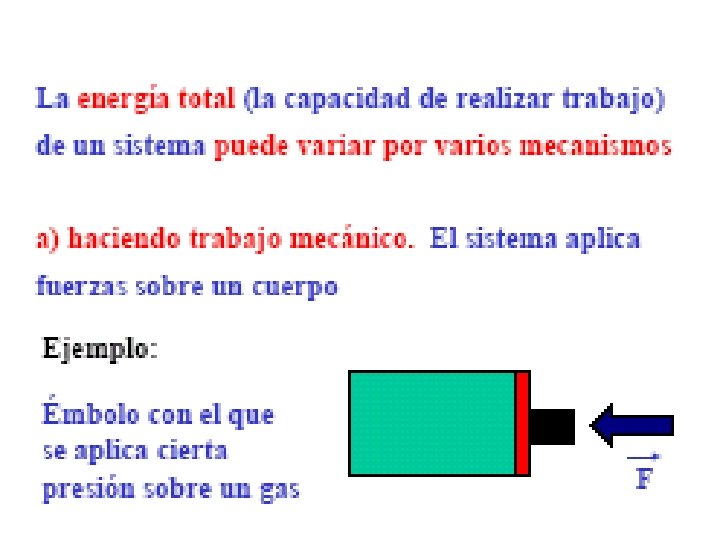
5. - Trabajo efectuado por un gas ideal. • Cuando un gas se encuentra encerrado y experimenta un proceso de expansión, se dice que realiza un trabajo sobre las paredes internas del recipiente (límites del sistema), cuyo valor dependerá del tipo del proceso. • Si este es isobárico (a presión constante) se verifica que: Wgas = p ΔV





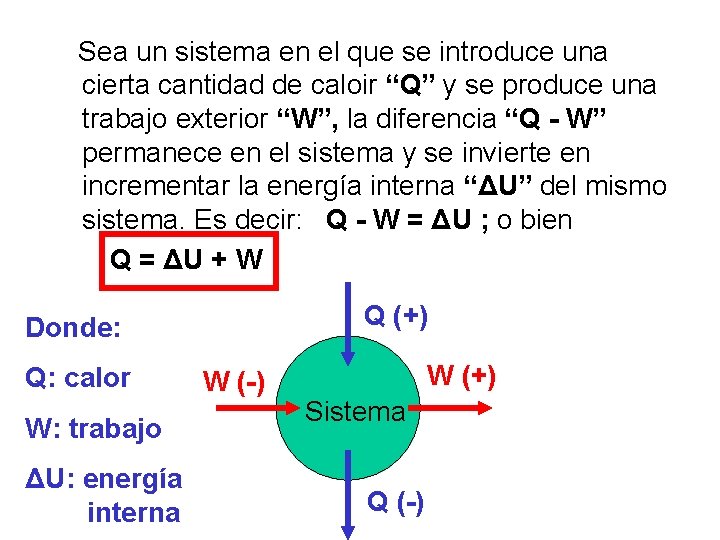
6. - Primer Principio de termodinámica. • En la transformación de cualquier tipo de energía en energía calorífica, o viceversa, la energía calorífica producida equivale exactamente a la energía transformada. Q = ΔU + W

Sea un sistema en el que se introduce una cierta cantidad de caloir “Q” y se produce una trabajo exterior “W”, la diferencia “Q - W” permanece en el sistema y se invierte en incrementar la energía interna “ΔU” del mismo sistema. Es decir: Q - W = ΔU ; o bien Q = ΔU + W Q (+) Donde: Q: calor W: trabajo ΔU: energía i interna W (-) W (+) Sistema Q (-)

7. - Máquinas térmicas. • Se denomina así a aquel sistema termodinámico cuya sustancia de trabajo, funcionando en un ciclo, nos entrega trabajo neto, a cambio de una absorción neta de calor. • En otras palabras una máquina térmica recibe calor y a cambio desarrolla trabajo, mientras realiza un ciclo termodinámico.

8. - Rendimiento de una máquina térmica “η%” (letra griega eta) • El rendimiento de una máquina térmica esta dado por la relación que existe entre el trabajo neto obtenido de la máquina y el calor suministrado a la máquina. • Es decir

9. - Máquina de Carnot (Ciclo de Carnot. ) • En 1824 el frances Sadi Carnot ideó un ciclo termodinámico que trabajando entre dos temperaturas limites, conseguía tener una eficiencia mayor que cualquier otro que trabaje entre los mismos límitres; principio que lleva su nombre: ciclo de Carnot.

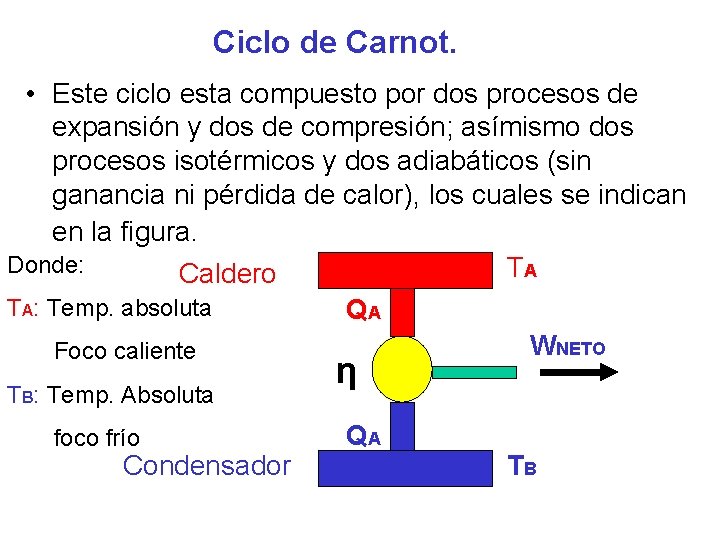
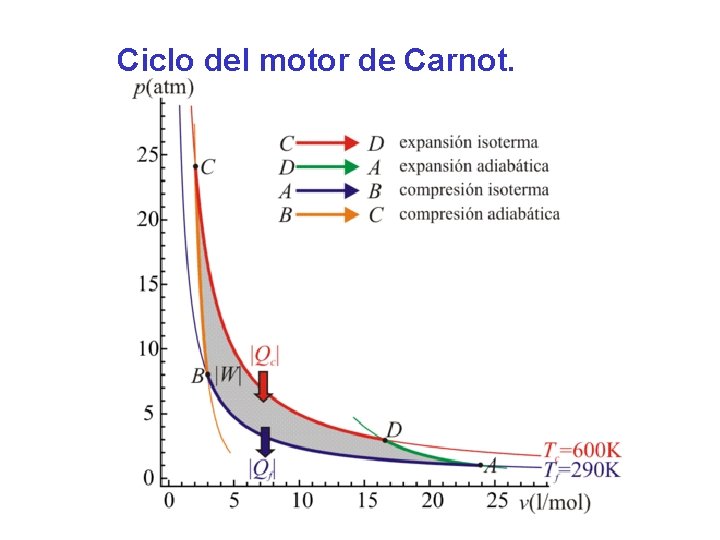
Ciclo de Carnot. • Este ciclo esta compuesto por dos procesos de expansión y dos de compresión; asímismo dos procesos isotérmicos y dos adiabáticos (sin ganancia ni pérdida de calor), los cuales se indican en la figura. Donde: TA C Caldero TA: Temp. absoluta QA WNETO Foco caliente TB: Temp. Absoluta foco frío Condensador η QA TB

Ciclo de Carnot. La eficiencia de este ciclo solo depende de las temperaturas absolutas de los focos caliente y frío y viene dado por las fórmulas: ηc = T A - T B / T A = 1 - (T B / T A ) ηc = W NETO / QSUMINISTRADO Donde: TA: Temp. Absoluta Foco caliente TB: Temp. Absoluta foco frío

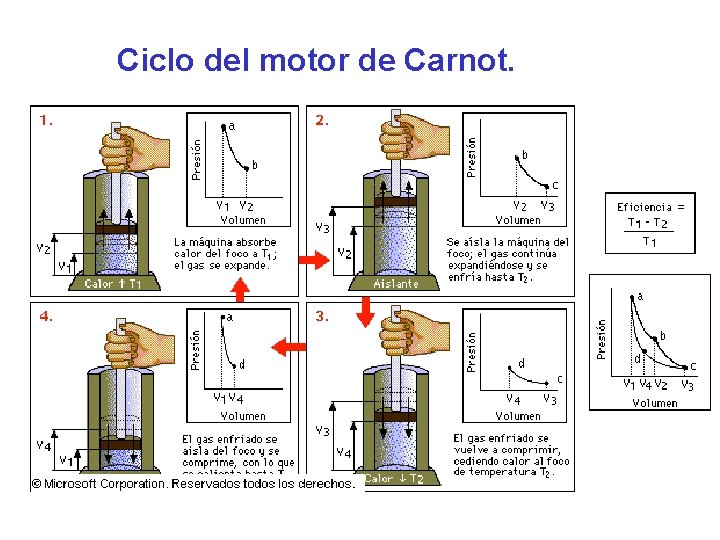
Ciclo del motor de Carnot.

Ciclo del motor de Carnot.

Ciclo del motor de Carnot.

10. -Segundo principio de termodinámica. • El calor se proparaga de manera natural de las zonas de alta tempertatura hacia las zonas de baja temperatura. • Asimismo esta principio aplicado a máquinas térmicas tiene los siguientes enunciados:

1. - En una máquina térmica es imposible que durante un ciclo, el calor suministrado se convierta integramente en trabajo. 2. - No es posible construir una máquinba o dispositivo físico que opere continuamente en un ciclo, recibiendo calor de una sola fuente y produciendo una cantidad equivalente de trabajo. 3. - Es imposible que exista una máquina 100 % eficiente.

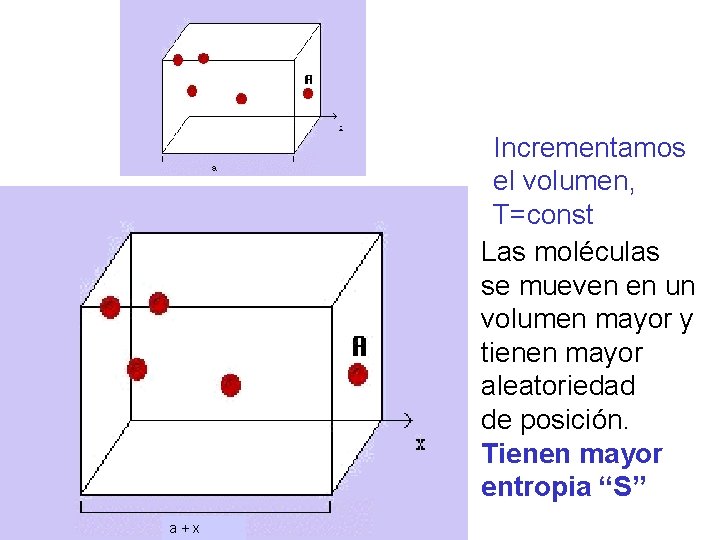
11. - Entropía “S”. • La entropía es una medida cuantitativa del desorden. • Consideremos una expansión isotérmica infinitecimal de un gas ideal; agreguemos calor d. Q y dejamos que el gas se expanda un volúmen d. V apenas lo suficiente para mantener constante la temperatura.

Incrementamos el volumen, T=const Las moléculas se mueven en un volumen mayor y tienen mayor aleatoriedad de posición. Tienen mayor entropia “S” a+x

Entropía “S”. • Dado que la energía interna U del gas ideal solo depende de la temperatura, entonces U también será constante. • Por el primer principio de termodinámica (Q = ΔU + W) , el trabajo d. W efectuado por el gas es igual al calor d. Q agregado; es decir: d. Q = d. W = (P) d. V = (n. RT / V) d. V; entonces d. Q = (n. RT / V) d. V luego (d. V / V) = d. Q / n. RT = (d. Q / T) (1 / RT)

Entropía “S”. (d. V / V) = (d. Q / T) (1 / RT) Observamos que la variación del volúmen d. V sobre el volúmen V, es directamente proporcional a la variación del calor suministrado d. Q sobre la temperatura absoluta T, a lo que llamaremos entropia “S”.

Entropía “S”. • Entonces el gas esta en un estado mas desordenado después de la expansión, porque las moléculas se mueven en un volumen mayor y tienen mayor aleatoriedadde posición. • Por tanto el cambio fraccionado del volumen d. V/V es una medida del aumento del desorden; y la ecuación anterior indica que es proporcional a d. Q / T (que llamamos entropia S)

Resumen de Entropía “S”. • Si se agrega un calor total “Q” a un sistema termodinámico, durante un proceso isotérmico reversible, a una temperartura absoluta “T”; entonces el cambio de entropía total “ΔS” será ΔS = S 2 – S 1 ; y esta dado por ΔS = S 2 – S 1 = = Q / T Proceso isotérmico reversible. Unidades: J / °K (Joul sobre grado Kelvin) Q/T: es una característica apropiada del aumento de aleatoriedad o desorden cuando hay flujo de calor hacia el sistema
