REACCIONES QUMICAS Oxidacin reduccin Pilas Fsica y Qumica

































- Slides: 44

REACCIONES QUÍMICAS Oxidación – reducción. Pilas Física y Química 4º ESO: guía interactiva para la resolución de ejercicios I. E. S. Élaios Departamento de Física y Química

ïOxidación reducción Índice ï ï ï ï ï Ejercicio Ejercicio Ejercicio Ejercicio Ejercicio 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 º Electrólisis y pilas º º º º Ejercicio Ejercicio Ejercicio Ejercicio I. E. S. Élaios Departamento de Física y Química 19 20 21 22 23 24 25 26 27 28 29 30 31 32

Ayuda Una reacción de oxidación se definió como aquella en la que una sustancia se combinaba con el oxígeno, como sucede con las dos reacciones siguientes: Una reacción de reducción era aquella en la que un óxido metálico se convertía en metal dejando de estar combinado con el oxígeno, como sucede con las reacciones siguientes: Sin embargo, la definición de ambos tipos de reacciones por separado no tiene sentido, puesto que si nos fijamos, por ejemplo, en la reacción siguiente, vemos que el aluminio se oxida al mismo tiempo que el cromo se reduce: Por lo tanto un proceso de reducción siempre va acompañado por un proceso de oxidación, como se puede comprender también en los anteriores ejemplos de procesos de reducción. En los procesos de oxidación mostrados también sucede lo mismo, pero lo aclararemos más adelante. I. E. S. Élaios Departamento de Física y Química

Ayuda Por los conocimientos de la estructura de la materia sabemos que la reacción de formación del óxido de magnesio conduce a la formación de una red cristalina iónica con iones Mg 2+ y O 2 -, de forma que se puede escribir: Cada átomo de magnesio cede dos electrones y se transforma en un ion magnesio con dos cargas positivas. No obstante eso es lo mismo que le sucede al magnesio si reacciona con el cloro, formando una red cristalina iónica de cloruro de magnesio: Incluso en una reacción entre el magnesio metálico y una disolución de Cu. SO 4, que en forma iónica se escribe como: cada átomo de magnesio cede dos electrones y se transforma en un ion Mg 2+ que, en lugar de estar en una red cristalina, se encuentra en disolución. No existe ninguna razón para diferenciar lo que le sucede al magnesio en cada una de las reacciones anteriores, en todas las cuales cede dos electrones. En consecuencia la definición general de oxidación es: Una sustancia se oxida cuando pierde electrones I. E. S. Élaios Departamento de Física y Química

Ayuda Del mismo modo, si detallamos la reducción del óxido de cobre (II), que es también una sustancia iónica: Observamos que el ion Cu 2+ gana dos electrones en la reacción que hemos clasificado como reducción desde el punto de vista clásico, que es exactamente lo mismo que le sucede cuando reacciona con el magnesio, tal como hemos visto anteriormente: Lo mismo diríamos si se obtiene cobre a partir de una disolución de Cu. SO 4 En consecuencia, se define la reducción como: Una sustancia se reduce cuando gana electrones Si a todo esto añadimos que para que una sustancia gane electrones otra tiene que cederlos, encontramos el significado de la afirmación de la primera Ayuda en el sentido de que no existen reacciones de oxidación o de reducción por separado, sino que todo proceso de oxidación debe ir acompañado de otro de reducción, es decir que las reacciones en las que hay intercambio de electrones son procesos de oxidación y de reducción, que suelen denominarse abreviadamente como reacciones o procesos redox. La sustancia que se oxida provoca la reducción de la que se reduce, y se denomina reductor. La sustancia que se reduce provoca la oxidación de la que se oxida, y se denomina oxidante. I. E. S. Élaios Departamento de Física y Química

Ayuda – Los metales como reductores Sabemos desde el estudio de la formulación que los números de oxidación de los metales son positivos, lo que significa que tienen tendencia a ceder electrones, es decir, a oxidarse y son, por tanto, agentes reductores. Sin embargo no todos son igualmente reductores. Supongamos los tres metales, sodio, hierro y plata; si se trata de hacerlos reaccionar con el oxígeno, se encuentran los siguientes resultados: El sodio se oxida inmediatamente en contacto con el aire, el hierro se oxida lentamente, mientras que la plata no se oxida. Como al oxidarse un elemento actúa como reductor, se dice que el sodio es más reductor que el hierro y este más que la plata, como se verá más adelante. Las reacciones de dichos metales con el ácido clorhídrico son las siguientes: Estas reacciones muestran que el sodio y el hierro reducen al hidrógeno (porque este los oxida), mientras que no lo hace la plata. En la próxima ayuda veremos como se pueden clasificar los metales por su poder reductor. Los metales más reductores son los más reactivos. I. E. S. Élaios Departamento de Física y Química

Ayuda – Los metales como reductores La ordenación de los metales por su poder reductor se hace mediante reacciones como las siguientes. Si se introduce un trozo de cinc en una disolución de sulfato de cobre (II) de color azul, se observa que el color de la disolución disminuye y el trozo de cinc, cuya masa disminuye, se recubre de cobre metálico de color. Esto puede explicarse por la reacción: El cinc se oxida y el cobre se reduce, lo que indica que el cinc es más reductor que el cobre. Una reacción similar tiene lugar entre el hierro o el magnesio y una disolución de sulfato de cobre (II). Si se introduce un trozo de cobre en una disolución de sulfato plata incolora, se observa que el color de la disolución se vuelve azul y el trozo de cobre, cuya masa disminuye, se recubre de plata metálica. Esto puede explicarse por la reacción: El cobre se oxida y la plata se reduce, lo que indica que el cobre es más reductor que la plata. Con experiencias de este tipo, complementadas con las del tipo señaladas en la ayuda anterior, se puede hacer una clasificación de los metales y del hidrógeno ordenándolos por su poder reductor. La tabla se muestra en la ayuda siguiente, I. E. S. Élaios Departamento de Física y Química

Ayuda – Los metales como reductores Mas reductor Menos reductor Potasio K(s) K+(aq) + e- Calcio Ca(s) Ca 2+(aq) + 2 e- Sodio Na(s) Na+(aq) + e- Magnesio Mg(s) Mg 2+(aq) + 2 e- Aluminio Al(s) Al 3+(aq) + 3 e- Cinc Zn(s) Zn 2+(aq) + 2 e- Hierro Fe(s) Fe 2+(aq) + 2 e- Plomo Pb(s) Pb 2+(aq) + 2 e- Hidrógeno H(s) H+(aq) + e- Cobre Cu(s) Cu 2+(aq) + 2 e- Plata Ag(s) Ag+(aq) + e- Oro Au(s) Au 3+(aq) + 3 e- I. E. S. Élaios Departamento de Física y Química

Ayuda – Los no metales como oxidantes De la misma forma que se determinó el poder reductor de los metales, y por tanto su reactividad, se puede determinar el poder oxidante y la reactividad de los no metales observando el comportamiento de los no metales frente a disoluciones de compuestos metálicos, como en la siguiente reacción: En esta reacción el yodo se reduce, su número de oxidación pasa de 0 a -1, mientras que el azufre se oxida, su número de oxidación pasa de -2 a 0. El yodo es más oxidante que el azufre. La siguiente reacción muestra que el cloro es más oxidante que el bromo, como es fácil de razonar: Reacciones de este tipo permiten hacer la clasificación que se muestra en la siguiente tabla: Más oxidante Cloro Cl 2(g) + 2 e- 2 Cl-(aq) Oxígeno O 2(g) + 4 e- 2 O 2 -(aq) Bromo Br 2(g) + 2 e- 2 Br-(aq) Yodo Menos oxidante Azufre I 2(g) + 2 e- 2 I-(aq) S 2(g) + 4 e- 2 S 2 -(aq) I. E. S. Élaios Departamento de Física y Química

Ayuda – Conductores y aislantes Un conductor es toda sustancia que permite el paso de la corriente eléctrica; para que una sustancia sea conductora es preciso que posea cargas que se puedan mover. Hay dos clases de conductores: los metales y las disoluciones de electrólitos. Las cargas móviles en los metales son electrones. Un electrólito es toda sustancias que fundida o disuelta en agua proporciona iones que se pueden mover y, por tanto, permite el paso de la corriente eléctrica. Un electrólito fundido o disuelto se descompone al paso de la corriente eléctrica en un proceso que se denomina electrólisis. Las dos figura siguientes muestran los montajes para detectar la conductividad de una sustancia: I. E. S. Élaios Departamento de Física y Química

Ayuda – Explicación de la electrólisis La figura adjunta muestra cómo se explica la electrólisis de una sal fundida, concretamente el cloruro de sodio fundido. Dado que existe un solo tipo de iones de cada signo, esos son los que necesariamente se descargarán: Na+ + 1 e- Na(s) Reacción catódica 2 Cl- Cl 2(g) +2 e- Reacción anódica En el cátodo se verifica la reducción de los iones Na+ y en el ánodo la reducción de los iones Cl-. En las electrólisis de disoluciones es más difícil predecir que ion se descarga y que producto se obtiene, puesto que a los iones de la sal se añaden iones del agua, y es mucho más complicado predecir los productos de la electrólisis. Así por ejemplo, nunca se descargan en el ánodo los iones NO 3 - ni los iones SO 42 -, sino que se forma oxígeno que proviene del agua, y se obtiene hidrógeno y no el metal que forma parte de la sal si dicho metal es muy reactivo. I. E. S. Élaios Departamento de Física y Química

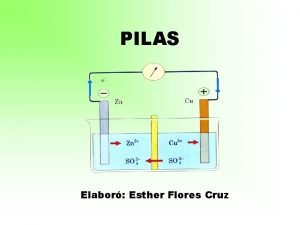
Ayuda – Pilas electroquímicas y pilas secas. Una pila electroquímica es un dispositivo que proporciona energía eléctrica mediante una reacción química. La primera pila electroquímica fue inventada por Volta en 1793, y se muestra en la figura adjunta. En el ánodo o borne negativo de la pila se produce la reacción: Zn(s) Zn 2+(aq) + 2 e-. En el cátodo o borne positivo la reacción que se produce es: 2 H+(aq) + 2 e- H 2(g). Existe una gran variedad de pilas electroquímicas. Las pilas de uso práctico, como la pila de cinc-carbono, o pila Leclanché, tiene un funcionamiento similar, aunque el electrólito es una masa pastosa encerrada dentro de una caja formada por el propio electrodo negativo, que se puede utilizar en cualquier posición. Se muestra su esquema en la figura inferior. I. E. S. Élaios Departamento de Física y Química

1 Indica cuáles de las siguientes ecuaciones químicas representan reacciones de oxidación y reacciones de reducción, de acuerdo con la definición que encontrarás en la Ayuda. (a) Reacción de oxidación (c) Reacción de reducción (d) Reacción de oxidación (e) Reacción de reducción (f) Reacción de reducción I. E. S. Élaios Departamento de Física y Química

Este ejercicio es el mismo que el anterior, pero con el concepto de oxidación reducción ampliado que debes estudiar en las Ayudas. 2 (i) Indica cuáles de las siguientes ecuaciones químicas representan reacciones redox. (ii) Indica el oxidante y el reductor en cada reacción redox. Contesta al apartado (i) Son reacciones redox las representadas por las ecuaciones químicas (a), (c), (d), (e) y (f) Contesta al apartado (ii) (a) Oxidante el oxígeno y reductor el hierro (c) Oxidante el óxido de hierro (II) y reductor el carbono (d) Oxidante el oxígeno y reductor el sodio (e) El agua es el oxidante y el reductor (f) Oxidante el óxido de cinc y reductor el carbono. I. E. S. Élaios Departamento de Física y Química

3 (i) Indica cuáles de las siguientes ecuaciones químicas representan reacciones redox. (ii) Indica el oxidante y el reductor en cada reacción redox. Contesta al apartado (i) Son reacciones redox las representadas por las ecuaciones químicas (b), (e) y (f). Contesta al apartado (ii) (b) Oxidante la plata y reductor el mercurio. (e) Oxidante el cloro y reductor el sodio. (f) Oxidante el cloro y reductor el yodo. I. E. S. Élaios Departamento de Física y Química

4 Indica la sustancia que se oxida y la que se reduce en las reacciones químicas cuyas ecuaciones se indican. Contesta al enunciado (a) (b) (c) (d) (e) Se Se Se oxida oxida el el el monóxido de carbono y se reduce el oxígeno. monóxido de carbono y se reduce el óxido de plomo (II). hidrógeno y se reduce el azufre. sulfuro de plomo (II) y se reduce el peróxido de hidrógeno (H 2 O 2). sulfuro de hidrógeno y se reduce el dióxido de azufre. I. E. S. Élaios Departamento de Física y Química

5 (i) ¿Cuáles de las siguientes ecuaciones químicas representan reacciones redox? (ii) En las ecuaciones redox indica el oxidante y el reductor Contesta al apartado (i) Son reacciones redox las representadas por las ecuaciones químicas (b), (d) y (e). Contesta al apartado (ii) (b) Oxidante el óxido de cobre (II) y reductor el amoniaco. (d) Oxidante el ácido sulfúrico y reductor el magnesio. (e) Oxidante el óxido de manganeso (IV) y reductor el ácido clorhídrico. I. E. S. Élaios Departamento de Física y Química

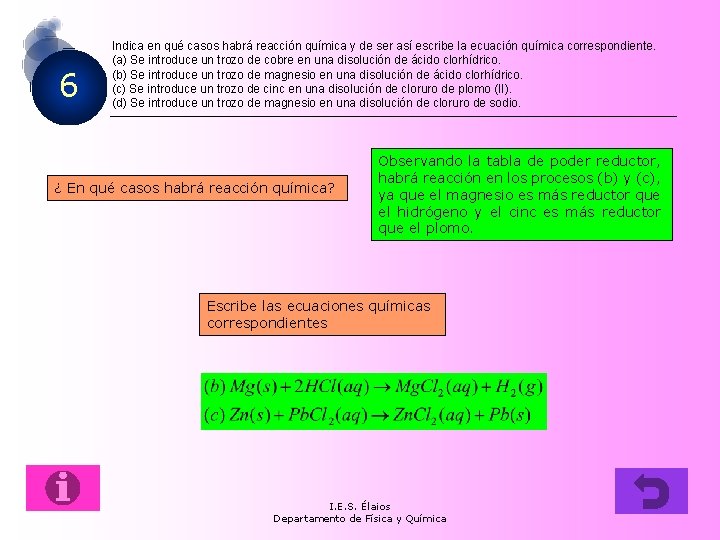
6 Indica en qué casos habrá reacción química y de ser así escribe la ecuación química correspondiente. (a) Se introduce un trozo de cobre en una disolución de ácido clorhídrico. (b) Se introduce un trozo de magnesio en una disolución de ácido clorhídrico. (c) Se introduce un trozo de cinc en una disolución de cloruro de plomo (II). (d) Se introduce un trozo de magnesio en una disolución de cloruro de sodio. ¿ En qué casos habrá reacción química? Observando la tabla de poder reductor, habrá reacción en los procesos (b) y (c), ya que el magnesio es más reductor que el hidrógeno y el cinc es más reductor que el plomo. Escribe las ecuaciones químicas correspondientes I. E. S. Élaios Departamento de Física y Química

7 El metal sodio se guarda sumergido en éter de petróleo, en lugar de estar dentro de un bote cerrado al aire como la mayoría de los reactivos. ¿Qué explicación darías a este hecho? El sodio es un metal muy reactivo, es muy reductor, y reacciona rápidamente con el oxígeno del aire. Dado que los botes de los reactivos se cierran llenos de aire se produciría la oxidación inmediata del sodio, al menos en su superficie, hasta que no quedase más oxígeno. Este proceso se repetiría cada vez que se abriese el bote. Tenerlo sumergido en éter de petróleo, con el cual el sodio no reacciona, evita su contacto con el oxígeno del aire. I. E. S. Élaios Departamento de Física y Química

8 Indica en qué casos habrá reacción química y escribe la ecuación química correspondiente. (a) Se introduce un trozo de plata en una disolución de ácido clorhídrico. (b) Se introduce un trozo de calcio en una disolución de ácido clorhídrico. (c) Se introduce un trozo de hierro en una disolución de cloruro de cobre (II). ¿ En qué casos habrá reacción química? Observando la tabla de poder reductor, habrá reacción en los procesos (b) y (c), ya que el calcio es más reductor que el hidrógeno y el hierro es más reductor que el cobre. Escribe las ecuaciones químicas correspondientes I. E. S. Élaios Departamento de Física y Química

9 Indica en qué casos habrá reacción química y escribe la ecuación química correspondiente. (a) Se hace burbujear cloro a través de una disolución de yoduro de potasio. (b) Se introduce un trozo de yodo en una disolución de cloruro de sodio. ¿ En qué casos habrá reacción química? Observando la tabla de poder oxidante habrá reacción en el proceso (a), ya que el cloro es más oxidante que el yodo. No habrá reacción en el proceso (b) por la misma razón. Escribe la ecuación química correspondiente. I. E. S. Élaios Departamento de Física y Química

10 Indica en qué casos habrá reacción química y escribe la ecuación química correspondiente. (a) Se introduce un trozo de hierro en una disolución de ácido clorhídrico. (b) Se introduce un trozo de oro en una disolución de ácido clorhídrico. (c) Se introduce un trozo de plomo en una disolución de nitrato de plata. (d) Se introduce un trozo de yodo en una disolución de sulfuro de sodio. (e) Se hace burbujear cloro a través de una disolución de bromuro de potasio. ¿ En qué casos habrá reacción química? Para los apartados (a), (b) y (c) hay que acudir a la tabla de poder reductor, de la que se deduce que se verificarán reacciones en los apartados (a) y (c), puesto que el hierro es más reductor que el hidrógeno y el plomo es más reductor que la plata; no habrá reacción en el proceso (b) puesto que el hidrógeno es más reductor que el oro. La tabla de poder oxidante será necesaria para los apartados (d) y (e), que se verificarán ambos puesto que el yodo es más oxidante que el azufre y el cloro es más oxidante que el bromo. Escribe las ecuaciones químicas correspondientes. I. E. S. Élaios Departamento de Física y Química

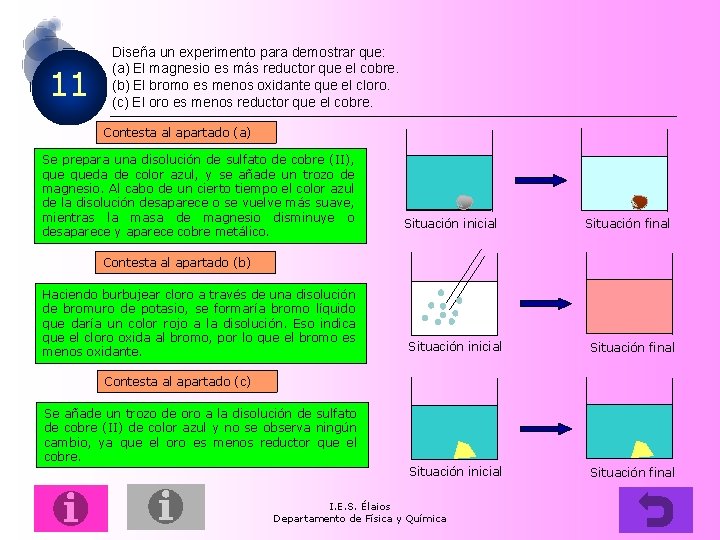
11 Diseña un experimento para demostrar que: (a) El magnesio es más reductor que el cobre. (b) El bromo es menos oxidante que el cloro. (c) El oro es menos reductor que el cobre. Contesta al apartado (a) Se prepara una disolución de sulfato de cobre (II), queda de color azul, y se añade un trozo de magnesio. Al cabo de un cierto tiempo el color azul de la disolución desaparece o se vuelve más suave, mientras la masa de magnesio disminuye o desaparece y aparece cobre metálico. Situación inicial Situación final Contesta al apartado (b) Haciendo burbujear cloro a través de una disolución de bromuro de potasio, se formaría bromo líquido que daría un color rojo a la disolución. Eso indica que el cloro oxida al bromo, por lo que el bromo es menos oxidante. Situación inicial Situación final Contesta al apartado (c) Se añade un trozo de oro a la disolución de sulfato de cobre (II) de color azul y no se observa ningún cambio, ya que el oro es menos reductor que el cobre. I. E. S. Élaios Departamento de Física y Química

12 Razona si las siguientes afirmaciones son verdaderas o falsas: (a) El cobre es más reductor que el cinc. (b) El cinc es más reductor que el plomo. (c) El hidrógeno es más reductor que el magnesio. (d) El hidrógeno es más reductor que la plata. Explica en qué te basarás para responder a las afirmaciones. En la tabla del poder reductor de los metales (incluyendo el hidrógeno) que es también una medida de la reactividad de los mismos. Contesta globalmente a los cuatro apartados. (a) (b) (c) (d) Es Es falsa puesto que el cobre está por debajo del cinc en la tabla de poder reductor. verdadera puesto que el cinc está por encima del plomo en la tabla. falsa puesto que el hidrógeno está por debajo del magnesio en la tabla. verdadera porque el hidrógeno está por encima de la plata en la tabla. I. E. S. Élaios Departamento de Física y Química

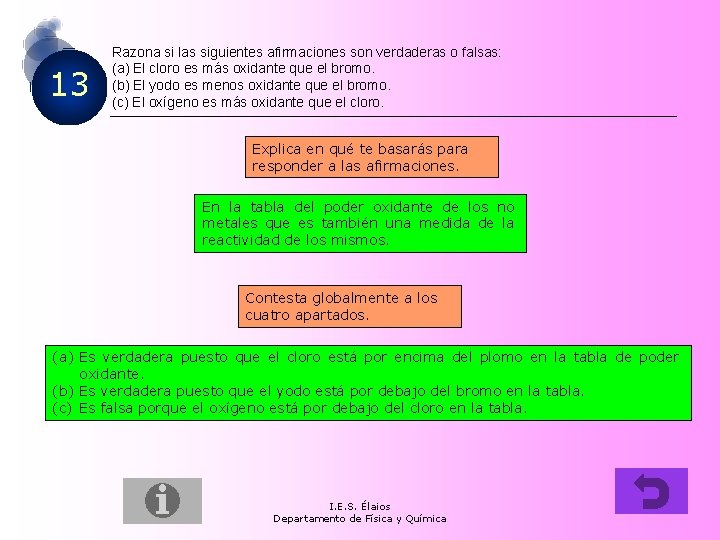
13 Razona si las siguientes afirmaciones son verdaderas o falsas: (a) El cloro es más oxidante que el bromo. (b) El yodo es menos oxidante que el bromo. (c) El oxígeno es más oxidante que el cloro. Explica en qué te basarás para responder a las afirmaciones. En la tabla del poder oxidante de los no metales que es también una medida de la reactividad de los mismos. Contesta globalmente a los cuatro apartados. (a) Es verdadera puesto que el cloro está por encima del plomo en la tabla de poder oxidante. (b) Es verdadera puesto que el yodo está por debajo del bromo en la tabla. (c) Es falsa porque el oxígeno está por debajo del cloro en la tabla. I. E. S. Élaios Departamento de Física y Química

14 Razona si las siguientes afirmaciones son verdaderas o falsas: (a) Las sales de sodio son poco oxidantes. (b) Los yoduros son más reductores que los cloruros. Contesta al apartado (a) La respuesta es verdadera, ya que si el sodio es muy reductor quiere decir que tiene mucha tendencia a estar oxidado, lo que significa que no tiende a reducirse, que sería cuando actuara como oxidante. Esto puede verse en la siguiente reacción: en la que se observa que el sodio reduce al hierro. Sin embargo la reacción opuesta no se verifica, ya que si lo hiciese significaría que el ion Na+ sería capaz de oxidar al hierro, lo que no sucede en la realidad. Contesta al apartado (b) Decir que los yoduros son más reductores que los cloruros equivale a decir que el cloro es más oxidante que el yodo, lo que se muestra en la siguiente reacción: I. E. S. Élaios Departamento de Física y Química

15 Tenemos una disolución que contiene nitrato de cinc y nitrato de plomo (II)). (a) ¿Qué procedimiento se puede utilizar para separar únicamente el plomo metálico. (b) Si a la disolución original se le añade un trozo de cinc, ¿qué sucedería? Contesta al apartado (a) Contesta al apartado (b) Una disolución de nitrato de cinc y de nitrato de plomo (II) contiene iones Zn 2+ y Pb 2+. Para precipitar un metal de una disolución de un compuesto de dicho metal hay que añadir un metal que lo reduzca, es decir, que sea más reductor que el metal que se quiere obtener. Cualquier metal que esté por encima del plomo precipitará plomo de la disolución. Si sólo se quiere precipitar el plomo y no el cinc hay que utilizar un metal comprendido entre ambos en la tabla de reactividad. El metal adecuado es el hierro. Si se añadiese un trozo de cinc precipitaría únicamente el plomo, pero como no se puede saber la cantidad de cinc necesaria, el plomo quedaría mezclado con el exceso de cinc y no estarían separados. O lo que es lo mismo, el plomo estaría impurificado con cinc. I. E. S. Élaios Departamento de Física y Química

16 Cuando se introduce un cuchillo en el agua procedente de las minas de Riotinto (donde se obtienen minerales de cobre) éste queda recubierto por una capa rojiza de cobre metálico. (a) ¿Qué ha sucedido? (b) Escribe la ecuación química correspondiente. Contesta al apartado (a) El cobre precipita de la disolución de sales de cobre que contiene el agua de las minas. Para que esto suceda, el metal del que está constituido fundamentalmente el cuchillo, que es el hierro, ha reducido al ion Cu 2+ a cobre metálico. La ecuación iónica que ha tenido lugar es: Contesta al apartado (b) I. E. S. Élaios Departamento de Física y Química

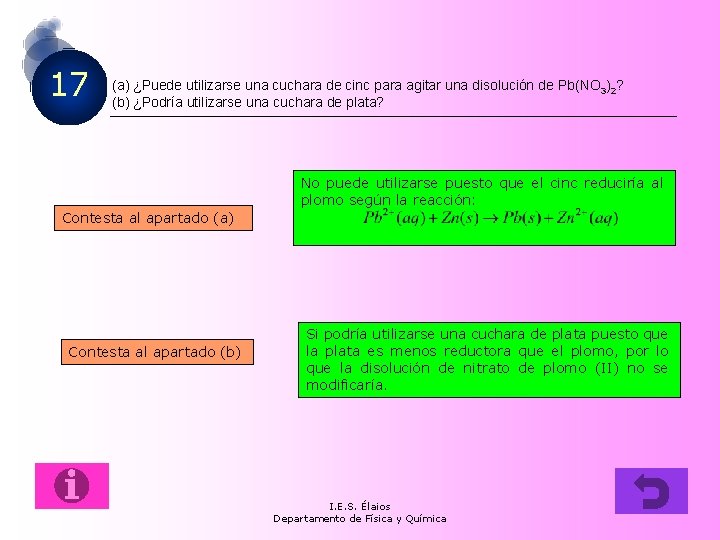
17 (a) ¿Puede utilizarse una cuchara de cinc para agitar una disolución de Pb(NO 3)2? (b) ¿Podría utilizarse una cuchara de plata? No puede utilizarse puesto que el cinc reduciría al plomo según la reacción: Contesta al apartado (a) Contesta al apartado (b) Si podría utilizarse una cuchara de plata puesto que la plata es menos reductora que el plomo, por lo que la disolución de nitrato de plomo (II) no se modificaría. I. E. S. Élaios Departamento de Física y Química

18 Se introduce un trozo de metal desconocido en una disolución de Cu. SO 4 y el color de la disolución se mantiene sin modificación. ¿De qué metal puede tratarse? Escribe tu respuesta y haz clic para comprobarla. Que el color de la disolución no varíe significa que la concentración del ion Cu 2+, que es el responsable de la tonalidad azul, permanece constante. Cualquier metal que sea menos reductor que el cobre cumpliría la condición del ejercicio, es decir, cualquier metal que esté por debajo del cobre en la tabla de reactividad. En nuestra tabla encontramos la plata y el oro. I. E. S. Élaios Departamento de Física y Química

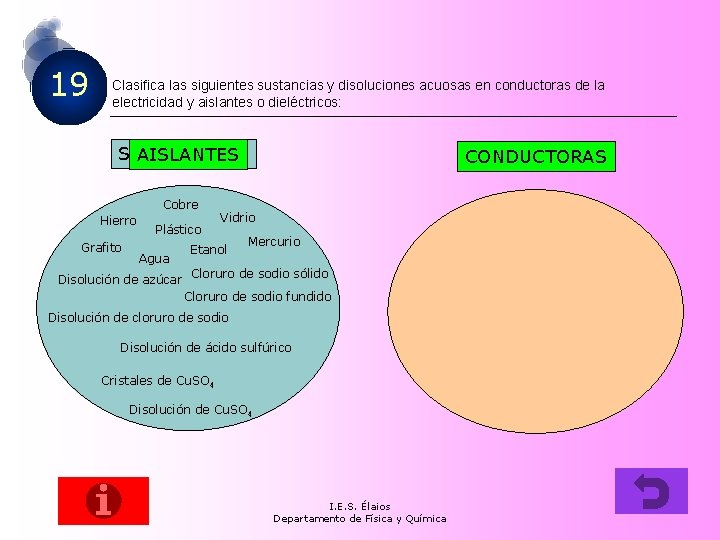
19 Clasifica las siguientes sustancias y disoluciones acuosas en conductoras de la electricidad y aislantes o dieléctricos: SUSTANCIAS AISLANTES Cobre Hierro Grafito Plástico Agua Disolución de azúcar CONDUCTORAS Vidrio Etanol Mercurio Cloruro de sodio sólido Cloruro de sodio fundido Disolución de cloruro de sodio Disolución de ácido sulfúrico Cristales de Cu. SO 4 Disolución de Cu. SO 4 I. E. S. Élaios Departamento de Física y Química

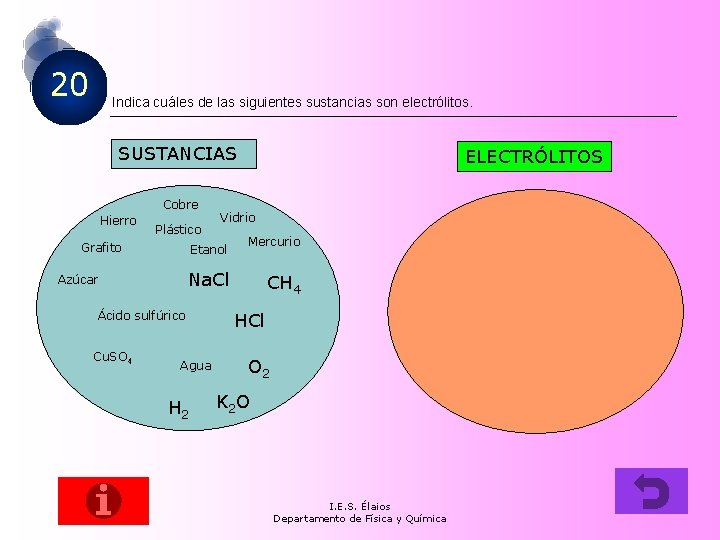
20 Indica cuáles de las siguientes sustancias son electrólitos. SUSTANCIAS Cobre Hierro Plástico Grafito Vidrio Etanol Mercurio Na. Cl Azúcar Ácido sulfúrico Cu. SO 4 ELECTRÓLITOS Agua H 2 CH 4 HCl O 2 K 2 O I. E. S. Élaios Departamento de Física y Química

21 (a) ¿Por qué el agua del grifo es conductora de la electricidad? (b) ¿Por qué no es conductora una disolución de azúcar? Contesta al apartado (a) El agua del grifo es conductora porque contiene sales disueltas, en mayor o menor proporción. Concretamente existen ciudades en España, tales como Zaragoza, Sabadell o Tarragona que tienen un elevado contenido en sales disueltas. Contesta al apartado (b) Una disolución de azúcar no es conductora porque el azúcar no es un electrólito, es decir, no proporciona iones al disolverse en agua; las partículas de azúcar dispersas en el agua son moléculas neutras I. E. S. Élaios Departamento de Física y Química Recuerda que el agua pura no es buena conductora

22 Haz un esquema del montaje que utilizarías para electrolizar un electrólito fundido o disuelto. Indica el nombre de cada parte del montaje y haz una descripción corta de cada parte. Dibuja el esquema Describe cada parte Batería: es una fuente de corriente continua; puede ser una pila, pilas en serie o una fuente de alimentación. Electrólito: es una sal fundida o una disolución en agua de un ácido, un hidróxido o una sal. Electrodos: son barras conductoras inertes sumergidas en el electrólito. El ánodo es el electrodo conectado al borne positivo de la pila, y el cátodo es el electrodo conectado al borne negativo I. E. S. Élaios Departamento de Física y Química

23 ¿Qué productos esperas obtener en el ánodo y en el cátodo con cada una de las siguientes electrólisis: (a) Bromuro de sodio fundido (b) Cloruro de calcio fundido (c) Yoduro de plomo (II) fundido Contesta al apartado (a) Se obtienen sodio y bromo mediante las siguientes reacciones en los electrodos: Ánodo: 2 Br- Br 2(l) + 2 e. Cátodo: Na+ + 1 e- Na(s) Contesta al apartado (b) Se obtienen calcio y cloro mediante las siguientes reacciones en los electrodos: Ánodo: 2 Cl- Cl 2(g) + 2 e. Cátodo: Ca 2+ + 2 e- Ca(s) Contesta al apartado (c) Se obtienen plomo e yodo mediante las siguientes reacciones en los electrodos: Ánodo: 2 I- I 2(s) + 2 e. Cátodo: Pb 2+ + 2 e- Pb(s) I. E. S. Élaios Departamento de Física y Química

24 (a)¿Qué esperas que se obtenga en el cátodo si se electroliza una disolución de nitrato de plata? (b) ¿Qué se obtendría en el cátodo si la disolución fuese de nitrato de magnesio? Contesta al apartado (a) Contesta al apartado (b) En el cátodo se produce una reducción de los iones positivos, que para el nitrato de plata es el ion Ag+. Por lo tanto se obtiene plata según la reacción: Ag+ + 1 e- Ag(s) Los dos iones que se pueden reducir son el ion Mg 2+ que procede de la sal y el ion H+ que procede del agua. Se descarga este último ya que el magnesio es muy reactivo (muy reductor), por lo que no tiene tendencia a reducirse sino a permanecer en el estado oxidado. La reacción que se verifica es: 2 H+ + 2 e- H 2 (g) I. E. S. Élaios Departamento de Física y Química

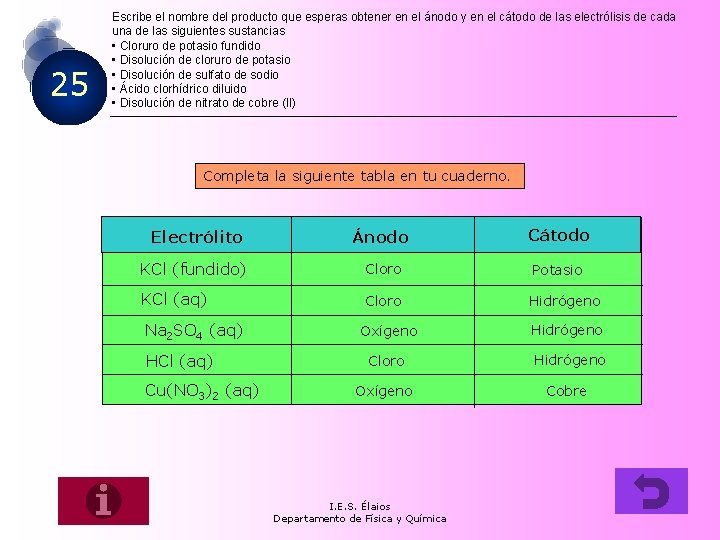
25 Escribe el nombre del producto que esperas obtener en el ánodo y en el cátodo de las electrólisis de cada una de las siguientes sustancias • Cloruro de potasio fundido • Disolución de cloruro de potasio • Disolución de sulfato de sodio • Ácido clorhídrico diluido • Disolución de nitrato de cobre (II) Completa la siguiente tabla en tu cuaderno. Electrólito Ánodo Cátodo KCl (fundido) Cloro Potasio KCl (aq) Cloro Hidrógeno Na 2 SO 4 (aq) HCl (aq) Cu(NO 3)2 (aq) Oxígeno Hidrógeno Cloro Hidrógeno Oxígeno Cobre I. E. S. Élaios Departamento de Física y Química

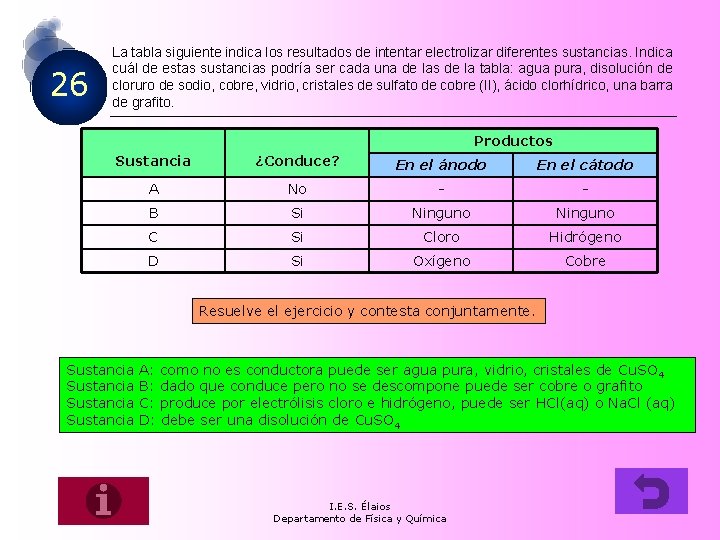
26 La tabla siguiente indica los resultados de intentar electrolizar diferentes sustancias. Indica cuál de estas sustancias podría ser cada una de las de la tabla: agua pura, disolución de cloruro de sodio, cobre, vidrio, cristales de sulfato de cobre (II), ácido clorhídrico, una barra de grafito. Productos Sustancia ¿Conduce? En el ánodo En el cátodo A No - - B Si Ninguno C Si Cloro Hidrógeno D Si Oxígeno Cobre Resuelve el ejercicio y contesta conjuntamente. Sustancia A: como no es conductora puede ser agua pura, vidrio, cristales de Cu. SO 4 B: dado que conduce pero no se descompone puede ser cobre o grafito C: produce por electrólisis cloro e hidrógeno, puede ser HCl(aq) o Na. Cl (aq) D: debe ser una disolución de Cu. SO 4 I. E. S. Élaios Departamento de Física y Química

27 (a) ¿Cómo cubrirías de plata un cubierto (cuchara, tenedor o cuchillo) de níquel? (b) ¿Cómo cubrirías de oro un objeto de plata? Contesta al apartado (a) Se utilizaría una disolución de nitrato de plata, un ánodo de plata pura, y como cátodo el cubierto a platear. Se producen las siguientes reacciones: Ánodo: Ag(s) Ag+(aq) + 1 e. Cátodo: Ag+ + 1 e- Ag (s) El montaje se muestra en la figura adjunta Contesta al apartado (b) Se utilizaría un montaje como el del apartado anterior, con una sal de oro como electrólito, un ánodo de oro puro y como cátodo el objeto de plata que se quiere dorar. I. E. S. Élaios Departamento de Física y Química

28 Cuando se quiere obtener sodio se realiza una electrólisis de cloro de sodio fundido, obteniéndose además gas cloro. Sin embargo, si lo único que se pretende es obtener cloro se utiliza la electrólisis del cloruro de sodio disuelto en agua. (a) Indica por qué se utiliza ese procedimiento. (b) ¿Qué otro producto se obtiene además del cloro? Contesta al apartado (a) Si la pretensión es obtener cloro, al utilizar una disolución de cloruro de sodio se evita el consumo de energía necesario para fundir la sal, con lo cual el proceso resulta más barato. El cloro se desprende en el ánodo por la reacción: 2 Cl-(aq) Cl 2(g) Contesta al apartado (b) Se obtiene hidrógeno en lugar de sodio por ser éste mucho más reactivo, según la reacción en el cátodo: 2 H+(aq) H 2(g) Los iones H+ provienen del agua. I. E. S. Élaios Departamento de Física y Química

29 El aluminio puede obtenerse por reducción de la bauxita mediante un metal más reductor que el aluminio. Sin embargo, no se utiliza ese procedimiento en la práctica. (a) Explica la razón del párrafo anterior. (b) Busca información sobre el procedimiento que se utiliza para obtener aluminio en la práctica. Contesta al apartado (a) El aluminio podría obtenerse por reducción con sodio del óxido de aluminio: Al 2 O 3(s) + 6 Na(s) 2 Al(s) + 3 Na 2 O(s). Sin embargo, como el sodio es caro el proceso no es rentable. Contesta al apartado (b) El aluminio se obtiene por electrólisis de una mezcla fundida de Al 2 O 3 y criolita, que es también un compuesto de aluminio, como muestra la figura siguiente. I. E. S. Élaios Departamento de Física y Química

30 (a) Las pilas de cinc-carbono se agujerean cuando se gastan. ¿A qué es debido? (b) ¿Qué problemas puede comportar esta perforación? (c) ¿Cómo se pueden evitar los problemas anteriores? Contesta al apartado (a) En este tipo de pilas la envoltura exterior es el propio electrodo de cinc, que se consume cuando la pila se gasta. Aunque el consumo no sea total pueden producirse agujeros. Contesta al apartado (b) La masa pastosa que constituye el electrólito es corrosiva, y puede escaparse por los agujeros y dañar el aparato que usa la pila para su funcionamiento. Contesta al apartado (c) Los daños pueden evitarse impidiendo la salida del electrólito, lo que se consigue mediante una envoltura impermeable alrededor del electrodo de cinc. Este es el tipo de pilas conocidas como “blindadas”. I. E. S. Élaios Departamento de Física y Química

31 Se suele decir que una pila alcalina tiene una vida tres veces mayor que una pila corriente. ¿Cómo puede comprobarse esta afirmación? Haz clic cuando tengas la respuesta La afirmación puede comprobarse midiendo el tiempo que dura cada pila en el mismo aparato. Por ejemplo, si se necesita una pila para hacer funcionar un aparato de radio, se coloca la pila corriente, se pone la radio en funcionamiento, y se mide el tiempo que el aparato funciona adecuadamente con esa pila. Se repite la prueba con la pila alcalina. Si el tiempo de funcionamiento correcto de la radio con la segunda pila es aproximadamente el triple que el de la primera, la afirmación sería correcta. I. E. S. Élaios Departamento de Física y Química

32 (a) ¿Por qué no deben tirarse a la basura las pilas de mercurio? (b) ¿Por qué no debe tirarse a la basura ninguna pila? Contesta al apartado (a) El mercurio es un contaminante muy peligroso, por lo que las pilas de mercurio deben depositarse en los contenedores de reciclado previstos al respecto. Contesta al apartado (b) La masa pastosa que constituye el electrólito es corrosiva, y por tanto también contaminante, aunque menos que en el caso del mercurio. Todas las pilas deben depositarse en los contenedores adecuados. I. E. S. Élaios Departamento de Física y Química
 Qumicas
Qumicas Electrolisis
Electrolisis Reduccin
Reduccin Estados de oxidación ejercicios
Estados de oxidación ejercicios Oxidacin
Oxidacin Oxidacin
Oxidacin Oxidacin
Oxidacin L
L Fem pilas
Fem pilas Convertir expresión infija a postfija y prefija en java
Convertir expresión infija a postfija y prefija en java U
U Pila estructura de datos
Pila estructura de datos Pilas y colas
Pilas y colas Las pilas de cajas deben estar organizadas
Las pilas de cajas deben estar organizadas Disposicion de pilas usadas
Disposicion de pilas usadas Concepto de pilas en programacion
Concepto de pilas en programacion Estructuras lineales pilas
Estructuras lineales pilas Ejemplos de la electrostática
Ejemplos de la electrostática Vaviao
Vaviao Fsica
Fsica Reacciones estatica
Reacciones estatica Vector
Vector V
V Fsica
Fsica Fsica
Fsica Fsica
Fsica Lógica
Lógica Fsica
Fsica Fsica
Fsica Tipos de sistema de referencia
Tipos de sistema de referencia Fsica
Fsica Fsica
Fsica Expresion vectorial
Expresion vectorial Aceleración normal y aceleración tangencial
Aceleración normal y aceleración tangencial Fsica
Fsica Grandezas
Grandezas Leis de newton
Leis de newton Sistema termodinamico
Sistema termodinamico Fsica
Fsica Ufsc uma particula efetuando um movimento retilineo
Ufsc uma particula efetuando um movimento retilineo Ramas de la física moderna
Ramas de la física moderna Carbonos primarios secundarios terciarios y cuaternarios
Carbonos primarios secundarios terciarios y cuaternarios Qumica
Qumica Qumica
Qumica Hibridação
Hibridação