Reacciones de Oxidacin y reduccin Unidad 3 Introduccin




















- Slides: 29

Reacciones de Oxidación y reducción Unidad 3

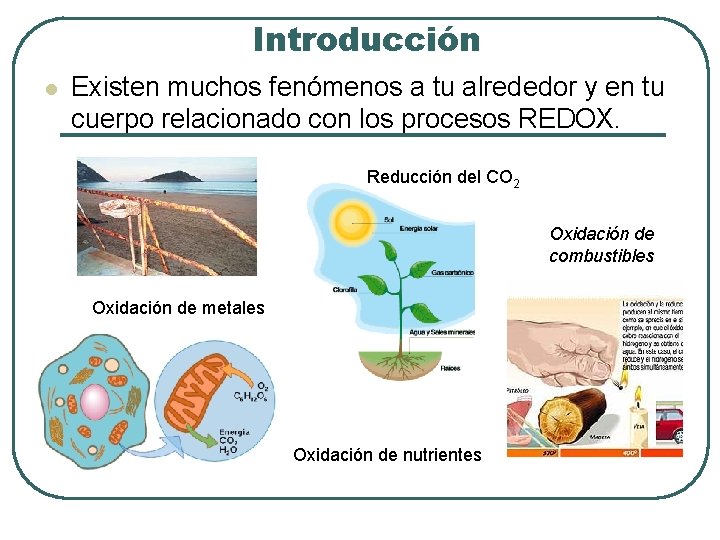
Introducción l Existen muchos fenómenos a tu alrededor y en tu cuerpo relacionado con los procesos REDOX. Reducción del CO 2 Oxidación de combustibles Oxidación de metales Oxidación de nutrientes

Alcance y Campo de Aplicación l La disciplina que estudia las leyes de que rigen los procesos redox y su relación con la producción de electricidad se llama electroquímica.

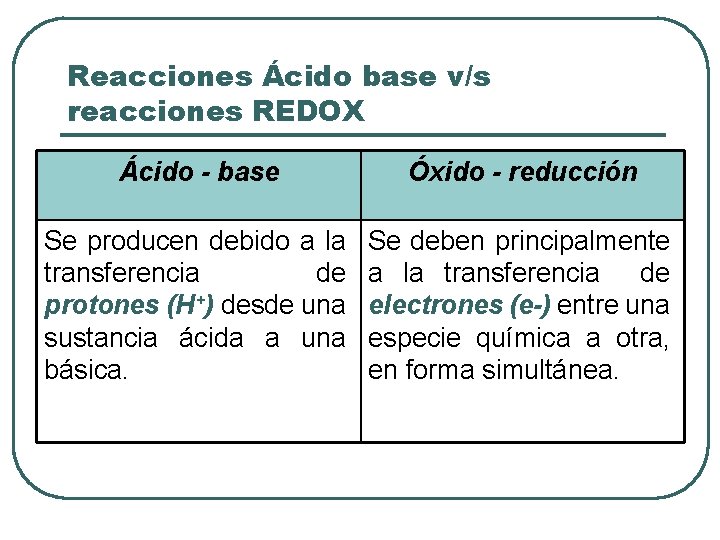
Reacciones Ácido base v/s reacciones REDOX Ácido - base Óxido - reducción Se producen debido a la transferencia de protones (H+) desde una sustancia ácida a una básica. Se deben principalmente a la transferencia de electrones (e-) entre una especie química a otra, en forma simultánea.

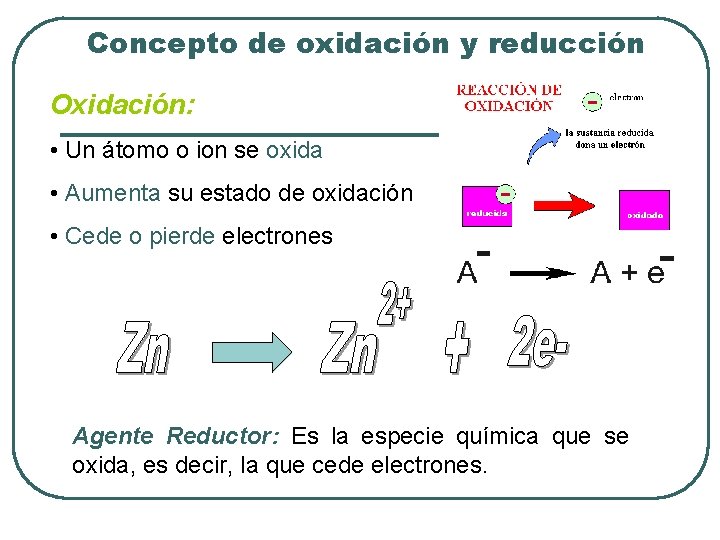
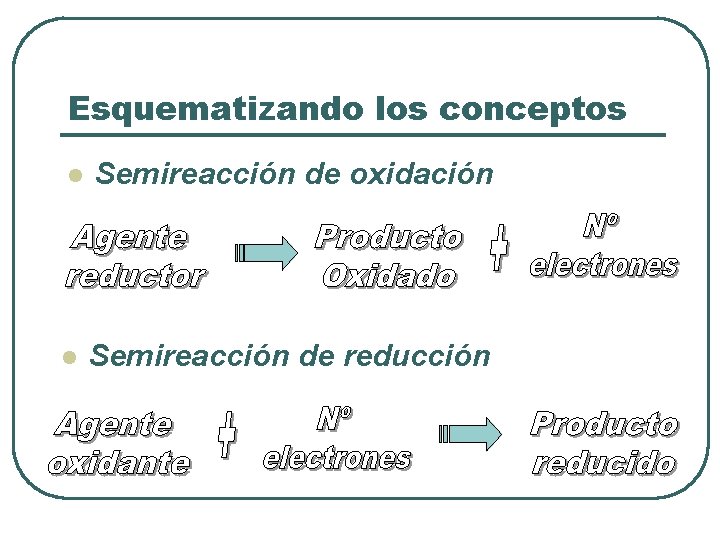
Concepto de oxidación y reducción Oxidación: • Un átomo o ion se oxida • Aumenta su estado de oxidación • Cede o pierde electrones Agente Reductor: Es la especie química que se oxida, es decir, la que cede electrones.

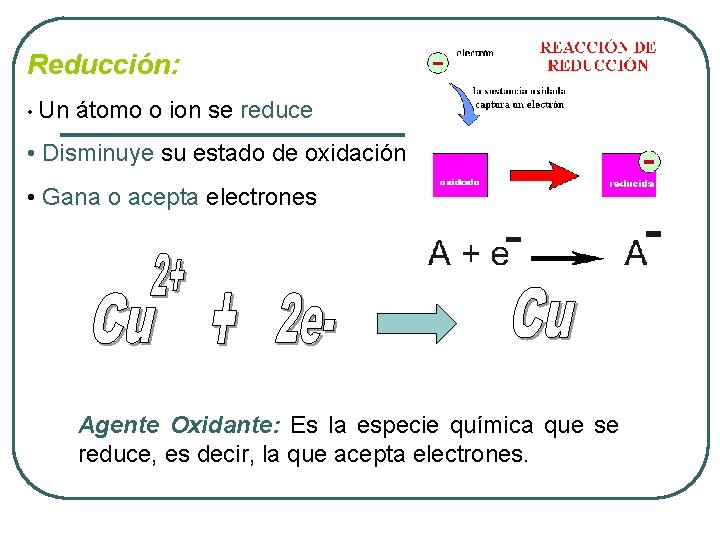
Reducción: • Un átomo o ion se reduce • Disminuye su estado de oxidación • Gana o acepta electrones Agente Oxidante: Es la especie química que se reduce, es decir, la que acepta electrones.

Observaciones l En los procesos de óxido reducción, la transferencia de electrones ocurre siempre desde un agente reductor a un agente oxidante.

Esquematizando los conceptos l Semireacción de oxidación l Semireacción de reducción

Ejercicios l Identificar: Oxidación, reducción, agente oxidante y agente reductor. 1. Al 2. Ca 2+ Al 3+ + 3 e+ 2 e- 3. Mg 4. Na+ 5. 2 H+ Mg 2+ + 2 e+ 1 e+ 2 e- 6. 2 I 7. Cl 2 Ca Na H 2 I 2 + 2 e- 2 Cl-

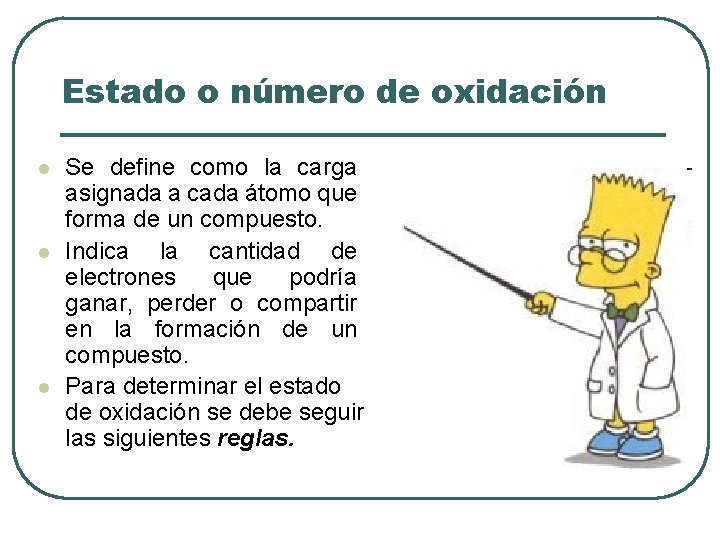
Estado o número de oxidación l l l Se define como la carga asignada a cada átomo que forma de un compuesto. Indica la cantidad de electrones que podría ganar, perder o compartir en la formación de un compuesto. Para determinar el estado de oxidación se debe seguir las siguientes reglas.

Reglas para determinar Estado de oxidación 1. El estado de oxidación de cualquier átomo en estado libre, es decir, no combinado, y moléculas biatómicas es CERO. Elementos no combinados Moléculas biatómicas Cu, Al, Ar, Ag H 2, O 2, Cl 2, Br 2

Reglas para determinar Estado de oxidación 2. El estado de oxidación del hidrógeno es +1, excepto en el caso de los hidruros (MHv), donde es -1. Ácidos H 2 SO 4 +1 Hidruros Na. H -1

Reglas para determinar Estado de oxidación l El estado de oxidación del oxígeno en la mayoría de los compuestos es -2, excepto en los peróxidos (M 2 O 2 v) donde es -1 y cuando se encuentra unido con el fluor, donde actúa con estado de oxidación +2. Peróxidos Con Fluor Na 2 O 2 F 2 O -1 +2

Reglas para determinar Estado de oxidación l l En los iones simples, cationes (+) y aniones (-), el estado de oxidación es igual a la carga del ion. Ejemplos: Cationes Aniones Cu 2+ = +2 Cl- = -1 Na+ = +1 S 2 - = -2

Reglas para determinar Estado de oxidación l l En los iones poliatómicos, la suma de los estados de oxidación de todos los átomos debe ser igual a la carga del ion. Ejemplo: SO 42 Nº at. Est. Ox. S= 1 • O= 4 • X = X -2 = -8 -2 X=6

Reglas para determinar Estado de oxidación l l En las moléculas neutras, los estados de oxidación de todos los átomos deben sumar CERO. Ejemplo: H 2 SO 4 Nº at. Est. Ox. H= 2 • +1 = +2 S= 1 • X = X O= 4 • -2 = -8 0 X=6

Determinación del Estado de Oxidación l l A través de una ecuación matemática. Ejemplo: Calcular el estado de oxidación del nitrógeno en el HNO 3 H N O 3 1 (+1) + 1 • X + 3 (-2) = 0 X = +5

Ejercicios Determine el estado de oxidación de: l P en el H 3 PO 3 l N en el NH 2 OH l S en el H 2 SO 3 l Cl en el KCl. O 3 l S en el Na 2 S l Cr en el Cr 2 O 72 l Mn en el Mn. O 42 -

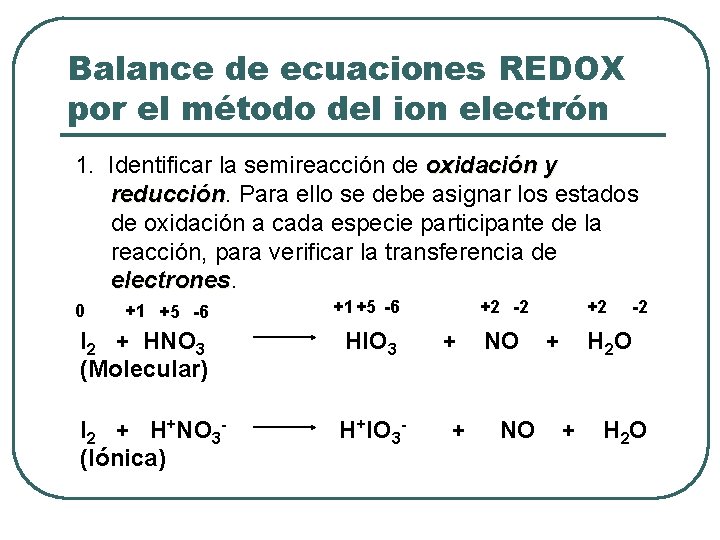
Balance de ecuaciones REDOX por el método del ion electrón 1. Identificar la semireacción de oxidación y reducción Para ello se debe asignar los estados de oxidación a cada especie participante de la reacción, para verificar la transferencia de electrones +1 +5 -6 I 2 + HNO 3 (Molecular) HIO 3 I 2 + H+NO 3(Iónica) H+l. O 3 - 0 +2 -2 + + NO NO +2 + -2 H 2 O + H 2 O

Balance de ecuaciones REDOX por el método del ion electrón 2. Se escribe por separado el esqueleto de las ecuaciones iónicas parciales del agente oxidante y el agente reductor. I 2 l. O 3 - Oxidación NO 3 - NO Reducción Agente Reductor Agente Oxidante

Balance de ecuaciones REDOX por el método del ion electrón l Se balancea por tanteo (inspección) los átomos distintos de H y O : I 2 2 l. O 3 - NO

Balance de ecuaciones REDOX por el método del ion electrón l Se igualan los átomos de oxígenos agregando moléculas de H 2 O para balancear los oxígenos: I 2 NO 3 - + 6 H 2 O 2 l. O 3 NO + 2 H 2 O

Balance de ecuaciones REDOX por el método del ion electrón l Igualar los átomos de hidrógenos, agregando iones hidrógeno H+ donde falte éste. I 2 + 6 H 2 O 4 H+ + NO 3 - 2 l. O 3 - + 12 H+ NO + 2 H 2 O

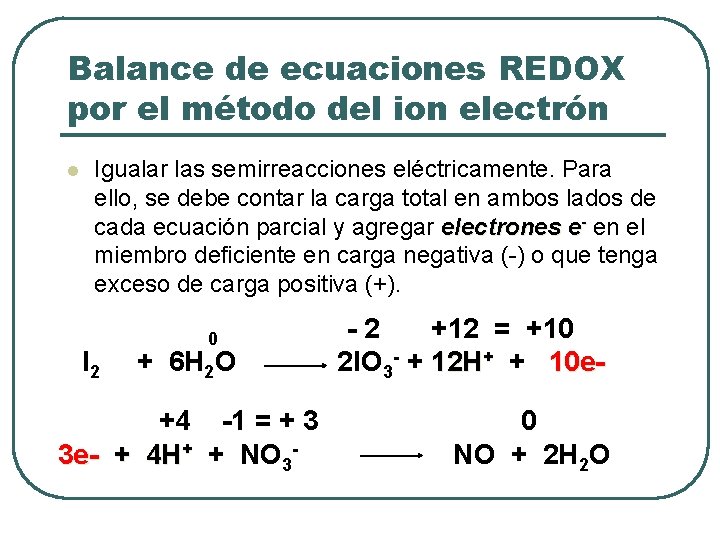
Balance de ecuaciones REDOX por el método del ion electrón l Igualar las semirreacciones eléctricamente. Para ello, se debe contar la carga total en ambos lados de cada ecuación parcial y agregar electrones e- en el miembro deficiente en carga negativa (-) o que tenga exceso de carga positiva (+). I 2 0 + 6 H 2 O +4 -1 = + 3 3 e- + 4 H+ + NO 3 - -2 +12 = +10 2 l. O 3 - + 12 H+ + 10 e 0 NO + 2 H 2 O

Observaciones l l l Estos pasos aquí son comunes para reacciones en medio ácidos, neutros o básicos (alcalinos). Si la reacción está en medio básico o alcalino después de haber colocado los e- se debe: “agregar a cada miembro de las ecuaciones parciales tantos OH- como H+ haya. Combinar los H+ y OH- para formar H 2 O y anular el agua que aparezca duplicado en ambos miembros”. Nota: En esta ecuación no se realiza porque no tiene OH-, es decir, no está en medio básico (está en medio ácido, HNO 3).

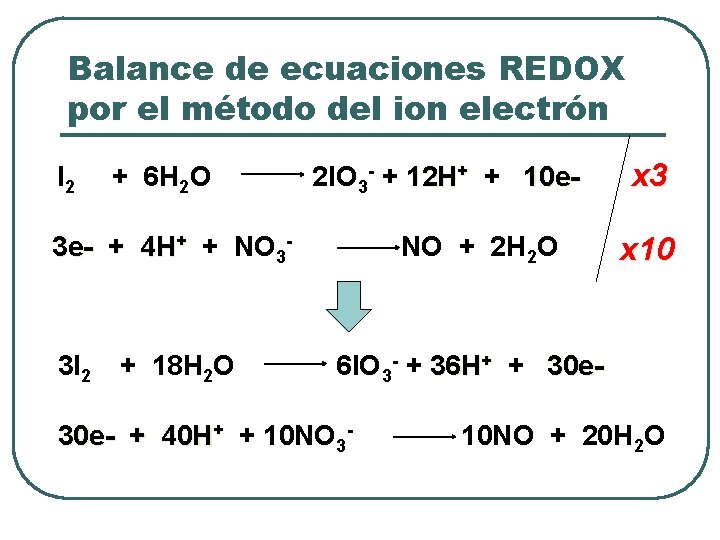
Balance de ecuaciones REDOX por el método del ion electrón l I 2 Igualar el número de e- perdidos por el agente reductor, con los e- ganados por el agente oxidante, multiplicando las ecuaciones parciales por los número mínimos necesario para esto. + 6 H 2 O 3 e- + 4 H+ + NO 3 - 2 l. O 3 - + 12 H+ + 10 e. NO + 2 H 2 O x 3 x 10

Balance de ecuaciones REDOX por el método del ion electrón I 2 + 6 H 2 O 2 l. O 3 - + 12 H+ + 10 e- 3 e- + 4 H+ + NO 3 - 3 I 2 + 18 H 2 O NO + 2 H 2 O x 3 x 10 6 l. O 3 - + 36 H+ + 30 e- + 40 H+ + 10 NO 3 - 10 NO + 20 H 2 O

Balance de ecuaciones REDOX por el método del ion electrón l 3 I 2 Sume las dos semireacciones reduciendo términos semejantes, es decir, cancelando cualquier cantidad de e-, H+, OH- o H 2 O que aparezca en ambos lados, con lo cual se obtendrá la ecuación finalmente balanceada. + 18 H 2 O 6 l. O 3 - + 36 H+ + 30 e- + 40 H+ + 10 NO 33 I 2 + 10 NO 3 - + 4 H+ 10 NO + 20 H 2 O 6 IO 3 - + 10 NO + 2 H 2 O

Balance de ecuaciones REDOX por el método del ion electrón l Si la ecuación fue dada originalmente en forma iónica, ésta es la respuesta del problema. 3 I 2 + 10 NO 3 - + 4 H+ 6 IO 3 - + 10 NO + 2 H 2 O • Si la ecuación fue dada originalmente en forma molecular; se trasladan estos coeficientes a la ecuación molecular y se inspeccionan el balanceo de la ecuación. 3 I 2 + 10 HNO 3 6 HIO 3 + 10 NO + 2 H 2 O
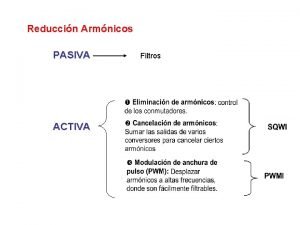
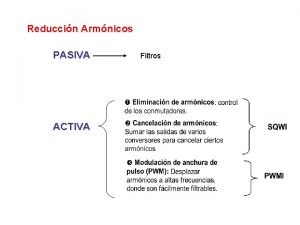
 Reduccin
Reduccin Electrolisis aplicaciones
Electrolisis aplicaciones Enzimas introducción
Enzimas introducción Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Las 4 etapas de la filosofía
Las 4 etapas de la filosofía L
L Oxidacin
Oxidacin Oxidacin
Oxidacin Reglas de los numeros de oxidacion
Reglas de los numeros de oxidacion Oxidacin
Oxidacin Decena centena unidad
Decena centena unidad Clculas
Clculas Eacciones quimicas
Eacciones quimicas Reacciones redox
Reacciones redox Que es una reaccion irreversible
Que es una reaccion irreversible Reacciones anapleroticas
Reacciones anapleroticas Mapa conceptual de reacciones endotérmicas y exotérmicas
Mapa conceptual de reacciones endotérmicas y exotérmicas Reacciones supravitales
Reacciones supravitales Reacciones anodicas y catodicas
Reacciones anodicas y catodicas Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Algunas reacciones contra el proyecto moderno
Algunas reacciones contra el proyecto moderno Ecuaciones químicas sencillas
Ecuaciones químicas sencillas Reacciones químicas de nuestro entorno
Reacciones químicas de nuestro entorno Frases del atomo
Frases del atomo Saturada
Saturada Tipo de reacciones quimicas
Tipo de reacciones quimicas Que es la neutralizacion
Que es la neutralizacion